不同产地玛卡遗传多样性的ISSR分析
谭晓蕾,易帆,谭芳,彭勇
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·基础研究·
不同产地玛卡遗传多样性的ISSR分析
谭晓蕾,易帆,谭芳,彭勇*
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:从DNA 分子水平分析国内外5个不同产地玛卡的遗传多样性,探索其相互之间的亲缘关系。方法:采用简单重复序列区间(ISSR)分子标记技术对11份不同产地玛卡进行聚类分析。从20条ISSR引物中筛选出8条进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳检测,扩增结果进行遗传参数统计分析,用NTSYS软件UPGMA 法进行亲缘关系聚类分析,构建聚类图。结果:8条引物共获得51条清晰可辨条带,其中多态性条带22条,平均多态性比率为43.1%。11份玛卡的相似系数在:0.627 5~0.960 8。聚类结果显示,国产与秘鲁原产玛卡明显被分为两大类。在国产9个样品中,云南、西藏、青海聚为一支,新疆产玛卡单独聚成一支。结论:ISSR标记可以区别秘鲁原产与引种的玛卡样品,然而国产玛卡整体遗传变异小,遗传稳定性强。
玛卡;ISSR;遗传多样性;亲缘关系
玛卡LepidiummeyeniiWalp.是原产于秘鲁安第斯山脉(海拔3500 m以上)的珍稀高山药食两用植物,属十字花科独行菜属,除含有多种营养成分外,还含有玛卡生物碱、芥子油苷及其衍生物、甾醇等多种次生代谢活性成分[1-3]。研究表明玛卡具有抗疲劳[4-5]、改善性功能[6]、调节内分泌、增强免疫力、抗氧化[7]的作用,并对骨质疏松[8]、抑郁症等有很好的治疗效果[9-10],有秘鲁人参、秘鲁国宝等美誉。2001年《国外医药—植物药分册》首次介绍了来自南美洲的玛卡[11]。2002 年玛卡在云南会泽首次引种成功,此后短短十几年间发展迅速,相继在我国云南、新疆、青海等省(区)引种成功,在中国引起广泛关注,并形成一定规模,成为高海拔山区发展经济新的增长点。但是随着栽培地区增多,药材质量也相应成为值得社会正视的问题。
近年来,分子标记技术已经广泛运用于药物基因组DNA的分析之中,主要手段有ISSR、RAPD、RFLP、AFLP等。ISSR分子标记技术(Inter Simple Sequence Repeat,简单重复间隔序列)不需要知道基因组序列即可设计引物并进行扩增,具有操作简单、模板需要量少、多态性丰富、结果记录方便、实验成本低、操作简单等优点,现已在遗传多样性、系统进化与物种鉴定等多个研究领域得到广泛应用[12-13],在芍药[14]、金钱草[15]、狼毒[16]、丹参[17]、萝卜[18]等中药材上已有成功应用和报道。种质资源是影响药材产量和质量的一个重要因素,由于用传统的形态学方法很难将不同产地的玛卡严格地区分鉴别开,而有关用分子标记分析不同产地玛卡遗传关系的研究也未见报道。为此,笔者采用ISSR技术对国内外不同产地玛卡的亲缘关系进行分析,并对不同产地的药材进行分子鉴别研究,为该药材的规范引种栽培、加强资源保护和选种育种提供科学参考。
1 材料与仪器
1.1 材料
用于本实验研究的玛卡样本共11份,分别采自中国的云南、新疆、西藏、青海以及秘鲁。经中国医学科学院药用植物研究所彭勇研究员鉴定为玛卡LepidiummeyeniiWalp.的根,凭证标本保存于药用植物亲缘中心标本室,具体编号及产地信息见表1。
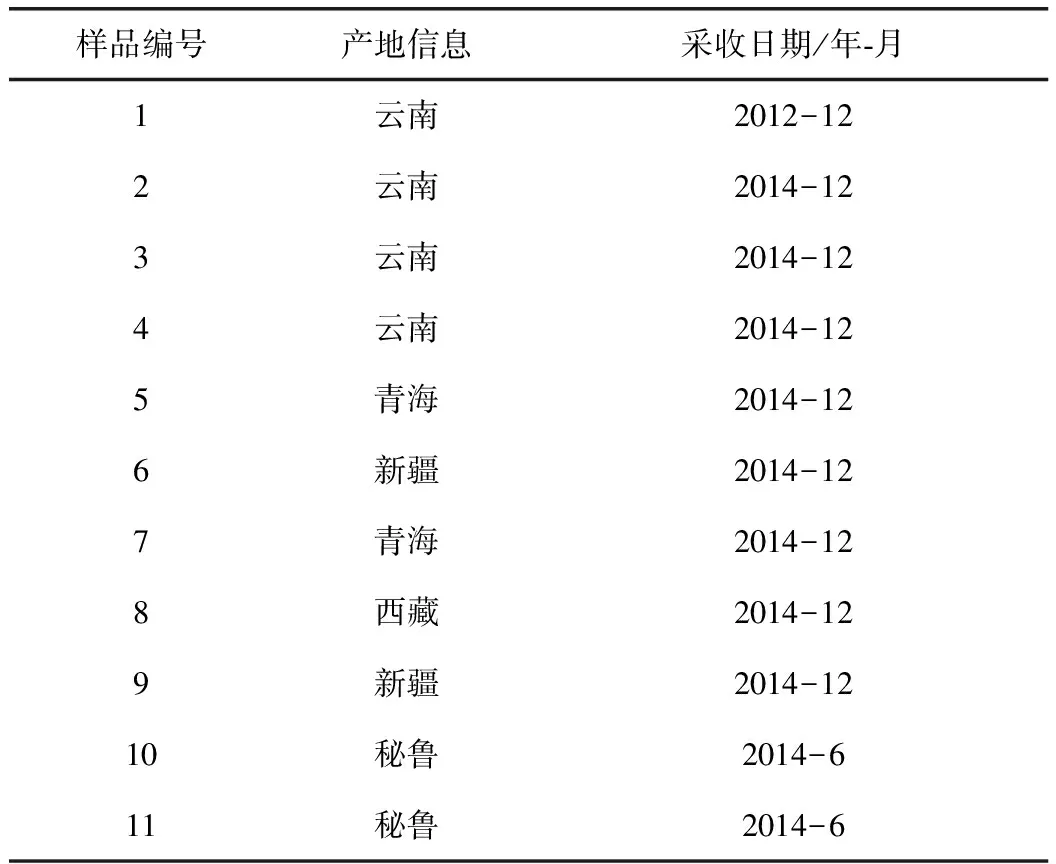
表1 不同产地的玛卡样品信息
1.2 试剂与仪器
PCR相关试剂:提取植物基因组 DNA 用十六烷基三基溴化铵(CTAB)、β-巯基乙醇购自SIGMA公司,植物基因组DNA提取试剂盒(北京天根生化科技有限公司)。琼脂糖(A-garose,Gene公司)。Taq DNA聚合酶、PCR缓冲液、dNTPs、超纯水等(上海生工生物工程有限公司),引物由北京博友顺生物技术有限公司合成;其他试剂均为国产分析纯。Marker:GeneRuler Express DNA Ladder (MBI Fermentas公司)。
主要实验仪器:Gel Doc 2000凝胶成像系统(美国BIO-RAD公司);PTC-200 PCR仪(美国BIO-RAD公司);TGear微型离心机(北京天根生化科技有限公司);DK-8D型电热恒温水槽(上海医用恒温设备厂);DYY-7型电泳槽、DYY-12型电源(北京六一仪器厂)。
2 方法
2.1 玛卡总DNA的提取
取不同产地玛卡干药材适量,用灭菌超纯水(ddH2O)将表面冲洗干净,吸去水分,刮掉栓皮部分,切1~2 mm直径小块,称取50 mg。采用北京天根生化科技有限公司植物DNA提取试剂盒提取基因组DNA,用1%的琼脂糖凝胶电泳检测DNA的完整性和纯度,结果见图1。
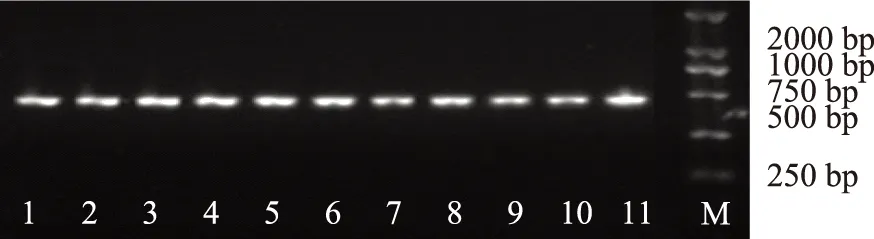
注:1~11.不同产地样品;M.Marker DL2000;下同。图1 不同产地玛卡的总DNA 电泳图谱
2.2 ISSR扩增及产物检测
ISSR引物序列参考University of British Columbia提供的标准序列,同时参考其他相关文献[18-20],筛选出能产生多态、清晰且可重复条带的引物,用于全部11个样本分析。
ISSR反应体系(50 μL)为:上下游引物和dNTP各1.0 μL (2.5 mmol·L-1),总DNA 4 μL,MgCl24 μL(25 mmol·L-1),PCR buffer 5 μL(10×),0.6 μL Ex Taq,用ddH2O补足体积。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性45 s,55~62 ℃复性45 s,72 ℃延伸1.5 min,35个循环;循环结束后72 ℃延伸10 min,产物置4 ℃保存。
扩增产物用1%的琼脂糖凝胶电泳,电泳结束后凝胶成像系统照相,记录结果。引物S6和S7扩增结果见图2。
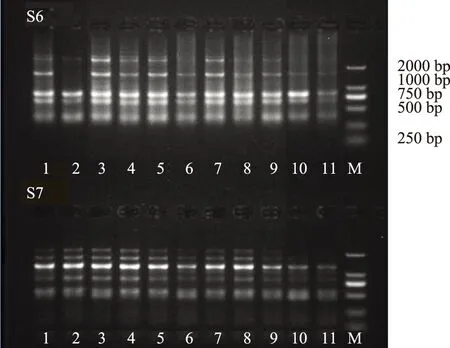
图2 引物S6和S7对11个玛卡样品PCR扩增电泳图谱
2.3 数据统计分析
电泳图谱中迁移率一致的条带被认为具有同源性,根据ISSR扩增条带的有无,以1和0表示。具体而言PCR扩增产物的电泳位置在凝胶的某个相同迁移率位置上有DNA条带记为1,无DNA条带记为0。形成ISSR的表型数据矩阵NTSYS软件计算相似系数(DICE系数),并且按照遗传距离进行UPGMA聚类分析,建立样品间的亲缘关系。
3 结果与分析
通过对20条引物的多次反复筛选,选出可有效扩增的8个引物,用于全部11个种群样本分析。筛选原则:条带清晰可见,多态性高,重复性好。
对表1中11个不同产地玛卡进行ISSR扩增,各引物序列及扩增结果见表2。Jaccard相似系数矩阵和聚类系统树见表3和图3。
ISSR扩增的DNA片段集中在170~2000 bp,8条引物共获得51条清晰可辨条带,其中多态性条带22条;平均每对引物扩增出6.4条带,2.8条具有多态性,平均多态性比率为43.1%。其中,多态性最高的为60%,低的只有16.7%。每对引物扩增的条带数5~8条不等,平均每个引物扩增6.4条带和2.8条多态带。
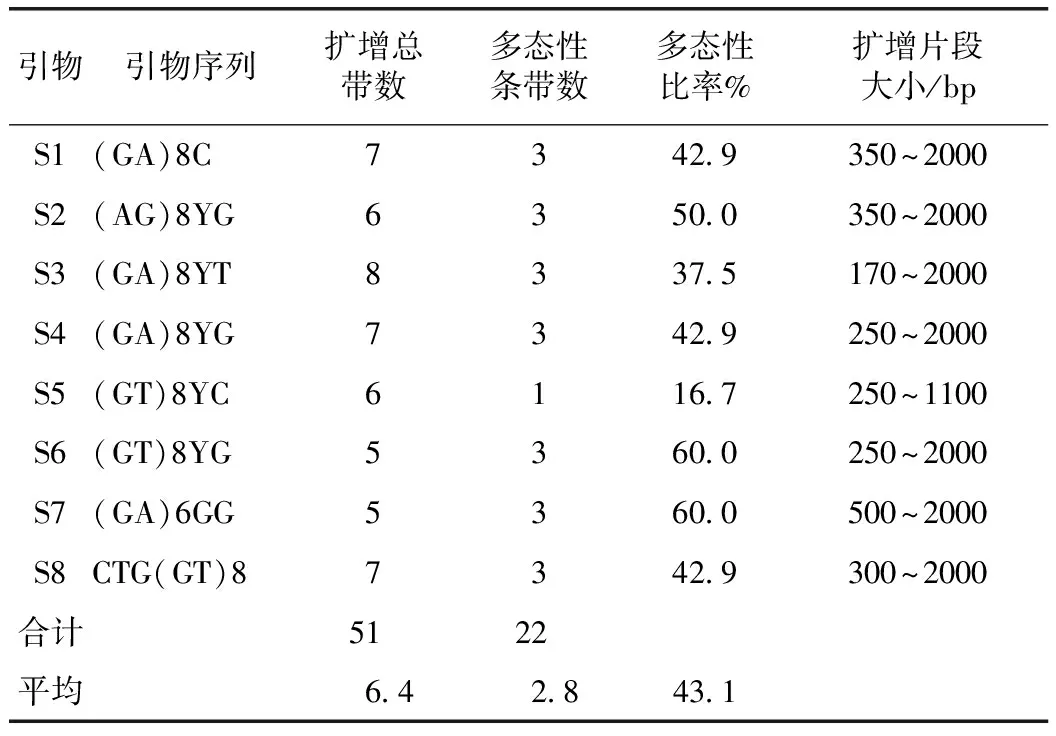
表2 ISSR 8对引物扩增结果
注:Y=(C,T)。
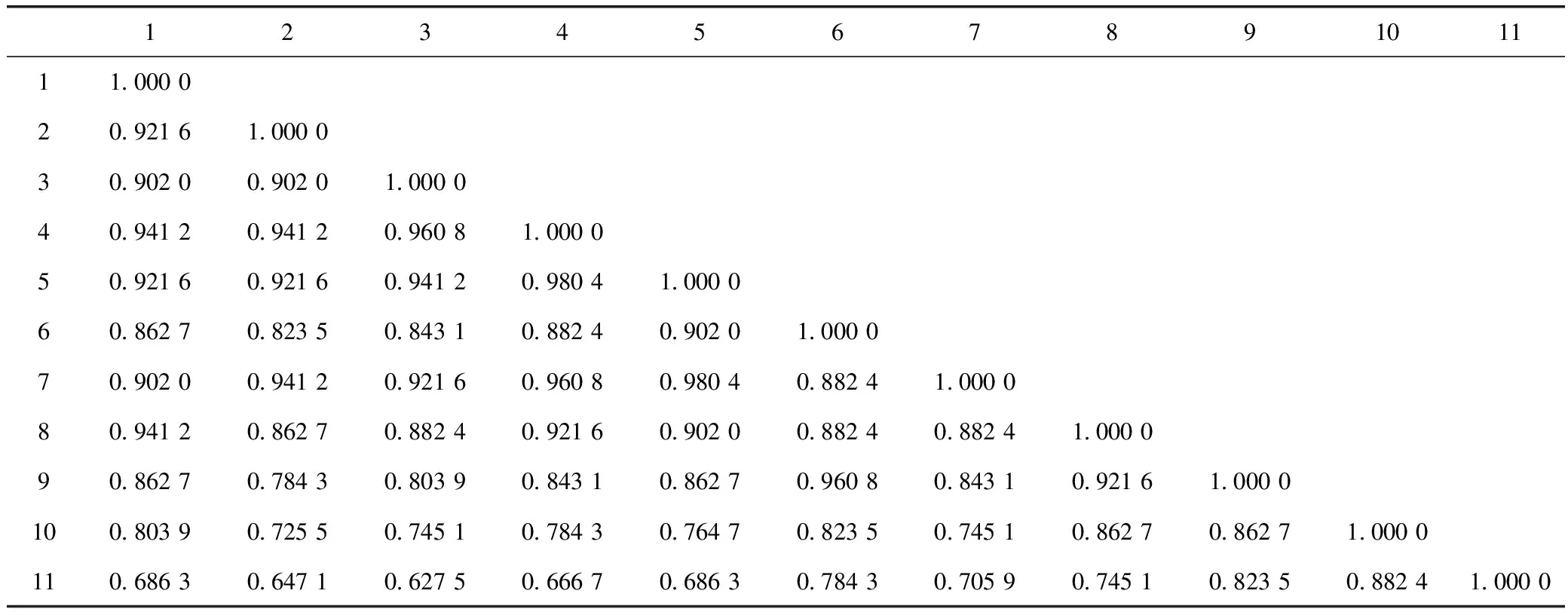
表3 基于ISSR标记的玛卡13个样品的遗传相似系数矩阵
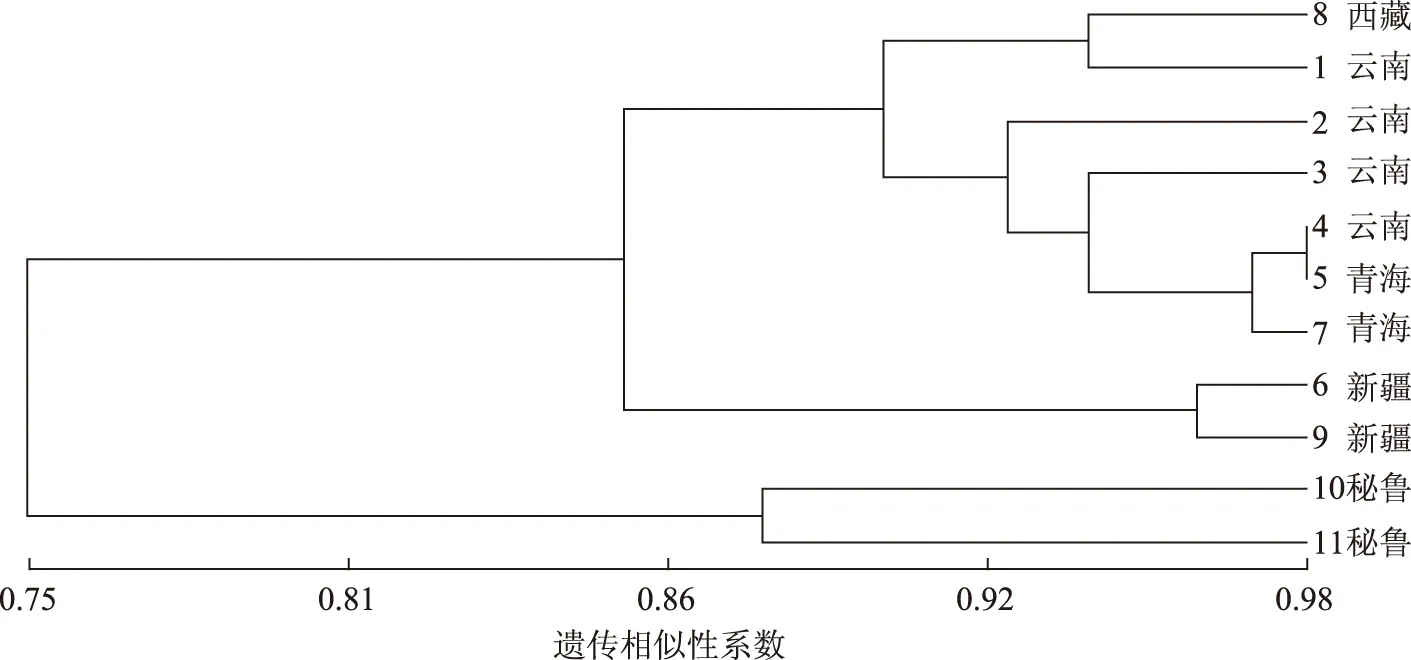
图3 基于ISSR标记的玛卡11个样品的UPGMA聚类分析
利用8对引物在11个玛卡样品中获得51条扩增片段,在NTSYS软件中计算样品间的遗传相似系数(GS值),得到相似矩阵。遗传相似系数越大,表明亲缘关系越近,遗传相似系数越小,表明亲缘关系越远。从Jaccard 相似系数矩阵中可知各产地玛卡的相似系数在:0.627 5~0.960 8,变幅为0.333 3。其中4号和5、7号样品(云南和青海)遗传相似系数最大(0.960 8),6号和9号(新疆)遗传相似系数其次(0.960 8),表明它们之间的亲缘关系较近,遗传差异性小。3号(云南)和13号(秘鲁)样品之间的遗传相似系数最小(0.627 5),表明这2个样品之间的亲缘关系较远,遗传差异性较大。整体遗传差异与地理分布有一定关系,但整体遗传变异小,遗传稳定性强。
聚类树状图上显示9种不同产地玛卡共聚为4支,第1支为8号(西藏)、1号(云南)。第2支为2号(云南)、3号(云南)、4号(云南),5号(青海)、7号(青海);其中4号与5号先聚为1支,而后与7号聚为1支,最后这1支与3号、2号共聚为1支。第3支为6号(新疆)、9号(新疆)。第4支为10号(秘鲁)、11 号(秘鲁)。结果显示,国产与秘鲁原产的玛卡整体上聚成两大支,9个国产玛卡聚在1支,上述前2支即云南、西藏、青海玛卡聚为1支,新疆产玛卡单独聚成1支,表明玛卡遗传变异与地理分布存在一定的联系,但9个国产的样本,地理距离相对比较近的同一产地的药材并没有完全聚在一起,表明玛卡药材遗传变异与地理分布没有呈现明显的相关性,说明国内产区之间的遗传分化不明显。
4 讨论
利用8条引物对11 个不同产地玛卡总DNA进行ISSR 扩增,遗传距离、遗传相似系数等数据表明国产引种与秘鲁原产的玛卡之间的基因组DNA存在明显的差异,产生差异的原因除了不同的明显的地理因素之外,还可能与栽培样品的种质来源以及国内外的栽培方法多样有关。
同时,国产不同产地玛卡间亲缘关系较近,遗传差异小,遗传较为稳定,原因可能是:①云南是目前国产玛卡种植区域最广泛、产量最高的地区,其他地区玛卡可能源于与云南主产区之间的相互引种,并且引种历史不长,尚未发生变异;②玛卡为闭花自交植物,基因流动有限[21],农民在水肥管理、病虫害管理以及作物轮作等方面的不规范化严重制约了优质玛卡的可持续生产;③2011年5月18日卫生部发布公告,批准玛咖粉为新资源食品,玛卡行业进入到快速发展阶段,丽江玛卡渐已成为继昭通天麻、文山三七之后,云南植物王国里的又一张名片,应市场需求,周边地区如西藏、青海、四川等地也开始进行大量人工种植。目前,国产玛卡几乎全部来源于人工栽培,这种人工栽培驯化及定向选择,使遗传差异越来越小。另一方面,玛卡遗传稳定性强,有利于保留其优良基因,降低了选种、留种的难度,对进一步的引种栽培及推广种植等均具有积极意义。因此,需要通过加强环境控制、规范栽培技术、完善检测方法等措施,保证国产引种外来植物药的质量。
[1] 牛建伟,彭勇,Gustave F.Gonzales.健康新资源——玛卡[M].北京:中国医药科技出版社,2014:68-75.
[2] WANG Y L,WANG Y C,BRIAN M,et al.Maca:An Andean crop with mμlti-pharmacological functions[J].Food Research International,2007,40:783-792.
[3] MCCOLLOM M M,VILLINSKI J R,MCPHAIL K L,et al.Analysis of macamides in samples of Maca (Lepidiummeyenii) by HPLC-UV-MS/MS[J].Phytochemical Analysis,2005,16(6):463-469.
[4] 余龙江,金文闻.玛卡(Lepidiummeyenii.)干粉的营养成分及抗疲劳作用研究[J].食品科学,2004,25(1):164-166.
[5] 胡远,李兴平,周毅,等.引种玛卡抗疲劳实验研究[J].华西药学杂志,2015,30(4):440-441.
[6] 李诗,阚红金,华玉祥.玛卡复方醇提物对改善小鼠性功能及抗疲劳功能的影响[J].药物生物技术,2015,22(3):229-232.
[7] Zha S H,Zhao Q S,CHEN J J,et al.Extraction,purification and antioxidant activities of the polysaccharides from maca (Lepidiummeyenii)[J].Carbohydrate Polymers,2014,111(13):584-587.
[8] Liu H,Jin W,Fu C,et al.Discovering anti-osteoporosis constituents of maca (Lepidiummeyenii) by combined virtual screening and activity verification[J].Food Research International,2015.77(2):215-220.
[9] Eliana Esparza,Antonella Hadzich,Waltraud Kofer,et al..Bioactive maca (Lepidiummeyenii) alkamides are a resμlt of traditional Andean postharvest drying practices[J].Phytochemistry,2015,116:138-148.
[10] Gabriel Sifuentes-Penagos,Susan León-Vásquez,Luz María Paucar-Menacho.Estudio de la Maca (LepidiummeyeniiWalp.),cultivo andino con propiedades terapéuticas[J].Scientia Agropecuaria,2015,6(2):131-140.
[11] 肖培根,刘勇,肖伟.玛卡—全球瞩目的保健食品[J].国外医药—植物药分册,2001,16(6):24-27.
[12] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1996:148.
[13] 徐国钧,徐珞珊.常用中药材品种整理和质量研究:一册[M].福州:福建科技出版社,2002:613-616.
[14] 王淼,于恒秀,龚志云,等.芍药栽培品种ISSR反应体系的优化和应用[J].扬州大学学报(农业与生命科学版),2007,28(2):78-82.
[15] 任凤鸣,金江群,胡开治,等.中药金钱草种质资源的ISSR遗传多样性研究[J].中国药学杂志,2015,50(15):1277-1281.
[16] 李伟,李莉,陈振江.ISSR标记不同产地的大戟科狼毒种质资源多样性分析[J].辽宁中医药大学学报,2014,16(3):51-52.
[17] 徐红,王燕燕,王峥涛,等.不同产地丹参药材的ISSR分析与鉴别[J].中药新药与临床药理,2007,18(6):454-457.
[18] 周娜,李丹丹,柳李旺,等.萝卜遗传多样性的ISSR,RAPD与RAMP分析[J].西南农业学报,2015,28(2):704-712.
[19] 陈章靖.玛卡组织培养再生系统的建立及组培苗遗传稳定性的分析[D].长沙:中南林业科技大学,2014:33-38.
[20] 宋江华,赵颖,汪承刚,等.乌塌菜ISSR-PCR反应体系的建立及优化[J].植物研究,2013,33(2):238-242.
[21] 万文婷,张志鹏,谭晓蕾,等.玛卡云南主产区发展现状调查[J].中国现代中药,2015,17(7):726-729.
GeneticAnalysisofLepidiummeyeniiWalp.ResourcesfromDifferentHabitatsBasedonISSRMarkers
TANXiaolei,YIFan,TANFang,PENGYong*
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100193,China)
Objective:To study the population genetic diversity and relationships ofLepidiummeyeniiWalp.resources from 5 different habitats according to their DNA molecule among them.Methods:Inter-simple sequence repeat (ISSR) molecular marker technique was adopted to analyze genetic diversity ofL.meyeniifrom different habitats.8 ISSR primers with good repeatability screened from 20 ISSR primers were screened out with PCR and the amplification products were examined by 1.5% agarose gel electrophoresis.Genetic parameters were analyzed statistical and population genetic cluster was assessed by using UPGMA method (NTSYS software).Results:A total of 51 bands were amplified from 8 ISSR primers,of which 22 bands were polymorphic loci.The percentage of polymorphic fragment was up to 43.1%.The genetic similarity coefficient of the 11samples was 0.627 5-0.960 8 and samples could be divided into 2 categories differencing between Peru and China.However,9 samples from China could not be distinguished from each other significantly through cluster analysis.Conclusion:The ISSR markers can be used for identification ofL.meyeniifrom Peru or China,but the genetic variation of ChineseL.meyeniiis small with strong genetic stability.
LepidiummeyeniiWalp.;ISSR;genetic diversity;genetic relationship
10.13313/j.issn.1673-4890.2016.11.011
2015-12-27)
*
彭勇,研究员,研究方向:中药资源、保健食品研发及中药信息学研究;E-mail: ypeng@implad.ac.cn

