药物共晶(HTHB)4·(SiW12O40)合成、表征及抗肿瘤活性研究
张羽男,张大俊,张 宇,殷和美,刘立新,张向宇,冯艳茹,沙靖全,张云杰,王朝兴,沈 宇,匡海学
(1.佳木斯大学黑龙江省药学研究所,黑龙江 佳木斯 154007;2.黑龙江中医药大学中药学教育部重点实验室,哈尔滨 150040)
药物共晶(HTHB)4·(SiW12O40)合成、表征及抗肿瘤活性研究
张羽男1,张大俊1,张宇1,殷和美1,刘立新1,张向宇1,冯艳茹1,沙靖全1,张云杰1,王朝兴1,沈宇1,匡海学2
(1.佳木斯大学黑龙江省药学研究所,黑龙江佳木斯154007;2.黑龙江中医药大学中药学教育部重点实验室,哈尔滨150040)
利用溶剂热法探索合成一种未见报道的四氢小檗碱与硅钨酸药物共晶(HTHB)4·(SiW12O40),通过X-射线单晶衍射、IR、XRPD和TGA等方法确定结构。X-射线单晶衍射数据分析结果表明,该化合物属四方晶系,P4/n空间群,晶胞参数:a=23.7874(15)Å,b=17.2595(16)Å,c=23.7874(15)Å,V=9 766.1(13)Å3,F(000)= 7 496,Z=4。体外抗肿瘤活性试验结果表明,相同药物浓度下药物共晶(HTHB)4·(SiW12O40)抗肿瘤活性优于四氢小檗碱和硅钨酸抗肿瘤活性。
四氢小檗碱;硅钨酸;药物共晶;抗肿瘤活性
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.020.html
张羽男,张大俊,张宇,等.药物共晶(HTHB)4·(SiW12O40)合成、表征及抗肿瘤活性研究[J].东北农业大学学报,2016,47(8):75-81. Zhang Yunan,Zhang Dajun,Zhang Yu,et al.Study on synthesis,characterization and antitumor activity of pharmaceutical cocrystal of(HTHB)4·(SiW12O40)[J].Journal of Northeast Agricultural University,2016,47(8):75-81.(in Chinese with English abstract)
四氢小檗碱(Tetrahydroberberine,THB)属原小檗碱类生物碱,主要源于紫堇属植物(罂粟科),如蛇果黄堇、三裂延胡索等,在镇静、镇痛、抗氧化和抗心律失常等方面具有良好临床药用活性[1-2]。洪娟研究表明,提高药用生物活性及稳定性可促使四氢小檗碱临床药用,因此研究主要集中在原有分子结构修饰和改造[3]。但改变原有分子结构将产生新化合物,且毒副作用也将发生改变。因此,在保证四氢小檗碱分子结构不变前提下,提高其生物活性和稳定性极具重要意义。
近年来,研究人员将晶体工程学、超分子化学等学科原理及方法广泛应用于晶体药物研发,为开发晶型药物及药物共晶提供新思路[4-5]。药物共晶是药物活性成分和共晶配体在分子间作用力下形成具有固定化学计量比的一种新型药物固体形态。药物共晶技术作为药物研发新兴技术,可通过共晶配体改变原有药物活性成分理化性质和生物活性,而原有分子结构不变[6-9]。因此,利用药物共晶技术制备四氢小檗碱药物共晶,有助于解决四氢小檗碱难以成药问题。
多金属氧酸盐(简称多酸)因结构多样性和可扩展性,在材料科学、光化学和药物化学等领域应用前景良好,有望成为优良共晶配体,备受研究人员关注[10-11]。多酸药物化学作为多酸领域热点,已在抗菌、抗病毒和抗肿瘤活性等方向取得成果。王恩波等针对多酸抗肿瘤活性展开深入研究[10-15]。以多酸为共晶配体与四氢小檗碱形成药物共晶将可能改变四氢小檗碱表面电荷分布状态,增强四氢小檗碱生物活性并改变原有理化性质,为四氢小檗碱成药性研究提供新思路。
本文利用溶剂热法探索合成一种四氢小檗碱与硅钨酸的药物共晶,通过X-射线单晶衍射、IR、XRPD和TGA等方法确定试验产物结构。同时,利用SRB法测试其对人肝癌HepG2细胞株体外抑制活性,为今后相关研究奠定基础。
1 材料与方法
1.1材料
1.1.1仪器
XCALIBUR E型X-射线单晶衍射仪(美国安捷伦科技有限公司)单晶结构测试;650型红外光谱仪(广州科晓科学仪器有限公司)IR测试;D8 AD⁃VANCE型X-射线粉末衍射仪(德国布鲁克公司)XRPD测试;GY-10CC44型热重分析仪(湖南杰林光源科技有限公司)TGA测试。化合物合成及抗肿瘤活性测试部分仪器设备如下:AUX220型电子天平(日本岛津公司)、TF101-4数显鼓风干燥箱(苏州同福烘箱制造有限公司)、HJ-6B型六联数显磁力搅拌器(上海梅香仪器有限公司)、PC-9965型酸度计(东莞市大信电子科技有限公司)、STX型体视显微镜(云南欧视雅科技有限公司)、SG7200HPT型数控超声波清洗器(北京信康亿达科技发展有限公司)、HH.CP-01型二氧化碳培养箱(杭州聚同电子有限公司)、MR-96A型酶联免疫检测仪(深圳迈瑞生物医疗电子股份有限公司)、KJ-201BY型平板振荡器(无锡沃信仪器有限公司)、4-5R型低速冷冻离心机(湖南恒诺仪器设备有限公司)和96孔板(崇川区洋铭办公耗材商行)。
1.1.2细胞株
人肝癌HepG2细胞株购自上海汉博生物科技有限公司。
1.1.3药物及试剂
四氢小檗碱(C20H21O4N,98%)购自上海樊克生物科技有限公司;硅钨酸(H4SiW12O40,分析纯)购自徐州索通生物科技有限公司;甲醇和二甲基亚砜(DMSO)(均为分析纯)均购自广州市芯苑化工有限公司;冰醋酸和三氯乙酸(TCA)(均为分析纯)均购自南通林港化工有限公司;磺酰罗丹明B (SRB,分析纯)购自大连美仑生物技术有限公司;三羟甲基氨基甲烷(Tris,99.9%)购自南京探求生物技术有限公司;三蒸水由佳木斯大学药学院制备。
1.2方法
1.2.1探索合成条件
经前期试验探索及理论分析,设定四氢小檗碱与硅钨酸物质的量比(4 ϑ 1、3 ϑ 1、2 ϑ 1、1 ϑ 1、1 ϑ 2、1 ϑ 3或1 ϑ 4)和溶液pH(1.0、1.5、2.0或2.5)为变量,探索四氢小檗碱与硅钨酸药物共晶合成条件,试验方案见表1。除表1所列四氢小檗碱与硅钨酸物质的量比不同外,各组均精密称取NaCl (10.0 mg,0.17 mmol),均量取甲醇(5.0 mL)和三蒸水(10.0 mL)混合于100 mL烧杯中。5%盐酸溶液调节混合液pH至所设定值,搅拌混合液5 h,将混合液封装入以聚四氟乙烯为内衬的反应釜中(填充度75%),135℃晶化72 h。最后,反应釜随烘箱冷却至室温,观察是否有试验单晶体生成。
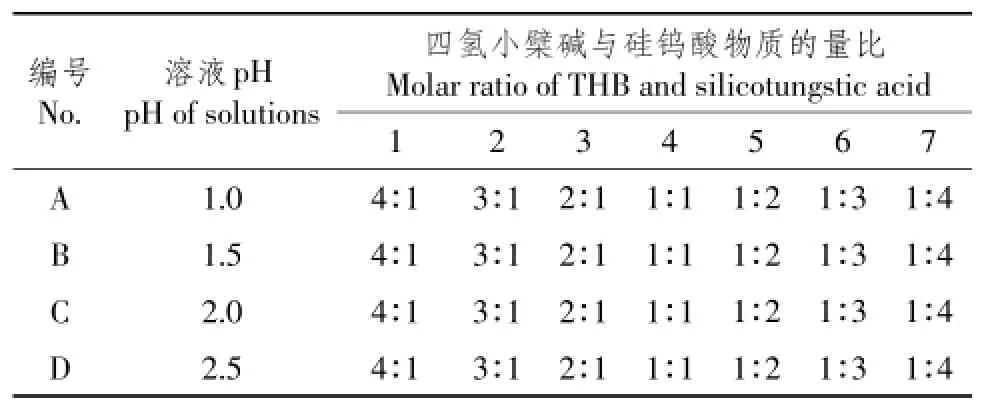
表1 合成条件探索Table 1 Exploration of synthesis conditions
1.2.2产物表征
1.2.2.1单晶结构测试
X-射线单晶衍射法(X-ray single-crystal dif⁃fraction)利用单晶体对X-射线具有衍射效应解析物质结构。X-射线单晶衍射法从原子和分子水平上提供物质三维空间结构数据,可深入了解晶体物质电荷分布、键角、键长、扭转角、构象和立体构型等信息。选取结构规则完整单晶体于X-射线单晶衍射仪上测试并收集数据。测试单晶体尺寸为0.40 mm×0.35 mm×0.35 mm。X-射线单晶衍射法测试选用Mo Kα射线(λ=0.71073 Å),测试温度298(2)K,EosS2CCD探测器,CrysAlisPro软件收集和分析数据。SHELXL-2014程序解析和修正数据。该晶体结构解析和精修方法分别为Patterson法和Full-matrix Least-squares法,晶体学参数见表2。
1.2.2.2红外光谱测试
以连续波长的红外光区电磁波照射测试样品测得吸收光谱即红外光谱(Infrared spectroscopy,IR)。根据红外光谱的谱图信息可推断化合物中化学键、官能团和分子间作用力、氢键等。分别称取适量四氢小檗碱、硅钨酸及试验产物烘箱干燥并KBr压片。IR测试波数在400~4 000 cm-1。
1.2.2.3X-射线粉末衍射测试
X-射线粉末衍射法(X-ray powder diffraction,XRPD)谱图分析确定测试样品晶型变化、结晶度、晶体状态及有无混晶等信息。分别称取适量四氢小檗碱、硅钨酸及试验产物,研磨成粉状并作XRPD测试。X-射线粉末衍射法测试条件:Cu Kα射线(λ=1.54184 Å)、电压50 kV、电量40 mA、扫描速率4°·min-1及2θ在5~60°。

表2 药物共晶(HTHB)4·(SiW12O40)晶体学参数Table 2 Crystallographic data of pharmaceutical cocrystal of(HTHB)4·(SiW12O40)
1.2.2.4热重测试热重分析法(Thermal gravity analysis,TGA)测试物质质量与温度关系,根据热重曲线图推测该化合物热稳定性和组分。使用氧化铝坩埚取适量试验产物热重测试,每分钟升温10℃,最高温度700℃。热重测试过程在N2保护下完成。
1.2.3抗肿瘤活性测试
1.2.3.1细胞培养
细胞培养于含10%胎牛血清、100 U·mL-1链霉素和100 U·mL-1青霉素的DMEM高糖培养基中,将该细胞置于5%CO2培养箱中37℃培养。用细胞培养液将对数期细胞调至5×104个·mL-1。将细胞以190 μL·孔-1接种于96孔板。
1.2.3.2SRB法
细胞培养24 h后,将溶于DMSO中的四氢小檗碱、硅钨酸和药物共晶(HTHB)4·(SiW12O40)测试样品分别加入96孔板中(均设置4个浓度梯度,终浓度为15、30、60和120 μmol·L-1,相同浓度设5个复孔)。试验设空白组(该组无细胞,仅加入细胞培养液和DMSO溶剂)和阴性对照组(该组有细胞,但加入等量DMSO溶剂)。加药培养48 h后,加入40%TCA溶液50 μL·孔-1,4℃孵育1 h,弃去培养液,三蒸水清洗风干。随后,4%磺酰罗丹明B试剂100 μL·孔-1染色30 min,1%冰醋酸溶液洗4遍后风干。每孔加入150 μL Tris溶液(10 mmol·L-1) 振荡30 min,酶联免疫检测仪于492 nm测定吸光度OD。

1.2.3.3统计分析
2 结果与分析
2.1药物共晶合成
将混合液135℃晶化72 h后,体视显微镜下观察反应釜内有无晶体、晶体颜色、尺寸和形态。试验发现B4组,即溶液pH为1.5且反应物物质的量比为1 ϑ 1时,反应釜内出现一种红棕色块状晶体。经数据表征,该红棕色晶体为四氢小檗碱与硅钨酸形成的目标单晶体(按W计算产率为24%)。
2.2晶体结构描述
单晶结构解析结果表明,药物共晶(HTHB)4·(SiW12O40)由四氢小檗碱和硅钨酸离子组成具有三维结构超分子单晶体化合物。其中[SiW12O40]4-由1个硅氧四面体和4个三金属簇W3O13共角相连组成,三金属簇W3O13由3个钨氧八面体共边相连组成。药物共晶(HTHB)4·(SiW12O40)不对称单元中,包含4个四氢小檗碱和2个[SiW12O40]4-,其中[SiW12O40]4-均为其自身对称结构一半(见图1)。三维空间结构中,以Si1为中心原子的[SiW12O40]4-通过氢键等分子间作用力与8个四氢小檗碱连接。同时,以Si2为中心原子的[SiW12O40]4-通过氢键等分子间作用力与12个四氢小檗碱连接。此外,四氢小檗碱与[SiW12O40]4-通过氢键等分子间作用力形成三维超分子结构(见图1)。
2.3红外光谱分析
四氢小檗碱、硅钨酸和药物共晶(HTHB)4· (SiW12O40)红外光谱(见图2)。
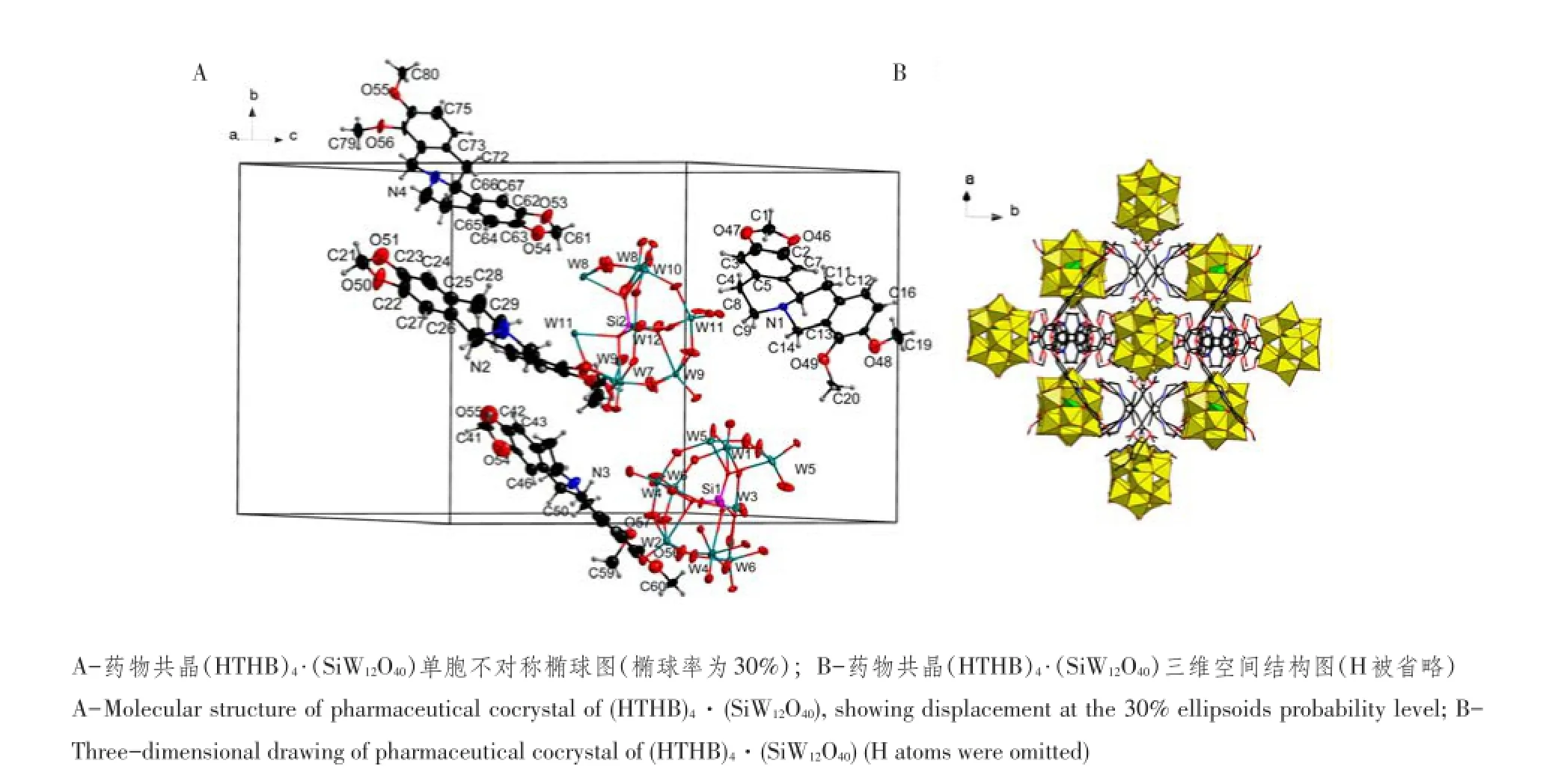
图1 药物共晶(HTHB)4·(SiW12O40)结构Fig.1 Structure of pharmaceutical cocrystal of(HTHB)4·(SiW12O40)

图2 红外光谱对比Fig.2 Comparison of IR spectras
由图2可知,四氢小檗碱与药物共晶(HTHB)4· (SiW12O40)红外光谱中部分峰型及峰位发生改变,如药物共晶(HTHB)4·(SiW12O40)红外光谱图在2 927、2 839和2 835 cm-1处红外吸收峰变宽。推测是氢键等分子间作用力改变药物共晶(HTHB)4· (SiW12O40)红外光谱中峰型及峰位。此外,四氢小檗碱与药物共晶(HTHB)4·(SiW12O40)红外光谱图均出现四氢小檗碱特征吸收峰。由硅钨酸和药物共晶(HTHB)4·(SiW12O40)红外光谱图对比可知,药物共晶(HTHB)4·(SiW12O40)红外光谱图部分峰型及峰位发生改变,在低波数区1 598 cm-1处出现硅钨酸特征吸收峰。可能是由于氢键等分子间作用力改变药物共晶(HTHB)4·(SiW12O40)红外光谱峰位。此外,药物共晶(HTHB)4·(SiW12O40)红外光谱图中在971、919、795和530 cm-1处出现硅钨酸特征吸收峰则几乎未发生变化。进一步说明试验产物为四氢小檗碱与硅钨酸通过氢键等分子间作用力形成药物共晶。
2.4X-射线粉末衍射分析
四氢小檗碱、硅钨酸、药物共晶(HTHB)4· (SiW12O40)及单晶数据模拟的XRPD谱对比结果见图3。图3中该化合物单晶模拟XRPD谱图中峰型和峰位与上述试验产物XRPD谱图中峰型和峰位一致。

图3 XRPD谱图对比Fig.3 Comparison of the XRPD patterns
由图3可知,试验产物XRPD谱图中特征峰与四氢小檗碱和硅钨酸XRPD谱图中特征峰均不同,表明该化合物为新晶相。此外,试验产物XRPD谱图中特征峰与该化合物单晶模拟数据XRPD谱图特征峰一致,表明试验产物为均一纯相。
2.5热重分析
药物共晶(HTHB)4·(SiW12O40)热重曲线见图4。
由图4可知,药物共晶(HTHB)4·(SiW12O40)随温度升高两步失重。第一步失重在180~390℃,总失重32.43%,对应为4个四氢小檗碱分子丢失,理论值为32.14%。390~640℃时,测试曲线呈现一个平台。第二步失重在640℃后,推断为硅钨酸骨架快速分解直至结构坍塌。表明试验产物可能是四氢小檗碱与硅钨酸形成的新化合物。

图4 药物共晶(HTHB)4·(SiW12O40)热重曲线Fig.4 TGA curve of pharmaceutical cocrystal of (HTHB)4·(SiW12O40)
2.6抗肿瘤活性分析
四氢小檗碱、硅钨酸和药物共晶(HTHB)4· (SiW12O40)抗肿瘤试验抑制率对比结果见图5。
由图5可知,硅钨酸在15 μmol·L-1浓度下未表现对人肝癌HepG2细胞抑制活性,随药物浓度增加,硅钨酸肿瘤抑制率增加。四氢小檗碱和药物共晶(HTHB)4·(SiW12O40)对人肝癌HepG2细胞株抑制率也随药物浓度增加而增加。同时药物共晶(HTHB)4·(SiW12O40)对人肝癌HepG2细胞株展现良好抗肿瘤活性,且在相同药物浓度下,药物共晶(HTHB)4·(SiW12O40)抗肿瘤活性明显优于四氢小檗碱和硅钨酸抗肿瘤活性。

图5 抗肿瘤试验抑制率对比Fig.5 Comparison of inhibition ratios of antitumor activities
3 讨 论
朱玉俊指出,溶剂热法在水热法基础上发展而成,在有机溶剂或非水溶剂密闭体系中,一定温度和压力作用下促进混合物合成[16]。王淼研究显示,影响溶剂热法反应因素有溶液pH、反应物物质的量、溶剂极性、晶化时间、晶化温度及模板剂和矿化剂使用等[17]。经前期试验探索及理论分析,该试验合成过程主要影响因素为溶液pH和反应物物质的量。当pH<1.5时,四氢小檗碱分子可能会质子化结构不稳定;当pH>1.5时,硅钨酸离子可能会分解改变反应物物质的量。当四氢小檗碱与硅钨酸物质的量比>1时,四氢小檗碱可能会争夺硅钨酸离子表面结合位点,无法形成稳定分子间相互作用力;当四氢小檗碱与硅钨酸物质的量比<1时,硅钨酸离子表面结合位点可能无法达到饱和,难以形成稳定氢键。因此,当溶液pH为1.5且反应物物质的量比为1 ϑ 1时(B4组),硅钨酸离子和四氢小檗碱恰好可形成数目合适且方向稳定分子间氢键,保证反应物自身结构稳定生成试验产物单晶体。
结构分析发现,四氢小檗碱分子结构中含氮饱和六元环的σ键可绕键轴旋转,形成多种构型;另一方面,四氢小檗碱分子表面有多种质子氢,如芳环质子及饱和烃质子等,是良好的质子氢供体。此外,[SiW12O40]4-具有较大体积(平均直径为10.372 Å)且表面分布有大量电负性氧原子,是优良氢质子受体。因此,[SiW12O40]4-与四种构型的四氢小檗碱分子通过氢键等分子间作用力形成三维超分子结构。
四氢小檗碱分子通过氢键等分子间作用力与表面电荷非定域硅钨酸离子形成药物共晶(HTHB)4· (SiW12O40)后,四氢小檗碱分子表面电荷分布状态发生改变,改变四氢小檗碱活性位点或活性基团表面电荷分布状态,使药物共晶(HTHB)4·(SiW12O40)抗肿瘤活性增强,但相关机理待于后续深入研究。
4 结论
本文采用溶剂热法探索合成四氢小檗碱与硅钨酸药物共晶(HTHB)4·(SiW12O40)。当溶液pH为1.5且四氢小檗碱与硅钨酸物质的量比为1 ϑ1时,反应釜内出现红棕色目标单晶体。并通过X-射线单晶衍射、IR、XRPD和TGA等方法对目标单晶体结构表征。SRB法体外抗肿瘤活性试验结果表明,该化合物对人肝癌HepG2细胞显示较明显抑制活性,在相同药物浓度下药物共晶(HTHB)4·(SiW12O40)抗肿瘤活性明显优于四氢小檗碱和硅钨酸抗肿瘤活性。研究可为促进四氢小檗碱临床药用提供新思路。
[1]邱峰.天然药物化学[M].北京:清华大学出版社,2013:344-410.
[2]Pingali S,Donahue J P,Payton-Stewart F.Tetrahydroberberine,a pharmacologically active naturally occurring alkaloid[J].Acta Crystallog C,2015,71(4):262-265.
[3]洪娟.四氢小檗碱衍生物的合成与抗炎活性研究[D].广州:暨南大学,2013.
[4]Karki S,Frišciá T,Fábián L,et al.Improving mechanical prop⁃erties of crystalline solids by cocrystal formation:New compress⁃ ible forms of paracetamol[J].Adv Mater,2009,21(38-39):3905-3909.
[5]Raza K,Kumar P,Ratan S,et al.Polymorphism:The phenome⁃non affecting the performance of drugs[J].SOJ Pharm and Pharm Sci,2014,1(2):1-10.
[6]Korotkova E I,Kratochvíl B.Pharmaceutical cocrystals[J].Proce⁃dia Chemistry,2014,10:473-476.
[7]张羽男,殷和美,张宇,等.以4,4'-联吡啶为配体的木犀草素药物共晶的合成及表征[J].东北农业大学学报,2015,46(12): 72-78.
[8]Wang Z,Chen J,Lu T.Enhancing the hygroscopic stability ofS-oxiracetam via pharmaceutical cocrystals[J].Cryst Growth Des, 2012,12(9):4562-4566.
[9]边林.药物共晶的设计合成与表征[D].天津:天津大学,2013.
[10]王恩波.多酸化学概论[M].长春:东北师范大学出版社,2009: 289-327.
[11]Miras H N,Yan J,Long D L,et al.Engineering polyoxometalates with emergent properties[J].Chem Soc Rev,2012,41(22):7403-7430.
[12]Pu F,Wang E,Jiang H,et al.Identification of polyoxometalates as inhibitors of basic fibroblast growth factor[J].Mol BioSyst, 2013,9(1):113-120.
[13]Wang X,Liu J,Li J,et al.Synthesis and antitumor activity of cy⁃clopentadienyltitanium substituted polyoxotungstate[CoW11O39(Cp⁃Ti)]7−(Cp=η5-C5H5)[J].J Inorg Biochem,2003,94(3):279-284.
[14]Zhang N,Tai Y,Li M,et al.Main group bismuth(iii),gallium(iii) and diorganotin(iv)complexes derived from bis(2-acetylpyrazine) thiocarbonohydrazone:synthesis,crystal structures and biological evaluation[J].Dalton Trans,2014,43(13):5182-5189.
[15]Yamase T.Anti-tumor,-viral,and-bacterial activities of poly⁃oxometalates for realizing an inorganic drug[J].J Mater Chem, 2005,15(45):4773-4782.
[16]朱玉俊.多金属氧酸盐无机有机杂化材料的水热合成和晶体结构[D].北京:北京化工大学,2007.
[17] 王淼.配位化合物的设计、合成及催化应用研究[D].杭州:浙江大学,2009.
Study on synthesis,characterization and antitumor activity of pharma⁃ceutical cocrystal of(HTHB)4·(SiW12O40)
ZHANG Yunan1,ZHANG Dajun1,ZHANGYu1,YIN Hemei1,LIU Lixin1,ZHANG Xiangyu1,FENG Yanru1,SHA Jingquan1,ZHANG Yunjie1,WANG Chaoxing1,SHEN Yu1,KUANG Haixue2(1.Institute of Pharmacy in Heilongjiang Province,Jiamusi University,Jiamusi Heilongjiang 154007,China;2.Key Laboratory of Chinese Materia Medica,Ministry of Education,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
A new pharmaceutical cocrystal of the tetrahydroberberine(THB)with the silicotungstic acid,(HTHB)4·(SiW12O40),had been explored and synthesized by solvothermal method,and its structure had been characterized by X-ray single-crystal diffraction,IR,XRPD and TGA.X-ray singlecrystal diffraction analysis revealed it belonged to the tetragonal system,space group P4/n,witha= 23.7874(15)Å,b=17.2595(16)Å,c=23.7874(15)Å,V=9 766.1(13)Å3,F(000)=7 496,Z=4.Additionally,in vitroexperi-mental study of the antitumor activity of the title compound had been investigated.The results demonstrated that the title compound exhibited more remarkable activity than parent compounds against human hepatoma HepG2 cells at the same concentration.
tetrahydroberberine;silicotungstic acid;pharmaceutical cocrystal;antitumor activity
R284
A
1005-9369(2016)08-0075-07
2016-05-26
中国博士后科学基金资助项目(2014M561382);佳木斯大学青年基金项目(Lq2012-49)
张羽男(1979-),男,副教授,博士,硕士生导师,研究方向为天然药物共晶制备。E-mail:zhangyunan79@163.com

