ZNF451和TGF-β在胃癌中的表达及其与临床病理特征及预后的相关性研究
戎瑞洲韩志伟李曙晶张燕燕董金垚郭建昇
ZNF451和TGF-β在胃癌中的表达及其与临床病理特征及预后的相关性研究
戎瑞洲①韩志伟①李曙晶①张燕燕①董金垚①郭建昇①
目的:探讨锌指转录因子451(ZNF451)在胃癌发生、发展过程中的作用及其与血管内皮生长因子(TGF-β)的相关性。方法:用组织芯片和免疫组织化学法检测144例胃癌组织及对应癌旁组织中ZNF451、TGF-β的表达。结果:ZNF451在胃癌中阳性表达率为71.5%,高于癌旁组织的18.8% (P<0.01);TGF-β在胃癌中阳性表达率为79.9%,高于癌旁组织的9.1%(P<0.01)。ZNF451和TGF-β表达均与胃癌分化程度、浸润深度、有无淋巴结转移和TNM分期相关(P<0.05);胃癌组织中ZNF451表达和TGF-β表达正相关(P<0.05)。单因素生存分析显示,ZNF451和TGF-β高表达均与生存时间呈负相关(P<0.05)。Cox多元回归分析提示,ZNF451阳性胃癌和TGF-β阳性胃癌的预后更差(P<0.05)。结论:ZNF451在胃癌组织中高表达,并可能与TGF-β在胃癌的发生和发展过程中起协同作用,ZNF451结合TGF-β可作为胃癌预后的预测因子。
胃癌; 免疫组织化学; ZNF451; TGF-β; 预后
First-author’s address:The First Hospital of Shanxi Medical University,Taiyuan 030001,China
目前,就全球而言胃癌(gastric carcinoma,GC)以占各种恶性肿瘤的第二位和第三位的发病率和死亡率成为了最常见的消化道恶性肿瘤,并且其差的预后不仅对人民的生命健康构成了重大的威胁还给人们造成了沉重的经济负担[1],我国作为一个欠发达的发展中国家,这种情况愈发的明显[2]。目前,在诸多治疗胃癌的手段方法中,手术是有明确的疗效的值得肯定的治疗策略[3],但是大多数患者因胃癌早期症状不明显在就诊时即确诊为进展期胃癌,错失手术良机并不能达到满意的治疗效果。因此,进一步研究胃癌发生发展的分子学机制,开发新的靶向治疗的靶点,对手术治疗进行进一步的补充显得极为重要且迫切[4]。研究发现,ZNF451在细胞的生长增殖过程中起着不同的作用,一方面其能通过减弱TGF-β信号通路从而对细胞的生长起到阻滞效应;另一方面其直接抑制E-cadherin在细胞中的表达从而使得上皮细胞具有向间充质细胞转变的倾向[5]。TGF-β在肿瘤发生发展的过程中起着双面的作用,在早期它能够通过抑制细胞生长从而起到抑癌基因的作用,在肿瘤进程的后期TGF-β具有促进肿瘤的侵袭和转移的作用,使患者的预后变得更差[6]。目前尚未有对ZNF451在胃癌发生发展中作用的研究,本文采用免疫组化法检测ZNF451 和TGF-β在胃癌组织中的表达情况,通过对两者的表达情况与胃癌临床病理特征进行统计学分析,从而期望能在胃癌的分子学机制与靶向治疗方面做出贡献。
1 材料与方法
1.1材料 选取2010年1月-2013年12月本院行胃癌根治术、术后病理诊断明确、临床资料完整的、术前未行放化疗的术后石蜡标本作为研究对象,通过对HE切片的复阅,选取癌组织及对应的癌旁组织144例,所有病例病理报告均为腺癌。其中,男111例,女33例;年龄>60岁组67例,≤60岁组77例;TNM分期Ⅰ~Ⅱ期50例,Ⅲ~Ⅳ期94例;有淋巴结转移者107例,无淋巴结转移者37例。
1.2主要试剂 ZNF451 antibody (Sigma),兔抗人TGF-β抗体(武汉博士德生物工程有限公司),羊抗鼠/兔二抗(福州迈新生物技术开发有限公司),DAB显色试剂盒(北京中杉金桥生物技术有限公司)。
1.3免疫组织化学
1.3.1组织芯片制备 使用组织芯片蜡块制备仪(CHLOE,北京)制备受体蜡块,按照实验设计采用10×6阵列(间距1 mm、内径2.2 mm)。按病理号调取所有HE染色玻片,镜下复读并于病变典型部位做一记号标记,然后在供体蜡块上相应位置做标记,使用配套的取样套针穿刺取材,并将获得的组织芯小心地注入受体蜡块孔内,于受体蜡块的右下角两个孔留空白以供定位之用。制备好的组织芯片常规4 μm厚连续切片,将其敷贴于免疫组化专用载玻片上,恒温箱烤片,70 ℃过夜。
1.3.2免疫组织化学染色 将过夜烤片的切片按实验步骤过缸,分别进行脱蜡,水化,消除内源性过氧化物酶,使用PBST漂洗后进行高温高压热修复,冷却至室温,滴加一抗(ZNF451抗体浓度1∶200,TGF-β抗体浓度1∶200)4 ℃过夜,PBST漂洗,加入羊抗鼠/兔二抗,37 ℃孵育20 min,PBST漂洗行DAB显色,镜下观察显色程度,及时以自来水中止显色反应,苏木素复染3 min,盐酸乙醇分化,脱水后中性树胶封片保存。以PBS作阴性对照。
1.3.3结果判断标准 每张切片高倍镜下随机选取5个视野,观察并记录细胞染色强度:细胞无显色0分;细胞浅黄色,1分;细胞棕黄色,2分;细胞黄褐色,3分。记录阳性细胞占肿瘤实质细胞的百分比:阳性细胞数占肿瘤实质细胞≤25%,1分;25%<阳性细胞数占肿瘤实质细胞≤50%,2分;50%<阳性细胞数占肿瘤实质细胞≤75%,3分;阳性细胞数占肿瘤实质细胞>75%为4分。阳性细胞比例与细胞染色强度计分的乘积为每例标本的最终积分。<3分为阴性(-),≥3分为阳性(+)。所有切片染色结果均由两名病理医师独立评分。
1.4随访 以手术日为随访起始日期,以患者死亡或随访截止日期(2015年10月1日)为随访终点,通过查阅患者复诊情况、电话联系等方式进行。随访时间长度21~70个月,中位随访时间45个月,共随访94例,随访率65.3%。
1.5统计学处理 运用SPSS 20.0统计学软件处理数据,计数资料采用x2检验,同时采用Spearman秩相关分析、Kaplan-Meier生存分析、Log-rank检验、Cox回归分析法等方法进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1胃癌组织、对应癌旁组织中ZNF451和TGF-β的表达 ZNF451蛋白在胃癌(图1A)、癌旁组织(图1B)中均有不同程度的表达,表达信号为棕黄色,定位于细胞质。胃癌组织和癌旁组织ZNF451蛋白阳性表达率分别为71.5%(91/144)、18.8% (27/144),比较差异有统计学意义(x2=80.9,P<0.001);胃癌组织中ZNF451的表达水平明显高于其对应的癌旁组织。TGF-β蛋白在胃癌(图1C)、癌旁组织(图1D)中均有不同程度的表达,表达信号为棕黄色,定位于细胞质。胃癌组织和癌旁组织TGF-β蛋白阳性表达率分别为79.9% (115/144)、9.1%(13/144),比较差异有统计学意义(x2=146.3,P<0.001);胃癌组织中TGF-β的表达水平明显高于其对应的癌旁组织。
2.2胃癌组织中ZNF451和TGF-β的表达与相关临床参数的关系 胃癌组织ZNF451表达在肿瘤TNM分期、淋巴结转移、浸润深度、肿瘤大小中的差异均有统计学意义(P<0.05),年龄、性别、分化程度中的差异均无统计学意义(P>0.05)。TGF-β表达在肿瘤TNM分期、淋巴结转移、浸润深度、肿瘤大小中的差异有统计学意义(P<0.05),年龄、性别、分化程度中的差异无统计学意义(P>0.05),见表1。
2.3胃癌组织中ZNF451和TGF-β的表达的相关性 103例ZNF451阳性的胃癌组织中有89例TGF-β表达阳性,14例TGF-β表达阴性;115例TGF-β阳性的胃癌组织中有89例ZNF451表达阳性,26例ZNF451表达阴性。Spearman相关分析显示,ZNF451和TGF-β高蛋白表达的相关性有统计学意义,两者表达呈正相关(r=0.259,P=0.002)。
2.4胃癌生存预后的Cox多元回归分析 将与生存相关的各项指标均纳入单因素分析,结果提示:肿瘤TNM分级、肿瘤大小、淋巴结转移、浸润深度与患者生存期相关,ZNF451和TGF-β高表达均与生存时间呈负相关(P<0.05)。将上述临床病理因素和ZNF451、TGF-β均纳入Cox比例风险模型进行多因素分析,结果显示:肿瘤TNM分级(RR=10.519)、ZNF451(RR=0.083)、TGF-β (RR=0.326)均为独立危险因素,见表2。
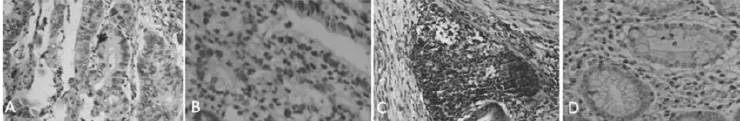
图1 ZNF451和TGF-β蛋白在胃癌和癌旁组织中的表达(S-P,×200)注:图A为胃癌组织中ZNF451表达;图B为癌旁组织中ZNF451表达;图C为胃癌组织中TGF-β表达;图D为癌旁组织中ZNF451TGF-β表达
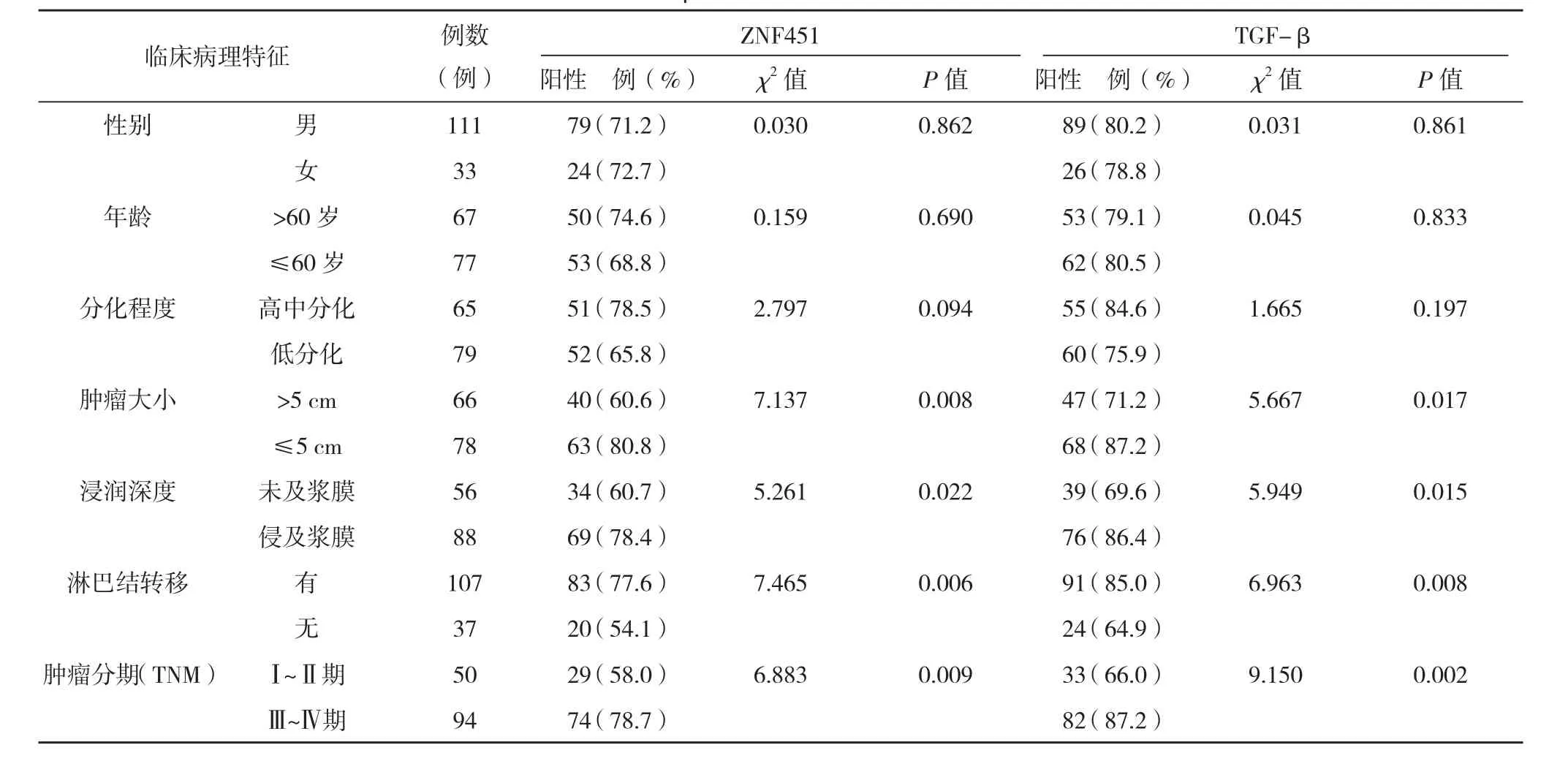
表1 ZNF451和TGF-β的表达与胃癌临床病理参数之间的关系
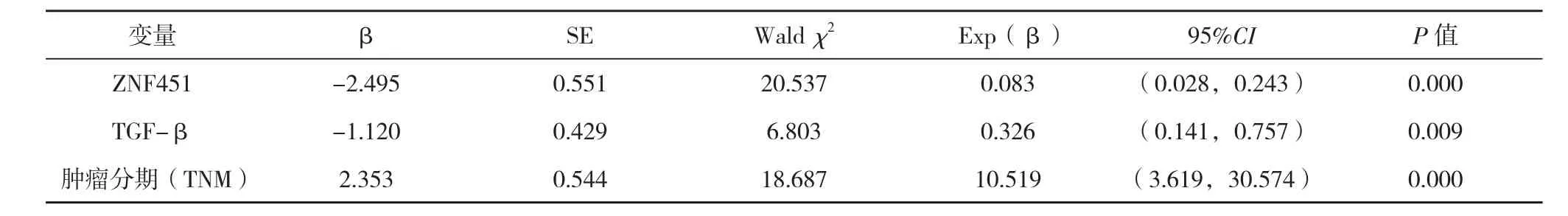
表2 影响胃癌预后的多因素分析
3 讨论
胃癌(gastric carcinoma,GC)因其高的发病率和死亡率而成为了一种常见的消化道恶性肿瘤[1],据相关报告,全球每年有将近100万的新发病的胃癌患者,其中我国约为40万余,因胃癌死亡的患者约为80万,我国有将近28万,由此可见我国胃癌的发病率和死亡率之高[2]。概因胃癌的早期症状不典型,不易发现,确诊时大多数为进展期,且由于化疗的毒副作用及耐药往往使晚期胃癌患者生存期更短,手术根治的机会少,因此需进一步研究其发病机制,为早期胃癌的鉴别诊断、术后跟踪观察和新的可能的靶向治疗方案的靶点,亟需在早期诊断的方法和治疗胃癌的技术方面取得新的进展[4]。
上皮细胞向间充质细胞转化(EMT)是近年来细胞生物学领域的一大重大发现,这一过程在胚胎发育的过程、组织再生修复以及上皮细胞肿瘤恶变侵袭能力增强等方面都有起着重要的作用。EMT过程中存在着上皮细胞解离、重塑并向远处迁徙的现象。许多不同种类的细胞因子参与到EMT早期的过程,导致了基质分子的降解。细胞自身表达的TGF-β、EGF、IGF-Ⅱ和FGF-2可以起到促进EMT过程的作用[7-8]。上皮细胞具有极性并且相互之间具有紧密连接的结构,在EMT的过程中,上皮细胞失去这些特点转而具有了间充质细胞的特征,离开上皮细胞自身所在的区域并游离渗透进入周围组织[9],在上皮细胞EMT过程中,TGF-β信号通路起到了重要的作用,向培养的上皮细胞中(如MCF1OA,NMuMG和MDCK)加入TGF-β,使细胞培养的微环境中TGF-β浓度升高就能观察到EMT现象的频率明显升高[10-11]。肿瘤的侵袭转移是通过侵袭基质并突破基底膜实现的,细胞破坏了细胞间的粘连结构并浸润到周围组织是恶性肿瘤的特征[12]。
ZNF451属于属于锌指蛋白家族成员,为近年来这一家族的新成员,该蛋白具有11个锌指结构,其富含酸性氨基酸的N端和C端分别具有SIM及UIM特征结构域。有文献报道,ZNF451定位于细胞核内亚结构PML(promyelocytic leukaemia)小体里,并通过SUMO化系统行使相关功能[13]。研究发现,ZNF451在细胞的生长增值过程中起着不同的作用,一方面其能通过减弱TGF-β信号通路从而对细胞的生长起到阻滞效应;另一方面其直接抑制E-cadherin在细胞中的表达从而使得上皮细胞具有向间充质细胞转变的倾向,认为ZNF451可能在癌症细胞的增殖、发展和远处侵袭转移的过程起着重要作用[5,13]。
TGF-β在肿瘤发生发展的过程中起着双面且截然不同的相反的作用,在早期,它能够通过抑制细胞生长从而抑制肿瘤发生起到抑癌基因的作用,在肿瘤发展的后期,TGF-β具有通过促进肿瘤细胞的侵袭和转移的作用,而使得患者的预后变得更差。一方面,在体外实验已经证实了TGF-β具有使肾细胞癌、甲状腺癌等的进程延缓的作用[14-16];研究发现部分TGF-β受体表达缺失的瘤细胞可以通过逃逸TGF-β介导的负性调控作用从而迅速增殖[17]。另一方面,高水平的TGF-β在乳腺癌中起到了促进癌细胞的浸润与转移的作用[18-19];在裸鼠成瘤实验中,向结肠癌细胞株中转染TGF-β1反义寡核苷酸表达质粒可降低其致瘤性[20];还有研究证实TGF-β1 高表达与胃癌患者的不良预后相关,其高表达与年轻患者、女性患者、远端胃癌、低分化胃癌、弥漫型胃癌和淋巴结转移患者的不良预后相关[21-23]。
目前关于ZNF451在胃癌发生演进中作用的研究未见报道,ZNF451对胃癌的影响及其与TGF-β作用有无相关性未见有相关报道,因此值得研究探讨其在胃癌细胞及癌旁组织中的表达情况有无差异性,进一步研究ZNF451在胃癌的发生发展、浸润及转移过程中与TGF-β有无相关性,或可阐明它们之间的相互作用机制,找到针对特定或某个位点的关键靶点,为胃癌的临床治疗提供新的肿瘤标志物、治疗思路或方案。实验结果发现,与癌旁组织相比胃癌组织中ZNF451和TGF-β蛋白表达强度和表达率显著升高。统计学分析发现,胃癌组织ZNF451蛋白表达与下列因素相关:(1)与肿瘤分期呈正相关,Ⅲ、Ⅳ胃癌中的表达明显高于Ⅰ、Ⅱ期;(2)与TGF-β蛋白表达相关,可能与TGF-β蛋白在胃癌的发生发展中起协同作用;(3)与患者的生存期呈负相关,表达阳性患者生存期显著低于表达阴性患者。上述结果表明其与胃癌的恶性生物学行为呈正相关,提示ZNF451具有促进肿瘤生长、侵袭的功能。因此认为检测胃癌组织ZNF451和TGF-β表达可能预测胃癌的预后也可能从相同TNM分期的病例中区分出高危亚组和预后较好亚组,根据胃癌组织中ZNF451和TGF-β表达进行分类,更有助于区分术后高危患者和通过调控ZNF451的表达对TGF-β相关的信号转导通路进行影响而改善预后。
[1] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J]. CA:A Cancer Journal for Clinicians,2011,61(1):69-90.
[2] Chen W Q,Zheng R,Baade P D,et al.Cancer statistics in China,2015[J].Ca A Cancer Journal for Clinicians,2016,66 (2):115-132.
[3]周凯凯,张建文,黄仁峰,等.117例胃体癌手术切除方式分析[J].中国医学创新,2014,11(1):3-5.
[4] Alexra T,Ari R.Targeted therapy in gastric cancer[J].Apmis,2015,123(5):365-372.
[5] Feng Y,Wu H,Xu Y,et al.Zinc finger protein 451 is a novel Smad corepressor in transforming growth factor-β signaling[J]. Journal of Biological Chemistry,2014,289(4):2072-2083.
[6] Fitchev P P,Wcislak S M,Lee C,et al.Thrombospondin-1 regulates the normal prostate in vivo through angiogenesis and TGF-β activation[J].Laboratory Investigation,2010,90(7):1078-1090.
[7] Yoshida K,Murata M,Yamaguchi T,et al.Reversible human TGF-β signal shifting between tumor suppression and fibrocarcinogenesis:implications of Smad phospho-isoforms for hepatic epithelial-mesenchymal transitions[J].Journal of Clinical Medicine,2015,5(1):573.
[8] Chen X,Wang Y,Xia H,et al.Loss of E-cadherin promotes the growth, invasion and drug resistance of colorectal cancer cells and is associated with liver metastasis[J].Molecular Biology Reports,2012,39(6):6707-6714.
[9] Xu J,Samy,Lamouille,et al.TGF-β-induced epithelial to mesenchymal transition[J].Cell Research, 2009,90(2):156-172.
[10] Portella G,Cumming S A,Liddell J,et al.Transforming growth factor beta is essential for spindle cell conversion of mouse skin carcinoma in vivo: implications for tumor invasion[J].Cell Growth & Differentiation the Molecular Biology Journal of the American Association for Cancer Research,1998,9(5):393-404.
[11] Oft M,Heider K H,Beug H.TGFβ signaling is necessary for carcinoma cell invasiveness and metastasis[J].Current Biology,1998,8(23):1243-1252.
[12] Cano A,Pérezmoreno M A,Rodrigo I,et al.The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression[J].Nature Cell Biology,2000,2(2):76-83.
[13] Karvonen U,Jääskeläinen T,Rytinki M,et al.ZNF451 is a novel PML body- and SUMO-associated transcriptional coregulator[J].Journal of Molecular Biology,2008,382(3):585-600.
[14] Mincione G,Tarantelli C,Vianale G,et al.Mutual regulation of TGF-β1,TβRⅡ and ErbB receptors expression in human thyroid carcinomas[J].Experimental Cell Research,2014,327 (1):24-36.
[15] Brace M D,Wang J,Petten M,et al.Differential expression of transforming growth factor-beta in benign vs. papillary thyroid cancer nodules;a potential diagnostic tool[J]. Journal of Otolaryngology-head & Neck Surgery,2014,43 (1):1-6.
[16] Jing X,Ying L,Li J,et al.High expression of long non-coding RNA lncRNA-ATB is correlated with metastases and promotes cell migration and invasion in renal cell carcinoma[J].Acta Pharmacologica Sinica,2016,26(9):1069-1075.
[17]马久力,周语平.TGF-β和PDGF在肝纤维化进程中的研究进展[J].中国医学创新,2011,8(26):192-193.
[18] Park S Y,Kim M J,Park S A,et al.Combinatorial TGF-β attenuation with paclitaxel inhibits the epithelial-to-mesenchymal transition and breast cancer stem-like cells[J].Oncotarget,2015,6(35):37 526-37 543.
[19] Wahdanalaswad R,Harrell J C,Fan Z,et al.Metformin attenuates transforming growth factor beta (TGF-β) mediated oncogenesis in mesenchymal stem-like/Claudin-low triple negative breast cancer[J].Cell Cycle,2016,15(8):1046-1059.
[20] Yitao J,Suqiao Z,Lingling M,et al.Activation of platelet protease-activated receptor-1 induces epithelial-mesenchymal transition and chemotaxis of colon cancer cell line SW620[J]. Oncology Reports,2015, 33(6):2681-2688.
[21] Xu J,Attisano L.Mutations in the tumor suppressors Smad2 and Smad4 inactivate transforming growth factor beta signaling by targeting Smads to the ubiquitin-proteasome pathway[J]. Proceedings of the National Academy of Science,2000,97 (9):4820-4825.
[22] Park K,Kim S J,Bang Y J,et al.Genetic changes in the transforming growth factor beta (TGF-beta) type II receptor gene in human gastric cancer cells:correlation with sensitivity to growth inhibition by TGF-beta[J].Proceedings of the National Academy of Sciences,1994,91(19):8772-8776.
[23]汪玖川.胃癌患者围术期血清TGF-β1、TNF-α及IL-2水平变化研究[J].中国医学创新,2012,9(1):12-13.
The Expression of ZNF451 and TGF-β in Gastric Cancer and Their Association with Clinicopathological and Prognostic Significance
RONG Rui-zhou,HAN Zhi-wei,LI Shu-jing,et al.
Medical Innovation of China,2016,13(23):001-005
Objective:To investigate the correlation of the expression of zinc finger transcription factor 451 (ZNF451) and transforming growth factor beta (TGF-β) with the carcinogenesis and tumor progression in human gastric cancer. Method:Immunohistochemical method (SP) was used to detect the expression of ZNF451 and TGF-β protein in 144 cases human gastric cancer tissues and para-carcinoma tissues.Result:The positive rate of ZNF451 and TGF-βin gastric cancer tissues were 71.5%,79.9%,higher than that para-carcinoma tissues of 18.8%,9.1%(P<0.01).The expressions of ZNF451 and TGF-β related to size of tumor,depth of invasion,TNM staging,and lymph node metastasis(P<0.05).ZNF451 and TGF-βexpression in gastric cancer tissue had positive correlation(P<0.05).Single factor survival analysis showed that ZNF451 and TGF-βhigh expression were negatively correlated with survival time(P<0.05).The prognosis of ZNF451 positive gastric cancer and TGF-positive gastric cancer were even worse(P<0.05).Conclusion:ZNF451 highly expresses in gastric cancer,and might promote the occurrence and progression of gastric cancer in correlation with VEGF.
Gastric; Cancer; ZNF451; TGF-β; Prognosis
10.3969/j.issn.1674-4985.2016.23.001
①山西医科大学第一医院 山西 太原 030001
郭建昇
2016-03-28) (本文编辑:蔡元元)

