达氏鲟精巢细胞消化分离和超低温冷冻保存
颉 璇,厉 萍,席萌丹,3,郭 威,3,乔新美,杜 浩,刘志刚,危起伟,3
(1.西南大学生命科学学院,重庆 400715;2.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉 430223;3.中国科学院水生生物研究所,武汉 430072)
达氏鲟精巢细胞消化分离和超低温冷冻保存
颉璇1,2,厉萍2,席萌丹2,3,郭威2,3,乔新美2,杜浩2,刘志刚2,危起伟1,2,3
(1.西南大学生命科学学院,重庆400715;2.农业部淡水生物多样性保护重点实验室,中国水产科学研究院长江水产研究所,武汉430223;3.中国科学院水生生物研究所,武汉430072)
通过研究两种酶对精巢细胞的消化效果,探究抗冻剂、降温程序、糖类和卵磷脂对达氏鲟(Acipenserdabryanus)精巢细胞冻存效果的影响,获得消化冻存后高存活率的细胞。实验使用0.25%胰蛋白酶和2 mg/mL胶原酶 H+500 U/mL中性酶II的组合酶对达氏鲟精巢细胞进行消化,获得不同消化时间内的活细胞数量。另外,还研究了冷冻稀释液中分别添加10% 二甲基亚砜(DMSO)、乙二醇(EG)、甲醇(MET)作为抗冻剂,采用-1 ℃/min慢速降温以及直接投入液氮中的快速降温方法冻存,冷冻稀释液采用D-海藻糖或同浓度D-蔗糖,以及添加5%、8%、11%卵磷脂对冻存效果的影响。结果显示:两种消化酶在同一时间消化所得的活细胞数和活细胞率无显著差异,并且都在3 h获得最多活细胞。慢速降温的冻存效果极显著地好于快速降温(P=0.01)。不同抗冻剂的保存效果差异显著,复苏后细胞相对存活率EG(51.70%±5.24%)>MET(45.09%±3.15%)>DMSO(40.18%±3.90%)。不同糖对达氏鲟精巢细胞冻存效果无显著影响;不同浓度的卵磷脂冻存效果有极显著差异。含8%卵磷脂的冻存液对细胞的冻存效果最好,细胞存活率可达(93.55±2.56)%,培养10 d后细胞数目为0 d时的3.19倍。
达氏鲟(Acipenserdabryanus);胰蛋白酶;冷冻保存;抗冻剂;卵磷脂
达氏鲟(Acipenserdabryanus)属鲟形目鲟科鲟属,又名沙腊子、长江鲟,是我国特有物种,为淡水定居性鲟鱼类[1],主要分布于金沙江下游及长江上游,具有较高的经济价值和科研价值。近30年来,由于葛洲坝工程的兴建以及长江上游的环境污染、过度捕捞等原因,达氏鲟的资源已极为稀少[2-3],1990年以来未发现其自然繁殖,物种以人工群体维持延续,亟待加强其保护及其相关研究。
鱼类种质资源保护和利用的策略包括个体水平以及细胞水平上的遗传保护。目前鱼类精子的超低温保存技术已较为成熟,近年有关其他种质细胞的研究也逐步深入,其中有不少学者将研究集中于鱼类生殖细胞的体外保存,与细胞移植技术结合,为鱼类种质细胞的保存开辟了新的领域[4]。由于达氏鲟个体较大,性成熟时间长,因此养殖成本较高,通过对达氏鲟精巢细胞的保存可以有效地降低成本;此外,保存达氏鲟精巢细胞可以保护达氏鲟的遗传多样性,同时还可借助同种生殖细胞移植技术产生具有遗传多样性的可育后代,应用于保种和人工增殖放流。
对于细胞的超低温冷冻保存研究,在哺乳动物中,目前已经有胚胎细胞、成纤维细胞、造血干细胞及生殖细胞冻存的报道[5-9]。在鱼类中,丁鱥[10]、虹鳟[11]等鱼类成功地保存了生殖细胞。目前,有学者研究了西伯利亚鲟精原细胞与卵原细胞的分离保存方法[12],将分离后的细胞移植入小体鲟体内并成功增殖[13],而对于达氏鲟种质细胞保存等方面的研究尚未见报道。本试验研究了两种酶对达氏鲟精巢细胞的消化效果,并从抗冻剂、降温程序、糖类和卵磷脂四个角度探讨了最适宜达氏鲟精巢细胞的冷冻保存方案。为鲟鱼类精巢细胞的体外保存提供有效的理论依据和技术方案,为达氏鲟的生殖细胞移植做必要准备。
1 材料与方法
1.1实验材料
本实验所用达氏鲟来自长江水产研究所荆州市太湖中华鲟养殖基地。所用精巢样本采集自20—24月龄雄性达氏鲟,该年龄的达氏鲟精巢处于II期末期。共12尾,体质量为( 6.27±0.83) kg;全长为( 107.33±2.11) cm。
1.2主要试剂
胰蛋白酶粉末(Worthington);2.5% 胰蛋白酶-EDTA (Gibco);胶原酶H(Roche);D-海藻糖(Biosharp);胎牛血清(FBS,四季青);二甲基亚砜(DMSO,Wako);Dipsae II,L-15 培养液,DNase I,D-蔗糖,卵磷脂,牛血清白蛋白(BSA)均购自Sigma公司。表皮细胞生长因子(EGF),碱性成纤维细胞生长因子(bFGF)购自普飞生物。甲醇(MET)、乙二醇(EG)为国产分析纯。
1.3溶液配制
(1)冷冻稀释液I:50 mmol/L D-海藻糖,5 mg/mL BSA,200 mL/L胎牛血清,溶于PBS (pH 8.0);再加入青霉素 200 units/mL,链霉素 20 mg/L,两性霉素B 50 mg/L;于0.2 μm过滤灭菌。
冷冻稀释液II:50 mmol/L D-蔗糖,5 mg/mL BSA,200 mL/L胎牛血清,溶于PBS (pH 8.0);再加入青霉素 200 units/mL,链霉素 20 mg/L,两性霉素B 50 mg/L;于0.2 μm过滤灭菌。
(2)消化酶溶液:
a.5% 胰蛋白酶溶液 50 μL;胎牛血清 50 μL;胶原酶 H 100 μL;1% DNaseI 50 μL ;L-15培养液 750 μL,制成1 mL 0.25%胰蛋白酶消化液。于0.2 μm无菌过滤,现用现配。
B.50 μL 40 mg/mL胶原酶H,50 μL 10 000 U/mL 中性酶II,900 μL L-15 培养液;制成1 mL 2 mg/mL胶原酶 H+500 U/mL中性酶II组合酶溶液。于0.2 μm无菌过滤,现用现配。
1.4方法
1.4.1达氏鲟精巢细胞悬液制备
将雄性达氏鲟鱼体全身消毒,带入无菌间。迅速摘取无菌双侧精巢,置于盛有适量磷酸缓冲液(PBS,pH7.2~7.4)和抗生素(青霉素、链霉素及两性霉素B)的培养皿中;剥去组织外膜和血管,将精巢组织剪碎至1 mm3小块。精巢组织块用L-15培养液加抗生素反复清洗,1 000 r/min,4 ℃离心5 min;重复清洗三次以上。将精巢组织放入事先称重的离心管内称重,以组织块∶消化液=1∶4(w/v)分别加入胰蛋白酶溶液及组合酶溶液,将其移至六孔板内,分别放置于20 ℃和25 ℃(分别为0.25%胰蛋白酶和组合酶的最适温度)培养箱中消化,每30 min吹打一次。消化2、3、4、5 h时加入胎牛血清终止消化,40 μm滤网过滤;滤液以1 000 r/min,4 ℃离心5 min。再用1 mL L-15+20% FBS溶液重悬细胞。并于显微镜下测定细胞活率。实验重复6次,用于实验的雄性达氏鲟6尾。
1.4.2细胞存活率测定
取少量细胞悬液和0.4% 台盼蓝溶液1∶1(v/v)混合后,显微镜下(40×,Leica,Germany)用血球计数板计细胞总数以及细胞存活率。
1.4.3细胞冻存
(1)抗冻剂和降温方法筛选
在冷冻稀释液I中分别添加10% DMSO,10% EG及10% MET作为抗冻剂,制成三种细胞冷冻保存液。设置两种降温程序:Cryo-I:慢速降温:冰上平衡15 min,然后使用程序降温盒,以1 ℃/min的速率降温至-80 ℃,在-80 ℃停留30 min,投入液氮中。Cryo-II:快速降温:冰上平衡15 min,然后直接投入液氮中。将以上三种细胞冷冻保存液和两种降温程序两两配伍,共设置6种保存方法。将精巢组织用0.25%胰酶消化2 h,检测细胞活率后重新离心,用细胞冷冻保存液以1×105个/mL重悬细胞,分装至冻存管中,再分别用两种降温方式冻存。每个实验样本保存3管,实验重复3次,用于实验的雄性达氏鲟3尾。
(2)糖和卵磷脂浓度筛选
在冷冻稀释液I和冷冻稀释液II中分别添加10% EG。制成两种细胞冷冻保存液。在冷冻保存液中分别添加0%(空白对照),5%,8%,11% 卵磷脂,于0.2 μm过滤除菌。将以上两种细胞冷冻保存液和4个浓度的卵磷脂两两配伍,共设置8种保存方法。将精巢组织用0.25%胰酶消化2 h,检测细胞活率后重新离心,用细胞冷冻保存液以1×105个/mL重悬细胞,分装至冻存管中。冰上平衡15 min,然后使用程序降温盒,以1 ℃/min的速率降温至-80 ℃,在-80 ℃停留30 min,投入液氮中。每个实验样本保存3管,实验重复3次,用于实验的雄性达氏鲟3尾。
1.4.4细胞复苏及复苏率测定
从液氮中取出冷冻管,迅速放置于37 ℃水浴35 s,使其恰好融化,用适量L-15+10% FBS离心清洗细胞3次(1000 r,4 ℃离心5 min);显微镜下台盼蓝染色计算细胞活率,观察复苏细胞形态,每次取样统计细胞总数不低于800个。并将上述实验方案细胞存活率最高的复苏后接种于12孔板中,L-15+20% FBS+25 ng/mL EGF+25 ng/mL bFGF作为培养液,25 ℃恒温培养箱中培养,观察细胞生长状况。
1.5统计分析
本实验中,不同酶对达氏鲟精巢细胞的消化效果结果采用t-检验(t-test)分析;降温方式、抗冻剂、糖及卵磷脂对精巢细胞冻存效果的研究采用双因素方差分析(Two-Way ANOVA)进行统计分析。所有统计检验均应用spss 19.0软件执行。
2 结果
2.1不同酶对达氏鲟精巢细胞的消化效果
两种酶在不同时间的消化效果如表1。通过t检验分析,0.25% 胰蛋白酶和胶原酶+中性酶的组合酶在同一时间消化获得的活细胞数无显著差异(P>0.05)。两种酶均在精巢组织被消化3 h可获得最多的活细胞。
2.2降温方法和抗冻剂对细胞活率的影响
学生要提高自我约束的能力。[4]高职院校管理相对高中较为松散,而学生的自我控制能力较差,容易导致整体学习积极性不高,学习风气差。因此,学校要加强管理,学生要强化自我约束意识,加强纪律观念,时刻铭记校风校纪,并以校风校纪约束自己。
对降温方法、抗冻剂进行双因素方差分析,结果显示,降温方法、抗冻剂交互作用不显著(P>0.05),两种降温方法对冻存细胞存活率的影响差异极显著(P<0.05),三种抗冻剂对细胞的保存效果也具有显著差异(P<0.05);从表2可看出,使用慢速降温法的细胞存活率都高于使用快速降温法的细胞;其中,EG作为抗冻剂保存的细胞冻存效果最好;复苏后活细胞率为冻存前活细胞率的(51.70±5.24)%;而MET作为抗冻剂冻存的效果差于EG,DSMO的冻存效果最差。使用DMSO、EG、MET作为抗冻剂,通过快速降温法保存的细胞相对存活率较低。显微镜观察细胞形态,用慢速降温复苏后的细胞多数呈现透明、圆形饱满良好的活细胞形态,而采用快速降温保存的细胞复苏后形态都有不同程度的破坏,细胞发生变形、破碎。
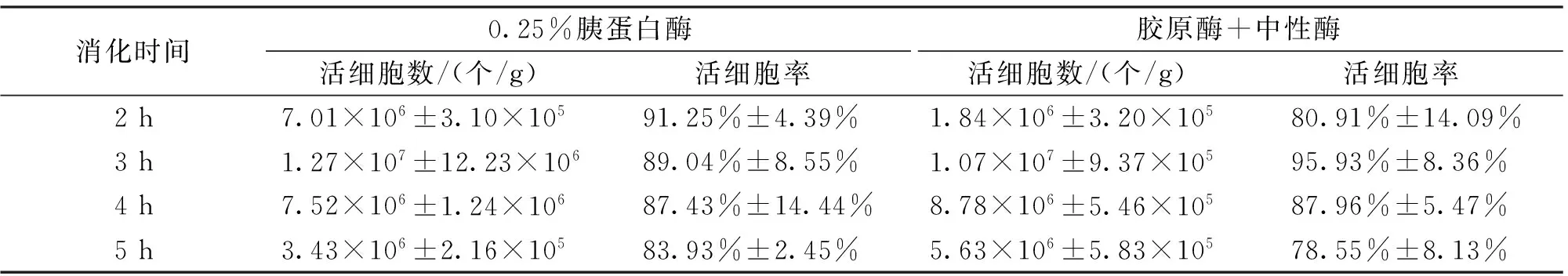
表1 不同酶消化达氏鲟精巢细胞的活细胞数量Tab.1 The quantity of living cells digested with two different types of enzymes.
注:图中显示数据表示平均数±标准差(n=6)。两种酶消化效果无显著差异(P>0.05)。

表2 不同抗冻剂和降温方式保存细胞相对存活率 (n=3)Tab.2 Relative percentage of living cells cryopreserved by different cryoprotectants and freezing rate (n=3)
注:如图所示细胞相对存活率±标准差;双因素方差分析得出降温方法、抗冻剂交互作用不显著(P>0.05),不同降温方法对冻存细胞存活率的影响差异极显著(P≤0.01),不同抗冻剂对细胞的保存效果具有显著差异(P<0.05)。
2.3糖和卵磷脂浓度对精巢细胞活率的影响
将细胞复苏后检测细胞活率,通过双因素方差分析(two-way ANOVA)显示,糖和卵磷脂交互作用显著(P<0.05)。冷冻稀释液中添加海藻糖与添加蔗糖的保存效果差异不显著(P>0.05),而不同浓度卵磷脂的添加对细胞冻存的影响差异极显著(P<0.01)。从表3可看出,冷冻稀释液使用海藻糖并添加8%的卵磷脂时,保存效果最好,细胞相对存活率可达(93.55±2.56)%。
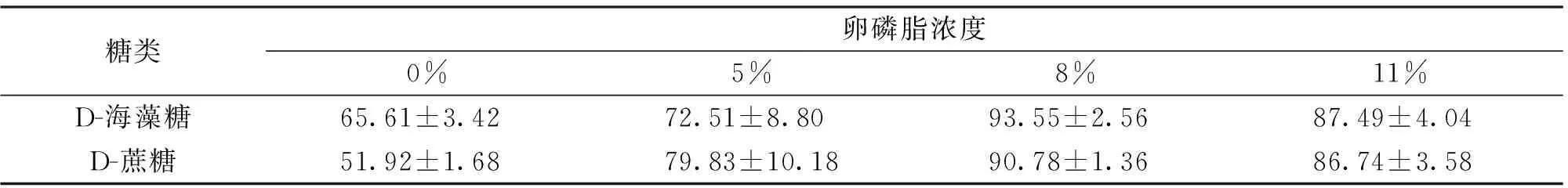
表3 不同糖和卵磷脂浓度保存细胞相对存活率 (n=3)Tab.3 Relative percentage of living cells cryopreserved by different sugars and concentration of lecithin (n=3)
注:如图所示细胞相对存活率±标准差;双因素方差分析得出糖、卵磷脂浓度交互作用显著(P<0.05),不同糖对冻存细胞存活率的影响差异不显著(P>0.05),不同浓度卵磷脂的添加对细胞冻存的影响差异极显著(P<0.01)。
冷冻稀释液使用海藻糖时,添加卵磷脂的冻存效果普遍好于未添加卵磷脂组。用含11%卵磷脂的细胞保存液冻存细胞,细胞相对存活率低于含8%卵磷脂组。
冷冻稀释液使用蔗糖,添加8%卵磷脂冻存细胞时冻存效果最好,复苏后的细胞活率是冻存前的(90.78±1.36)%;用含11%卵磷脂的细胞保存液冻存细胞,细胞相对存活率低于含8%卵磷脂组。显微镜观察细胞形态,可见复苏后添加卵磷脂的处理组细胞大多都状态良好,呈现活细胞形态,复苏培养2 d后,可见细胞分裂增殖,细胞数目增多。将添加8%卵磷脂的海藻糖组细胞复苏培养,10 d后细胞总数为0 d时的3.19倍(图1)。
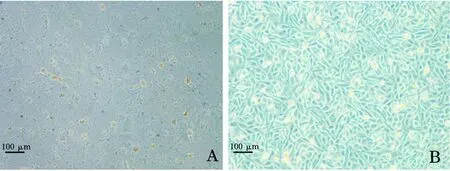
图1 复苏后培养的精巢细胞Fig.1 Testicular cells cultured after thawing A.复苏培养0 d的精巢细胞;B.复苏培养10 d的精巢细胞
3 讨论
3.1不同酶对达氏鲟精巢细胞的消化效果
采用适当的程序及消化方法也是制备良好单细胞悬液的关键环节之一。检验不同种类的酶和不同消化时间对达氏鲟精巢细胞的消化效果的影响,可为精原细胞的纯化做准备,得到高活率的细胞是纯化后实现精原细胞高存活率的保证。
目前,分离各种动物细胞普遍采用胰蛋白酶、胶原酶或几种酶的组合。在鱼类中,Lacerda 等[14]用胶原酶、胰蛋白酶和DNase I组合酶消化尼罗罗非鱼(Oreochromisniloticus)精巢细胞,再梯度离心分离精原细胞,最后得到的细胞活细胞率较高。Shikina等[11]同样用胰蛋白酶、胶原酶、中性酶及其组合酶分离虹鳟(Oncorhynchusmykiss)精巢细胞,得到的细胞通过原代培养仍可增殖。Linhartova 等[10]用0.1% 胶原酶和胰蛋白酶消化分离丁鱥(Tincatinca)性腺,并通过Percoll 密度梯度离心纯化精原细胞。王爱珍[15]对吉富罗非鱼精原细胞分离培养的研究中,分别用0.1%胶原酶IV,0.25%胰蛋白酶,0.04% EDTA·Na2及其组合酶消化吉富罗非鱼精巢,其中经过胰蛋白酶消化活细胞率最高,为86.60%。
本研究采用的是0.25% 胰蛋白酶和胶原酶与中性酶的组合酶消化达氏鲟精巢细胞。实验发现,两种酶消化相同重量的精巢组织时,可获得的活细胞数没有显著差异,但这两种酶消化所得的细胞数会随时间变化。由此可见,两种酶的消化效果都比较温和,经过2~3 h才可获得最多的活细胞。因此在消化过程中胶原酶与中性酶的组合酶对精巢细胞的损伤较小。但是由于组合酶消化过程耗时较长,而且组合酶中的胶原酶价格昂贵,而采用胰蛋白酶分离精巢细胞不仅得到的活细胞率高、操作方便,而且消化时间相对较短。
3.2不同冷冻方案的冻存效果比较
影响细胞冻存效果的因素主要有抗冻剂、降温方式及冷冻稀释液种类[16]。抗冻剂属于渗透性冷冻保护剂,近年来常用的抗冻剂有DMSO、EG、MET及甘油(GLY)。渗透性冷冻保护剂对不同物种的保存效果存在很大的差异,因此选择恰当的冷冻保护剂对其冷冻保存效果至关重要[17]。Yoshizaki等[4]采用1.8 mol/L EG,0.5% BSA,5.5 mmol/L D-葡萄糖作为冻存液保存虹鳟生殖细胞,复苏后存活率为45.4%。本实验通过对几种抗冻剂对精巢细胞冻存的研究,结果显示,用EG的冷冻效果最好,可达(51.70±5.24)%。有研究显示EG也是西伯利亚鲟生殖细胞的最佳抗冻剂,用1.5 mol/L EG,0.5% BSA,5.5 mmol/L D-葡萄糖保存西伯利亚鲟生殖细胞,复苏率为61.75%[5]。可见对于鲟来说,EG可能是较为合适的细胞抗冻剂。
降温速率直接关系到冷冻效果,降温速率过快或过慢都会对细胞膜造成损伤。不同的组织细胞中均有一个存活率最高的冷冻速率范围,称为“适宜冷冻速率”[18]。本研究选择了缓慢冷冻法和快速冷冻法两种降温方式,实验结果显示两种方法差异较大,通过慢速冷冻的手段可得到较高的细胞复苏率。可见-1 ℃/min 对于达氏鲟精巢细胞来说是较为适宜的降温速率。Linhartova等[10]对丁鱥原始生殖细胞冻存的研究,同样采用-1 ℃/min的降温速率降至-80 ℃可获得较好的冻存效果(57.69±16.85)%。
糖类,例如海藻糖和蔗糖,属于非渗透保护剂,添加糖类的冻存液配方可显著提高多种类型细胞的冻存效果,包括胚胎细胞、成纤维细胞、造血干细胞及生殖细胞[5-8]。Aurich等[19]认为,动物细胞膜中含有的卵磷脂具有亲脂亲水的特性,细胞冻存液中添加卵磷脂,可以有效保持水分不至过多流失,提供能源,从而保护细胞减少冷冻伤害。本文对于细胞冻存液的进一步研究显示,含海藻糖或蔗糖的冷冻稀释液在冻存达氏鲟精巢细胞时无显著差异,在相同卵磷脂浓度下,复苏后的相对存活率差异较小;0%卵磷脂的蔗糖组细胞相对存活率最低,添加8%卵磷脂时,细胞的相对存活率最高。有研究指出,卵磷脂没有冷冻毒性[20],但是在我们的研究中显示当卵磷脂浓度升高至11%时细胞复苏后存活率反而降低,同样的结果出现在用卵磷脂冷冻保存马精液[21]的研究中,这可能是由于当卵磷脂的浓度增加时,稀释液中的糖和盐类析出形成沉淀引起渗透压下降,从而造成细胞损伤。
4 结论
本研究通过探讨两种酶消化分离达氏鲟精巢细胞的效果以及比较抗冻剂、降温程序、糖类和卵磷脂对达氏鲟精巢细胞冻存效果的影响,得出保存达氏鲟精巢细胞效果最佳方法为:先用0.25%胰蛋白酶消化3 h分离达氏鲟精巢细胞,再用50 mmol/L D-海藻糖,5 mg/mL BSA,200 mL/L胎牛血清,10% EG及8%卵磷脂作为冷冻保存液,以-1 ℃/min慢速降温保存达氏鲟精巢细胞效果最佳。
[1]丁瑞华.四川鱼类志[M].成都:四川科学技术出版社,1994:29.
[2]Zhang H,Wei Q W,Du H,et al.Present status and risk for extinction of the Dabry′s sturgeon (Acipenserdabryanus) in the Yangtze River watershed:A concern for intensified rehabilitation needs[J].J Appl Ichthyol,2011,27(2):181-185.
[3]Zhuang P,Ke F E,Wei Q W,et al.Biology and life history of Dabry′s sturgeon,Acipenserdabryanus,in the Yangtze River[J].Environ Biol Fish,1996,48(1-4):257-264.
[4]Yoshizaki G,Fujinuma K,Iwasaki Y,et al.Spermatogonial transplantation in fish:A novel method for the preservation of genetic resources[J].Comp Biochem Physiol Part D,2011,6(1):55-61.
[5]Oberstein N,O’Donovan M K,Bruemmer J E,et al.Cryopreservation of equine embryos by open pulled straw,cryoloop,or conventional slow cooling methods[J].Theriogenology,2001,55(2):607-613.
[6]Eroglu A,Toner M,Toth T L.Beneficial effect of microinjected trehalose on the cryosurvival of human oocytes[J].Fertil Steril,2002,77(1):152-158.
[7]Izadyar F,Matthijs-Rijsenbilt J J,den Ouden K,et al.Development of a cryopreservation protocol for type A spermatogonia[J].J Androl,2002,23(4):537-545.
[8]Lee Y A,Kim Y H,Ha S J,et al.Cryopreservation of porcine spermatogonial stem cells by slow-freezing testis tissue in trehalose[J].J Anim Sci,2014,92(3):984-995.
[9]Mrowiec Z R,Fernandez-DeLeon M,Marchioni M,et al.Comparison of controlled vs non-controlled rate freezing of umbilical cord blood units[J].Ashmtg,2004,104(11):5011-5021.
[10]Linhartová Z,Rodina M,Guralp H,et al.Isolation and cryopreservation of early stages of germ cells of tench (Tincatinca)[J].Czech J Anim Sci,2014,59(8):381-390.
[11]Shikina S,Ihara S,Yoshizaki G.Culture conditions for maintaining the survival and mitotic activity of rainbow trout transplantable type A spermatogonia[J].Mol Reprod Dev,2008,75(3):529-537.
[14]Lacerda S M S N,Batlouni S R,Silva S B G,et al.Germ cells transplantation in fish:The Nile-tilapia model[J].Anim Reprod,2006,3(2):146-159.
[15]王爱珍.吉富罗非鱼精原干细胞分离与体外培养的研究[D].广东湛江:广东海洋大学,2013.
[16]Watson P F.The causes of reduced fertility with cryopreserved semen[J].Anim Reprod Sci,2000,60-61:481-492.
[18]Mazur P.Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing[J].J Gen Physiol,1963,47(2):347-369.
[19]Aurich C,Seeber P,Müller-Schlösser F.Comparison of different extenders with defined protein composition for storage of stallion spermatozoa at 5 ℃[J].Reprod Domest Anim,2007,42(4):445-448.
[20]Fiume Z.Final report on the safety assessment of Lecithin and Hydrogenated Lecithin[J].Int J Toxicol,2000,20(S1):21-45.
(责任编辑:邓薇)
Digestion,isolation and cryopreservation of testicular cells from Dabry sturgeon (Acipenser dabryanus)
XIE Xuan1,2,LI Ping2,XI Meng-dan2,3,GUO Wei2,3,QIAO Xin-mei2,DU Hao2,LIU Zhig-ang2,WEI Qi-wei1,2,3
(1.SchoolofLifeScience,SouthwestUniversity,Chongqing400715,China;2.KeyLaboratoryofFreshwaterBiodiversityConservation,MinistryofAgricultureofChina;YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China3.InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,China)
In this study,to obtain high recovery ratio of living cells after thawing for Dabry′s sturgeon (Acipenserdabryanus) testicular cells,we evaluate the effect of enzymatic dissociation on testicular cells,and the influence of cryoprotectants,freezing ratio,sugars and lecithin on testicular cells cryopreservation.Testes were dissociated and digested with 0.25% trypsin or a combination of 2 mg/mL collagenase H and 500 U/mL Dispase II.The number of testicular cells was counted respectively when tests were dissociated by these two enzymes for 2,3,4 and 5 h.The result showed that there was no significant difference between those enzymes.Per gram testis can obtain 1.27×107living cells dissociated by 0.25% trypsin and 1.07×107by the combined enzymes on average.We also investigate the effect of cryoprotectants,freezing rate,sugars and lecithin on testicular cells cryopreservation.Cells was diluted in 50 mM D-trehalose,5 mg/mL Bovine serum albumin,200 mL/L fetal bovine serum (pH 8.0) supplemented with 10% dimethyl sulfoxide (DMSO),ethylene glycol (EG) or methanol (MET) respectively,freezing on a cooling protocol from 0 ℃ to -80 ℃at a rate of -1 ℃/min,or transferring into liquid nitrogen (LN2) directly.The results demonstrated that cryopreservation with those cryoprotectants significantly influenced recovery rate of living cells,in the following sequence:EG(51.70%±5.24%)>MET(45.09%±3.15%)>DMSO(40.18%±3.90%).And freezing on slow rate,-1 ℃/min,showed obviously high rate of living cells after thawing.Based on the previous study,D-trehalose in the extenders was replaced by D-sucrose,and supplemented 0%,5%,8%,11% lecithin.Almost the same viability rates were obtained with no significant differences among tested sugars,but the differences performed obviously on lecithin.The results showed that (93.55±2.56)% living cells can be obtained after thawing when 8% lecithin was supplemented.The number of testicular cells increased 3.19 times for 10 days culture.
Acipenserdabryanus;trypsin;cryopreservation;cryoprotectant;lecithin
2016-03-01;
2016-03-23
中央级公益性科研院所基本科研业务费(2015B02YQ01);公益性行业(农业)科研专项(201203086);国家自然基金青年项目(31402301)
颉璇(1991-),女,硕士研究生,专业方向为细胞生物学。E-mail:xiexuan_1111@163.com
危起伟。E-mail:weiqw@yfi.ac.cn
S917.4
A
1000-6907-(2016)05-0019-06

