Strain ultrasound elastography predicting pathological complete response to neoadjuvant chemotherapy in breast cancer patients
, , ,
(Department of Ultrasound, Shengjing Hospital ofChina Medical University, Shenyang 110004, China)
Strain ultrasound elastography predicting pathological complete response to neoadjuvant chemotherapy in breast cancer patients
MAYan,LIJing,RENWeidong*,DENGLijun
(DepartmentofUltrasound,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China)
ObjectiveTo evaluate the predictive diagnostic performance of strain ultrasound elastography (SUE) in pathological complete response (pCR) after neoadjuvant chemotherapy (NAC) in breast cancer patients. MethodsSixty breast cancer patients were consecutively included. The strain ratio and strain score was assessed by SUE before biopsy. Pathologic response was evaluated according to Miller-Panye grading system, and immunohistochemical analysis was recorded.Logisticregression analysis was performed to explicit the independent risk factors of pCR. The ROC curve and the area under the ROC (AUC) were calculated,Ztest was used to compare the differences between AUCs. ResultsHigh strain score was the independent risk factor for pCR. The predictive value of the strain ratio was the best among all variables, the AUC was 0.92±0.03. The difference of AUC between Ki-67 (0.60±0.08) and strain ratio was significant (P<0.01); but the difference between strain ratio and strain score (0.89±0.05) had no significant (P=0.36). ConclusionThe stiffness evaluated by SUE is variable for predicting the pCR to NAC, SUE plays an important role in individualized treatment of breast cancer.
Breast neoplasms; Elasticity imaging techniques; Neoadjuvant chemotherapy; Ultrasonography
乳腺癌是威胁女性身体健康的恶性疾病之一。新辅助治疗是乳腺癌整体治疗的重要组成部分,目的在于对一些局部晚期乳腺癌患者采用全身治疗,使肿瘤体积缩小、分期降低,从而使不可手术的乳腺癌患者重新获得手术治疗的机会,使不适合保乳手术的患者获得可以保乳治疗的机会。乳腺癌新辅助治疗包括新辅助化疗(neoadjuvant chemotherapy, NAC)、新辅助内分泌治疗和靶向治疗,以NAC应用最为广泛[1]。
近年来,应变力超声弹性成像 (strain ultrasound elastography, SUE)技术通过评估组织的变形能力反映组织的硬度,从而判断病灶的良恶性,与传统的B型超声相比显示出其独特的优越性。在NAC治疗前,利用SUE预测乳腺癌NAC的病理反应性,有利于尽早发现对化疗抵抗的肿瘤,并及时调整更换治疗方案,合理安排手术时机,以减少不必要的治疗及化疗药物的毒副反应[1-3]。本研究旨在探讨SUE在早期预测乳腺癌NAC疗效中的价值。
1 资料与方法
1.1一般资料选取2014年1月—2015年12月于我院乳腺外科接受NAC并最终手术的女性乳腺癌患者60例,年龄27~66岁,平均(46.9±10.2)岁,肿瘤最大径1.0~10.0 cm,平均(4.17±1.82)cm。患者均为临床分期Ⅱ~Ⅲ期高级别乳腺癌,其中42例肿瘤较大或有淋巴结转移,18例拟行保乳手术治疗,均无远处转移。所有患者NAC治疗前均经超声引导下粗针穿刺活检证实为乳腺癌,且未接受其他治疗。
所有患者均行6个周期NAC后进行手术治疗。采用TEC化疗方案,为多西他赛(75 mg/m2)、表柔比星(75 mg/m2)、环磷酰胺(500 mg/m2);荧光原位杂交(fluorescence in situ hybridization, FISH)检测示人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)阳性的患者中6例同时给予靶向药物赫赛汀治疗,首次8 mg/kg体质量,之后6 mg/kg体质量。以21天作为1个周期,均持续进行6个周期后21天内进行手术切除。本研究经本院伦理委员会审批,患者均签署知情同意书。
1.2仪器与方法采用Hitachi HV 900超声诊断仪,探头频率6~13 MHz。在肿物穿刺活检前,行常规超声及SUE检查。首先行常规放射状超声扫查,观察肿瘤的形态、纵横比、边界、回声、周围组织及血流等特点,记录肿瘤的最大径。然后启动SUE,ROI≥病灶大小的2倍,深度为紧邻皮肤的皮下脂肪层到肌层。实时调整探头角度,保证探头与皮肤垂直,且皮肤表面无明显变形。对病灶区进行轻微振动,使压放频率为3~4。待图像稳定后存储,测量病灶与轴位脂肪组织的弹性应变率比值(strain ratio, SR)。检查过程中,对同一肿物至少评估两个相互垂直切面的弹性,计算平均值,并记录。
采用5分法对SUE图像进行弹性评分:1分为肿瘤全部发生变形,图像显示为绿色;2分为肿瘤大部分发生变形,但仍有小部分未变形,图像显示为绿色和蓝色,并以绿色为主;3分为肿瘤边界发生变形,中心未变形,图像显示病灶中心为蓝色,周边为绿色;4分为肿瘤全部无变形,图像显示病灶整体为蓝色;5分为肿瘤全部和周边组织都无变形,图像显示病灶和周边组织为蓝色。1~3分认为是低弹性评分;4~5分认为是高弹性评分。
以上超声检查由1名具有5年以上乳腺弹性超声诊断经验的医师完成。
1.3病理评价对穿刺活检的乳腺癌标本进行雌激素受体(estrogen receptor, ER)、孕激素受体(progestrone receptor, PR)、HER2以及Ki-67免疫组化检测。于400倍光镜下随机观察10个视野,将阳性细胞计数所占细胞比例的平均值作为阳性细胞百分比,ER、PR癌细胞核阳性细胞>1%则认为阳性;Ki-67>14%认为Ki-67高表达;经HER2按阳性率情况分为0~3级,其中≤1级认为HER2阴性,≥2级则进行FISH检测,如提示扩增,则为阳性,反之仍为阴性。依据2013年乳腺癌St Gallen专家共识[4],所有标本被分为Luminal A、Luminal B、HER2和三阴型4种分子亚型。
术后对NAC病理反应性进行判断,参照Miller-Panye分级法:1级,浸润癌细胞基本无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级,浸润癌细胞轻度减少,但总数量仍高,癌细胞减少<30%;3级,浸润癌细胞减少30%~90%;4级,浸润癌细胞显著减少>90%,仅残存散在的小簇状癌细胞或单个癌细胞;5级,原肿瘤瘤床部位已无浸润癌细胞,但可存在导管原位癌,即病理完全缓解(pathological complete regress, pCR)。1~4级为非pCR,5级为pCR。病理评估由1名具有10年乳腺疾病病理诊断经验的医师完成。
2 结果
60例患者均为乳腺浸润性癌,其中浸润性导管癌54例,浸润性小叶癌6例。
根据Miller-Panye分级,60例乳腺癌NAC后手术病理结果为1级9例,2级18例,3级11例,4级6例,5级16例。非pCR44例,pCR16例。
将可能影响pCR结局的变量进行单因素分析,提示弹性评分、SR、高弹性评分(4~5分)、Ki-67高表达(>14%),在pCR和非pCR间的差异有统计学意义(P<0.05),见表1。经多元Logistic回归分析,只有高弹性评分是pCR的独立影响因素(OR=0.04,95%CI 0~0.37,回归系数=-3.35,P<0.01)。pCR(Miller-Panye分级5级)的SUE图像见图1。
以pCR为金标准,将弹性评分、SR、Ki-67指数作为变量绘制ROC曲线,SR的AUC最大,为0.92±0.03,95%CI 0.83~0.98;弹性评分的AUC为0.89±0.05,95%CI 0.78~0.96;Ki-67指数的AUC为0.60±0.08,95%CI 0.47~0.73(图2);弹性评分、SR与Ki-67指数的AUC差异均有统计学意义(P均<0.01),SR与弹性评分的AUC差异无统计学意义(P=0.36);SR的最佳诊断界点为8.7,敏感度为100%,特异度为75%,弹性评分的最佳诊断界点为3分,敏感度为88%,特异度为75%。
3 讨论
本研究发现乳腺癌高弹性评分是NAC后pCR结局的独立影响因素,通过评估乳腺癌的SR及弹性评分,SUE可对NAC后病理pCR结局进行有效地预测,且诊断效能明显高于Ki-67指数等免疫组化指标。
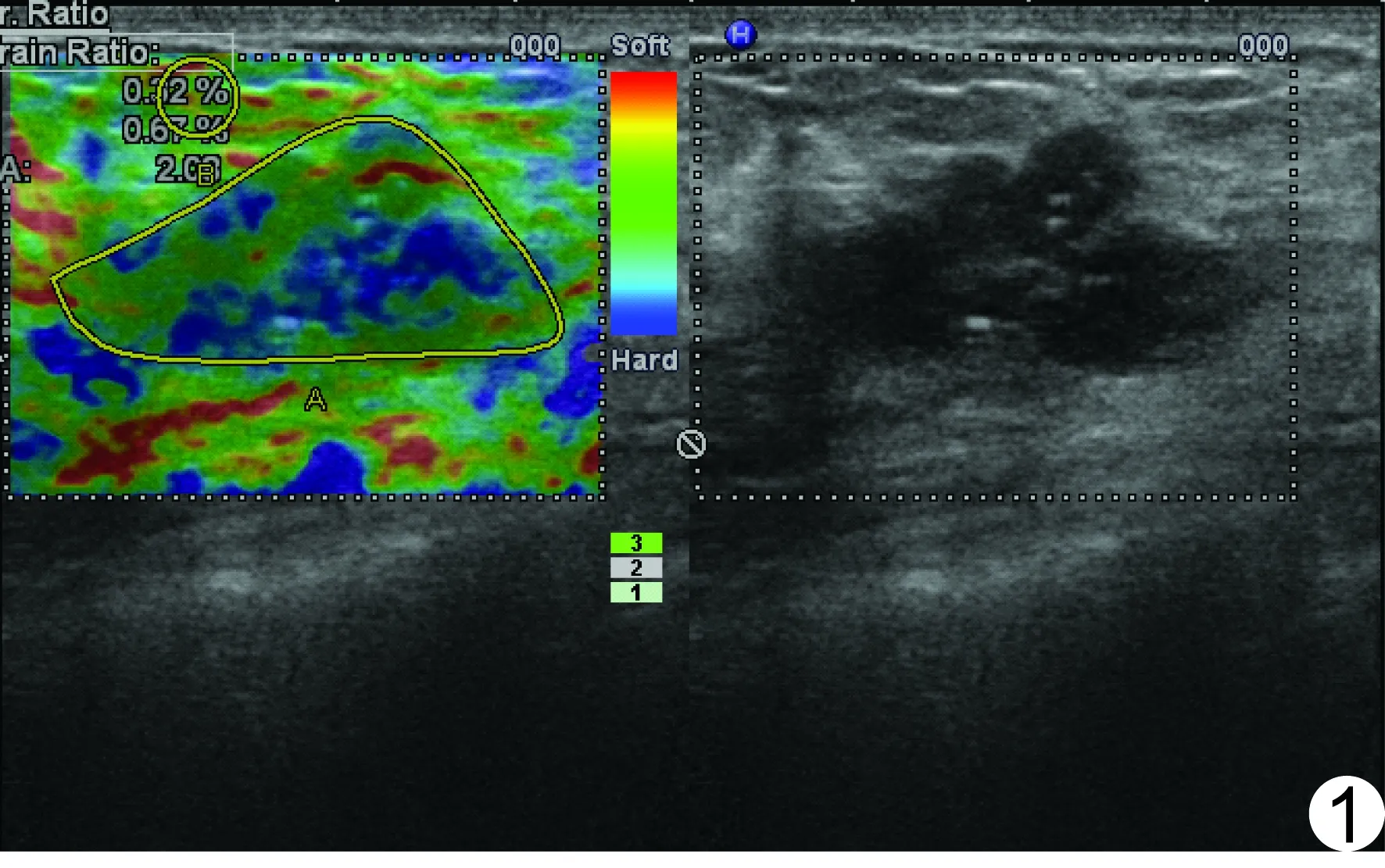
图1 患者,46岁,穿刺活检证实为浸润性导管癌 NAC前SUE的弹性评分2分,SR为2.09,NAC后Miller-Panye分级为5级

图2 弹性评分、SR和Ki-67指数预测NAC后PCR的ROC曲线
早期预测肿瘤对化疗的敏感性,有助于评价化疗疗效、调整后续治疗策略。目前,影像学方法、免疫组化标志物、基因检测均已应用于乳腺癌NAC的评估及预测。临床常用的无创影像学方法包括超声及MRI以早期预测NAC反应性,但均存在一定的局限性:常规MRI主要通过乳腺肿瘤的大小、肿瘤增强效应、表观弥散系数、波谱及癌周间质增强效应评估乳腺癌恶性程度及NAC反应性[5-6];常规B型超声仅仅从病灶形态、大小、回声等方面评估乳腺癌NAC中的生物效应,预测评估能力明显低于MRI[6]。而最近的研究[7]认为超声弹性检测对NAC后乳腺残位癌评估效能较好,提示SUE等弹性成像在乳腺癌NAC的反应性监测,早期评估中也具有重要作用。
乳腺癌的进展侵袭不仅仅是单一癌细胞自我增殖生长,也是癌细胞与细胞外微环境间的生物性“对话” (cross-talk)相互作用过程。在细胞外微环境中,间质细胞及细胞外基质起重要的作用。癌细胞外组成在NAC反应性中也有不可替代的作用。离体研究[8]表明,较高的基质硬度增加潜在的化疗抵抗风险。Zustiak等[9]对MDA-MB-231和MCF-7多个乳腺癌细胞系测试,发现硬质培养环境可降低乳腺癌细胞对化疗药物的敏感性,而癌细胞对化疗药物的抵抗可能与PI3K和JNK信号通路激活有关[10]。间质的成纤维细胞特征基因组对NAC反应性也有预测作用[11]。总之,癌细胞基质构成异常可增加NAC抵抗风险。本研究中,通过SUE硬度评估对pCR预测效能较好,与既往研究[8]结果相一致。但癌细胞增殖的标志物与弹性成像是否可相互补充,进而提高NAC病理反应性的预测效能,还需进一步研究。
在某些病理或分子亚型中,SUE的预测效能是否存在差异尚不得知。本研究中,小叶癌、Luminal A、三阴及HER2亚型的患者数较少,不足以按照病理分型的亚组分析。剪切波弹性成像、声辐射力脉冲成像等其他超声弹性技术是否同样适用于本研究结论有待进一步探讨。乳腺癌本身存在异质性,同一肿瘤内部的硬度也不完全均匀一致,应变力弹性成像对肿瘤的硬度评估存在一定的缺陷;目前有研究[12]认为三维剪切波弹性成像可更加真实地反映组织的总体弹性及硬度分布情况,尚不明确其是否可更好地预测NAC反应性。有研究[13]通过正电子发射计算机断层显像证实,NAC前腋窝淋巴结转移情况是pCR及病理抵抗的重要因素,而超声无法对所有NAC前淋巴结转移情况及硬度进行精准评估[14],而穿刺活检不能确定所有阳性淋巴结,可能存在病灶遗漏。因此,明确乳腺癌的硬度是否与淋巴结转移情况相关,SUE对pCR的预测作用是否同样适用于包含淋巴结情况的NAC病理评分系统还有待进一步研究。
总之,本研究提示通过SUE评估肿瘤硬度在乳腺癌的个体化精准治疗中有重要的地位。
[1]King TA, Morrow M. Surgical issues in patients with breast cancer receiving neoadjuvant chemotherapy. Nat Rev Clin Oncol, 2015,12(6):335-343.
[2]Corben AD, Abi-Raad R, Popa I, et al. Pathologic response and long-term follow-up in breast cancer patients treated with neoadjuvant chemotherapy: A comparison between classifications and their practical application. Arch Pathol Lab Med, 2013,137(8):1074-1082.
[3]袁沙沙,程莹莹,杨春雪,等.剪切波弹性成像评价乳腺癌新辅助化疗的疗效.中国医学影像技术,2016,32(1):71-74.
[4]Goldhirsch A, Winer EP, Coates AS, et al. Personalizing the treatment of women with early breast cancer: Highlights of the St Gallen international expert consensus on the primary therapy of early breast cancer 2013. Ann Oncol, 2013,24(9):2206-2223.
[5]Marinovich ML, Sardanelli F, Ciatto S, et al. Early prediction of pathologic response to neoadjuvant therapy in breast cancer: Systematic review of the accuracy of MRI. Breast, 2012,21(5):669-677.
[6]Nakahara H, Yasuda Y, Machida E, et al. MR and US imaging for breast cancer patients who underwent conservation surgery after neoadjuvant chemotherapy: Comparison of triple negative breast cancer and other intrinsic subtypes. Breast Cancer, 2011,18(3):152-160.
[7]Lee SH, Chang JM, Han W, et al. Shear-wave elastography for the detection of residual breast cancer after neoadjuvant chemotherapy. Ann Surg Oncol, 2015,22 (Suppl 3):376-384.
[8]Oskarsson T. Extracellular matrix components in breast cancer progression and metastasis. Breast, 2013,22(Suppl 2):S66-S72.
[9]Zustiak S, Nossal R, Sackett DL. Multiwell stiffness assay for the study of cell responsiveness to cytotoxic drugs. Biotechnol Bioeng, 2014,111(2):396-403.
[10]Cox TR, Erler JT. Molecular pathways: Connecting fibrosis and solid tumor metastasis. Clin Cancer Res, 2014,20(14):3637-3643.
[11]Farmer P, Bonnefoi H, Anderle P, et al. A stroma-related gene signature predicts resistance to neoadjuvant chemotherapy in breast cancer. Nat Med, 2009,15(1):68-74.
[12]Athanasiou A, Latorre-Ossa H, Criton A, et al. Feasibility of imaging and treatment monitoring of breast lesions with three-dimensional shear wave elastography. Ultraschall Med, 2015. [Epub ahead of print]
[13]Crippa F, Agresti R, Sandri M, et al.18F-FLT PET/CT as an imaging tool for early prediction of pathological response in patients with locally advanced breast cancer treated with neoadju-
vant chemotherapy: A pilot study. Eur J Nucl Med Mol Imaging, 2015,42(6):818-830.
[14]史俊妮,陈曼.超声弹性成像诊断乳腺癌并评估腋窝淋巴结状态的应用进展.中国介入影像与治疗学,2015,12(7):450-453.
中国医科大学附属盛京医院院内课题(MD63)。
马燕(1983—),女,辽宁沈阳人,在读博士,讲师,主治医师。研究方向:乳腺及浅表小器官疾病的超声诊断。
任卫东,中国医科大学附属盛京医院超声科,110004。E-mail: renwd01@163.com
2016-03-11
2016-05-19
10.13929/j.1672-8475.2016.07.007
应变力超声弹性成像预测乳腺癌患者新辅助化疗后病理完全缓解
马燕,李晶,任卫东*,邓力军
(中国医科大学附属盛京医院超声科,辽宁 沈阳110004)
目的评估应变力超声弹性成像(SUE)技术预测乳腺癌患者新辅助化疗(NAC)后病理完全缓解(pCR)的效能。方法 收集乳腺癌患者60例,采用SUE评估NAC前肿瘤的弹性评分和弹性应变率比值,记录肿瘤穿刺活检的免疫组化结果,术后病理参照Miller-Panye分级法评估病理反应性,采用Logistic回归分析获得影响NAC后pCR的独立影响因素。绘制不同指标预测pCR结局的ROC曲线,并计算曲线下面积(AUC),Z检验比较不同指标的AUC。结果 高弹性评分是pCR的独立影响因素。弹性应变率比值的预测效能最佳,AUC为0.92±0.03,且与Ki-67(0.60±0.08)的AUC比较差异有统计学意义(P<0.01);而弹性应变率比值与弹性评分(0.89±0.05)的AUC差异无统计学意义(P=0.36)。结论 SUE评估乳腺癌硬度可预测NAC后pCR结局,在乳腺癌的个体化精准治疗中有重要作用。
乳腺肿瘤;弹性成像技术;新辅助化疗;超声检查
R737.9; R445.1
A
1672-8475(2016)07-0416-05
E-mail: horsebird@163.com
- 中国介入影像与治疗学的其它文章
- Application of percutaneous endobiliary radiofrequency ablation for treatment of malignant biliary obstruction
- Three-dimensional circumferential strain in evaluating changes of left ventricular myocardial contractional function in early chronic kidney disease patients
- Prenatal ultrasound in diagnosis of fetal aortic arch interruption
- Imaging features of dermatofibrosarcoma protuberan
- Acoustic properties of HIFU ablation for uterine fibrods with different T2WI signal
- Smart optimum tube voltage regulation technology in children impacted teeth CT scan

