酸性KI溶液被空气中O2氧化的数字化实验研究
顾晔
摘要:碘离子在酸性条件下容易被空气中的O2氧化,而碘量法滴定常常处于酸性环境中,空气中氧气是否会对滴定终点产生影响?为了解决上述问题,利用数字化实验手段研究了碘离子在酸性条件下被空气中的O2氧化的情况,得到0.6 mol/L KI溶液在不同pH环境下的吸光度随时间变化图像,并由此判断常规碘量法定量实验过程中可以忽略氧气对滴定终点的影响。
关键词:KI;碘量法滴定;氧化;酸度;色度传感器
文章编号:1005–6629(2016)8–0055–03 中图分类号:G633.8 文献标识码:B
KI固体、标准溶液等常用于物质组成、样品浓度等定量分析,如碘量法、沉淀法等,而I-离子在溶液中具有一定的还原性(I2+2e-=2I-,φθ=+0.5355V[1]),滴定过程中溶液中的I-离子可能直接被空气中的O2(O2+4e-+4H+=2H2O,φθ=+1.229V[2])氧化,这样就会对最终的分析结果产生影响。果真如此吗?碘量法是经典的定量实验方法,其终点的准确性是不是受酸度的影响?根据Nernst方程可知“凡有H+参加的电极反应,酸度对电极电势的影响都是很大的[3]”,那么酸度在怎样的区间可以忽略空气中氧气对滴定的影响?带着这些疑问,笔者尝试了碘化钾溶液在不同酸度环境下被O2氧化的相关实验。
1 相关文献研究
人教版高中化学选修4(化学反应原理)模块第二章第二节的[科学探究]栏目探究了反应“4I-+ O2+4H+=2I2+2H2O”中溶液出现蓝色的时间和温度的关系(提供1 mol/L KI溶液、0.1 mol/L H2SO4溶液和淀粉溶液);2010年朱正德老师研究了敞开体系中上述实验中出现蓝色的时间和温度的关系[4](观色法);谢庆群在此基础上采用平行对比试验研究了密闭体系下温度的影响[5](观色法),两位老师均采用课本中给予的0.1 mol/L H2SO4溶液控制了酸度变量;2012年李桂林等研究了酸度对碘量法滴定的影响,提出弱酸性的KI淀粉溶液能作为测定KIO3的试剂的观点[6];后来也有老师探讨了酸碱性环境对该反应的影响:2013年李晓明等探讨了碘化钾与空气反应的酸碱性条件得出“在碱性溶液中碘离子也可以被O2氧化,且随着pH的减小碘离子的氧化越容易[7]”的结论;随后2015年吴朝辉老师借助实验条件和理论计算分析了不同pH条件下氧化、歧化速率的相对大小和影响因素,提出“KI和O2的反应,受KI的状态、溶液的pH以及氧的分压等因素影响[8]”。
显然,除了温度,酸度对该反应的影响也是非常明显的,而滴定过程中涉及KI的体系均需控制在中性或碱性环境中吗?2012年江苏卷19题就出现了酸性条件下的类似滴定:“……为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。……”。此处pH=3~4对滴定终点判断没有影响吗?过量的KI是否会被空气中的O2氧化?仅凭视觉观察加入淀粉后有无蓝色出现可能不太可靠,不同人的辨色能力有差异,同一个人看不同样品也不能做到完全一致。分光光度计是适用于解决此类问题的,但连续的吸光度变化需要若干数据作工作曲线,于是笔者尝试采用色度传感器做数字化实验。
2 实验部分
2.1 实验试剂和器材
试剂:0.6 mol/L KI溶液、0.5%淀粉溶液(新配)、1.0 mol/L H2SO4、0.10 mol/L H2SO4、10-2 mol/L H2SO4、10-3 mol/L H2SO4、10-4 mol/L H2SO4、10-5 mol/L H2SO4、10-6 mol/L H2SO4
器材:色度传感器、比色皿、数据采集器(Venier LoggerPro)、计算机等
2.2 实验步骤
(1)相关溶液的配制(略)。
(2)向1~8号试管中分别加入3mL 0.6 mol/L的KI溶液,滴入1滴新配制的0.5%淀粉溶液。
(3)向1~7号试管中分别加入3mL 1.0 mol/L、0.10 mol/L、10-2 mol/L、10-3 mol/L、10-4 mol/L、10-5 mol/L、10-6 mol/L硫酸,振荡均匀后,取适量液体于比色皿中,用色度传感器(吸收波长选择565nm)测量各试管中溶液的吸光度随时间的变化曲线。
(4)在8号试管中再加入3mL的蒸馏水,同样方法测量其吸光度随时间的变化曲线。
(5)分析数据,记录各混合液吸光度达到0.15(A)时所需的显色时间。
2.3实验数据采集和分析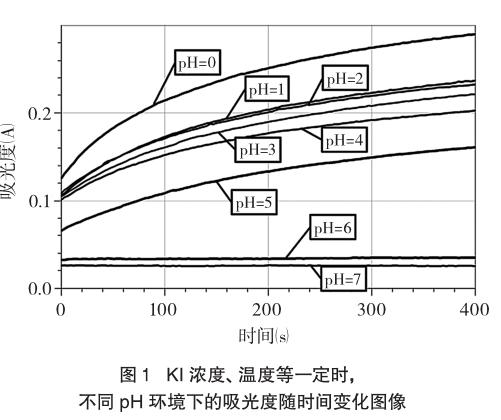
取实验条件为室温13.3℃,记录1~8组(其中第8组为参比组)、实验吸光度达15%的显色时间(从图1获取或直接从LogPro软件中读取),结果如表1。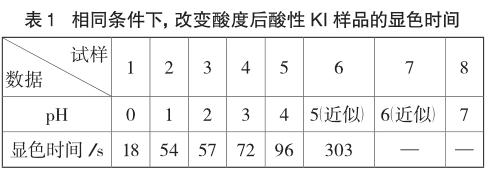
可见,在控制温度、气压、吸光度等变量时,显色时间随pH的增大而延长。只有在c(H+)=1 mol·L-1时(实验室温度13.3℃)溶液才在短短18s内被迅速氧化。表1数据说明强酸性条件下碘离子很快被氧化成I2,较弱的酸性条件下该反应是较慢的,故在酸性不是很强的介质中,碘离子被空气中氧气氧化的因素可以忽略。也正因为如此,在间接碘量法滴定铜离子、铁离子时,往往有一个调节pH的环节,如中国化学会第26届全国高中生化学竞赛(省级赛区)试卷第3题测定Cu2+离子时有“冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀”的操作,其中Na2CO3的加入与调节反应体系pH不无关系。
3 结论与讨论
3.1 结论
结合文献给出的电极电势数据:“I2+2e-=2I-,φθ=+0.5355V,O2+4e-+4H+=2H2O,φθ=+1.229V”,不难发现该反应“4I-+O2+4H+=2I2+2H2O”进行的趋势是较为明显的,但反应的限度是热力学问题,能否立即发生是动力学问题,表1数据说明较弱的酸性条件下该反应是很慢的,到肉眼可观察到明显变色所需时间更长,故文章开始引用的2012年江苏卷19题调节pH至3~4是较为合理的。强酸性条件(pH<2)下,才需考虑空气中氧气对滴定终点的影响,否则经典的“碘量法”为何时至今日仍在使用呢?当然,为了力求实验结果的准确性,我们在碘量法滴定过程中也应该避免滴定时间过长,将氧气的影响降到最小。
3.2 实验技术反思
以色度传感器为主要技术支撑的数字实验在该实验中起到了记录连续时间范围内的吸光度变化数值,为数据筛选提供了较大的数据样本和方便的采集途径,同时也有利于控制肉眼较难判断的颜色深浅的程度。当然,限于比色皿的空间和操作规则,本实验还有一个遗憾,表1中的pH是计算得出的,部分数据不够精确,若能配合pH传感器和溶解氧传感器给出pH和溶解氧的实时变化数据,相信实验结论将更加完善。
3.3 对教学的启发
反应“4I-+O2+4H+=2I2+2H2O”是一个很好的探究温度对化学反应速率影响的实验素材,但不妨将之拓展:(1)氧气量(溶解氧传感器和压强传感器)对显色时间的影响;(2)酸度对显色时间的影响;(3)KI浓度对显色时间的影响(控制酸度变量,配制0.1~2.0 mol/L的KI溶液)。这样学生对这个重要反应的认识便更加深刻,同时对影响速率的因素认识也将更加全面。
致谢:感谢南京师范大学教师教育学院研究生韦存容、葛春洋等在实验技术、器材等方面给予的支持和帮助!
参考文献:
[1][2]武汉大学等.无机化学(上)(第三版)[M].北京:高等教育出版社,1994:500~502.
[3]华彤文等.普通化学原理(第3版)[M].北京:北京大学出版社,2009:213.
[4]朱正德.淀粉碘化钾酸性溶液在空气中出现蓝色与温度的关系实验研究[J].中学化学教学参考,2010,(6): 46~47.
[5]谢庆群.淀粉碘化钾酸性溶液变为蓝色的实验条件再探究[J].化学教学,2014,(8):69.
[6]李桂林.碘量法在中学化学实验中的应用和探究[J].化学教学,2012,(2):48~50.
[7]李晓明,管廷河. KI溶液遇空气氧化变质原因的探究[J].化学教学,2013,(5):47~48.
[8]吴朝辉.碘化钾淀粉溶液遇氧气是否变色的原因探析[J].化学教学,2015,(8):53~55.

