干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响
梁建萍,贾小云,刘亚令,吴 云,周 然,冯前进
1 山西农业大学生命科学学院,太谷 030801 2 山西中医学院,晋中 030619
干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响
梁建萍1,贾小云1,刘亚令1,吴云1,周然2,*,冯前进2
1 山西农业大学生命科学学院,太谷0308012 山西中医学院,晋中030619
以山西道地药材黄芪一年生幼苗为试验材料,设置常规水分条件(CK)、轻度干旱胁迫(A1)、中度干旱胁迫(A2)、重度干旱胁迫(A3)4 个不同处理,研究土壤干旱胁迫对黄芪生长及生理的影响。结果表明:黄芪茎叶快速生长集中在出苗后80—120 d,以后生长减缓;当茎叶枯萎时,根中生物量短期快速积累。与常规水分条件相比,干旱胁迫处理显著降低了黄芪苗高及茎叶生物量,但对抗氧化能力、根系生长及次生代谢物积累产生了不同的影响。轻度干旱胁迫下 SOD、POD、CAT 3种抗氧化酶活性升高,丙二醛(MDA)含量和细胞膜透性降低,同时根长与根生物量增加、多糖与皂苷两种次生代谢物积累增多,黄芪药材的质量得到显著提高(P<0.05);胁迫上升到中度、重度时,SOD 酶活性逐渐降低,重度胁迫下低于对照,而 POD 及 CAT 酶活性、MDA 含量、细胞膜透性均随胁迫增强而升高,相反,根长、根生物量、多糖与皂苷含量降低,导致黄芪药材的质量显著降低(P<0.01)。综上表明,干旱胁迫下,SOD 酶表现较为敏感,可能在清除活性氧中起主要作用;轻度水分胁迫能有效启动黄芪体内抗氧化酶系统和次生代谢,它们相互协作共同对抗胁迫对细胞产生的伤害,通过降低地上部分的生长,将营养物质优先运往根部,促进根产量及药材质量的提高。这一结论,可在黄芪多糖和皂苷次生代谢物定向培育的水分管理中加以利用。
蒙古黄芪;干旱胁迫;抗氧化酶;次生代谢物
中药材GAP的制定与实施,就是要使中药材生产向着“优质、高产、质量稳定、可控”的方向发展,而提高中药材栽培技术,实现中药材生长与药效成分合成人工调控是保证中药材质量的根本。药效成分大多是药用植物中的次生代谢物,当受到干旱、高温、冷害、水淹等环境胁迫后,体内活性氧(reactive oxygen species,ROS)代谢失衡,引发抗氧化酶活性改变,进而通过信号转导、基因表达、酶的合成及各种酶促反应等不同层次影响次生代谢过程[1-2],从而显著提高次生代谢物含量甚至从头合成[3]。
水分是植物生存必需的环境因子,而根系是吸收水分的主要器官,因而土壤水分含量对根系的生长发育至关重要。对于根类药材来讲,水分是影响药材产量和质量的重要环境因子。研究表明,适宜的水分胁迫能促进根系生长,并能诱导次生代谢过程,提高药效成分含量,如适宜的土壤干旱有利于高山红景天地下部分的生长及红景天甙含量的积累[4];中度干旱胁迫可以促进菘蓝根部生长和靛玉红的积累,产量与质量可以兼顾,而严重水分胁迫不利于根系生长和次生物的合成[5];中度干旱胁迫有利于鼠尾草酚类物质的合成,而重度胁迫下其合成量会下降[6];短期的轻度干旱处理有利于提高黄檗幼苗小檗碱、药根碱及掌叶防己碱的合成和积累[7]。由此可见,在不影响植物正常生长的基础上,适度控制土壤含水量,达到根系生长与次生代谢人为调控是获得根类药材优质高产的重要保障。
黄芪是山西省著名的根类道地药材,来源于豆科植物蒙古黄芪(AstragalusmembranaceusBunge var.mongholicus(Bge.)Hsiao)或膜荚黄芪(Astragalusmembranaceus(Fisch.) Bge.)的干燥根,具有调节免疫功能、抗衰老、抗应激、抗心肌缺血和保护肾脏、肝脏、镇静、镇痛和抗骨质疏松等作用,广泛应用于临床配方。由于长期大量无节制采挖,野生黄芪资源濒临枯竭,目前,黄芪药材主要来源于人工栽培,但因缺乏生产规范化意识,加之对环境生态因子的重视度不够,以致药材的质量和规格难以保证。因此加强黄芪栽培生产薄弱环节的理论研究,提高水肥管理水平,对实现黄芪 GAP 及质量稳定可控显得尤为重要。本研究借鉴植物逆境生理学研究成果,从控制土壤水分入手,研究水分胁迫对蒙古黄芪幼苗生长、生理及多糖、皂苷、黄酮3种主要药用成分积累的影响,旨在为黄芪规范化栽培中提高水分管理技术,控制药材质量提供理论依据和技术指导。
1 材料与方法
1.1试验地概况
试验地设在山西农业大学生命科学学院中药材栽培基地,该区属温带大陆性季风气候,海拔 781 m,年均气温 10 ℃左右,1月均温 -7 ℃, 7月均温 23 ℃,最高气温 36 ℃,最低气温 -26 ℃,年降水量 540 mm,无霜期为 140—180 d。
1.2试验材料及处理
本试验以蒙古黄芪一年生实生幼苗为试材,种子采自山西省浑源县官儿乡半野生黄芪分布区。
2013 年 4 月 30 日,对种子进行催芽,先将种子浸于 50 ℃ 温水中搅动,待水温降至 40 ℃ 后浸泡 24 h,涝出洗净用湿布覆盖,种子膨大或种皮破裂时进行播种。5 月 4 日将种子拌适量细沙,均匀撒入 3 cm 深的播种沟内,覆土 1—1.5 cm,稍加镇压。5 月 20 日出苗,正常供水 2 个月后,选择生长良好,大小一致的幼苗移至塑料盆内,盆高 27 cm、上口径 35 cm、下口径 22 cm,每盆装风干土 10 kg,定苗 1 株。缓苗后于 7 月 31 日开始进行控水处理,至 10 月下旬黄芪地上部枯萎结束试验。试验期间,晴天将所有盆栽苗暴露在自然环境中,阴雨天设遮雨棚以防降水。
1.3试验设计
试验采用完全随机区组设计。在预实验基础上设置4种水分处理,包括常规水分条件(CK:土壤含水量为田间最大持水量的70%—75%)、轻度干旱胁迫(A1:土壤含水量为田间持水量的60%—65%)、中度干旱胁迫(A2:土壤含水量为田间持水量的50%—55%)、重度干旱胁迫(A3:土壤含水量为田间持水量的40%—45%),每个处理3次重复,共计240株。土壤含水量采用称重法控制,试验期间每隔1 d下午通过称重监测失水情况并进行补水,使各处理保持在设定的水分标准范围。
各试验指标测试于 7 月 31 日(作为基础数据)开始,苗高及生理指标每隔 1 周测定 1 次,根长与生物量每 2 周测定 1 次,多糖、黄酮、皂苷3种药效成分于生长末期测定,每个指标测定 3 株,3 次重复,结果取平均值。
1.4生长量及生物量的测定
用直尺测量苗高和根长。生物量测定分茎叶和根两部分,样品采回后,105 ℃ 杀青,70 ℃ 烘干至恒重,称重。
1.5保护酶活性与脂质过氧化测定
酶液提取方法: 称取植株中上部最新发育成熟的叶片 0.3 g 于预冷研钵中,加入 6 mL 0.1mol/L的磷酸缓冲液(pH7.8),冰浴下匀浆,4 ℃ 下15000 r/min 离心 15 min,收集上清液用于 SOD、POD、CAT 及 MDA 含量的测定。具体测定均参照李合生[8]的方法,超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定,以每 mg 蛋白抑制 NBT 光化还原 50% 的酶量作为1个酶活性单位(U/mg蛋白);过氧化物酶(POD)活性采用愈创木酚显色法测定,以每分钟吸光值变化 0.01 作为一个酶活性单位(U min-1g-1蛋白);过氧化氢酶(CAT)活性采用紫外吸收法测定,以每分钟分解的 H2O2表示酶活性单位(U min-1mg-1蛋白);丙二醛(MDA)含量采用硫代巴比妥酸(TBA)显色法测定(μmol/g)。
细胞质膜透性采用电导仪法测定[8]。准确称取 0.2 g 叶片,加入 10 mL 去离子水,真空抽气 15 min,置于摇床室温保持 1 h,测电导率S1;然后沸水浴 10 min,冷却至室温测电导率S2,依公式计算膜相对透性,电导率(%)=(S1/S2)%。
1.6次生代谢物含量的测定
1.6.1多糖的测定
以无水葡萄糖为对照品制标准曲线,苯酚-硫酸比色法测定多糖含量[9]。
将黄芪根样品粉碎混匀,45 ℃ 烘干 24 h 后,准确称取 0.2 g 样品,放入 100 mL 容量瓶中,加入 80% 乙醇溶液定容。超声波提取 2 h,过滤,弃去滤液,用 80% 乙醇溶液清洗容量瓶、滤渣及滤纸 3 次。将滤渣连同滤纸放入原容量瓶中,加沸水约 80 mL,再超声波提取 1 h,冷却至室温后定容、摇匀、过滤。取滤液 2.5 mL 于 50 mL 容量瓶中,加蒸馏水定容作为多糖提取液,每个样品重复 3 次。
精密吸取多糖提取液 10 μL,注入 2 mL 刻度试管,蒸馏水定容、摇匀,用紫外可见分光光度计测定 485 nm 处的吸光值,根据线性方程Y=0.0321X-0.0024(R2=0.985)计算多糖含量。
1.6.2总黄酮的测定
利用黄酮类化合物与铝盐反应生成红色络合物,以芦丁为对照品,紫外可见分光光度计测定总黄酮含量[10]。
称取经60 ℃ 烘干的黄芪根样品2.0 g,置于50 mL容量瓶,加甲醇35 mL,浸泡2 h,超声波提取30 min,加甲醇至刻度放置24 h即得总黄酮提取液。
精密吸取提取液2.0 mL置于25 mL容量瓶,定容。在500 nm处测吸光值,代入Y=1.3077X+0.015(R2=0.9823),计算总黄酮含量。
1.6.3总皂苷的测定
以黄芪甲苷为对照品,采用香草醛-冰醋酸比色法测定总皂苷含量[11]。
准确称取3.0 g样品,加60 mL甲醇在索氏提取器中冷浸12 h,然后水浴提取6 h,回收甲醇,残渣加水10 mL加热溶化,转入分液漏斗中,用30 mL的水饱和正丁醇萃取4次,合并正丁醇层,用20 mL氨试液(400 mL浓氨水加水配成1000 mL)洗涤3次,弃去碱水层,回收正丁醇,残渣用甲醇定容至5 mL即成总皂苷提取液。
精密吸取提取液 0.5 mL,在 540 nm 处测定吸光值,按Y=0.4367X+0.0072(R2=0.9933)计算总皂苷含量。
2 结果与分析
2.1土壤干旱胁迫对黄芪生长量及生物量的影响
黄芪苗高与茎叶生物量随幼苗生长一直处于增长趋势,出苗后 80—110 d(8月14日—9月12日)苗高生长最快,生物量快速积累;出苗后120 d(9月19日)苗高生长减缓,生物量积累速率降低,至出苗后 150 d(10月17日试验结束)苗高与生物量达到最大值(图 1)。干旱胁迫后对苗高、茎叶生物量产生显著影响(表 1),随着胁迫强度增大,苗高与茎叶生物量随幼苗生长递减,与正常水分条件(土壤含水量70%—75%)相比,轻度干旱胁迫(A1:土壤含水量60%—65%)下苗高降低了 11.60%(P<0.05),虽然生物量也有所降低,但并无显著差异;中度干旱胁迫(A2:土壤含水量50%—55%)下,苗高与生物量分别比对照降低 23.18%、18.78%(P<0.01),重度干旱(A3:土壤含水量40%—45%)降低了 55.79%、32.13%(P<0.01),说明水分胁迫抑制了幼苗地上部分的生长与物质积累,且干旱胁迫愈强影响愈大。
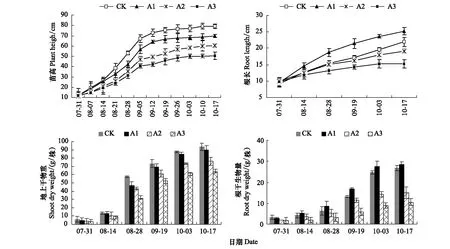
图1 不同土壤干旱胁迫对黄芪生长的影响Fig.1 Effect of different drought stress on growth of Astragalus membranaceus var.mongolicus
根长随幼苗的生长而增加,茎叶枯萎时达最大值;出苗后 100 d 内根生物量积累缓慢,以后积累加快,至出苗后约 150 d 达到最大值(图 1)。轻度干旱胁迫后,促进了根的生长与生物量积累,根长与生物量分别比对照增加 15.18%(P<0.05)、29.13%(P<0.01);中度干旱下根长比对照降低 12.86%,差异不显著,但生物量极显著降低 43.95%(P<0.01);重度干旱严重影响了根生长与生物量积累,分别比对照降低了30.28%(P<0.01)、60.60%(P<0.01)(图 1、表 1)。说明轻度干旱有助于根系生长,而胁迫加重后抑制根系的正常生长。

表1 不同土壤干旱胁迫下黄芪的生长量与生物量
表中数据为平均值±标准误,样本数=9;同列中不同大小写字母分别表示处理间在 0.01 和 0.05 上差异显著
2.2土壤干旱胁迫对黄芪抗氧化酶活性的影响
黄芪幼苗叶片 SOD 酶活性在生长期内呈波浪型变化,生长前期活性较高,随后活性降低,生长后期再度升高,至生长末期又降到最低(图 2)。不同干旱胁迫对 SOD 酶的影响不同,轻度干旱胁迫下,没有改变 SOD 酶的变化趋势,整个生长期内酶的活性明显高于对照,胁迫初期 SOD 酶活明显升高;中度干旱胁迫下,SOD 酶活一直维持在高于对照但低于轻度胁迫的水平,初期 SOD 活性有所降低,后期活性升高;重度干旱胁迫下,SOD 酶活性明显低于对照,而且随幼苗生长持续降低,处于 4 组水分处理的最低水平。

图2 不同土壤干旱胁迫对黄芪叶片3种抗氧化酶活性的影响Fig.2 Effect of different drought stress on activities of three antioxidant enzymes in leaves of Astragalus membranaceus var.mongolicus
图 2 显示,POD 酶活性在生长前期随幼苗生长而下降,8 月 21 日降到最低值,比测定初期(7 月 31日)降低 47.24%,然后稍有升高直至叶片枯萎,但活性低于初期,测定末期(10月3日)的酶活是测定初期的 60.41%。干旱胁迫后,随着胁迫强度加强,POD 酶活性降低或升高的幅度加大,生长前期酶活急速下降,8 月 21 日,3种胁迫下的酶活性分别比测定初期降低了 54.70%、61.83%、60.0%;之后酶活性又呈不同程度升高,轻度胁迫下酶活缓慢上升,至叶片枯萎时略有下降,10 月 3 日的酶活比 8 月 21 日升高了 47.42%,但比初期降低 33.22%,中度和重度胁迫后,末期酶活性分别比 8 月 21 日提高了 1.37倍、2.32 倍,中度胁迫后末期酶活仍低于初期,但重度胁迫后酶活明显升高,比初期提高了 32.97%。轻度和中度胁迫下,POD 酶活变化曲线呈“S”型,而重度胁迫下呈“V”型。
CAT 酶活性在整个生长期内变化平缓,平均活性为 194.95 U g-1min-1,测定末期低于初期。干旱胁迫后,CAT 酶活性始终高于对照,呈现先升高后降低再升高再降低的波浪型变化趋势(图 2)。轻度胁迫下,CAT 酶的变化幅度轻小,平均酶活为 226.13 U g-1min-1,高于对照 16.0%,且末期酶活性低于初期;中度和重度胁迫下,CAT 酶活性升高幅度较大,平均酶活性分别比对照提高 34.97%、52.91%,尤其在生长后期酶活性明显升高,之后随叶片枯萎降低,至末期酶活性高于初期。
2.3土壤干旱胁迫对黄芪叶片脂质过氧化程度的影响
本试验用丙二醛(MDA)含量和细胞膜相对透性来衡量细胞膜受伤害的程度。从图 3 可以看出,生长期内黄芪叶片丙二醛含量呈先降低后升高趋势,且生长末期含量高于初期,而细胞膜渗透率先升高然后降低,生长末期低于初期。不同强度干旱胁迫对二者产生的影响不同,轻度干旱胁迫后,整个生长期内膜渗透率和 MDA 含量均低于对照,中度和重度干旱胁迫后,二者均明显高于对照,干旱强度愈大,脂质过氧化程度愈明显。

图3 不同土壤干旱胁迫对黄芪丙二醛及电导率的影响Fig.3 Effect of different drought stress on contents of malondialdehyde and electrolyte leakage of Astragalus membranaceus var.mongolicus
2.4土壤干旱胁迫对黄芪根中3种次生代谢物含量及产量的影响
常规供水条件下,黄芪根中多糖含量最高为12.18 mg/g,皂苷含量次之为4.82 mg/g,黄酮含量最低为3.37 mg/g(图4)。干旱胁迫对次生物的积累影响不同,轻度干旱胁迫下,多糖和皂苷含量分别比对照增加17.82% 和 12.33%,黄酮含量与对照差异不大;中度和重度干旱胁迫下,次生物质含量减少,尤其是重度胁迫下多糖和皂苷含量显著降低,分别比对照降低17.98%、27.18%。
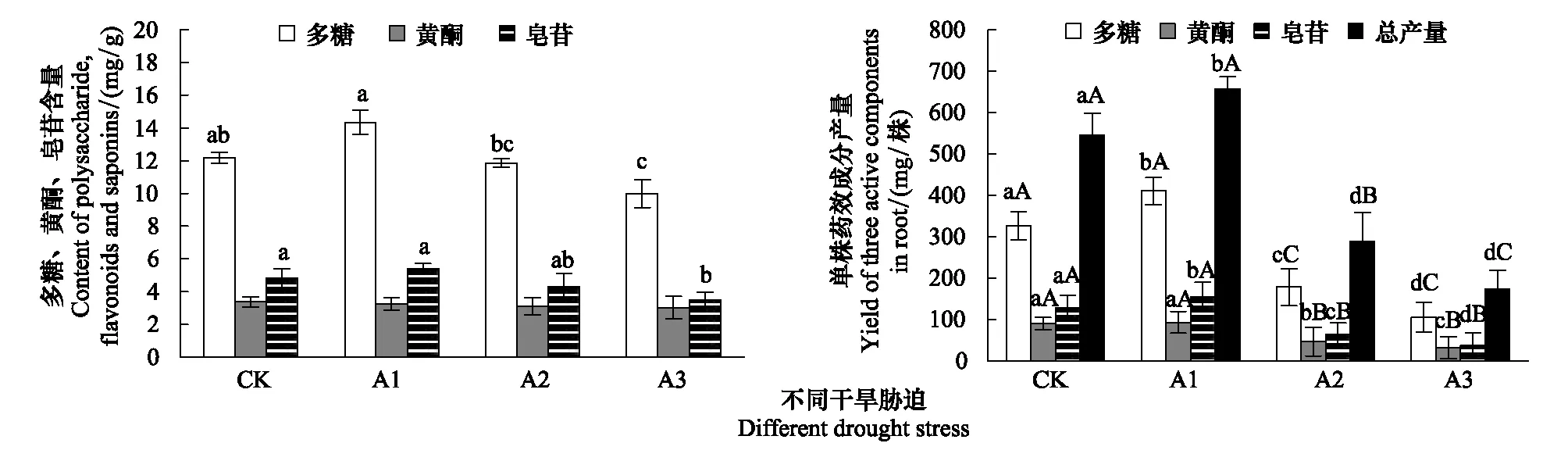
图4 不同土壤干旱胁迫下黄芪单株次生代谢物含量和产量Fig.4 The Secondary metabolites content and yield in root of Astragalus membranaceus var.mongolicus seedling under different drought stress图中不同大小写字母分别表示处理间在0.01和0.05水平差异显著
在生产中人们更关心的是黄芪药效成分的产量,即药效成分含量与根生物量干重的乘积。轻度干旱胁迫下,不仅促进了根的生长和生物量的积累,而且也显著增强了多糖和皂苷的含量,尽管黄酮含量没有明显提高,但由于根生物量的增加,因而黄酮产量也有所增加,3种药效成分多糖、黄酮、皂苷产量分别比对照提高了25.70%(P<0.05)、2.97%、19.63%(P<0.05),总产量提高了20.51%(P<0.05)(图4);中度和重度干旱胁迫下,根生长受到抑制,3种药效成分含量减少,因而产量极显著降低,其中多糖产量分别比对照降低45.48%、67.70%(P<0.01),黄酮降低50.53%、64.73%(P<0.01),皂苷降低49.93%、71.32%(P<0.01),总产量降低47.0%、68.07%(P<0.01)。
3 讨论与结论
水分对植物根系的生长发育具有调控作用,尤其与根类药材的生长和药效成分的合成积累关系密切。在适宜水分条件下,根系生长良好,构型合理,产量高,但不利于药效成分的合成;而适度的水分胁迫能诱导防御与适应反应,增强体内次生代谢[2,12],从而提高药效成分含量。因此,研究水分与药材生长及药效成分合成积累之间的关系,寻找既能提高质量又不影响产量的土壤含水量,是中药材规范化生产中水分管理的关键技术。
本研究发现,轻度干旱胁迫下黄芪苗高和茎叶生物量降低,但显著促进了根的生长和生物量的积累;中度和重度干旱胁迫下显著抑制了苗木生长及生物量积累。植物在受到资源限制时,通常会调节生物量分配以适应环境变化[13],在轻度干旱条件下,黄芪为了满足对水分的需求,将生长中心向根系转移,试图从土壤中吸收更多的水分[14],从而促进了根的生长,而地上部因受水分限制生长减弱;当土壤干旱加重时,根系吸水受阻,影响同化物的合成,因而根长、根生物量显著降低(图 1,表 1)。
干旱胁迫诱导植物的抗氧化防御反应已有很多报道,一般来说,随着胁迫强度的增大和时间的延长,植物体内膜脂过氧化产物 (MDA) 含量和电导率增加,抗氧化酶活性表现出先升后降的变化,也有些植物不同抗氧化酶活性表现出不同的变化规律[15]。本研究显示,轻度干旱胁迫下黄芪生长期内 MDA 含量和电导率降低(图 3),SOD、POD、CAT 3种抗氧化酶活性总体高于对照(图 2),SOD 酶活性呈先升后降再升再降的波浪型变化趋势,POD 酶活性变化呈“S”型,CAT 酶活性变化平缓,这与陈思婷等[16]对槟榔幼苗的研究结果一致。3种抗氧化酶不同的变化趋势,说明细胞通过抗氧化酶之间的协同作用,清除细胞内的活性氧和降低膜脂过氧化程度来提高植株的抗性[17],因而植株得以正常生长。当干旱胁迫上升到中度、重度时,SOD 酶活性明显降低,而 POD 及 CAT 酶活性提高,MDA 含量、电导率随胁迫增强而升高(图 2,图3), 说明胁迫已超出了细胞的承受能力,细胞膜脂过氧化程度加深,细胞受到的伤害增强,以致植株生长受到抑制[18]。
黄璐琦等[19]研究道地药材时提出了逆境效应理论,指出环境胁迫能刺激植物次生代谢产物的合成与积累。本研究中,轻度干旱胁迫明显提高了黄芪根中多糖和皂苷的含量,而中度和重度胁迫下含量降低,这与 Bettaieb 等[6]对鼠尾草的研究结果相类似。结合抗氧化酶的变化情况分析,轻度干旱胁迫下黄芪体内SOD、POD、CAT 活性提高,表明活性氧(ROS)作为信号分子引发适应和防御反应,同时上调与干旱逆境有关的蛋白表达,促进次生代谢物含量的提高[20];干旱胁迫加重后,ROS 与抗氧化系统间的平衡被破坏,ROS 大量积累,脂质过氧化程度加深,引起细胞生理和代谢异常[2],导致幼苗生长受阻、次生代谢过程减弱。
综上所述,轻度干旱胁迫(土壤含水量 60%—65%)能促进黄芪药用部位根的生长及多糖、皂苷含量的积累,但中度(土壤含水量 50%—55%)和重度(土壤含水量 40%—45%)干旱胁迫超过了黄芪所能承受的抗逆能力,次生代谢物含量大大降低。这一结果可为黄芪种植中药效成分的定向培育提供水分调控理论依据和技术指导,但本研究中黄酮的含量没有得到明显提高,因而探讨黄酮合成的适宜环境因子有待进一步研究。
[1]Xu M J, Dong J F, Zhu M Y. Nitric oxide mediates the fungal elicitor-induced puerarin biosynthesis inPuerariahomsoniiBenth. suspension cells through a salicylic acid (SA)-dependent and a jasmonic acid (JA)-dependent signal pathway. Science in China Series C: Life Sciences, 2006, 49(4): 379-389.
[2]孟祥才, 王喜军. 活性氧促进道地药材质量形成的假说及其探讨. 中草药, 2011, 42(4): 799-804.
[3]张争, 杨云, 魏建和, 孟慧, 陈怀琼, 隋春. 环境因子导致的植物防御反应与药用次生代谢物的合成和积累. 植物生理学通讯, 2009, 45(9): 919-924.
[4]尚辛亥, 王洋, 阎秀峰. 土壤水分对高山红景天生长和红景天甙含量的影响. 植物生理学通讯, 2003, 39(4): 335-336.
[5]谭勇, 梁宗锁, 董娟娥, 郝海员, 叶青. 水分胁迫对菘蓝生长发育和有效成分积累的影响. 中国中药杂志, 2008, 33(1): 19-22.
[6]Iness Bettaieb, Ibtissem Hamrouni-Sellami, Soumaya Bourgou, Ferid Limam, Brahim Marzouk. Drought effects on polyphenol composition and antioxidant activities in aerial parts ofSalviaofficinalisL. Acta Physiologiae Plantarum, 2011, 33(4):1103-1111.
[7]李霞, 王洋, 阎秀峰. 水分胁迫对黄檗幼苗三种生物碱含量的影响. 生态学报, 2007, 27(1): 58-64.
[8]李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 164-263.
[9]张立, 马琼, 何永利, 张朋涛. 灵芝、香菇、黄芪、枸杞提取物中多糖的含量测定. 中草药, 2004, 35(2):167-168.
[10]王小青, 海力茜, 帕丽达, 努尔比亚, 玛依拉, 努尔买买提. 天山岩黄芪不同部位中总黄酮含量的测定. 新疆师范大学学报: 自然科学版, 2006, 25(l): 49-51.
[11]陆一心. 黄芪甲甙定量方法的研究. 中成药, 1996, 18(2): 35-35.
[12]高扬, 梁宗锁. 水分对根类中药材根系生长及有效成分积累的影响. 现代中药研究与实践, 2004, 18(3): 10-15.
[13]安玉艳, 梁宗锁, 郝文芳. 杠柳幼苗对不同强度干旱胁迫的生长与生理响应. 生态学报, 2011, 31(3): 716-725.
[14]李芳兰, 包维楷, 吴宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应. 生态学报, 2009, 29(10): 5406-5416.
[15]李璇, 岳红, 王升, 黄璐琦, 马炯, 郭兰萍. 影响植物抗氧化酶活性的因素及其研究热点和现状. 中国中药杂志, 2013, 38(7): 973-978.
[16]陈思婷, 孙程旭, 曹红星, 冯美利, 陈良秋, 张木炎. 干旱胁迫对槟榔幼苗生理生化特性的影响. 江西农业学报, 2009, 21(10): 70-72.
[17]Sun C H, Shi J J, Wang D, Li B W, Sun D. Effects on physiological and biochemical characteristics of medicinal plant pigweed by drought stresses. Journal Medicinal Plants Research, 2011, 5(17): 4041-4048.
[18]司灿, 张君毅, 徐护朝. 药用植物在干旱胁迫下生长代谢变化规律及应答机制的研究进展. 中国中药杂志, 2014, 39(13): 2432-2437.
[19]黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成. 中国中药杂志, 2007, 32(4): 277-280.
[20]Xiao X W, Yang F, Zhang S, Helena Korpelainen, Li C Y. Physiological and proteomic responses of two contrastingPopuluscathayanapopulations to drought stress. Physiologia Plantarum, 2009, 136(2): 150-168.
Effects of drought stress on seedling growth and accumulation of secondary metabolites in the roots ofAstragalusmembranaceusvar.mongholicus
LIANG Jianping1, JIA Xiaoyun1, LIU Yaling1, WU Yun1, ZHOU Ran2,*, FENG Qianjin2
1CollegeofLifeSciences,ShanxiAgriculturalUniversity,Taigu030801,China2ShanxiUniversityofTraditionalChineseMedicine,Jinzhong030619,China
Drought stress usually influences growth and secondary metabolite accumulation in the roots ofAstragalusmembranaceusvar.mongholicus, resulting in varied qualities and medicinal properties. In this study, four different drought treatments (regular soil-water content [CK], mild drought stress [A1], medium drought stress [A2], and strong drought stress [A3]) were applied to evaluate the effects of drought on one-year-old Shanxi nativeA.membranaceusseedlings. The results showed that an increase in the growth of stems and leaves ofA.membranaceusoccurred 80—120 d following germination, and then it gradually decreased. A high accumulation of root biomass occurred during the withering period of the aboveground parts of the plants. Drought stress reduced the height and aboveground biomass significantly and affected antioxidant activity, root development, and secondary metabolite accumulation. Under A1 conditions, the activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), were raised with increased root length, root biomass, polysaccharides, and saponins. However, the malondialdehyde (MDA) content and cell membrane permeability decreased accompanied with a significant improvement in the overall quality ofA.membranaceus(P< 0.05). The SOD activity decreased, and it was lower than that of the control under the A4 conditions. For increased drought stress, the activities of POD and CAT, MDA content, and cell membrane permeability were all increased and consequently resulted in a decreasing in root length, root biomass polysaccharides, saponins and the overall quality of the plant (P< 0.01). In summary, the result showed that the SOD activity was more sensitive to drought stress, suggesting a major function in the resistance to active oxygen. In addition, mild drought stress might promote the interaction between the antioxidant enzyme system and secondary metabolism system inA.membranaceusby increasing resistance to cell damage. The quality and yield of root could be improved by reducing aboveground growth for nutrient transportation to roots to some extent. The results of this study can be applied to promote the production ofA.membranaceuswith high polysaccharide and saponin contents through water management.
Astragalusmembranaceusvar.mongholicus; drought stress; antioxidant enzyme; secondary metabolites
国家“十二五”科技支撑计划项目(2011BAI07B01); 国家自然科学基金项目(31400285); 山西省科技攻关项目(20110313002-2); 山西农业大学博士项目(XB2008022); 山西省科技攻关计划(振东项目)(2014ZD0501-1)
2014-12-16; 网络出版日期:2015-10-10
Corresponding author.E-mail: zhour58@sohu.com
10.5846/stxb201412162507
梁建萍,贾小云,刘亚令,吴云,周然,冯前进.干旱胁迫对蒙古黄芪生长及根部次生代谢物含量的影响.生态学报,2016,36(14):4415-4422.
Liang J P, Jia X Y, Liu Y L, Wu Y, Zhou R, Feng Q J.Effects of drought stress on seedling growth and accumulation of secondary metabolites in the roots ofAstragalusmembranaceusvar.mongholicus.Acta Ecologica Sinica,2016,36(14):4415-4422.

