黄瓜低霜霉威残留性相关基因SDH克隆及表达
秦智伟,郭 磊,周秀艳,辛 明(东北农业大学园艺学院,哈尔滨 150030)
黄瓜低霜霉威残留性相关基因SDH克隆及表达
秦智伟,郭磊,周秀艳,辛明
(东北农业大学园艺学院,哈尔滨150030)
通过Solexa技术和比较基因组学方法鉴定霜霉威胁迫下黄瓜果实差异表达基因,筛选黄瓜低霜霉威残留性相关基因SDH。研究利用PCR克隆获得SDH基因全长,命名为CsSDH。构建亚细胞定位表达载体,利用农杆菌浸润法注射烟草叶片后激光共聚焦显微镜下观察;分别用荧光定量RT-PCR方法和酶联免疫法研究高、低农残品系D9320和D0351中CsSDH基因在农药霜霉威处理后,不同时间点、不同组织部位时空表达特征和琥珀酸脱氢酶活性。结果表明,CsSDH基因在烟草叶片细胞中被定位在细胞膜上。黄瓜低农残品种D0351中,CsSDH基因在果实受霜霉威胁迫后反应迅速,主要在处理前期响应表达强烈,琥珀酸脱氢酶活性显著增加,且该基因表达量显著高于其在高农残品种D9320中表达量。CsSDH果、叶中表达量较茎中高,且各组织部位表达量高低顺序稳定,为叶>果>茎。黄瓜高农残品种D9320中,CsSDH基因表达量在0.5、1、3、12 h呈现上调表达,6、9 h基因表达量差异不显著,48 h出现上调表达高峰。说明克隆得到的CsSDH基因属农药处理前期响应基因,且该基因可能在降低黄瓜农药残留过程中发挥重要作用。试验通过研究黄瓜琥珀酸脱氢酶基因(SDH)在霜霉威胁迫下表达情况,为挖掘黄瓜低农药残留性功能基因以及探明其作用分子机制奠定基础。
黄瓜;琥珀酸脱氢酶;基因克隆;亚细胞定位;基因表达
秦智伟,郭磊,周秀艳,等.黄瓜低霜霉威残留性相关基因SDH克隆及表达[J].东北农业大学学报,2016,47(4):24-33.
Qin Zhiwei,Guo Lei,Zhou Xiuyan,et al.Cloning and expression of theSDHgene related to the cucumber propamocarb's residual property[J].Journal of Northeast Agricultural University,2016,47(4):24-33.(in Chinese with English abstract)
网络出版时间2016-4-22 10:01:20[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160422.1001.022.html
农产品农药残留是影响食品安全的重要因素。化学农药自1938年在世界推广应用以来,20世纪50年代末农药残留问题凸现,蔬菜农药残留问题现已成为政府、市场和消费者关注的热点问题[1]。残留农药直接或间接传递给人、畜,并在人、畜体内富集,不仅造成生物体慢性中毒,有的农药还有致DNA损伤、致畸和致癌作用[2-3]。目前,从生物遗传育种角度探索降低农药残留机理,依靠生物体自身特性解决农药残留问题,培育低农残新品种,已成为解决蔬菜农残问题重要途径。
琥珀酸脱氢酶从酿酒酵母中首次提取克隆与鉴定,属黄素酶类[4]。也称为线粒体复合物Ⅱ,由A、B、C、D 4个亚基组成的异源四聚体,分别由相应核基因编码[5]。SDH是三羧酸循环和线粒体呼吸链组成部分,在细胞能量代谢中起重要作用。SDH在氧化磷酸化过程中,可催化琥珀酸产生延胡索酸,并将FAD还原成FADH2,通过TCA循环将糖分解为二氧化碳和水,生物体内大部分ATP均由此途径产生[6-7]。TCA途径是植物体能量代谢主要途径,为植物体提供能量和代谢合成原料。SDH是目前评定机体有氧代谢供能能力重要指标[8]。近年来,国内外对该基因在植物应用方面研究较少。张宇君等研究表明,病原菌编码琥珀酸脱氢酶基因不但与抗药性基因表达有关外,还与病原菌致病性基因表达密切相关[9]。在整个电子传递链上传递大量电子时,有些电子漏出,使氧气发生电子还原而产生超氧阴离子自由基[10]。Rothery等研究表明,定点突变的琥珀酸脱氢酶可提高超氧阴离子自由基产量,使生物体生物膜结构及功能受损伤,引起核酸及蛋白质变性等,对细胞及组织产生多种生物学效应[11]。Popov等研究发现,琥珀酸脱氢酶活性及mRNA含量受光及光敏色素调控[12]。Gleason等提供遗传证据表明,线粒体复合物II的电子传递链,有助于植物体局部修复,且在植物胁迫基因表达调控和防御反应中具有重要作用[13]。
蔬菜农药残留问题研究主要集中在农残对植物生理机制影响和农残检测技术方面[14],去除残留农药方法也主要以降解果蔬外农药残留为主[15]。马佰慧对黄瓜果实霜霉威残留性进行遗传分析,提出黄瓜果实中霜霉威残留性符合加性-显性遗传模型,受环境影响不大,是多基因控制的数量性状,同时检测到1个与霜霉威残留性相关的QTL位点,这个QTL位点距离最近标记图距为6.3 cM[16]。本课题组已从黄瓜种质资源中筛选出霜霉威残留量不同的黄瓜品种(品系)[16-18],并发掘参与霜霉威胁迫响应的蛋白和基因[19-20]。
基于吴鹏等Solexa高通量测序分析基础[20],通过对CsSDH基因克隆和序列及表达模式分析,拟探明该基因响应霜霉威胁迫规律,为黄瓜低霜霉威残留性分子机制研究奠定基础,同时为低农药残留黄瓜新品种选育提供理论依据。
1 材料与方法
1.1材料
1.1.1试验材料
以黄瓜“D0351”(低农残品系)和“D9320”(高农残品系)为试验材料[17],种子由东北农业大学园艺学院黄瓜课题组提供。
2015年4月中旬于温室内播种育苗,植株生长到两叶一心时定植于塑料棚内,正常田间管理,于定植后34 d(第10节位瓜商品成熟)全株喷施霜霉威处理,喷施剂量为400倍霜霉威盐酸盐水剂,以同时间喷水处理为对照,喷施到叶面和果实开始滴液程度时停止喷施。地面覆盖农膜,防止农药浸入土壤。于处理后0.5、1、3、6、9、12、24和48 h取黄瓜植株第10节位叶、茎、果实,并选取3株长势一致黄瓜植株混合取样。迅速冻于液氮,-80℃保存备用。田间种植在东北农业大学设施园艺中心完成。
1.1.2酶及生化试剂
TaqDNA聚合酶,DNAmarker,限制性内切酶HindⅢ、Bam HⅠ,T4DNA连接酶,质粒提取试剂盒购自北京全式金生物技术有限公司,SYBR qP⁃CRmix,ReverTra Ace qPCR RT Kit(东洋纺)购自大连赛拓生物技术有限公司,凝胶回收试剂盒购自百泰克,植物琥珀酸脱氢酶活性检测试剂盒(ml⁃bio)购自上海盈公实业有限公司,引物合成及菌液测序均由上海生物工程技术有限公司完成。其编号及序列见表1。

表1 引物序列及用途Table 1 Sequence and usage of primers
1.1.3克隆菌株及载体
pEASY-T3 Cloning Kit,DH5α感受态购自北京全式金生物技术有限公司,农杆菌LBA4404、PBI121载体及亚细胞定位载体eGFP均由东北农业大学园艺学院黄瓜课题组保存。
1.2方法
1.2.1总RNA提取与cDNA合成
按照Trizol试剂(Invetrition)说明书提取黄瓜叶片总RNA,琼脂糖凝胶电泳和SMA 3000检测其完整性和浓度。利用ReverTra Ace qPCR RT Kit (TOYOBO)说明书合成cDNA,样品稀释至200 ng·μL-1,-20℃保存,备用。
1.2.2CsSDH基因克隆
利用Premier 5.0软件,根据Solexa测序差异序列比对出黄瓜基因组数据库中Csa3M595230.2基因序列编码区设计引物并合成[20]。反应体系为cDNA 2.0 μL、dNTP(2.5mmol·L-1)2.0 μL、上下游引物(10mmol·L-1)各 0.5 μL、Buffer(10×)2 μL、Easy Taq酶0.2 μL和ddH2O 12.8 μL。95℃预变性5min;95℃变性30 s,62℃复性30 s,72℃延伸60 s,35个循环;72℃10min,4℃终止反应。将克隆获得产物切胶回收,与pEASY-T3载体连接后转化DH5α,37℃过夜培养,挑取阳性克隆,经菌体PCR验证正确后送金唯智(上海)股份有限公司测序。
1.2.3生物信息学分析
由核苷酸序列推导的氨基酸序列在NCBI数据库上用BLASTp分析序列相似性。基因开放阅读框用NCBI(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)的ORF Finder分析;利用protparam(http://web.ex⁃pasy.org/protparam/)分析编码蛋白氨基酸组成、理论分子质量和等电点;并通过NCBI(http://www.nc⁃bi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析基因保守结构域;应用ProtScal(http://www.expasy.ch/cgibin/protscale.pl)软件预测蛋白质疏水性;应用TMHMM Server V.2.0在线程序预测蛋白质跨膜结构域;利用TargetP 1.1 Server预测和分析氨基酸序列导肽;二级结构分析采用PredictProtein(http:// www.predictprotein.org/)分析,三级结构预测采用(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index);使用ClustaW软件多重序列比对;利用Mega5软件,采取Neighbor-Joining法构建系统进化树并分析[21]。
1.2.4不同品种、组织、时间点基因表达量分析
分别提取混合样品总RNA,方法同1.2.1。cDNA 第1链合成参考反转录说明书(TOYOBO)。将合成的cDNA稀释至200 ng·L-1后,于-20℃保存,用于荧光定量RT-PCR分析试验。利用网站(https://www. genscript.com/ssl-bin/app/primer)设计荧光定量引物CsSDH-qF和CsSDH-qR,以EF1a(Elongation Fac⁃tor 1a)为内参基因,设计特异PCR引物、EF1a-F、EF1a-R,qRT-PCR反应体系为cDNA2 μL,上下游引物分别为0.5 μL(10mmol·L-1),SYBR Green PCRmastermix 10 μL,ddH2O 7 μL。反应条件为95℃预变性 3min;95℃变性10 s,55℃ 30 s,72℃30 s,40个循环。样品和内参分别设3次重复。数据分析采用SPSS 17.0和2-ΔΔCt方法分析。
1.2.5CsSDH基因编码蛋白的亚细胞定位
设计亚细胞定位引物CsSDH-YF和CsSDHYR,以cDNA为模板,克隆目的基因,反应体系及程序同1.2.2,产物用1%琼脂糖凝胶电泳分析,切胶回收目的片段T/A克隆后测序。从测序正确菌液中提取质粒,再分别HindⅢ和Bam HⅠ双酶切,T4DNA连接酶连接到eGFP载体上,获得GFP/目的基因的融合表达载体。然后再转入DH5α感受态细胞、PCR扩增、酶切筛选阳性克隆,并对阳性克隆测序验证。将测序正确质粒转入农杆菌LBA4404,卡那霉素和利福平双抗性筛选含有功能质粒的农杆菌。将含有功能质粒的农杆菌28℃培养至OD600=0.3,等体积buffer(10mmol·L-1MES, 200 μmol·L-1acetosyringone,10mmol·L-1MgCl2)悬浮,并室温静置4~6 h,然后由下表皮注射到生长4周烟草叶片中,继续培养4~6 d,以不连接目的基因空载体eGFP(编码绿色荧光蛋白GFP)为阳性对照。用激光共聚焦显微镜直接观察叶片荧光情况。
1.2.6琥珀酸脱氢酶活性测定
利用酶联免疫法琥珀酸脱氢酶活性检测试剂盒(mlbio)检测霜霉威处理不同品种、组织及时间点琥珀酸脱氢酶活性。
2 结果与分析
2.1CsSDH基因克隆
通过在黄瓜基因组数据库(http://www.icugi.org/)中比对,找到基因ID为Csa3M595230.2的基因编码区全序列,使用引物设计软件Primer Premier 5.0设计引物SDH-F、SDH-R,以黄瓜D0351幼叶器官来源cDNA为模板,经克隆测序得SDH全长,命名为CsSDH,获得长度为834 bp全长ORF(见图1)。
图1 CsSDH的PCR扩增产物Fig.1 PCR products of CsSDH
2.2CsSDH生物信息学分析
2.2.1氨基酸序列及理化性质
将序列经NCBI上的ORF finder程序分析,得到ORF阅读框长为834 bp。该蛋白由20种氨基酸组成,包含277个氨基酸,分子质量为31 035.7,理论等电点为8.87。正电残基(Asp+Glu)为29,负电残基(Arg+Lys)为38。原子组成为1 361个C、2 176个H、386个N、403个O、20个S,化学式是C1361H2176N386O403S20,原子总数4 346个。该蛋白总平均亲水性(Grand average of hydropathI city,GRA⁃VY)、不稳定系数(Instability index)、脂肪系数(AlIphatic index)分别为-0.377、64.56、81.08,是一个不稳定蛋白,无信号肽。由TMHMM Server V.2.0在线程序预测CsSDH编码蛋白无跨膜区域,为非跨膜蛋白。
2.2.2CsSDH功能结构域分析
通过NCBI保守域结构分析程序对CsSDH进行蛋白质保守结构域分析,结果见图2。
由图2可知,CsSDH基因推导的氨基酸序列包含2个结构域,在48-152aa具有Fer_2保守结构域,此结构域属于Fer2超家族,在酶促反应和电子传递过程中起重要作用。而靠近C-端189-262 aa具有1个 Fer4_17结构域,此结构域属铁硫蛋白超家族(HCP-like superfamily),在氮代谢中发挥重要作用。

图2 CsSDH编码蛋白结构域预测Fig.2 CsSDH encoding protein domain prediction
2.2.3CsSDH二级和三维结构分析
二级结构预测结果表明,CsSDH编码的蛋白中螺旋结构占30.32%,肽链占6.86%,无规则卷曲占62.82%。可见,α-螺旋和无规则卷曲占据该蛋白质二级结构大部分构成。对CsSDH蛋白三级结构预测(见图3),可见,该蛋白含有多处粉红色的α-螺旋和黄色的β-折叠。

图3 黄瓜CsSDH三维结构模型Fig.3 3-D structuremodels of CsSDH
2.2.4CsSDH蛋白系统进化树
为研究CsSDH与其他植物琥珀酸脱氢酶基因进化关系,Clastal W对氨基酸序列比对后,利用MEGA 5.0软件通过Neighbor-Joining(NJ)法构建氨基酸序列进化树,结果显示(见图4),黄瓜CsSDH与甜瓜CmSDH关系最近,同源性为96%,与大豆同源性为84%,与菜豆同源性为85%,与鹰嘴豆同源性为86%,与蒺藜苜蓿同源性为84%,与番茄、马铃薯亲缘关系较远,同源性仅为82%。从进化树上看,相同科或类群植物聚为一类,但不同植物间SDH间也有很高同源性,可推测其在进化过程中相当保守。
2.3CsSDH基因不同品种、不同时间、不同组织部位表达量分析
为进一步了解该基因霜霉威胁迫下,不同黄瓜组织内表达特性,本研究以低农残黄瓜品系D0351和高农残黄瓜品系D9320为试验材料,利用荧光定量RT-PCR技术分析CsSDH基因在霜霉威处理后黄瓜果皮不同处理时间表达情况。结果如图5所示,D0351黄瓜果实霜霉威处理后,CsSDH基因表达水平迅速升高,并在1 h时达到高峰,是对照的4.75倍,然后逐渐降低,到48 h到达最低,是对照的0.6倍。在0.5~48 h处理时间内,除48 h外,其余时间点CsSDH基因表达量均高于对照组,尤其在霜霉威处理0.5、1、3、6 h处,CsSDH基因表达量均极显著高于对照13.5~1.5倍,说明CsSDH基因在果实受霜霉威胁迫后反应迅速,主要在处理前期响应表达强烈。而在高农残品种D9320中(见图6),CsSDH基因表达量在0.5、1、3、12 h也呈上调表达,但其表达量和表达规律与D0351表现不一致,特别是48 h出现上调表达高峰,是对照的11倍,与D0351表达规律相反。除48 h外,其余时间表达量均在1.5及以下,CsSDH基因整体表达水平低于低农残品种D0351表达量。由此可以看出,此基因对降低农残有重要作用,同时也表明,CsSDH基因是响应霜霉威胁迫的一个应答基因。

图4 CsSDH系统进化分析Fig.4 Phylogenetic analysis of CsSDH

图5 黄瓜CsSDH基因在低农残品系D0351果实中农药霜霉威处理后表达量Fig.5 Expression of CsSDH in low pesticide residues cucumber strain D0351 after propamocarb treatment
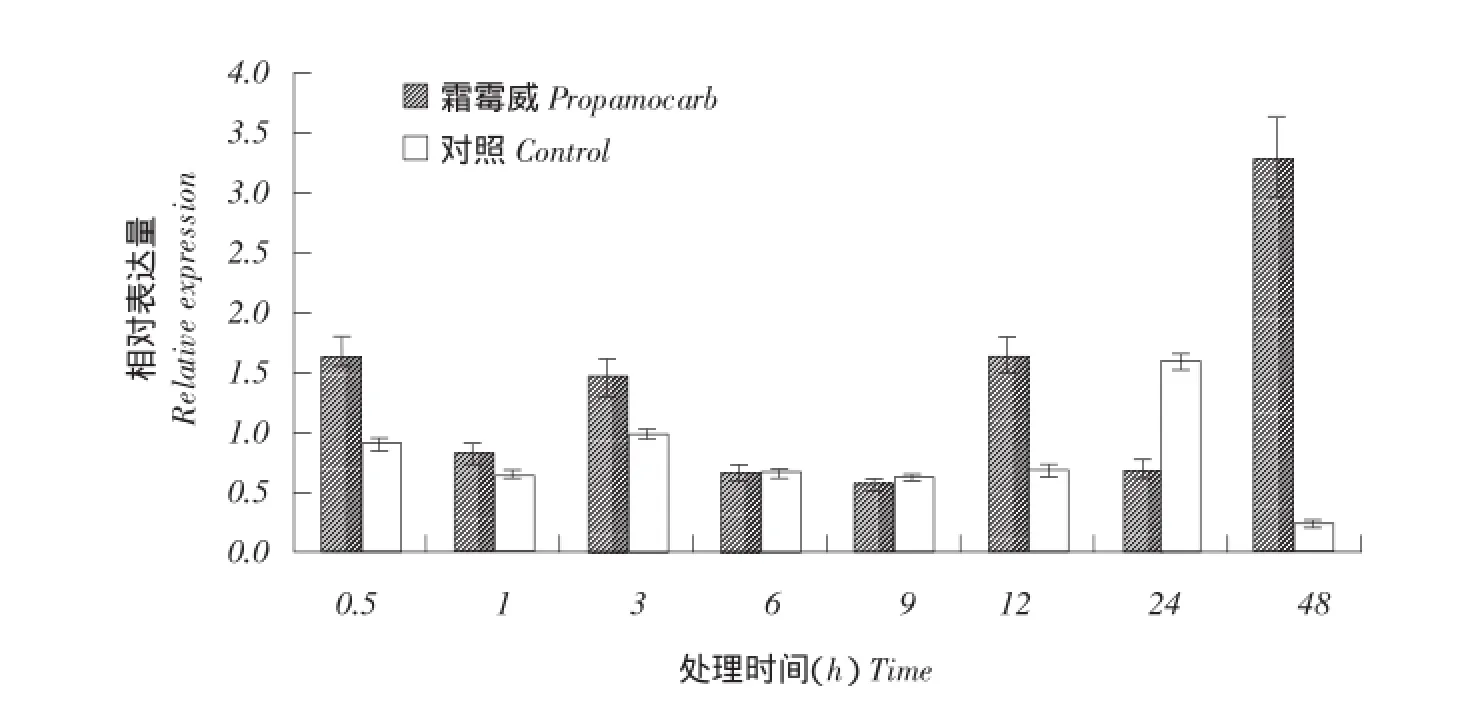
图6 黄瓜CsSDH基因在高农残品系D9320果实中农药霜霉威处理后表达量Fig.6 Expression of CsSDH in high pesticide residues cucumber strain D9320 after propamocarb treatment
同样利用qRT-PCR技术分析CsSDH基因霜霉威处理后低农残品系D0351果、叶、茎不同部位和不同时间点表达情况,结果见图7。经霜霉威处理后,CsSDH基因总体表达趋势:果实和叶片随处理时间延长其表达量逐渐降低,处理后3 h最高、9 h次之、24 h最低。不同部位表达量高低顺序是叶> 果>茎。CsSDH基因处理后3 h果实和叶片部位表达量最高,显著高于茎部,是茎中表达量的4倍以上。CsSDH基因在茎中的表达量3个不同处理时间段基本一致无变化,均显著低于其在果实和叶片中表达量。说明CsSDH基因在黄瓜叶片、果实和茎部稳定表达,该基因可能主要在叶片和果实中发挥作用。
2.4CsSDH基因编码蛋白的亚细胞定位
为研究CsSDH编码蛋白的亚细胞定位,将CsSDH-GFP融合表达载体转入烟草叶片细胞中,在激光共聚焦显微镜下观察CsSDH融合蛋白亚细胞定位情况。由图8可知,绿色荧光信号主要富集于细胞膜上,该基因编码蛋白主要定位于细胞膜上。

图7 黄瓜CsSDH组织特异性表达Fig.7 Tissue-specific expression of CsSDH gene in fruit,stem and leaf of cucumber

图8 黄瓜CsSDH基因亚细胞定位分析Fig.8 Subcellular localization analysis ofCsSDH
2.5琥珀酸脱氢酶活性测定
为进一步了解CsSDH基因表达在降低农药残留中的作用,测定D0351和D9320果实霜霉威处理后琥珀酸脱氢酶活性。结果表明(见图9),随霜霉威处理后时间增加,低残留品系D0351琥珀酸脱氢酶活性呈先降后升趋势,且整体酶活性均高于其他组。且其对照组中琥珀酸脱氢酶活性也高于D9320中此酶活性。而在D9320中,处理后24和48 h,琥珀酸脱氢酶活性低于其对照组,其他时间点此酶活性均高于对照组。此结果也间接验证CsS⁃DH基因在降低农药残留过程发挥重要作用。另外,在不同组织中,琥珀酸脱氢酶平均活性也呈叶>果>茎,这与CsSDH基因在不同组织中表达量结果一致(见图10)。

图9 霜霉威处理后黄瓜果实中琥珀酸脱氢酶活性变化Fig.9 Activity of succinate dehydrogenase in cucumber after propamocarb treatment
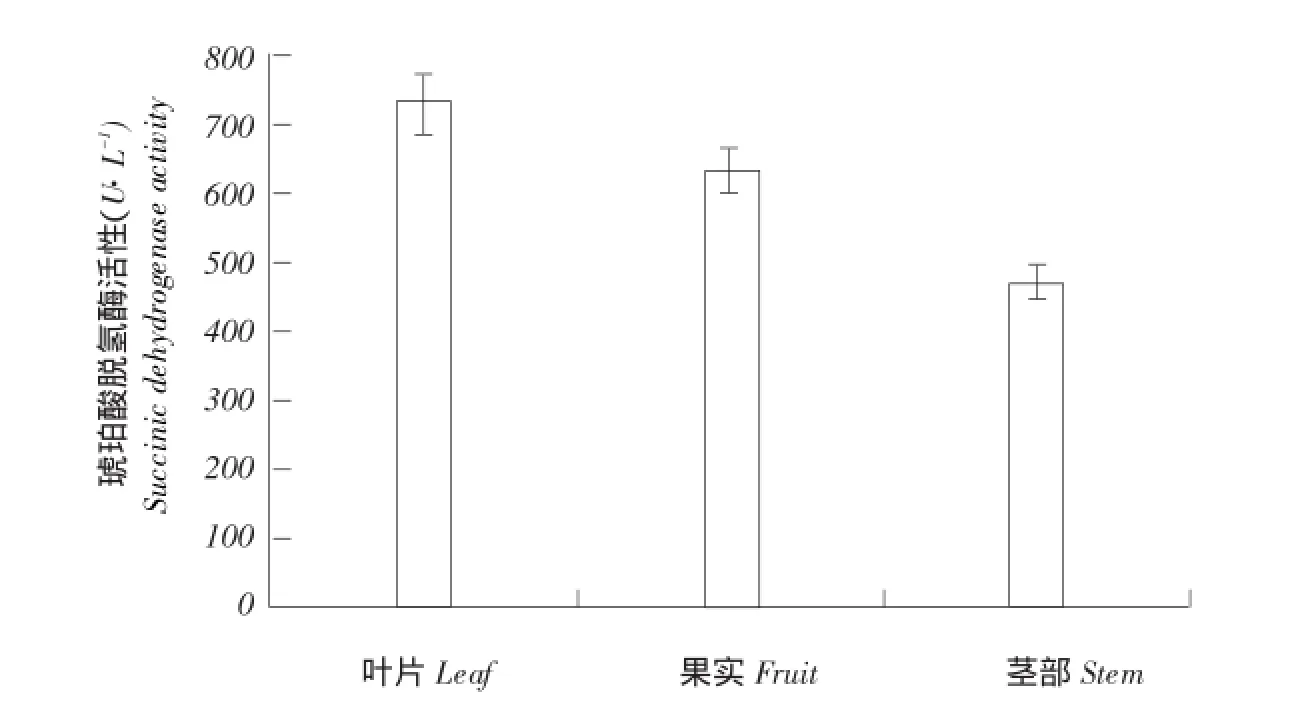
图10 黄瓜琥珀酸脱氢酶在果、叶、茎霜霉威处理后不同时间点的表达Fig.10 Expression of CsSDH at different time points of cucumber fruit, leaf and stem after propamocarb treatment by qRT-PCR
3 讨论
吴鹏等利用Solexa技术和比较基因组学方法鉴定霜霉威胁迫下黄瓜果实差异表达基因,结果发现在农药霜霉威胁迫下,黄瓜果实差异表达的基因主要有四大类,第一类主要为农药解毒相关基因,包括多向耐药性蛋白基因(PDR)、多药耐药性蛋白基因(MRP)、谷胱甘肽转移酶基因(GST)、ABC转动蛋白基因(ABCT)、细胞色素 P450 (CYP)、苯丙氨酸解氨酶基因(PAL)等;第二类主要包括与转录调节相关的转录因子,涉及TCP转录因子、GATA转录因子、WRKY转录因子30、DREB1转录因子等;第三类主要包括转运与信号相关基因,琥珀酸脱氢酶(SDH)、蔗糖转动基因(SUT)、氨基转移酶(AMT)等;第四类主要包括胁迫与刺激相关的基因,过氧化物酶基因(POD)、几丁质酶Ⅳ基因(CHI4)、半胱氨酸合酶(CYS、70 ku热休克蛋白基因(HSP)等[20]。本试验选择第三类转运与信号相关基因SDH展开研究。
为深入研究黄瓜中CsSDH基因具体调节机制及与低农残关系,本试验利用RT-PCR技术从黄瓜品种D0351中克隆CsSDH基因,并利用生物信息学方法分析CsSDH基因编码的蛋白可能结构和功能。系统进化树分析发现,CsSDH氨基酸序列与甜瓜中CmSDH氨基酸进化关系最近,推测CsS⁃DH基因可能参与甜瓜CmSDH相似的生物化学反应。从进化树上看,相同科或类群的植物聚为一类,但不同植物间SDH也有很高同源性,可推测其在进化过程中相当保守。
分析该基因在霜霉威处理后不同时间点表达发现,CsSDH基因在果实中受霜霉威胁迫反应迅速,主要在处理前期响应表达强烈,该结果与实验室前期转录组数据一致[20]。而在高农药残留品种D9320中(图6),CsSDH基因表达量0.5、1、3、12 h也呈上调表达,但表达量和表达规律与D0351表现不一致,特别是48 h出现上调表达高峰,是对照的11倍。这点与D0351表达规律相反。这可能是由于霜霉威处理后,果皮中农药残留量在48 h达到最大值,且高农药残留品种D9320果实中的残留量变化率大于低农药残留品种[22],因此CsSDH基因在低农药残留品种D0351中表达量变化稳定。以上结果,进一步说明CsSDH是一个响应霜霉威信号的关键基因,推测该基因表达量可能受农药残留量影响,在降低农药残留量过程中发挥重要作用。
分析CsSDH基因在低农残品种D0351中果、叶、茎霜霉威处理后不同时间点表达情况,结果发现,该基因转录在果和叶中处理后3 h表达量达到最高峰,是茎中该基因表达量的4倍,该基因在茎中不同时间点表达量变化不大。处理后9 h,各器官CsSDH基因表达量均降低,处理后24 h,基因表达量继续下降,此3个阶段表达量高低顺序均为叶>果>茎,说明CsSDH基因在黄瓜果、茎、叶中表达量高低顺序稳定,叶片中表达量最高,茎中最低。可能是由于叶片和果实是黄瓜的“生产源”和“积累库”,代谢网络庞大而复杂,对外界刺激有积极反应能力;茎是特化组织,功能专一,代谢相对简单,对外源刺激不敏感。这与ABC19在霜霉威胁迫下响应模式一致[23]。
利用酶联免疫法测定琥珀酸脱氢酶活性。结果表明,霜霉威胁迫下,D0351中琥珀酸脱氢酶活性显著高于对照组。且D0351中此酶活性整体高于D9320霜霉威处理组及对照组。这与该基因霜霉威胁迫下表达模式相符,与巴拉圭茶干旱胁迫下SDH基因上调表达及酶活升高结果一致[24]。
拟南芥中,琥珀酸脱氢酶的黄素蛋白亚基由两个核基因编码,sdh1-1和sdh1-2。Fuentes等研究发现,杂合子SDH1-1/SDH1-1突变体植株与野生型相比,表现出较高二氧化碳同化率和较高生长率[26]。这与Araújo等关于转基因番茄的研究结果一致[25]。二氧化碳同化和气孔导度之间相关性较强,且试验证明,此突变体植株较野生型植株有更高的气孔开度和密度。这也可合理解释琥珀酸脱氢酶基因的过量表达,可降低气孔开度及密度,减少农药从气孔浸入机率和浸入量。Fuentes等还发现,SDH1-1/SDH1-1突变体幼苗在限制氮含量条件下生长很好[26]。
后续研究工作中,将检测该基因在转基因植物中的表达情况,并用霜霉威处理转基因植株和非转基因植株,不同时间点取材测定组织农药残留量验证该基因功能,为深入探讨CsSDH在霜霉威降解过程中作用机制奠定基础。
4 结论
本研究通过RT-PCR方法分离并克隆黄瓜CsSDH基因,该基因全长834 bp,编码277个氨基酸,其编码蛋白无信号肽、跨膜结构和明显疏水区域;采用实时荧光定量PCR方法研究高农残品种D9320和低农残品种D0351喷施霜霉威后0.5、1、3、6、9、12、24、48 h各组织基因表达量。霜霉威胁迫下,CsSDH基因低农残品系D0351中表达量显著高于高农残品系D9320;不同组织内表达量高低顺序稳定,为叶>果>茎;低农残黄瓜品种D0351,CsSDH基因霜霉威胁迫初期(3 h)表达量最高,主要在叶片和果实中表达。亚细胞定位显示CsSDH基因编码的蛋白位于细胞膜。
[1]吴鹏,秦智伟,周秀艳,等.蔬菜农药残留研究进展[J].东北农业大学学报,2011,42(1):138-144.
[2]陈罡,冯伟民,樊平声,等.我国有机蔬菜发展现状及对策[J].江苏农业科学,2014,42(11):1-4
[3]陈宗懋.农药残留问题的过去、现在和将来[J].科技导报, 2011,29(32):76-79.
[4]Lombardo A,Carine K,Scheffler I E.Cloning and characteriza⁃tion of the iron-sulfur subunit gene of succinate dehydrogenasefrom Saccharomyces cerevisiae[J].The Journal of Biological Chem⁃istry,1990,265:10419-10423.
[5]Huang S,Taylor N,Narsai R,et al.Millar functional and composi⁃tion differences betweenmitochondrial complex II in Arabidop⁃sis and rice are correlated with the complex genetic history of the enzyme[J].Plantmol Biol,2010,72:331-342.
[6]Lemire B L,Oyedotun K S.The Saccharomyces cerevisiaemito⁃chondrial succinate:Ubiquinone oxidoreductase[J].Biochem Bio⁃phys Acta,2002,1553:102-116.
[7]Yankovskaya V,Horsefield R,Törnroth S,et al.Architecture of succinate dehydrogenase and reactive oxygen species generation [J].Science,2003,299:700-704.
[8]古力娜·达吾提,安惠霞.地锦草有效部位对真菌琥珀酸脱氢酶活性的影响[J].中国中医药信息.2010(11):34-36.
[9]张宇君,李俊,赵伟,等.水稻白叶枯病菌对拌种灵抗药性分子机制研究[J].中国农业科学,2005,38(1):64-69.
[10]李国婧.超氧阴离子的产生及其在植物体内作用的研究[J].生物技术世界,2012(4):24-25.
[11]Rothery R A,Weiner J H.Effects of site-directedmutations in Escherichia coli succinate dehydrogenase on the enzyme activity and production of superoxide radicals[J].Biochemistry and Cell Biology,2006,84(6):1013-1021.
[12]Popov V,Eprintsev A,Fedorin D A.Igamberdiev succinate dehy⁃drogenase in Arabidopsis thalianais regulated by light via phyto⁃chrome A[J].FEBS Lett,2010,584:199-202.
[13]Gleason C,Huang S,Thatcher L,et al.Mitochondrial complexⅡhas a key role inmitochondrial-derived reactive oxygen species influence on plant stress gene regulation and defense[J].Proc Natl Acad Sci USA,2011,108:10768-10773.
[14]Liang Y,Wang W,Shen Y,et al.Effects of home preparation on organophosphorus pesticide residues in raw cucumber[J].Food Chem,2012,133:636-640.
[15]白立伟,蒲全明,李文涛.果蔬有机农药残留降解方法研究进展[J].现代农业科技,2012(13):127-129.
[16]马佰慧.黄瓜果实霜霉威残留性的遗传分析与SSR分子标记[D].哈尔滨:东北农业大学,2010.
[17]刘芳芳,秦智伟,周秀艳.低农药残留量的黄瓜种质资源筛选[J].东北农业大学学报,2010,41(7):32-36.
[18]Wu P,Qin Z W.Study on relationship between cucumber germ⁃plasm and propamocarb residue using subjective rating technique [J].Journal of Northeast Agricultural University:English Edition, 2014,21(1):1-9.
[19]Wu P,Qin Z W.Proteomic analysis of cucumber defense respons⁃es induced by propamocarb[J].Journal of Integrative Agriculture, 2013,12(11):2022-2035.
[20]Wu P,Qin Z,Zhao W,et al.Transcriptome analysis reveals differ⁃entially expressed genes associated with propamocarb response in cucumber(Cucumis sativus L.)fruit[J].Acta Physiologiae Planta⁃rum,2013,35(8):2393-2406.
[21]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evo⁃lutionary genetics analysis usingmaximum likelihood,evolution⁃ary distance,andmaximum parsimonymethods[J].Mol Biol Evol, 2011,28:2731-2739.
[22]赵文.黄瓜低农药残留性解剖学及流动性研究[D].哈尔滨:东北农业大学,2013.
[23]吴鹏,郭茜茜,武涛,等.黄瓜ABC转运蛋白基因(abca19)的克隆及其对农药霜霉威胁迫的响应[J].作物杂志,2015(3):45-51.
[24]Acevedo Rm,Maiale S J,Pessino S C,et al.A succinate dehydro⁃genase flavoprotein subunit-like transcript is upregulated in Ilex paraguariensis leaves in response to water deficit and abscisic acid [J].Plant Physiology&Biochemistry,2013,65(6):48-54.
[25]Araújo W,Nuned-Nesi A,Osorio S,et al.Fernie Antisense inhibi⁃tion of the iron-sulphur subunit of succinate dehydrogenase en⁃hances photosynthesis and growth in tomato via an organic acidmediated effect on stomatal aperture[J].The Plant Cell,2011,23: 600-627.
[26]Fuentes D,Menesesm,Nunes-Nesi A,et al.A deficiency in the flavoprotein of Arabidopsismitochondrial complex II results in ele⁃vated photosynthesis and better growth in nitrogen-limiting condi⁃tions[J].Plant Physiol,2011,157:1114-1127.
Cloning and expression of theSDHgene related to the cucumber propamocarb's residual property
QIN Zhiwei,GUO Lei,ZHOU Xiuyan,XINming(School of Horticulture,NortheastAgricultural University,Harbin 150030,China)
Using Solexa technology,differentially expressed genes were identified under propamocarb treatment of cucumber fruit through themethod of comparative genomics,and found that theSDHgene related to the cucumber propamocarb's residual property.Obtain the full-length sequence ofSDHgene by using PCR cloning,and named asCsSDH.Construct subcellular localization expression vector and using a laser scanning confocalmicroscope to observe the tobacco leaves after injection by the way of agrobacterium infiltration;Respectively use fluorescence quantitative RT-PCR and enzymelinked immunosorbent assay to study the temporal and spatial characteristics in different tissues and at different time points after the treatment of pesticide propamocarb,and succinic dehydrogenase activity ofSDHgene in high and low agricultur-al product of D9320 and D0351.The results showed that theCsSDHgene were localized in the cellmembrane of tobacco leaf cells.In the cucumber low pesticide D0351,CsSDHgene responded rapidly after the fruit was threatened by propamocarb,this wasmainly embodied in strong response expression in the early stage of treatment and significant increase of succinate dehydrogenase activity,and the expression level was significantly higher than the expression in high agricultural residues D9320.The expression ofCsSDH in leaf and fruits was higher than that in stem,and the sequence of the expression of various tissue sites was stable,that was leaves>fruit>stem.In cucumber high agricultural residues D9320,the gene expression ofCsSDHshowed up-regulation at 0.5,1,3,12 h,the difference of gene expression was not significant at 6,9 h,while there was a rise peak of the expression at 48 h.It illustrated that the cloningCsSDHgene belonged to the response genes in the early stage of pesticide treatment,and this genemay play an important role in the process of reducing pesticide residues in cucumber.Through the analysis of the expression of cucumber succinate dehydrogenase(SDH)under the stress of propamocarb,it laid the foundation formining the functional gene of low pesticide residue in cucumber and ascertaining themolecularmechanism of its action.
cucumber;succinate dehydrogenase;gene cloning;subcellular localization;gene expression
S642.2
A
1005-9369(2016)04-0024-10
2015-12-30
国家自然科学基金项目(31272158)
秦智伟(1957-),男,教授,博士,博士生导师,研究方向为蔬菜遗传育种。E-mail:qzw303@126.com

