脐带间充质干细胞对皮肤创伤愈合影响的实验研究
李云霞
(南昌大学第二附属医院医疗美容科 江西 南昌 330006)
脐带间充质干细胞对皮肤创伤愈合影响的实验研究
李云霞
(南昌大学第二附属医院医疗美容科江西 南昌330006)
目的:探讨脐带间充质干细胞(MSCs)对皮肤创伤愈合影响的实验研究。方法:在重度烧伤大鼠中抽取80例作为研究对象,从脐血内分离出MSCs,依据随机数字法分为MSCs胶原凝胶组、单纯MSCs组、胶原凝胶组和生理盐水组各20例,对其进行GFP荧光检测、FISH原位杂交检验、Western Blotting、Real-Time PCR检验创面组织内VEGF、Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因与蛋白表达、血管生成情况。结果:相较于单纯MSCs组、胶原凝胶组和生理盐水组,MSCs胶原凝胶组皮肤愈合率最高(P<0.05),且Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因与蛋白表达最强(均P<0.05),MVD数量最多(P<0.05)。结论:脐带间充质干细胞应用于皮肤创伤移植,可促使创伤表面的新愈细胞修复和重建,提升创面愈合率,并改善创面愈合效果。
脐带间充质干细胞;皮肤创伤;愈合时间
在皮肤大面积创伤、烧伤或者因一些疾病导致皮肤严重受损情况下,患者因自身皮肤组织较为匮乏,因而临床上主要应用异体皮肤移植疗法暂时维护患者创面上的微粒皮组织。但因微粒皮组织的自主修复时间较长,10~14d后异体皮可因机体排斥而脱落[1],导致创面愈合结果较差,并出现瘢痕增生现象,严重影响美观。近几年来,经临床研究发现中胚层间充质干细胞存在免疫调控功能、多向分化潜能和支持造血以及促植入功能,在组织、器官修复方面有积极治疗作用。本研究对80例严重烧伤大鼠实施随机分组对照研究,评估脐带间充质干细胞对皮肤创伤愈合的作用,现报道如下。
1 资料和方法
1.1一般资料:入选本组研究的80例重度烧伤大鼠均为动物中心提供,将其随机分为MSCs胶原凝胶组、单纯MSCs组、胶原凝胶组和生理盐水组各20例。其中MSCs胶原凝胶组中雌鼠12例,雄鼠8例,平均周龄为(16.3±0.4)周,体质量是174~227g,平均体质量为(201.5±9.0)g;单纯MSCs组中雌鼠10例,雄鼠10例,平均周龄为(16.5±0.3)周,体质量是177~229g,平均体质量为(201.6±8.8)g;胶原凝胶组中雌鼠11例,雄鼠9例,平均周龄为(16.5±0.3)周,体质量是174~222g,平均体质量为(201.6±8.7)g;生理盐水组中雌鼠11例,雄鼠9例,平均周龄为(16.57±0.6)周,体质量是174~227g,平均体质量为(201.6±8.9)g;四组大鼠性别、周龄和体质量等资料两两比较均无统计学差异(P>0.05),可进行对比。本组所用脐带标本均为健康产妇的足月分娩健康新生儿脐带,且新生儿家长均对此知情同意,其培养板和培养瓶则采购于美国Coming公司,骨诱导、胎牛血清、脂肪诱导等培养基则采购于Gibco公司,其余试剂则为国产。
1.2脐带间充质干细胞分离和培养方法:将浸泡于DMEM培养液内的脐带标本自超净台取出,冲洗干净后切成1~2mm3的小段并于37℃条件下使用0.075%胶原酶II与0.125%胰酶配合,并分别进行30min消化处理。完成脐带血的分解后给予过滤和离心处理,在使用PBS持续冲洗两次,并把离心后单个的核细胞接种在DMEM培养液内。弃掉未贴壁细胞,继续培养至90%融合时,以胰蛋白酶予以消化和传代培养。使用PKH26荧光染色实验盒进行标记,并将标记过的3~5代有良好状态的骨髓间充质干细胞与小牛皮中图区的I型胶原相混合,在37℃状态下孵育0.5h后,将MSCs予以无血清培养,2d后移入气液面予以器官培养,2d后获得含MSCs的MSCs凝胶。
1.3皮肤创伤表面治疗方法:将大鼠进行麻醉、消毒处理。生理盐水组大鼠仅应用生理盐水清洗治疗;单纯MSCs组则予以3次生理盐水清洗,并给予麻醉药物注射处理。沿大鼠背部两侧烧伤创面皮肤到深处肌筋膜,将全层皮肤切除,并给予止血处理。取MSCs悬液1ml滴在创面上,保证其完全覆盖皮肤创面,使用两层纱布、透气胶带妥善包扎创面,底层使用无菌凡士林纱布,上层应用普通纱布。4h后将包扎拆除,再重新覆盖上1层无菌纱布,持续滴入MSCs上清液;胶原凝胶组大鼠、MSCs胶原凝胶组分别应用胶原凝胶、MSCs胶原凝胶治疗,操作过程和单纯MSCs组相同。
1.4观察指标:①评估两组大鼠皮肤创面愈合率,其中愈合标准如下:创面无疼痛、结痂和渗出以及瘙痒等现象,仅存在色素沉着;②病理检测:GFP荧光检测、FISH原位杂交检验、Western Blotting、Real-Time PCR检验创面组织内VEGF、Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因与蛋白表达、血管生成情况,其检验操作均严格依据试剂盒进行。
1.5统计学方法:本组所有数据资料均应用SPSS17.0软件分析。计数资料采用例数(n)表示,其组间率(%)对比则采用χ2检验分析;正态计量资料以±s表示,两组正态计量资料对比采取t检验;P<0.05表示数据对比有统计学差异。
2 结果
2.1对比两组大鼠的皮肤创面愈合率:MSCs胶原凝胶组、单纯MSCs组、胶原凝胶组和生理盐水组皮肤愈合率分别是95.05%、80.0%、70.0%、45.0%,其中MSCs胶原凝胶组皮肤愈合率最高(P<0.05),见表1。
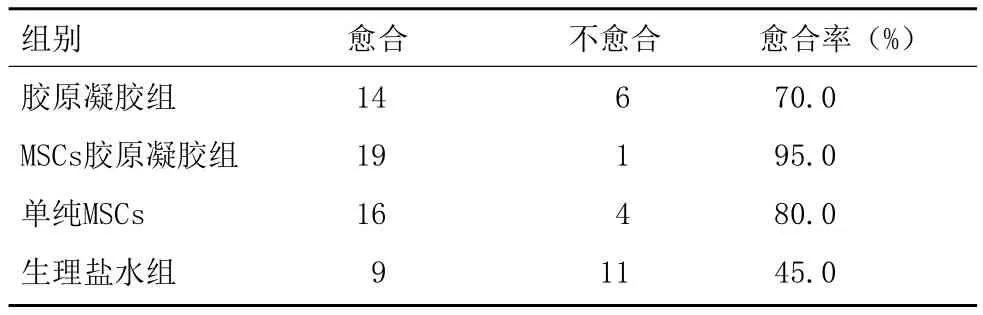
表1 各组大鼠的皮肤创面愈合率对比 (n=20,例)
2.2对比四组大鼠创面组织内Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases蛋白表达:相较于胶原凝胶组、单纯MSCs、生理盐水组,MSCs胶原凝胶组Ang-1、Ang-2、Tie-1、Tie-2蛋白表达水平最强(P<0.05),见表2。
表2 各组大鼠治疗后Ang-1、Ang-2、Tie-2蛋白表达水平 (±s)
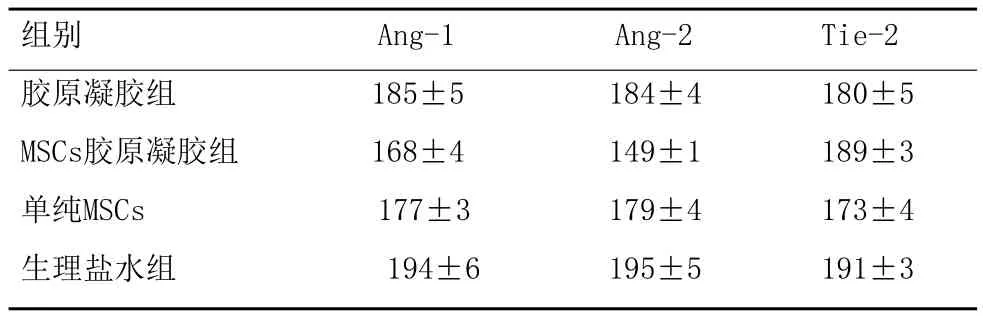
表2 各组大鼠治疗后Ang-1、Ang-2、Tie-2蛋白表达水平 (±s)
组别 Ang-1 Ang-2 Tie-2胶原凝胶组 185±5 184±4 180±5 MSCs胶原凝胶组 168±4 149±1 189±3单纯MSCs 177±3 179±4 173±4生理盐水组 194±6 195±5 191±3
2.3对比四组大鼠创面组织内Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因表达:相较于胶原凝胶组、单纯MSCs、生理盐水组,MSCs胶原凝胶组Ang-1、Ang-2、Tie-1、Tie-2基因表达最强(P<0.05),见表3。
表3 各组大鼠治疗后Ang-1、Ang-2、Tie-2基因蛋白表达水平(±s)
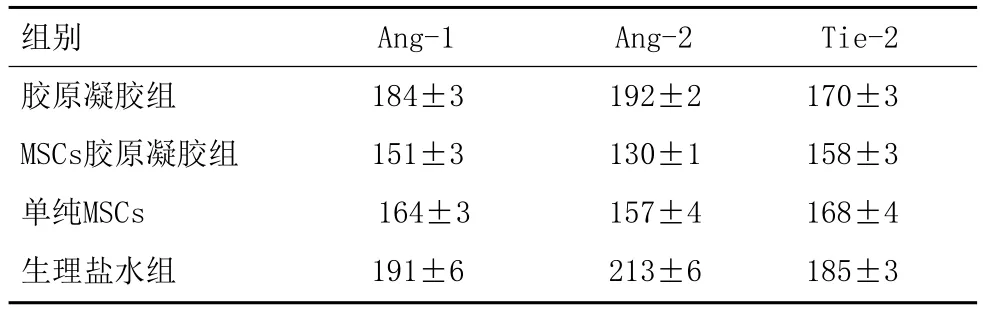
表3 各组大鼠治疗后Ang-1、Ang-2、Tie-2基因蛋白表达水平(±s)
组别 Ang-1 Ang-2 Tie-2胶原凝胶组 184±3 192±2 170±3 MSCs胶原凝胶组 151±3 130±1 158±3单纯MSCs 164±3 157±4 168±4生理盐水组 191±6 213±6 185±3
2.4对比四组大鼠创面组织内Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因表达和微血管密度(MVD)关系:相较于胶原凝胶组、单纯MSCs、生理盐水组,MSCs胶原凝胶组Ang-1、Ang-2、Tie-1、Tie-2的(+)MVD数量最多(P<0.05),见表4。
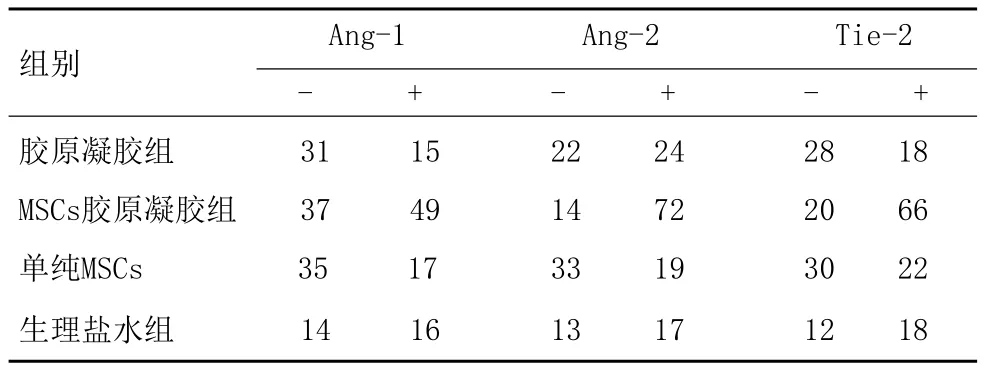
表4 各组大鼠治疗后Ang-1、Ang-2、Tie-2基因和MVD关系
3 讨论
目前,异体皮移植和自体微粒皮移植疗法,是覆盖皮肤创伤表面、修复患者大面积皮肤受损的最常见、最有效治疗方法之一,但因上述治疗过程需"种子"微粒皮缓慢生长和融合,容易因异体皮排斥、脱落,而未表皮化的皮肤创面又可能因异体皮的长期生长而被占位。期间的坏死异体皮可产生大量有害物质,甚至滋生细菌诱发感染[2],对于患者机体带来严重创伤。因此,如何促使患者皮肤创面微粒表皮生长,促使创面早期而快速的表皮化[4],对于救治皮肤创伤患者有重要临床意义。
伴随医学领域学者对于干细胞的研究飞速发展,人们对干细胞的特性也有了深入、全面认知[5]。干细胞治疗技术逐渐成为国际医学领域中最先进医疗技术之一。充质干细胞,是一种具备分化潜能、自我更新等多能干细胞,在成体上分布较为广泛[6],比如骨髓、胰腺、胚胎前提组织和脐带血中[7]。据相关学者研究发现,骨髓间充质干细胞可参与皮肤创面愈合过程,并促使迁延不愈的皮肤溃疡快速愈合[8]。另外,已经有对烧伤患者应用间充质干细胞治疗的报道,在深度烧伤患者创伤表面涂抹自体骨髓间充质干细胞悬液,可促使患者皮肤和血管再生[9]。脐带血间充质干细胞还具备以下功能:①独特免疫调节功能:免疫原性较低[10],其在体外,能有效抑制混合淋巴细胞活性反应,在体内则能诱导机体免疫细胞耐受力[11];多向分化潜能:一定诱导条件下,其可分化脂肪、成骨、肌腱、神经、肌肉、心肌、内皮、肝和韧带等多类组织细胞[12]。通过长期的连续传代培养液冷冻、培养,其多向分化潜能依然存在[13];促植入和支持造血功能:其可分泌出多种细胞因子与细胞外基质[14],并使其直接作用在细胞上,实现调控造血目的,最终促进机体造血干细胞的生长。依据脐带血间充质干细胞上述特征[15],其已经被广泛应用在移植物抗遗传性骨病、宿主病和骨髓移植等病症治疗中,发挥了其强大的组织、器官修复功能。
由本组试验研究结果和病理学检查结果可知,MSCs胶原凝胶组皮肤愈合率最高,Ang-1、Ang-2、Tie-1and -2Receptor Tyrosine Kinases基因与蛋白表达最强,且MVD数量最多,证实了MSCs胶原凝胶改善创面愈合、减少瘢痕形成的作用。
[1]赵旭,郝传铮,杨仁旭,等.左归丸对去卵巢大鼠骨髓间充质干细胞基因表达谱时间序列的影响[J].中医杂志,2015,56(16):1414-1419.
[2]郭勇英,高怀林,孙颖,等.通心络超微粉联合外周血间充质干细胞移植对糖尿病大鼠下肢缺血的影响[J].中医杂志,2015,56(6):506-510.
[3]魏增华,郝怀勇,贺敏敏,等.骨髓间充质干细胞联合Janus激酶信号转导及转录激活因子通路抑制剂治疗大鼠脑缺血再灌注损伤[J].中华实验外科杂志,2013,30(7):1481-1483.
[4]张琳,刘广义.骨髓间充质干细胞移植在脑缺血损伤中的作用与生长相关蛋白-43表达的相关性[J].中国康复,2011,26(3):167-170.
[5]刘志刚,郑启新,熊敏.骨髓间充质干细胞移植联合孕酮应用对脊髓损伤的修复作用[J].华中科技大学学报(医学版),2012,41(3):296-302.
[6]于双杰,陈黎明,吕飒,等.人脐带间充质干细胞治疗失代偿性乙型肝炎肝硬化的安全性与疗效[J].中华肝脏病杂志,2016,24(1):51-55.
[7]陈以胜,赵明亮,梁海乾,等.亚低温后脑损伤组织提取液对体外脐带间充质干细胞的影响[J].中华创伤杂志,2016,32(1):80-84.
[8]冯艳广,魏琴,刘小军,等.间充质干细胞治疗类风湿关节炎贫血的临床研究[J]. 中国现代药物应用,2016,10(2):170-171.
[9]刘慧文.人骨髓和脐带来源间充质干细胞体外分离培养及生物学特性比较[J]. 浙江临床医学,2015,17(11):1872-1873.
[10]陆士奇,孙海伟,刘励军,等.脐带源与骨髓源干细胞移植治疗大鼠脊髓损伤的疗效比较[J].中华神经外科杂志,2013,29(1):85-89.
[11]宋丽华,王庸晋,王金胜,等.白细胞介素6体外诱导骨髓间充质干细胞向肝细胞的分化[J].中国组织工程研究与临床康复,2011,15(14):2495-2499.
[12]杨燕美,李红,张雷,等.小鼠骨髓间充质干细胞分离培养新方法[J]. 中国实验血液学杂志,2013,21(6):1563-1567.
[13]王冠华,荆宝琴,高畅,等.间充质干细胞的毒性作用研究[J]. 药物评价研究,2015,38(3):271-273.
[14]丛姗,王秀梅,李岩,等.人羊膜间充质干细胞对四氯化碳诱导小鼠肝损伤定位修复的研究[J].中国生物工程杂志,2014,34(8):14-23.
[15]苏文霞,刘荟敏,陈永红,等.3.5Gy X射线对小鼠间充质干细胞的损伤及其机制的研究[J].中华放射医学与防护杂志,2011,31(6):644-648.
编辑/张惠娟
Experimental study on umbilical cord mesenchymal stemcells of the skin wound healing
LI Yun-xia
(Department of Medical Cosmetology, The Second Affliated Hospital of Nanchang University,Nanchang 330006, Jiangxi, China)
ObjectiveDiscussion Experimental Study of umbilical cord mesenchymal stem cells (MSCs) on skin wound healing.MethodsExtraction in rats with severe burn 80 cases for the study, MSCs isolated from umbilical cord blood,according to randomized into MSCs collagen gel, pure MSCs group, collagen gel and saline group, 20 cases of which carried GFP fuorescence detection, FISH test in situ hybridization, Western Blotting, within the Real-Time PCR test wound tissue VEGF, Ang-1, Ang-2, Tie-1and -2Receptor Tyrosine Kinases mRNA and protein expression, angiogenesis.ResultsPure MSCs group, collagen gel and saline groups, MSCs collagen gel skin healing rate was highest (P<0.05), and Ang-1, Ang-2, Tie-1and -2Receptor Tyrosine Kinases mRNA and protein compared to expression of the strongest (all P<0.05), maximum number of MVD (P<0.05).ConclusionUmbilical cord mesenchymal stem cells applied to the skin graft wound, can contribute to healing the wound surface of new cells to repair and rebuild, to enhance the rate of wound healing and improve wound healing effect.
umbilical cord mesenchymal stem cells; skin wound; healing time
Q813.1
A
1008-6455(2016)07-0051-03
江西省自然科学基金资助项目(20132BAB205050)
2016-02-02
2016-04-26

