高温胁迫下外源GABA对黄瓜幼苗生长的影响
黄娟
(四川宜宾市农业局,644000)
高温胁迫下外源GABA对黄瓜幼苗生长的影响
黄娟
(四川宜宾市农业局,644000)
以清白黄瓜为材料,在高温(40℃/35℃,昼/夜,各12 h)条件下研究了外源γ-氨基丁酸(GABA)对黄瓜幼苗形态生长、光合特性、生理代谢的影响。试验结果表明,高温胁迫下,外源GABA显著增加了黄瓜幼苗的株高、茎粗、叶面积,增强了壮苗指数、根冠比和根系活力,降低了叶片相对电导率(REC)和丙二醛(MDA)含量,减缓了叶绿素的分解,提高了渗透调节物质脯氨酸(Pro)和可溶性糖(SSC)含量,并有效增强了抗氧化酶(SOD、POD、CAT、APX)活性及光合作用,使Pn、Gs、Tr加强,Ci积累减少,缓解了高温对黄瓜幼苗的伤害,可维持植株正常生长,以10 mmol/L GABA处理效果最优。
黄瓜;外源GABA;幼苗生长;高温胁迫;生理特性;光合作用
黄瓜是我国设施栽培中的重要蔬菜作物之一,喜温、不耐寒、不耐热[1]。近年来,我国设施蔬菜产业发展迅速,黄瓜保护地栽培也得到空前的发展,设施栽培加露地栽培已经使黄瓜实现了集约化、专业化生产以及周年均衡供应,但在利用日光温室和塑料大棚进行黄瓜夏秋茬栽培时,温室内午后温度常常超过40℃,尤其在我国南方高温很容易对黄瓜造成热害,致使植株生长发育不良,生理代谢失调,产量和品质显著降低[2,3],因此,提高黄瓜的耐热性在生产中具有十分重要的意义。
γ-氨基丁酸(GABA)是植物体内广泛存在的一种自由态四碳非蛋白质氨基酸[4],在植物的生长发育调控、信号传导[5]、逆境调节等生理生化过程中发挥着十分重要的作用。研究表明,高温胁迫下,植物能通过提高谷氨酸脱羧酶活性和促进多胺降解等代谢途径来提高生物体内的GABA含量[6],而且外源GABA可以作为临时氮库[7],通过清除活性氧自由基[8]、调节渗透能力等作用减缓逆境胁迫对植株的伤害。研究发现,外源GABA能够增强番茄[9]、网纹甜瓜[10]、小麦[11]、玉米[12]、白三叶[13]等幼苗在干旱、盐害、冷害、缺氧、淹水等逆境胁迫中的抗性,但迄今在黄瓜上的研究甚少[14,15],尤其是在高温胁迫下,外源GABA对黄瓜生长的影响鲜见报道。
为此,以清白黄瓜为材料,在高温条件下研究GABA对黄瓜幼苗的生长、生理代谢、光合特性的影响,旨在探讨外源GABA在高温胁迫过程中对黄瓜的调节机制,以期为提高夏秋黄瓜的耐热性栽培提供理论依据和实践参考。
1 材料与方法
1.1试验材料
供试材料为清白黄瓜,其种子由重庆三千种业公司提供。GABA购自美国Sigma公司,配制营养液的化合物均为分析纯试剂。
1.2试验处理
选取大小一致且饱满的黄瓜种子,用9%H2O2消毒15 min后,用蒸馏水浸种12 h,然后放入28℃的恒温培养箱中于黑暗条件下催芽。挑选出芽整齐一致的种子,播于50孔穴盘中进行常规育苗,当子叶展平后,每3 d喷施1/2 Hoagland营养液,期间补充清水,保持基质含水量在75%左右。待黄瓜幼苗长到3叶1心时,于每天10:00,用0(对照)、2.5、5.0、10.0、20.0 mmol/L的 GABA溶液喷施黄瓜叶片,连续喷施3 d。喷施时溶液中加入1滴洗洁精作为溶剂附着剂,浓度为0.16%(V/V),以叶片正、反面喷匀滴水为准。
喷施3 d后将黄瓜幼苗移至光照培养箱(RXZ人工智能光照培养箱,宁波江南仪器制造厂),预处理2 d后,进行40℃/35℃(昼/夜,各12 h)高温胁迫处理,光照强度设置为430 μmol·m-2·s-1(8:00~20:00,光照12 h),用加湿器使箱内空气相对湿度保持在80%,分别于处理后第0、2、4、6天,选取每株幼苗第2片叶进行相关生理指标的测定,每处理随机选择3株取样,各指标均重复测定3次;于处理后第5天测定幼苗的生长指标和光合特性指标,每处理随机选取5株测定,求平均值。
1.3测定方法
①生长指标按宗学凤等[16]的方法随机取样,小心洗去幼苗根部的基质,用吸水纸吸干植株上的水分,以便测定株高、茎粗、鲜质量(地上/地下)、干质量(地上/地下)、叶面积、根系活力等指标。
株高:用直尺测量植株基部到顶端生长点的长度;茎粗:用游标卡尺测定植株子叶下2 cm的直径;地上/地下部鲜质量:用感量0.01 g电子天平称量;地上/地下部干质量:将称量后的植株放入纸袋中,置于烘箱以105℃杀青15 min,75℃烘干至恒重,用0.000 1 g电子天平称量;壮苗指数=(茎粗/株高)×植株干质量;根冠比=地下部鲜质量/地上部鲜质量;叶面积:用Ci-203激光叶面积仪测定;根系活力:采用TTC法[17]测定。
②光合特性指标用Li-6400便携式光合测定仪测定光合指标[18],在温度(25±1)℃、光强 (1 000±2)μmol·m-2·s-1,参比室CO2浓度(380± 10)μmol/L,相对湿度(RH)为65%~75%条件下选取功能叶,测定净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)。
③生理指标相对电导率(REC)采用郝再彬[19]的方法,使用DDS-11A型电导率仪测定;丙二醛(MDA)含量采用李合生[20]的硫代巴比妥酸法;脯氨酸(Pro)含量采用磺基水杨酸法;可溶性糖(SSC)含量采用王三根[21]的蒽酮法;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法;过氧化物酶(POD)活性采用愈创木酚法;过氧化氢酶(CAT)活性采用紫外吸收比色法;抗坏血酸过氧化物酶(APX)活性采用Nakano等[22]的比色法;叶绿素(Chl)含量采用陈建勋等[23]的乙醇-丙酮混合法。
1.4数据处理
试验数据采用Excel作图和计算,用SPSS 19.0软件进行方差分析,邓肯法进行显著性检验。
2 结果与分析
2.1高温胁迫下GABA对黄瓜幼苗生长指标的影响
从表1可以看出,高温胁迫下,与对照(CK)相比,外源GABA处理促进了黄瓜幼苗的株高、茎粗、叶面积的增加,提高了植株的壮苗指数、根冠比和根系活力,且随着GABA浓度的增加,黄瓜幼苗的生长指标呈现先上升后降低的趋势,且皆高于对照,其中以10.0 mmol/L处理效果最优,5.0 mmol/L次之。黄瓜幼苗株高、茎粗、壮苗指数在10.0 mmol/L GABA处理时比CK显著增加了26.58%、30.95%、255.56%,同时植株的根冠比、叶面积、根系活力比CK显著提高了53.57%、31.46%、30.31%。结果表明,高温胁迫下,外源GABA能有效促进黄瓜幼苗的生长、增强植株根系活力,从而有利于壮苗的形成。
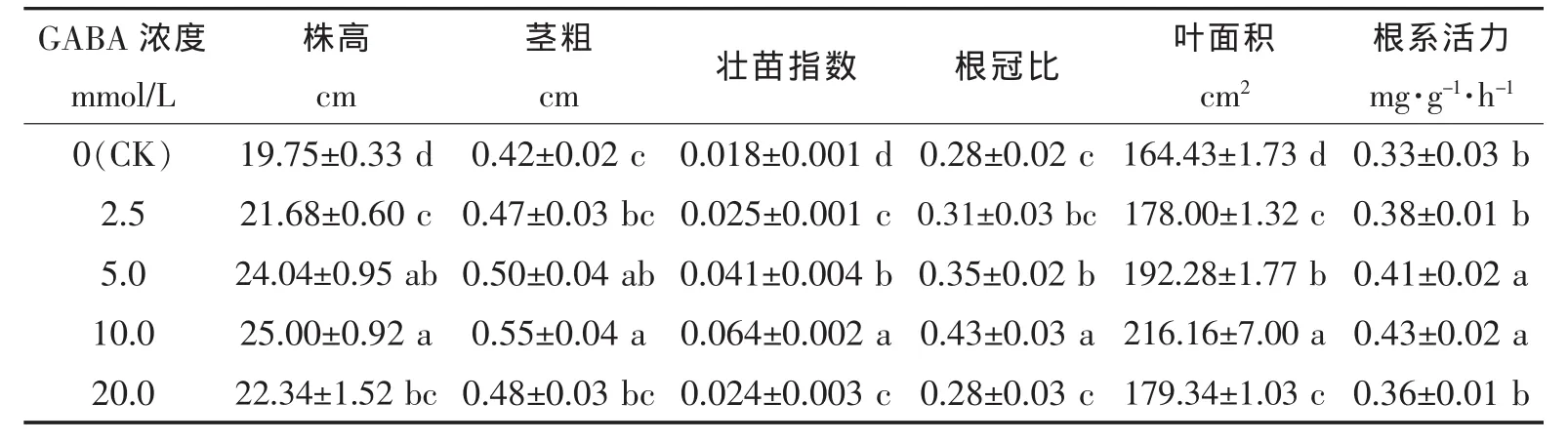
表1 高温胁迫下外源GABA对黄瓜幼苗生长的影响
2.2高温胁迫下GABA对黄瓜幼苗光合特性的影响
由图1可知,外源GABA能够不同程度地影响黄瓜幼苗叶片的光合特性,随着处理浓度的上升,Pn、Gs、Tr皆呈现先上升后降低的趋势,在10.0 mmol/L处理时达到峰值,分别为 10.42 μmol·m-2·s-1(CO2)、0.26 mol·m-2·s-1(H2O)、5.14 mmol·m-2·s-1(H2O),较CK显著提高了 28.8%、44.4%、26.2%,各指标20 mmol/L GABA处理时明显下降,但皆高于CK。Ci的变化趋势与Pn、Gs相反,随着GABA处理浓度的上升呈现先减后增的趋势,且在10.0 mmol/L处理时幼苗叶片Ci比CK显著降低了34.64%,而20.0 mmol/L GABA时Ci积累显著升高。结果说明,10.0 mmol/L GABA处理能够显著提高黄瓜幼苗叶片的Pn、Gs、Tr,降低Ci,促进高温胁迫下黄瓜幼苗的光合作用。
2.3高温胁迫下GABA对黄瓜幼苗生理特性的影响
①对黄瓜幼苗REC和MDA含量的影响高温胁迫直接影响植物细胞膜结构和功能,致使膜内大量电解质外渗,膜脂过氧化作用加重。研究中,通常将REC作为细胞膜透性、MDA作为膜脂过氧化程度的指标,用于表示细胞膜受伤害程度[24]。由图2可知,随着高温胁迫时间的延长,黄瓜幼苗的REC 和MDA含量逐渐升高,外源GABA处理显著降低了幼苗叶片的REC和MDA含量,2.5~10.0 mmol/L GABA处理中,随着GABA浓度的增大,黄瓜叶片的REC和MDA降低幅度越大,其中在处理第6天、GABA浓度为10.0 mmol/L时,黄瓜幼苗叶片的REC和MDA含量分别为38.6%、8.01 μmol/g,分别比对照显著降低了16.45%、15.33%,而20 mmol/L GABA处理的REC和MDA含量与对照差异不显著。结果表明,适宜浓度的GABA能够有效降低高温对黄瓜幼苗细胞膜的伤害,其中以10 mmol/L GABA处理效果最优。
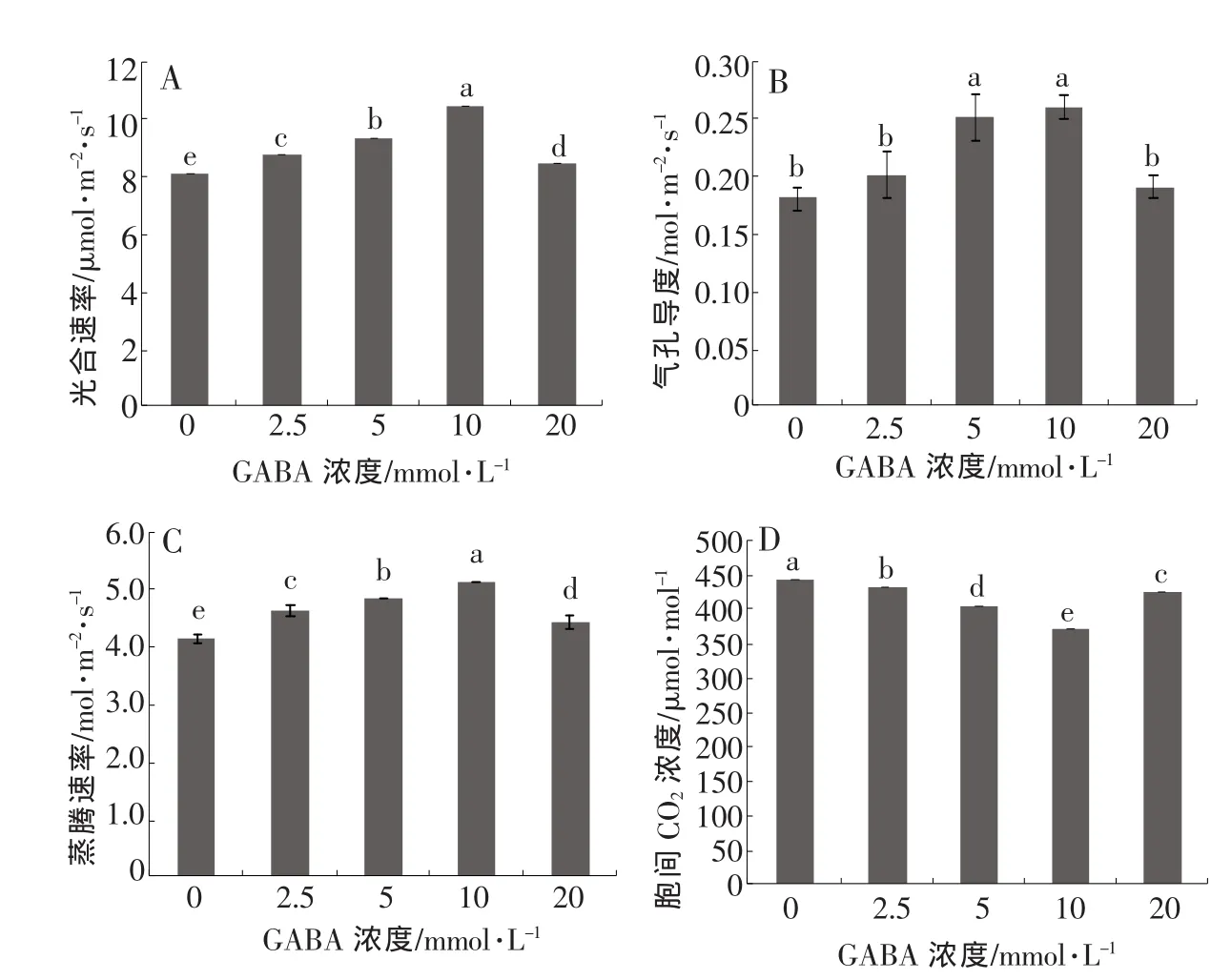
图1 高温胁迫下外源GABA对黄瓜幼苗光合特性的影响
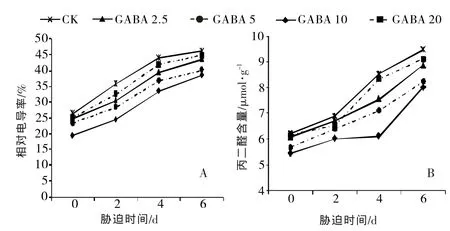
图2 高温胁迫下外源GABA对黄瓜幼苗REC、MDA含量的影响
②对黄瓜幼苗SOD、POD、CAT、APX活性的影响SOD、CAT、POD和APX等组成植物保护酶系统,在植物体内协同作用,能够有效清除和分解逆境胁迫中产生的过量ROS,维持细胞体内活性氧代谢平衡[25]。从图3可知,高温胁迫下,随着处理时间的延长,黄瓜幼苗叶片SOD、CAT、POD、APX活性皆呈现先上升(0~2 d)后持续下降(4~6 d)的趋势,在胁迫第6天降到低值,分别比CK降低了31.78%、17.33%、21.08%、21.62%,说明高温胁迫对黄瓜幼苗的膜结构造成了不可逆的伤害。2.5~10.0 mmol/L GABA处理能够显著提高黄瓜幼苗抗氧化酶的活性,其变化趋势与CK保持一致,且随着GABA处理浓度的增加,黄瓜幼苗的SOD、POD、CAT、APX活性均呈现逐渐升高的趋势,且在10.0 mmol/L GABA处理时活性最强,高温处理的第6天,分别比对照提高了21.22%、36.38%、19.85%、37.93%,其次是5.0 mmol/L,而20.0 mmol/L GABA处理与对照差异不显著。结果表明,在高温胁迫下,10.0 mmol/L GABA处理能够显著提高黄瓜幼苗的抗氧化酶活性,从而增强黄瓜叶片清除ROS的能力,提高黄瓜的耐热性。
③对黄瓜幼苗Pro、SSC含量的影响Pro和SSC都是植物细胞内重要的渗透调节物质,其含量与植物的抗逆性密切相关[26]。由图4可知,高温使黄瓜幼苗叶片的Pro逐渐积累,Pro含量随着胁迫时间的延长呈现不断上升的趋势,外源GABA处理可进一步促进高温胁迫下Pro含量的积累,且随着GABA浓度上升(2.5~10.0mmol/L),Pro含量显著增加,并在处理的第6天达最大值,其中以10.0 mmol/L GABA处理效果最优,Pro含量增加到80 μg/g,比对照升高19.40%,而在第6天20.0 mmol/L GABA处理的Pro含量反而低于对照。
高温胁迫下,SSC含量随着处理时间的延长而呈现先逐步上升 (第4天达到峰值)后快速下降的趋势。外源GABA处理后的变化趋势与对照基本一致,但皆高于CK,其中在10.0 mmol/L GABA处理时,黄瓜幼苗SSC含量显著高于其他处理,表明黄瓜幼苗在逆境条件下能产生自身抵抗机制,而适宜浓度的GABA能够促进Pro、SSC的积累,维持植株体内的渗透平衡,并且以10.0 mmol/L GABA处理时Pro、SSC含量最大,但也无法消除高温对植株的伤害。
④对黄瓜幼苗Chl含量影响叶绿素是光合作用的物质基础,其含量的多少与叶片的光合机能大小密切相关。由图5可知,随着高温胁迫时间的延长,黄瓜幼苗叶片的Chl含量不断下降,外源GABA能有效缓解叶绿素的降解,2.5~10.0 mmol/L GABA处理Chl含量显著高于CK和20.0 mmol/L GABA处理,且在胁迫第6天时,10.0 mmol/L GABA处理的Chl含量为2 mg/g,较对照显著提高了81.82%,说明高温胁迫下,喷施外源GABA可以提高黄瓜叶片叶绿素的含量,从而促进黄瓜幼苗正常生长。
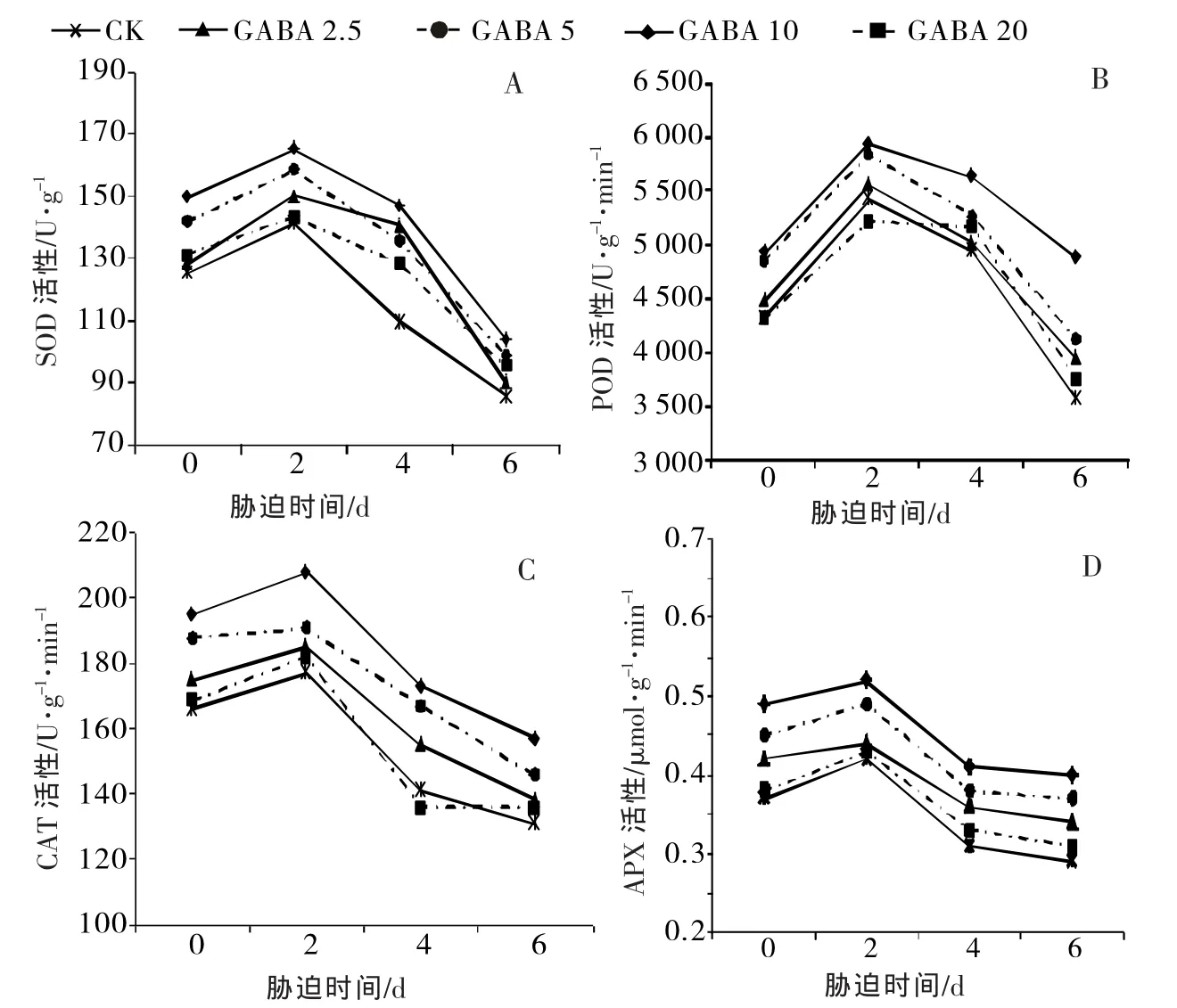
图3 高温胁迫下外源GABA对黄瓜幼苗抗氧化酶活性的影响
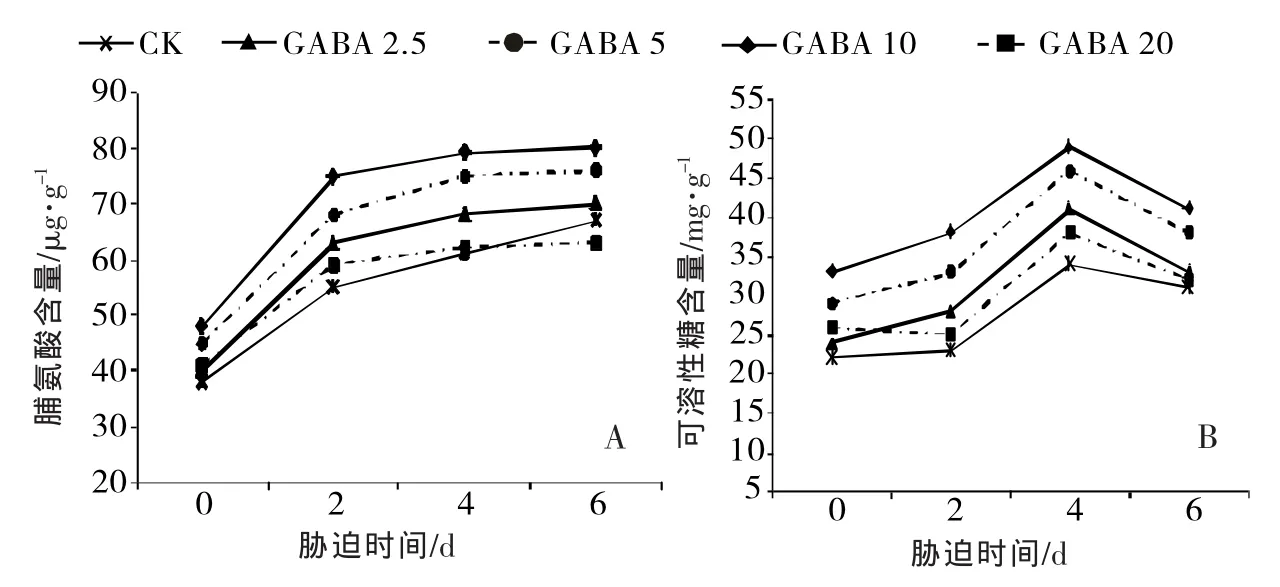
图4 高温胁迫下外源GABA对黄瓜幼苗Pro、SSC含量的影响
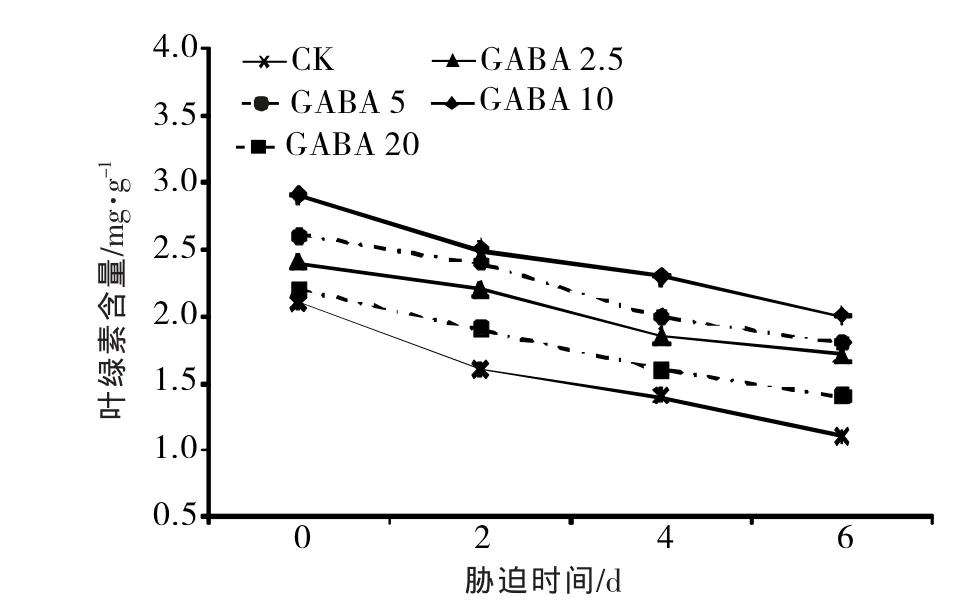
图5 高温胁迫下外源GABA对黄瓜幼苗Chl的影响
3 讨论与结论
3.1讨论
高温胁迫易造成植物细胞膜结构和功能受损[27],引发植物体内生理生化代谢紊乱,使细胞内ROS大量积累、膜脂过氧化加剧、电解质外渗,导致光合作用受阻和抗氧化酶活性相应变化[28]。
γ-氨基丁酸(GABA)是植物体内游离氨基酸库中一种重要的信号物质[5],大量研究证明,GABA可以通过稳定细胞膜结构、调节胞质pH值、诱导乙烯产生、降低活性氧伤害、促进生物大分子合成等提高植物的抗逆性[29]。
逆境胁迫下,幼苗植株的根、茎、叶等形态生长将会受到显著的影响,且植株的健壮程度与植物对逆境的抵御能力紧密相关[30]。罗黄颖等[31]发现,在NaCl胁迫下外源GABA促进了番茄幼苗根系生长,提高了番茄幼苗株高和生物量的积累;高洪波等[14]认为,营养液添加GABA处理可以缓解盐胁迫对黄瓜幼苗生长的抑制作用。本试验研究表明,高温胁迫下,外源GABA处理有效促进了黄瓜幼苗株高、茎粗、叶面积的增加,提高了植株的壮苗指数、根冠比和根系活力,有利于壮苗的形成。
逆境胁迫引起植物体内活性氧水平上升的同时启动酶防御系统,SOD、POD、CAT、APX四者协同作用,共同组成植物的保护酶系统,清除体内的ROS,从而提高植株的抗逆性[32]。王晓冬等[33]认为,GABA可通过调节抗氧化酶系统来减少涝害胁迫引起的生长抑制现象,从而增强小麦的耐涝性;杨丽文等[34]研究认为,低氧胁迫下外源GABA能显著提高甜瓜幼苗叶片SOD、CAT、APX、GR等抗氧化酶的活性。本试验研究表明,高温胁迫降低了黄瓜幼苗的SOD、POD、CAT、APX活性,而外源GABA显著提高了黄瓜幼苗的保护酶活性,尤其以10 mmol/L GABA处理效果最优。外源GABA提高黄瓜幼苗抗氧化酶活性的同时也降低了幼苗叶片的REC、MDA含量,增加了渗透调节物质Pro、SSC含量,说明外源GABA能够促进黄瓜幼苗ROS代谢平衡、提升细胞膜结构的稳定性、提高细胞渗透调节能力,从而缓解高温胁迫对植株造成的伤害,增强黄瓜的耐热性。
光合作用是植物体的基本生命活动之一,也是植物体内有机物合成和获得能量的主要源泉,其强弱直接影响到植物的同化能力及抗逆能力,所以研究中常把光合作用强弱作为判断植物生长健壮与否及抗性强弱的重要指标[35]。在目前研究中,人们认为逆境胁迫下植物叶片Pn降低的因素主要包括气孔因素和非气孔因素,根据Farquhar等[36]观点,气孔因素引起的Pn降低表现为Gs和Ci都降低,而非气孔因素引起Pn降低则伴随着Gs的下降、Ci的升高。本试验结果表明,高温条件下,2.5~10.0 mmol/L GABA处理黄瓜幼苗,Pn、Gs、Tr随着GABA浓度的上升而不断提高,而Ci的变化趋势与Pn、Gs刚好相反,呈现持续下降的变化趋势,说明高温胁迫下Pn的降低是由非气孔因素导致的。外源GABA可以改善黄瓜幼苗的光合特性,提高植株叶片Pn的同时,减弱Gs的降低、减轻对Tr的抑制、减少Ci的积累,从而增强黄瓜幼苗的耐热性,其中以10.0 mmol/L GABA促进光合作用的效果最强。
3.2结论
试验结果表明,高温胁迫下,外源GABA能有效促进黄瓜幼苗的生长,增强植株的根系活力,降低幼苗叶片的相对电导率与MDA含量,提高渗透调节物质Pro、SSC含量,减缓叶绿素的分解,增强抗氧化酶(SOD、POD、CAT、APX)活性及光合作用,从而提高黄瓜幼苗的抗逆性,减缓高温对植株的伤害,且皆以10 mmol/L GABA处理效果最佳。然而外源GABA在高温胁迫下对植株体内活性氧代谢过程和光合系统影响的分子机理还需要进一步的研究证明。
[1]郄丽娟,齐铁权,苏俊坡,等.低温弱光对不同砧木嫁接黄瓜幼苗生理特性的影响[J].西南大学学报:自然科学版,2008,30(10):68-72.
[2]孙艳,王鹏.水杨酸对黄瓜幼苗抗高温胁迫能力的影响[J].西北植物学报,2003,23(11):2 011-2 013.
[3]孟令波,秦智伟,李淑敏,等.高温胁迫对黄瓜产量和品质的影响[J].中国蔬菜,2004(5):4-6.
[4]蒋振晖,顾振新.高等植物体内γ-氨基丁酸合成、代谢及其生理作用[J].植物生理学通讯,2003,39(3):249-254.
[5]Bouche N,Lacombe B,Fromm H.GABA signaling:a conserved and ubiquitous mechanism [J].Trends in Cell Biology,2003,13:607-610.
[6]Su G X,Yu B J,Zhang W H,et al.Higher accumulation of gamma-aminobutyric acid induced by salt stress through stimulating the activity of diamine oxidases inGlycine max (L.)Merr.roots[J].Plant Physiology and Biochemistry,2007,45(8):560-566.
[7]Allan W L,Shelp B J.Fluctuations of γ-aminobutyrate,γhydroxybutyrate,and related amino acids inArabidopsis leaves as a function of the light-dark cycle,leaf age,and N stress[J].Canadian Journal of Botany,2006,84:1 339-1 346.
[8]Bouché N,Fait A,Bouchez D.Mitochondrial succinicsemialdehyde dehydrogenase of the T-aminobutyrate shunt isrequiredtorestrictlevelsofreactiveoxygen intermediatesin plants[J].Proceedings of the National Academy of Sciences,2003,100:6 843-6 848.
[9]罗黄颖,高洪波,夏庆平,等.γ-氨基丁酸对盐胁迫下番茄活性氧代谢及叶绿素荧光参数的影响[J].中国农业科学,2010,44(4):753-761.
[10]高洪波,郭世荣.外源γ-氨基丁酸对营养液低氧胁迫下网纹甜瓜幼苗活性氧代谢的影响[J].植物生理与分子生物学学报,2004,30(6):651-659.
[11]王晓冬,解备涛,李建民,等.外源γ-氨基丁酸(GABA)对小麦苗期耐涝性的影响[J].华北农学报,2010,25(1):155-160.
[12]田小磊,吴晓岚,李云,等.盐胁迫条件下γ-氨基丁酸对玉米幼苗SOD、POD及CAT活性的影响[J].实验生物学报,2005(38):75-79.
[13]李杰,窦晓月,车永梅,等.NO参与γ-氨基丁酸促进白三叶种子的萌发过程[J].植物生理学通讯,2008,44(6):1 071-1 074.
[14]高洪波,章铁军,吕桂云,等.NaCl胁迫下外源γ-氨基丁酸对黄瓜幼苗生长和活性氧代谢的影响[J].西北植物学报,2007,27(10):2 046-2 051.
[15]高洪波,章铁军,吴晓蕾,等.淹水胁迫下γ-氨基丁酸对黄瓜幼苗生长和生理代谢的影响[J].内蒙古农业大学学报,2007,28(3):158-162.
[16]宗学凤,王三根.植物生理研究技术[M].重庆:西南师范大学出版社,2011.
[17]孔祥生,易现峰.植物生理学实验技术[M].北京:中国农业出版社,2008:70-72.
[18]程玉静,郭世荣,束胜,等.外源硝酸钙对盐胁迫黄瓜幼苗生长和光合作用的影响 [J].江西农业学报,2012,2 (4):38-41.
[19]郝再彬.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[20]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[21]王三根.植物生理研究技术[M].重庆:西南师范大学出版社,2011.
[22]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[23]陈建勋,王晓峰.植物生理学试验指导[M].广州:华南理工大学出版社,2002.
[24]陈贵,胡文玉,谢甫娣,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991,27 (1):44-46.
[25]Stewart R R C,Bewley J D.Lipid peroxidation associated withacceleratedagingofsoybeanaxes[J].Plant Physiology,1980,65(2):245-248.
[26]崔岩,王丽萍,霍春玲,等.外源抗冷物质对低温胁迫下黄瓜幼苗抗冷性的影响[J].中国蔬菜,2008(2):15-18.
[27]许耀照.高温和水杨酸对黄瓜种子萌发和幼苗的影响[D].兰州:甘肃农业大学,2005.
[28]易小林,李名扬,黄娟.水杨酸对干旱、高温及双重胁迫下紫御谷幼苗膜脂过氧化的影响[J].西南大学学报:自然科学版,2013(5):41-45.
[29]Fait A,Fromm H,Walter D,et al.Highway or byway:the metabolic role of the GABA shunt in plants[J].Trends in Plant Science,2008,13(1):14-19.
[30]黄娟,李兴发,罗庆熙,等.γ-氨基丁酸浸种对不同温度胁迫下黄瓜种子萌发和幼苗生长的影响[J].长江蔬菜,2014 (12):30-35.
[31]罗黄颖,杨丽文,高洪波,等.γ-氨基丁酸浸种对番茄种子及幼苗耐盐性调节的生理机制[J].西北植物学报,2011,31(11):2 235-2 242.
[32]段九菊,郭世荣,康云燕.外源亚精胺对盐胁迫下黄瓜幼苗活性氧代谢的影响[J].农业工程学报,2005,21(z2):87-91.
[33]王晓冬,解备涛,李建民,等.外源γ-氨基丁酸(GABA)对小麦苗期耐涝性的影响[J].华北农学报,2010,25(10):155-160.
[34]杨丽文,高洪波,吴晓蕾,等.外源γ-氨基丁酸对低氧胁迫下甜瓜幼苗活性氧代谢的影响[J].西北植物学报,2011,31(11):2 243-2 251.
[35]惠红霞,许兴,李前荣.外源甜菜碱对盐胁迫下枸杞光合功能的改善[J].西北植物学报,2003,23(12):2 137-2 422.
[36]Farquhar G D,Sharkey T D.Stomatal conductance and Photosynthesis[J].Ann Rev Plant Physiol,1982,33:317-345.
Effects of Exogenous GABA on Growth of Cucumber Seedlings under High Temperature Stress
HUANG Juan
(Yibin Municipal Bureau of Agriculture,Sichuan 644000)
Taking Qingbai cucumber as material,we studied the effects of exogenous γ-aminobutyric acid(GABA)on seedling growth,photosynthetic characteristics and physiological metabolism under high temperature(40℃/35℃).The results showed that,under high temperature stress,exogenous GABA significantly promoted the growth of plant height,stem diameter,leaf area of cucumber seedlings,and enhanced sound seedling index,root-shoot ratio and root activity,while reduced REC and MDA content of leaves,with chlorophyll decompose slowed down,and Pro and SSC content increased.In addition,exogenous GABA effectively enhanced the activity of antioxidant enzymes(SOD,POD,CAT,APX)and photosynthesis,and increased Pn,Gs,Tr,while decreased Ci accumulation,thereby relieved the damage of high temperature on cucumber seedlings and maintained plant normal growth,among which 10 mmol/L GABA treatment had the best effect.
Cucumber;Exogenous GABA;Seedling growth;High temperature stress;Physiological characteristics;Photosynthesis
S642.2
A
1001-3547(2016)08-0073-06
10.3865/j.issn.1001-3547.2016.08.031
黄娟(1989-),女,硕士,主要从事蔬菜生理及设施园艺研究,E-mail:ajuanfighting@foxmail.com
2016-01-04

