表达绿色荧光蛋白重组鸭肠炎病毒构建
孙 莹,李俊平,黄小洁,李 岭,曹明慧,李启红,李慧姣,杨承槐
(中国兽医药品监察所,北京 100081)
表达绿色荧光蛋白重组鸭肠炎病毒构建
孙 莹,李俊平,黄小洁,李 岭,曹明慧,李启红,李慧姣,杨承槐
(中国兽医药品监察所,北京 100081)
【目的】鸭肠炎病毒(duck enteritis virus,DEV)不同毒株间存在明显差异,DEV疫苗株的UL2基因在195bp后连续缺失528bp,导致第65位氨基酸后连续缺失176aa[1]。将绿色荧光蛋白(GFP)基因插入DEV UL2基因中,获得表达绿色荧光蛋白的重组病毒,以研究UL2基因对DEV生物特性的影响和探讨DEV作为载体表达外源基因的可行性。【方法】以实验室保存的DEV细胞适应株DNA为模板,利用PCR技术扩增出病毒UL2基因上下游序列并克隆入pMD-18T载体;以UL2基因作为外源基因插入靶点及同源重组臂,将CMV启动子控制的含有GFP-gpt基因表达盒克隆入DEV UL2基因中,构建含GFP基因的转移质粒载体pT-UL2-GFP-gpt;用脂质体将其与DEV细胞适应株共转染CEF细胞,待80%细胞出现病变后,冻融3次,接种到新鲜CEF细胞单层的6孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,在荧光显微镜下挑取单个有绿色荧光的蚀斑,再接到新的细胞上,重复蚀斑筛选、纯化表达绿色荧光蛋白的重组病毒;利用 PCR、基因测序技术鉴定重组病毒;重组病毒接种CEF(moi=0.01),每12h取出1瓶接毒细胞,分别收集上清和细胞,测量其病毒含量,绘制一步生长曲线;重组病毒在CEF中连续传代20次,在荧光显微镜下观察绿色荧光蛋白表达情况,并用PCR检测GFP的传代稳定性;重组病毒免疫4周龄SPF鸭后14d,肌肉注射接种DEV强毒(CVCC AV1221),观察免疫保护情况。【结果】经双酶切鉴定,成功构建了含绿色荧光蛋白报告基因的转移质粒载体pT-UL2-GFP-gpt,将其与DEV共转染CEF细胞后 8h,即可见转染细胞中有带有绿色荧光的梭形细胞,经过 8轮蚀斑筛选,获得纯化的重组病毒 rDEV-△UL2-GFP-gpt;PCR鉴定及基因测序结果显示,GFP标记基因成功地插入到DEV基因组中,替换了DEV UL2基因的196—723位核苷酸;一步生长曲线结果显示,重组病毒在细胞和上清中的病毒含量分别在36h和72h达到峰值,为106.2TCID50/0.1mL、105.5TCID50/0.1mL,与亲本毒无明显差异;重组病毒在CEF中连续传代,1—5代可以稳定表达GFP基因,第6代起,开始出现少量没有荧光的细胞病变,15—20代中绝大部分细胞病变无绿色荧光,GFP在细胞连续传代过程中容易出现突变;重组病毒以103.0TCID50/只免疫麻鸭,免疫后14d能完全抵抗DEV强毒株的攻击,与亲本毒免疫原性一致。【结论】成功构建了表达绿色荧光蛋白的DEV,首次证实UL2基因缺失不影响其在细胞中的复制,也不影响其免疫原性。荧光重组病毒的构建为DEV UL2基因功能、活载体疫苗研究奠定了基础。
鸭肠炎病毒;UL2基因;绿色荧光蛋白;重组病毒
0 引言
【研究意义】鸭肠炎病毒(duck enteritis virus,DEV),又称鸭瘟病毒,属于疱疹病毒科,能引起鸭、鹅等雁形目禽类发生急性、热性、败血性的传染病。该病也称为鸭瘟,发病率和死亡率很高,对水禽养殖业危害很大[2]。【前人研究进展】1923年荷兰首次报道了该病。1957年,黄引贤在中国最早报道该病并分离到病毒[3-4]。目前预防鸭瘟的主要措施为疫苗免疫接种。常用的疫苗有鸡胚化弱毒活疫苗和灭活疫苗。疱疹病毒基因组很大,可表达外源基因作为活载体疫苗[5],如表达鸡传染性法氏囊病病毒VP2蛋白的重组火鸡疱疹病毒(HVT)活疫苗,免疫效果良好[6-8]。DEV基因组为158—162 kb[1,9-13],宿主范围小,且具有良好的免疫原性,免疫成年鸭后第3天即可产生一定的免疫力,第4天就能抵抗强毒攻击(内部资料),因此是很有前景的水禽疫苗病毒载体。绿色荧光蛋白(green fluorescent protein,GFP)是20世纪90年代中期发展起来的一种报告分子,它是一个238氨基酸的蛋白质,在UV或蓝光激发下产生绿色荧光,可直接观察,被广泛应用于生物学研究[14-15]。【本研究切入点】本研究将GFP插入到DEV UL2基因中,构建出UL2基因缺失的转移载体,用脂质体转染的方法将其与DEV共转染鸡胚成纤维细胞(CEF),经8轮蚀斑筛选、纯化,获得了表达GFP的重组DEV,测定了其体外生长特性和免疫原性。【拟解决的关键问题】本研究旨在探究UL2基因对DEV生物特性的影响以及 DEV作为载体表达外源基因的可行性,为 DEV UL2基因功能、DEV活载体疫苗研究奠定了基础。
1 材料与方法
1.1试验时间、地点
试验于2014年6月至2015年7月在中国兽医药品监察所完成。
1.2试验材料
1.2.1毒株和细胞 DEV细胞适应毒由中国兽医药品监察所病毒制品检测室保存;SPF鸡胚由北京梅里亚维通实验动物技术有限公司提供。按照文献[16]的方法制备CEF。
1.2.2质粒和菌株 含有 GFP基因的载体pT-GFP-gpt由中国兽医药品监察所病毒制品检测室构建保存;pMD18T载体购自大连TaKaRa公司,DH5α受体菌购自天根生化科技(北京)有限公司。
1.2.3主要试剂 Ex Taq DNA 聚合酶、限制性内切酶、T4 DNA 连接酶、T4 DNA 聚合酶购自大连TaKaRa公司;胶回收试剂盒等均购自天根生化科技(北京)有限公司;胎牛血清、M199培养液购自Hyclone公司;OPTI-MEM培养液购自Gibco公司;lipofectamine2000购自Invitrogen公司;无内毒素高纯质粒提取试剂盒 Endo-free plasmid mini kit II购自Omega公司。
1.2.4引物试验所用 PCR引物见表1,由上海Invitrogen生物公司合成。

表1 目的基因的扩增引物及鉴定引物Table 1 Primers for amplification and identification of target gene
1.3试验方法
1.3.1基因组DNA的提取 取DEV病毒液437.5μL,加入蛋白酶K(20mg·mL-1)12.5μL、10%SDS 50μL; 56℃水浴1 h;分别用酚、酚∶氯仿∶异戊醇=25∶24∶1、氯仿各抽提1次;取上清,加入1/10体积3 mol·L-1醋酸钠和2倍体积的无水乙醇,-20℃放置30 min;12 000×g离心10 min,沉淀用70%乙醇洗涤1次,沉淀溶于30μL去离子水中,-20℃保存备用。
1.3.2重组质粒的构建 重组质粒 pT-UL2-GFP构建策略见图1。以提取的DEV基因组DNA为模板,分别扩增UL2基因上下游两端同源臂UL2-u、UL2-d。将两同源臂片段分别克隆到pMD18T载体,测序正确后,再分别双酶切下UL2-u、UL2-d后连接,获得重组质粒pT-UL2ud。将重组质粒pT-UL2ud用SalI酶切,电泳回收去磷酸化后,与用SalI酶切的pT-GFP-gpt连接,将GFP-gpt表达盒插入到pT-UL2ud中,获得重组质粒pT-UL2-GFP-gpt。
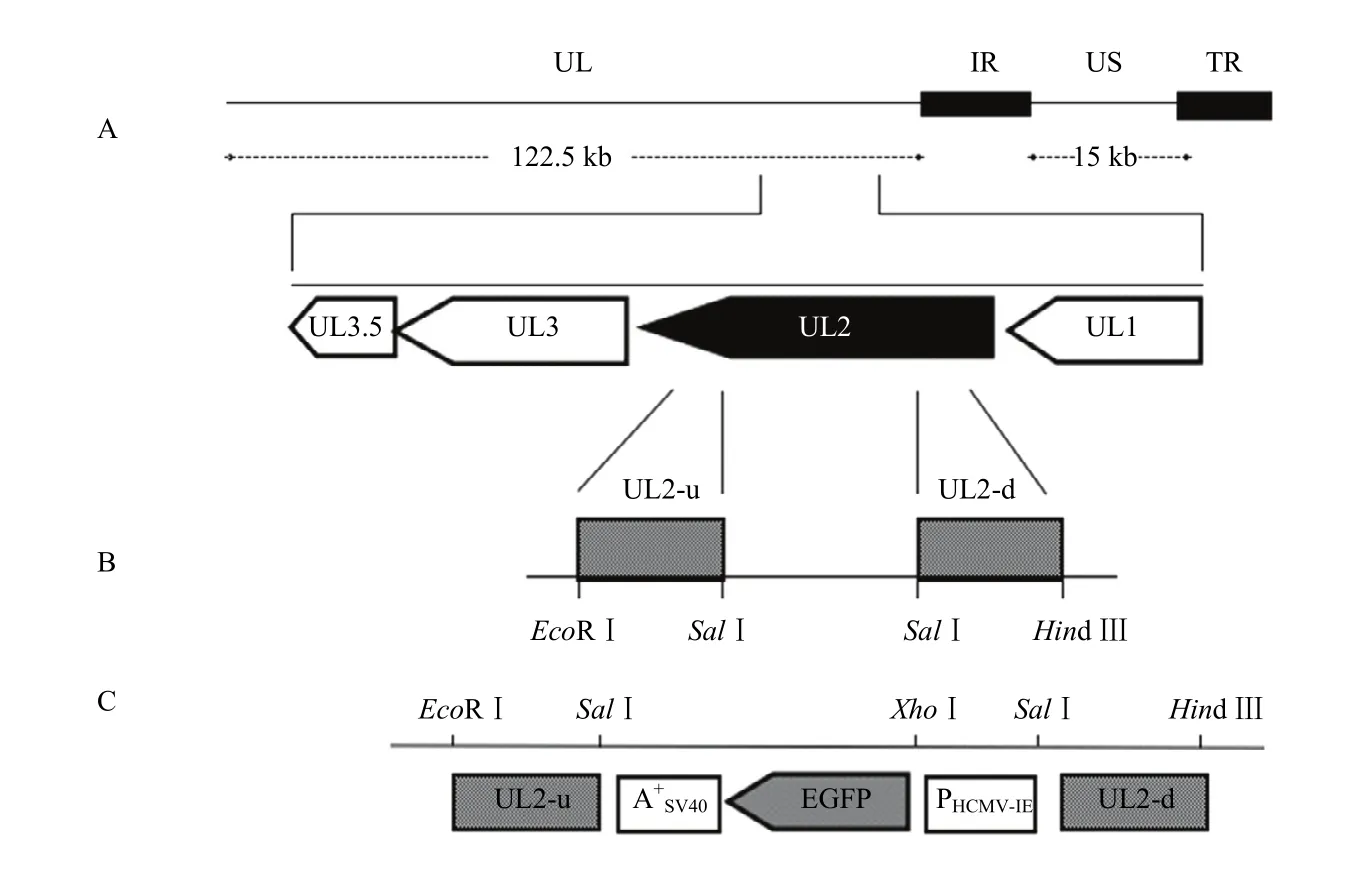
图1 重组病毒的构建Fig.1 Construction of recombinant DEV
1.3.3重组病毒的制备、纯化及鉴定 按说明书进行高纯度转移载体的提取。DEV接种CEF(moi=0.1),吸附1—2 h后,按Lipofectamine 2000说明书转染高纯质粒pT-UL2-GFP-gpt。转染后72—96 h,观察细胞病变情况,待80%细胞产生病变后,冻融3次,接种到新鲜CEF细胞单层的6孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,置5%CO2、37℃培养箱中培养72—96 h。观察荧光,挑取单个有绿色荧光的蚀斑,在细胞上重复多次传代,直至所有的蚀斑都带绿色荧光,确定为纯化的重组病毒。按1.3.1方法蛋白酶K-SDS方法提取重组病毒DNA,用鉴定引物ORFC17F、ORFC17R进行PCR扩增,PCR产物送上海Invitrogen生物公司测序。
1.3.4一步生长曲线 将重组病毒及其亲本病毒分别接种25cm2的细胞瓶中(moi=0.01),接种后每隔12 h取出1瓶接毒细胞,分别收集上清和细胞,测量其病毒含量,绘制一步生长曲线。
1.3.5重组病毒的稳定性 将重组病毒接种 CEF (moi=0.01),待80%细胞产生病变后,冻融3次,再接种CEF,如此连续传代20次。荧光显微镜下观察每代重组病毒的绿色荧光表达情况。按1.3.1方法提取病毒DNA,用引物ORFC17F、ORFC17R进行PCR鉴定外源基因GFP是否稳定存在。
1.3.6免疫原性测定 将15只4周龄SPF鸭,随机分成 3组,每组 5只。第 1组肌肉注射 rDEVΔ UL2-GFP,每只103TCID50,第2组肌肉注射DEV亲本毒,每只103TCID50,第3组不免疫,作对照。每组单独隔离饲养。在免疫后14 d,腿部肌肉注射接种DEV强毒(CVCC AV1221),每只103MLD。观察10 d,每天记录发病死亡情况。
2 结果
2.1重组质粒的构建及鉴定
2.1.1同源臂的扩增 以DEV细胞适应毒基因组为模板,分别用上游引物DEV UL2-uF1、UL2-dF1,下游引物DEV UL2-uR1、UL2-dR1扩增,结果扩增出1.1kb左右片段(图2-A)和1.3kb左右片段(图2-B),这与理论值相符。PCR产物克隆到pMD18T载体,转化 DH5α,分别获得了重组质粒 pMD18T-UL2u和pMD18T-UL2d。测序结果表明,本试验扩增的片段序列与已发表序列同源性100%。
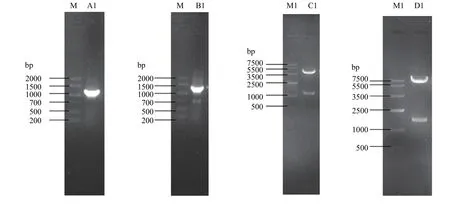
图2 重组质粒的构建及酶切鉴定Fig.2 Construction and identification of recombinant plasmid
2.1.2重组质粒pT-UL2ud的酶切鉴定 用限制性内切酶SalI和HindIII双酶切鉴定重组质粒pT-UL2ud,得到3.8 kb和1.3 kb大小的两个片段(图2-C),符合理论值。
2.1.3重组质粒pT-UL2-GFP-gpt的酶切鉴定 将重组质粒pT-UL2-GFP-gpt用限制性内切酶XhoI和BamH I双酶切鉴定,得到大小为5.6 kb和1.6 kb的两个片段(图2-D),符合预期。说明成功构建了含有GFP基因的缺失UL2的转移载体。
2.2重组病毒的制备、纯化及鉴定
2.2.1重组病毒的筛选 用 Endo-free plasmid mini kit II试剂盒提取高纯度转移载体质粒 pT-UL2-GFP-gpt,浓度为1 037µg·mL-1。将该转移质粒载体转染CEF细胞后8 h,即可见转染细胞中有带有绿色荧光的梭形细胞,说明质粒在细胞中瞬时表达。待80%细胞出现病变后,冻融3次,接种到新鲜CEF细胞单层的6孔培养板中,用含5%血清、1%双抗、1%琼脂的M199培养液覆盖,观察荧光,挑取单个有绿色荧光的蚀斑,再接到新的细胞上,经过8代筛选,所有的蚀斑都带绿色荧光,获得纯化的重组病毒。
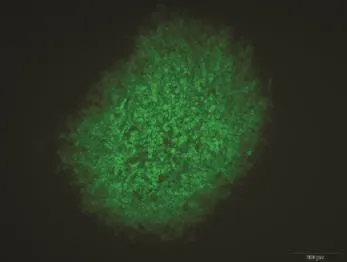
图3 表达绿色荧光的重组DEV病毒Fig.3 Recombinant DEV expressing the green flourescent protein
2.2.2重组病毒的鉴定 用特异性引物 ORFC17F/ ORFC17R进行PCR扩增鉴定,得到大小为2 400 bp的片段(图4),和理论值相符。将PCR产物送上海Invitrogen生物公司测序,测序结果表明,GFP标记基因成功地插入到DEV基因组中,替换了DEV UL2基因的196—723位核苷酸。
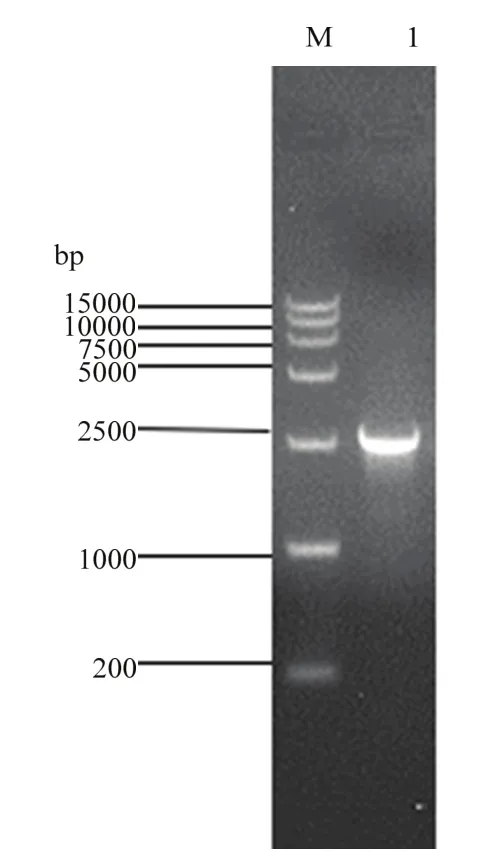
图4 重组病毒的鉴定Fig.4 Identification of the recombinant DEV
2.3一步生长曲线
绘制重组病毒及其亲本毒的一步生长曲线。结果表明,亲本毒接种CEF后36h,细胞样品的病毒含量达到峰值106.3TCID50/0.1mL,72 h上清样品病毒含量达峰值105.5TCID50/0.1mL。重组病毒细胞和上清的病毒含量分别在 36和72 h达到峰值,为 106.2TCID50/ 0.1mL、105.5TCID50/0.1mL,与亲本毒无明显差异(图5)。表明UL2的缺失对DEV的复制没有明显影响,缺失后培养病毒的滴度几乎无变化。
2.4重组病毒的传代稳定性
重组病毒经过传代 20次,观察绿色荧光在 1 —5代可以稳定表达,从第6代开始绿色荧光病变细胞开始减少,可观察到少量没有荧光的细胞病变,15—20代只有很少量的带有绿色荧光的细胞病变,绝大部分细胞病变无绿色荧光(图6)。对重组病毒的GPF基因进行PCR、测序,第5代PCR产物大小约2 200 bp,而第20代PCR产物只有800 bp左右。对第 20代重组病毒PCR产物进行测序,发现第 20代重组病毒从 CMV启动子的101bp至gpt的前208 bp共缺失1 456 bp,包括了GFP基因整个开放阅读框、部分启动子和部分gpt基因。
2.5重组病毒免疫原性
重组病毒rDEVΔUL2-GFP及其亲本毒免疫 SPF鸭后14d,均能100%抵抗DEV强毒攻击(表2),表明UL2基因缺失后不影响DEV的免疫原性。

图5 重组病毒的一步生长曲线Fig.5 One step growth curve of recombinant DEV in CEF
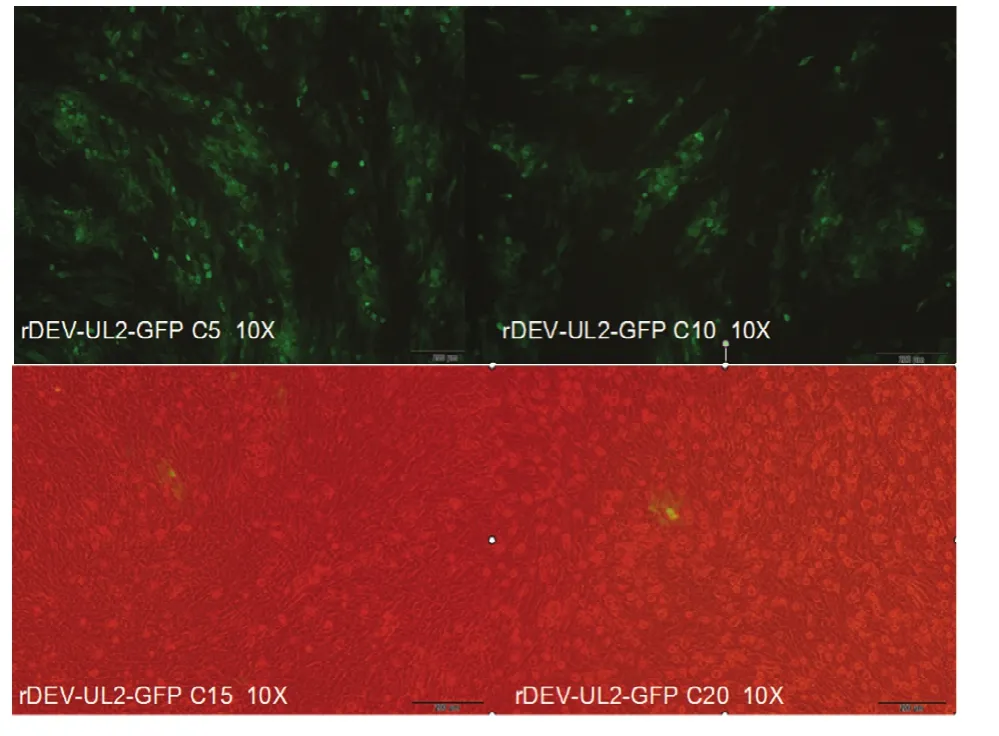
图6 重组病毒的传代稳定性检测Fig.6 Identification of stability of the recombinant DEV

表2 免疫后的攻毒保护效力Table 2 Protective efficacy against lethal challenge post-inoculation
3 讨论
本研究通过同源重组将绿色荧光蛋白 GFP插入鸭瘟病毒UL2基因,筛选并纯化了表达绿色荧光蛋白的UL2基因功能缺失的重组鸭瘟病毒,并对其生物学特性进行初步研究。表明该重组病毒的生长特性与亲本毒相似,且可以在CEF上稳定传代5次。
人单纯疱疹病毒1型(HSV-1)UL2基因编码了尿嘧啶 DNA糖基化酶(uracil DNA glycosylase,UNG),UNG是一种普遍存在的极为保守的DNA修复酶,它能将复制过程中dUTP错误插入DNA或是胞嘧啶的脱氨基造成的尿嘧啶残基切除,保证 DNA修复的正确性和顺利进行[17-18]。有研究表明,因为培养细胞本身可以提供UNG,因此UL2对HSV-1在细胞培养中的正常复制是非必需的,而在神经系统组织细胞中UNG活性很低甚至无,因而UL2对病毒在神经元中的复制有重要作用;缺失UL2的HSV-1突变体,小鼠颅内直接接种后,其神经毒力比亲本毒低10倍,而外周途径接种后神经毒力低100 000倍[19]。DEV UL2基因是否具有 HSV-1相似功能,目前尚未见报道,有待进一步研究。DEV强毒株UL2位于114 943 —115 944位核苷酸,全长1 002 bp,共编码333aa,而DEV弱毒Kp63株的UL2基因在195 bp后连续缺失528 bp导致65位氨基酸后缺失176aa[1]。本研究通过同源重组方法,将GFP基因表达盒替换DEV强毒株UL2基因的528 bp,获得了表达绿色荧光蛋白的重组DEV,为研究DEV UL2基因功能、DEV活载体疫苗奠定基础。
构建重组病毒时,常用的报告基因有β-半乳糖苷酶基因、二氢叶酸还原酶基因、氯霉素乙酰转移酶基因、绿色荧光蛋白(GFP)等,这些报告基因各有优缺点[20]。本研究选取比GFP更适合在动物细胞上表达的EGFP和大肠杆菌的黄嘌呤鸟嘌呤磷酸转移酶(gpt)基因作为双报告基因,提高了重组病毒筛选的效率。然而,本研究发现,GFP在DEV中不稳定,随着传代次数的增多,GFP会发生点突变或缺失。GFP在其他病毒中也出现了类似结果[21-23],这给重组病毒的反向筛选带来了不小难度,本研究结果提示,GFP作为重组 DEV的报告基因,应尽量减少传代次数,控制在5代内。
4 结论
4.1本研究应用同源重组技术,将GFP-gpt表达盒插入到UL2基因,成功构建了一株表达绿色荧光蛋白的重组DEV,并对重组病毒的生物学特性进行了初步研究。
4.2重组病毒的免疫原性和生长特性都与亲本毒相似,表明UL2基因的缺失对DEV的复制无明显影响,首次证明UL2对DEV在细胞中的复制是非必需的,而且UL2缺失后不影响DEV的免疫原性,是一个比较稳定的外源基因插入位点。
References
[1] YANG C,LI Q,LI J,ZHANG G,LI H,XIA Y,YANG H,YU K. Comparative genomic sequence analysis between a standard challenge strain and a vaccine strain of duck enteritis virus in China. Virus Genes,2014,48(2):296-303.
[2] 甘孟侯. 中国禽病学. 北京: 中国农业出版社,2000. GAN M H. The Chinese Diseases of Poultry,Beijing: China Agriculture Press,2000. (in Chinese)
[3] 黄引贤. 拟鴨瘟的研究. 华南农学院学报,1959(1): 67-78. HUANG Y X. Research on suspected duck enteritis virus. Journal of South China Agricultural College,1959(1): 67-68. (in Chinese)
[4] 黄引贤,欧守杼,邝荣禄,林维庆. 鸭瘟病毒的研究. 华南农学院学报,1980(1): 21-36. HUANG Y X,OU S C,KUANG R L,LIN W Q. Research on duck enteritis virus. Journal of South China Agricultural College,1980(1): 21-36. (in Chinese)
[5] 殷震,刘景华. 动物病毒学. 2版. 北京: 科学出版社. 1997: 1073-1081. YIN Z,LIU J H. Animal Virology. second edition. Beijing: Science Press,1997: 1073-1081. (in Chinese)
[6] DARTEIL R,BUBLOT M,LAPLACE E,BOUQUET J F,AUDONNET J C,RIVIERE M. Herpesvirus of turkey recombinant viruses expressing infectious bursal disease virus (IBDV) VP2 immunogen induce protection against an IBDV virulent challenge in chickens. Virology,1995,211(2): 481-490.
[7] BUBLOT M,PRITCHARD N,LE GROS F X,GOUTEBROZE S. Use of a vectored vaccine against infectious bursal disease of chickens in the face of high-titred maternally derived antibody. Journal of Comparative Pathology,2007,137(Suppl 1): 81-84.
[8] LE GROS F X,DANCER A,GIACOMINI C,PIZZONI L,BUBLOT M,GRAZIANI M,PRANDINI F. Field efficacy trial of a novel HVT-IBD vector vaccine for 1-day-old broilers. Vaccine,2009,27(4): 592-596.
[9] YANG C,LI J,LI Q,LI H,XIA Y,GUO X,YU K,YANG H. Complete genome sequence of an attenuated duck enteritis virus obtained by in vitro serial passage. Genome Announc,2013,1(5): e00685-13.
[10] WU Y,CHENG A,WANG M,ZHU D,JIA R,CHEN S,ZHOU Y,CHEN X. Comparative genomic analysis of duck enteritis virus strains. Journal of Virology,2012,86(24): 13841-13842.
[11] LI Y,HUANG B,MA X,WU J,LI F,AI W,SONG M,YANG H. Molecular characterization of the genome of duck enteritis virus. Virology,2009,391(2): 151-161.
[12] WANG J,HOPER D,BEER M,OSTERRIEDER N. Complete genome sequence of virulent duck enteritis virus (DEV) strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains. Virus Research,2011,160(1-2): 316-325.
[13] YANG C,LI J,LI Q,LI L,SUN M,LI H,XIA Y,YANG H,YU K. Biological properties of a duck enteritis virus attenuated via serialpassaging in chick embryo fibroblasts. Archives of Virology,2015,160(1):467-474.
[14] 张雪莲,范伟兴,周玉传,缪德年,钱莺娟,陈溥言. 表达绿色荧光蛋白的重组 CVI988病毒的构建及特性. 中国病毒学,2003(5): 468-472. ZHANG X L,FAN W X,ZHOU Y C,MIAO D N,QIAN Y J,CHEN P Y. Construction and characterization of recombinant CVI988 expressing the green fluorescent protein. Virologica Siniga,2003(5): 468-472. (in Chinese)
[15] GOWTHAMAN V,SINGH S D,DHAMA K,BARATHIDASAN R,MATHAPATI B S,SRINIVASAN P,SARAVANAN S,RAMAKRISHNAN M A. Molecular detection and characterization of infectious laryngotracheitis virus (Gallid herpesvirus-1) from clinical samples of commercial poultry flocks in India. Virusdisease,2014,25(3): 345-349.
[16] 中国兽药典委员会. 中华人民共和国兽药典(三部). 北京: 中国农业出版社,2010. Commission of Chinese veterinary pharmacopoeia. Veterinary pharmacopoeia of the People's Republic of China (the third section). Beijing: China Agriculture Press,2010. (in Chinese)
[17] KHATTAR S K,VAN DRUNEN LITTEL-VAN DEN HURK S,BABIUK L A,TIKOO S K. Identification and transcriptional analysis of a 3'-coterminal gene cluster containing UL1,UL2,UL3,and UL3.5 open reading frames of bovine herpesvirus-1. Virology,1995,213(1): 28-37.
[18] KRUSONG K,CARPENTER E P,BELLAMY S R,SAVVA R,BALDWIN G S. A comparative study of uracil-DNA glycosylases from human and herpes simplex virus type 1. Journal of Biological Chemistry,2006,281(8): 4983-4992.
[19] PYLES R B,THOMPSON R L. Evidence that the herpes simplex virus type 1 uracil DNA glycosylase is required for efficient viral replication and latency in the murine nervous system. Journal of Virology,1994,68(8): 4963-4972.
[20] 黄培堂. 分子克隆试验指南. 3版. 北京: 科学出版社,2003. Huang P T. Molecular Cloning: A Laboratory Manual. the third edition. Beijing : Science Press,2003. (in Chinese)
[21] FANG Y,ROWLAND R R,ROOF M,LUNNEY J K,CHRISTOPHERHENNINGS J,NELSON E A. A full-length cDNA infectious clone of North American type 1 porcine reproductive and respiratory syndrome virus: expression of green fluorescent protein in the Nsp2 region. Journal of Virology,2006,80(23): 11447-11455.
[22] KIM D Y,CALVERT J G,CHANG K O,HORLEN K,KERRIGAN M,ROWLAND R R. Expression and stability of foreign tags inserted into nsp2 of porcine reproductive and respiratory syndrome virus (PRRSV). Virus Research,2007,128(1-2): 106-114.
[23] ORMO M,CUBITT A B,KALLIO K,GROSS L A,TSIEN R Y,REMINGTON S J. Crystal structure of the Aequorea Victoria green fluorescent protein. Science,1996,273(5280): 1392-1395.
(责任编辑 林鉴非)
Construction and Characterization of Recombinant Duck Enteritis Virus Expressing the Green Fluorescent Protein
SUN Ying,LI Jun-ping,HUANG Xiao-jie,LI Ling,CAO Ming-hui,LI Qi-hong,LI Hui-jiao,YANG Cheng-huai
(China Institute of Veterinary Drug Control,Beijing 100081)
【Objective】Compared with duck enteritis virus (DEV) virulent strain,the vaccine strain has a 528 bp-deletions at the UL2,resulting to a 176 aa deletion after amino acids 65. To study the effect of UL2 gene on virus biological properties and explorethe feasibility of the DEV as a carrier to express foreign gene,a recombinant DEV expressing the green fluorescent protein (GFP)were constructed.【Method】In this study,the UL2 gene of DEV was chosen as a target site and homologous arm for recombination. Two fragments of UL2 gene were amplified by polymerase chain reaction (PCR) with DNA of DEV cell-adapted strain as template,and were cloned into the pMD-18T vector. The expression cassette including GFP gene and gpt gene controlled by CMV promoter was cloned into UL2 gene as a transfer vector pT-UL2-GFP-gpt. Confluent CEF monolayers were transfected with DEV and Lipofectamine 2000 was used as the transfer vector. When the cytopathic effect (CPE) was observed,the total supernatant and cells were harvested. The infected virus was diluted and then plated on the fresh CEF,and overlaid with M199-FBS containing 1% agarose. When green fluorescent plaques were observed,plaque-purification was carried out to obtain a green fluorescent plaque population termed rDEV-△UL2-GFP-gpt,PCR and sequencing assay were used to identify the recombinant virus. CEF cells cultured in 25cm2flasks were inoculated with recombinant virus at an MOI of 0.01. The cells and supernatants were harvested respectively every 12 hours,the titer of virus were measured and the one-step growth analyses was performed; To evaluate the genetic stability of GFP gene in the recombinant virus,the virus was passaged in primary CEF 20 times. Four-week-old specificpathogen-free (SPF) ducks were inoculated intramuscularly with the recombinant virus,and the ducks were challenged with lethal DEV (CVCC AV1221) by intramuscular injection at 14 days post vaccination,then the ducks were observed for symptom of disease and death.【Result】The recombinant expression vector pT-UL2-GFP-gpt was correctly constructed,identified by double-enzyme digestion. After 8 hours of transfection,spindle cells with green fluorescent were appeared. After 8 rounds of plaque-purification,the purified rDEV-△UL2-GFP-gpt were obtained. The results of the PCR and sequencing indicated that the GFP expression cassette has already successfully insert into the DEV genome,which replaced 196-723 nucleotide of UL2. The recombinant virus possessed growth kinetics were similar to that of the parental virus,the cell titer peaked at 36 hours with the peak titer 106.2TCID50/0.1mL,and the supernatant titer peaked at 72 hours with the peak titer 105.5TCID50/0.1mL. The virus were passaged in CEF cells 20 times,the GFP gene was stably maintained in 1st to 5th passages,however,from the 6th passage,there was little CPE without green fluorescent,and in 15th to 20th passages,most CPE had no green fluorescent,GFP mutated during subculture. All immunized animals were protected against subsequent challenge with lethal DEV,the insertion of the GFP gene did not alter the protective efficacy of parental virus. 【Conclusion】In this research,the recombinant DEV expressing the green fluorescent protein were successfully constructed,and firstly has confirmed that the deletion of UL2 gene has no effect on virus replication in cells and the immunogenicity in ducks. This study laid a foundation for the research of the function of the DEV UL2 gene and the DEV vector vaccine.
duck enteritis virus; UL2 gene ; GFP; recombinant virus
2016-02-19;接受日期:2016-03-28
北京市自然科学基金(6162025)
联系方式:孙莹,Tel: 010-62103640,E-mail:sunyinggoodluck@163.com。通信作者李慧姣,Tel:010-62103518;E-mail:lihuijiao@ivdc.org.cn。通信作者杨承槐,Tel:010-62103640;E-mail:ychenghuai@163.com

