小蓬NeMT2基因的克隆及其植物表达载体的构建
葛风伟, 曾卫军, 李艳红, 赵惠新
( 新疆特殊环境物种保护与调控生物学实验室, 新疆师范大学 生命科学学院, 乌鲁木齐 830054 )
小蓬NeMT2基因的克隆及其植物表达载体的构建
葛风伟, 曾卫军, 李艳红, 赵惠新*
( 新疆特殊环境物种保护与调控生物学实验室, 新疆师范大学 生命科学学院, 乌鲁木齐 830054 )
该研究利用RACE (Rapid amplification of cDNA ends)技术从小蓬中成功分离编码金属硫蛋白(Metallothionein,MT)的cDNA序列,命名为NeMT2,在GenBank中登录号为KT835290。该基因全长590 bp,开放阅读框为237 bp,编码78个氨基酸,编码的氨基酸序列中含有14个半胱氨酸残基(Cys,C),呈C-C,C-X-C,C-X-X-C排列,集中分布在肽链的N端和C端,基因编码蛋白的分子量为7.603 6 kD,等电点为4.71。系统发育分析表明,小蓬金属硫蛋白NeMT2与藜科的海蓬子(AEF01492)和盐穗木(AHI62953)同源性最高,其次是甜菜(XP_010667708.1)。生物信息学分析表明,金属硫蛋白NeMT2无信号肽结构,属于非跨膜亲水性蛋白;疏水性分析表明,NeMT2蛋白的35~45个氨基酸之间有较强的疏水性,其中第41位Asp具最强的疏水性(1.444);结构预测分析该蛋白质二级结构的主要元件是无规则卷曲。通过RT-PCR对NeMT2基因的表达分析发现,NeMT2基因在铜矿区和非铜矿区的小蓬叶片中均有表达,但该基因在铜矿区小蓬叶片的表达量明显高于非铜矿区。将小蓬NeMT2基因定向克隆到植物表达载体pCAMBIA1300的35S 启动子下游,构建该基因的植物超表达载体pCAMBIA1300+NeMT2。该研究结果为进一步研究该基因的功能和小蓬响应重金属胁迫的分子机制提供了一定基础。
小蓬,NeMT2, RACE, 序列分析, 植物表达载体
金属硫蛋白(Metallothionein,MT)是一类广泛存在于生物体内的低分子量(6 000~7 000 Da)蛋白,富含半胱氨酸(Cystine,Cys),对多种金属有高度亲和性。植物金属硫蛋白在重金属离子解毒及金属离子代谢(常团结和朱祯,2002a)、活性氧清除(Akashi et al,2004)、转运和储存金属离子(Belghith et al, 2016)、维持金属离子稳态(Hegelund et al, 2012)等方面起到重要作用。另外,该基因还参与了植物的生长发育、胚胎发育、果实成熟、衰老和抗逆反应等植物生理过程(常团结和朱祯,2002a,b;Charbonnel-Campaa et al, 2000)。因此,对金属硫蛋白基因MT的研究将成为植物抗逆研究中的一个重要方向(樊连梅等,2011)。目前,已从NCBI数据库中搜索到拟南芥等多种植物的金属硫蛋白基因,但对其功能研究还知之甚少。随着现代生物学技术的日新月异,植物抗逆基因资源的开发及转基因育种方面的研究,已成为植物逆境分子生物学的热点和农业抗逆领域的重要课题(颜宏等,2006)。
小蓬(Nanophytonerinaceum)是藜科小蓬属植物,是重要的抗逆植物。常生于戈壁、石质山坡,其适应性极强,在我国仅分布于新疆(新疆植物志编委会,1994)。阿勒泰市是新疆重点有色金属开发带,通过前期野外考察发现小蓬是阿勒泰富蕴县铜矿区的优势物种之一。目前对小蓬的研究多集中在抗逆生理学方面,关于其抗逆的分子机制尤其是小蓬金属硫蛋白基因MT的研究未见报道。因此,本研究以小蓬叶片为材料,通过RACE技术从小蓬中克隆得到金属硫蛋白基因NeMT2的cDNA全长序列,利用生物信息分析方法对NeMT2基因编码的氨基酸序列与组成、蛋白质理化性质、发育树进化分析、跨膜区与信号肽、疏水性分析、蛋白质二级结构进行预测。通过RT-PCR技术分析了NeMT2基因的表达,以pCAMBIA1300载体为基本载体构建了该基因的表达载体,上述工作将为小蓬金属硫蛋白基因NeMT2功能的研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料利用大量采样法分别采集生长在新疆阿勒泰富蕴县铜矿区(46°45.477′ N,89°41.430′ E)和非铜矿区(距离铜矿区3.5 km的国道)的小蓬植株,选取株龄基本一致的小蓬顶端光合枝叶片作为材料。在小蓬生长旺盛的铜矿区选取3个5 m × 5 m的采集区样方,分别于每个样方的4个方向各选1个点,每个点选取5株共60株小蓬进行样品采集。同时选取距铜矿区3.5 km处的非矿区采集小蓬叶片,方法同矿区一致。收集的叶片样品经液氮处理后带回实验室,置于-70 ℃冰箱中保存,提取的总RNA用于RT-PCR分析。
1.1.2 试剂菌株E.coliDH5α由实验室保存,质粒载体为pMD18-T Vector(Invitrogen)。MMLV第一链cDNA反转录试剂盒等购自宝生物公司,TRIzol、DNA凝胶回收试剂盒(AxyGEN)、PCR扩增试剂盒均购自北京天根公司。
1.2 方法
1.2.1 总RNA的提取与第一链cDNA合成采用TRIzol法提取小蓬幼叶总RNA。提取的总RNA上样于1%琼脂糖凝胶中,检测RNA的完整性。取11 μL的总RNA为模板,依据Reverse Transcriptase M-MLV(RNaseH-)(TaKaRa)反转录试剂盒进行cDNA第一链的合成。合成的cDNA样品稀释5~10倍,置于-20 ℃冰箱中,用于后续的基因克隆实验。设计金属硫蛋白基因克隆引物(表1),送至华大基因科技有限公司合成。
1.2.2NeMT2基因的克隆与序列测定根据本课题组前期研究获得的金属硫蛋白基因部分序列(KT821088,221 bp),设计3′RACE上游引物GSP3′1 和GSP3′ 2(表1)进行NeMT2基因3′序列的克隆。以上述反转录的cDNA第一链为模板,表1相对应的引物进行PCR扩增。GSP3′ 1为上游引物,AP1为下游引物,进行第1轮扩增。GSP3′ 2为上游引物,AP2为下游引物,进行第2轮扩增。同样根据NeMT2基因部分序列设计5′RACE的下游引物GSP5′1 和GSP5′2(表1)进行NeMT2基因5′序列的克隆。以AP3为上游引物,GSP5′1 为下游引物,进行第1轮扩增反应。以AP4为上游引物,GSP5′2为下游引物进行第2轮扩增反应。
利用克隆获得NeMT2的3′和5′的基因片段,拼接得到NeMT2基因的全长cDNA序列。用NCBI的ORF程序搜索NeMT2的开放阅读框(open reading frame,ORF),设计全长特异性引物NeMT2-F 和NeMT2-R(表1),PCR扩增NeMT2基因的编码区。扩增产物上样于1.2%的琼脂糖凝胶检测片段大小,根据凝胶回收试剂盒说明书进行片段回收与纯化。取4.5 μL纯化产物与1 μL pMD18-T载体连接,连接产物转化大肠杆菌感受态细胞,以氨苄为筛选标记在LB固体培养基上37 ℃过夜培养,之后进行蓝白斑筛选重组子。挑取单克隆菌落摇菌培养,进行PCR鉴定,菌液送华大基因科技有限公司测序。
1.2.3NeMT2基因生物信息学分析用NCBI(http://www.ncbi.nlm.nih.gov/)的BLAST软件进行同源性搜索,用ORF Finder程序(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测金属硫蛋白基因的开放阅读框;用Conserved Domains(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白质保守区分析;之后使用ClustalX软件进行氨基酸序列的多重比对分析;采用MEGA 5.0构建了系统进化树;利用ExPASy的ProtParam(http://web.expasy.org/protparam/)分析编码蛋白质的相对分子量、等电点、亲水性分析等理化性质(Walker,2005);用ExPASy的ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl) 以默认算法 (Hphob./Kyte & Doolittle)

表 1 小蓬NeMT2基因克隆引物
进行疏水性分析(Kyte et al,1982);利用TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/)和TMpred Server(http://ch.embnet.org/software/TMPRED_form.html)进行金属硫蛋白跨膜区预测;采用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP)对编码蛋白信号肽进行预测分析(Petersen et al,2011);用SOPMA程序(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html)预测NeMT2蛋白的二级结构(Geourjon & Deleage,1995)。
1.2.4NeMT2基因RT-PCR表达分析利用大量采样法分别采集生长在新疆阿勒泰富蕴县铜矿区和非铜矿区小蓬植株,采集小蓬顶端光合枝的叶片用TRIzol法提取总RNA,用酶标仪(Bio-tek ELx 800)测定RNA的浓度。分别取矿区和非矿区的小蓬叶片等量总RNA,依据M-MLV反转录试剂盒(TaKaRa)进行cDNA第一链的合成。根据藜科植物Actin基因序列设计一对引物Actin-F:5′-GTGGTCGTACAACGGTATTGTG-3′,Actin-R:5′-GACCCTCCAATCCAGACACTG-3′。以反转录的第一链cDNA为模板,用上述合成的Actin引物和NeMT2基因特异性引物同批异管进行RT-PCR基因表达分析。
1.2.5NeMT2基因真核表达载体的构建用BamHI和PstI双酶切含有NeMT2基因的克隆载体pMD18-T,pCAMBIA1300质粒同样进行双酶切,经琼脂糖凝胶电泳检测后进行胶回收及纯化。将目的基因与pCAMBIA1300载体进行体外连接,构建NeMT2基因的植物表达载体pCAMBIA1300+NeMT2。随后转化到大肠杆菌感受态细胞中,在含Kan的LB固体培养基中培养 。将转化出来的单菌落通过摇菌,将经过菌液PCR鉴定的阳性菌液进行质粒抽提。将抽提的重组质粒分别使用BamHI和PstI进行双酶切,根据片段大小鉴定质粒的构建。
2 结果与分析
2.1 RNA质量检测
由图1可见,28S、18S和5S条带整齐清晰,表明所提总RNA完整性较好,没有降解;紫外分光光度检测OD260/OD280为1.8~2.0之间。提取的总RNA的纯度及完整性都较高,可用于下一步的反转录分析。

图 1 RNA凝胶电泳图Fig. 1 RNA agarose gel electrophoresis
2.2 小蓬金属硫蛋白NeMT2基因的克隆
由图2可知,通过NCBI数据库进行比对,Blastn比对结果显示:其与藜科植物海蓬子MT基因(GenBank登录号:KF876178.1)序列的同源性为83%,与盐穗木MT2基因(GenBank登录号:JF780913.1)序列的同源性为80%。小蓬金属硫蛋白基因与其它植物的金属硫蛋白基因的亲缘关系也较近,序列同源性分析见表2,可推测其为MT家族成员。将克隆的基因命名为NeMT2,并提交到GenBank上,登录号为KT835290。
克隆获得的NeMT2基因全长590 bp,通过生物信息学(ORF Finder)分析其完整的开放阅读框(ORF)。发现该基因包含一个237 bp开放阅读框,编码78个氨基酸,其中5′非编码区211 bp,3′非编码区412 bp(图3)。
2.3 小蓬金属硫蛋白NeMT2理化性质预测及分析
ExPASy ProtParam预测表明,小蓬NeMT2基因编码蛋白的分子式为C300H477N89O108S17,理论分子量为7.6036 kD,理论等电点为4.71;预测该蛋白的半衰期为30 h ,不稳定参数为30.72 ,预测其为稳定蛋白(< 40为稳定蛋白)。相对含量较多的氨基酸有Gly (15个,19.2%),Cys (14个, 17.9%),Ala(8个,10.3%),Asn (6个,7.7%),Lys(5个,6.4%),Pro(4个,5.1%),Ser(4个,5.1%),Thr(4个,5.1%),Glu(4个,5.1%),Asp(3个,3.8%),Ile(3个,3.8%),Met(3个,3.8%),Phe(2个,2.6%)和Val(2个,2.6%);相对含量较少的氨基酸有Tyr(1个,1.3%);NeMT2蛋白不含有Pyl,Sec,Arg,Trp,Leu,Gln和His。亲水性平均数为-0.027,预测NeMT2蛋白为亲水性蛋白。

表 2 NCBI Blastn同源序列搜索
2.4 小蓬金属硫蛋白NeMT2氨基酸序列比对和系统进化树分析
2.4.1 金属硫蛋白NeMT2氨基酸序列比对分析根据Blast搜索,筛选出与小蓬NeMT2蛋白序列相似度较高的7个植物金属硫蛋白的同源序列,采用Clustal W软件进行多重序列的比对分析(图4)。
发现小蓬NeMT2蛋白的氨基酸序列同藜科海蓬子(Salicorniabrachiata)和盐穗木(Halostachyscaspica)相似序列较高。NeMT2基因编码的氨基酸序列共有14个Cys残基,该残基主要集中在肽链的N端和C端。Cys残基以C-C型,C-X-C型和C-X-X-C型排列,其中C-X-C型在该氨基酸序列出现了5次。该氨基酸中部不含有Cys,保守性很低。可见,Cys残基的数目和位置在不同物种间都有很高的保守性。根据Conserved Domains程序预测小蓬NeMT2蛋白的保守序列,发现第26~77个氨基酸之间的序列是Metallothionein-2的保守区,该区域具有金属硫蛋白基因典型的结构域特征,从而确定NeMT2基因为Ⅱ类金属硫蛋白基因(ClassⅡ)(图5)。

图 2 小蓬NeMT2基因全长cDNA及其推测的氨基酸序列 编码区用下划线标出(起始密码子ATG,终止密码子TGA)。Fig. 2 Total cDNA sequence of NeMT2 gene from Nanophyton erinaceum and deduced amino acid sequence Coding sequence is underlined (initiation codon is ATG, and stop codon is TGA).

图 3 NeMT2 PCR产物扩增 M. 分子量标记 (DL 2 000); 1. 3′ RACE产物; 2. 5′ RACE产物; 3. CDS产物。Fig. 3 PCR amplification result of NeMT2 M. Marker (DL 2 000); 1. 3′ RACE product; 2. 5′ RACE product; 3. CDS product.
2.4.2 系统进化树分析从NCBI上搜索了海蓬子、盐穗木、蝇子草(Sileneniceensis)、甜菜(Betavulgaris)、红树(Bruguieragymnorhiza)莲(Nelumbonucifera)、苋菜(Amaranthuscruentus)棉花(Gossypiumarboreum)、菠菜(Spinaciaoleracea)、马黛茶(IIexparaguariensis)、拟南芥(Arabidopsisthaliana)、荠蓝(Camelinasativa)和星星草(Puccinelliatenuiflora)共13种植物的金属硫蛋白基因的氨基酸序列,用于系统发育树的构建(图6)。进化分析表明,藜科的海蓬子(AEF01492)和盐穗木(AHI62953)来自同一个进化分枝,而本研究所克隆NeMT2基因所推测的氨基酸序列与这二者的同源性最高,其次是甜菜(XP_010667708.1);而与莲(XP_010253171)和马黛茶(AFP93964)的亲缘关系最远。
2.5 小蓬金属硫蛋白NeMT2跨膜结构、信号肽预测及疏水性分析
蛋白质跨膜结构域预测表明,NeMT2蛋白的肽链位于细胞膜外,说明该蛋白没有跨膜结构域。利用SignalP 4.1对NeMT2蛋白信号肽进行预测分析,发现该蛋白并不存在信号肽序列。可见,小蓬NeMT2蛋白属于非跨膜、非分泌型蛋白。
通过Protscale程序对蛋白质的疏水性预测(图7)结果可知,小蓬金属硫蛋白NeMT2中部疏水性较强,而两端则为亲水区。由图可知,第64位Cys的亲水性最强,分值为-1.178(最低);第41位Asp的疏水性最强,分值为1.444(最高)。
2.6 小蓬金属硫蛋白NeMT2的二级结构预测分析
利用SOPMA程序预测小蓬金属硫蛋白NeMT2的二级结构(图8)。由图8可知,金属硫蛋白NeMT2的二级结构包含65.38%的无规则卷曲、16.67%的α-螺旋、11.54%的延伸链、6.41%的β-折叠。可见,无规则卷曲在该蛋白的二级结构中占有大多数,预测其形成α-螺旋、β-折叠的氨基酸很少。
2.7 NeMT2基因RT-PCR表达分析
以小蓬肌动蛋白Actin基因为内参进行定量,通过RT-PCR对NeMT2基因在矿区和非矿区小蓬叶片中的表达进行分析。图9结果表明,NeMT2基因在铜矿区和非铜矿区的小蓬叶片中均有表达,但该基因在铜矿区小蓬叶片的表达量明显高于非铜矿区。

图 4 小蓬金属硫蛋白NeMT2与7种植物MT蛋白序列的比对Fig. 4 Multiple sequence alignment of metallothionein NeMT2 from Nanophyton erinaceum with MT protein from seven plants

图 5 NeMT2氨基酸保守功能区Fig. 5 Conserved domain of NeMT2

图 6 小蓬金属硫蛋白NeMT2系统进化树分析标尺在左下方,Bootstap = 1 000。Fig. 6 Phylogenetic tree analysis of metallothionein NeMT2 from Nanophyton erinaceum The scale was at the bottom-left, and the bootstrap values based on 1 000 replicates were indicated.

图 7 小蓬金属硫蛋白NeMT2疏水性分析 Fig. 7 Hydrophobicity profile of metallothionein NeMT2 from Nanophyton erinaceum
2.8 NeMT2基因真核表达载体的构建和鉴定
用BamHI和PstI双酶切克隆载体pMD18-T+NeMT2和pCAMBIA1300,将NeMT2片段和pCAMBIA1300载体片段用 T4 DNA 连接酶连接,转化大肠杆菌DH5a,筛选的阳性克隆用酶切验证(图10)。从图10(泳道3)可知,重组质粒用BamHI和PstI双酶切获得一条约 230 bp的条带,说明构建的植物表达载体已成功将小蓬NeMT2基因整合进去。
3 讨论
通过前期野外考察,发现小蓬是阿勒泰富蕴县铜矿区的优势物种。目前,关于金属硫蛋白基因MT的结构组成及特点、该基因在小蓬耐受重金属胁迫过程中的作用等相关研究未见报道。
本研究采用RACE技术从小蓬叶片中克隆得到金属硫蛋白基因NeMT2的cDNA全长序列。通常依据氨基酸序列中Cys 残基的排列方式对植物金属硫蛋白基因进行分类(张艳等,2007)。根据Cobbett & Goldsbrough(2002)的分类方法将小蓬金属硫蛋白NeMT2归为第Ⅱ类。Ⅱ类MT不存在信号肽序列,无跨膜结构域,属于非分泌亲水性蛋白;其蛋白质二级结构的主要元件是无规则卷曲(孟红恩等,2014)。对克隆得到的小蓬金属硫蛋白NeMT2进行生物信息学分析表明,NeMT2蛋白二级结构的主要成分是无规则卷曲,预测其二级结构中较少形成α-螺旋和β-折叠的肽段。张艳等(2006)认为MT分子中不含α-螺旋和β-折叠肽段,但存在一种很坚固的构象,本研究的预测与该文献相符。另外,NeMT2蛋白中共含有14个Cys残基,占该蛋白总氨基酸的17.9%,这些Cys残基主要分布在肽链的N端和C端。本研究同源序列比对表明,不同来源的植物金属硫蛋白两端序列的同源性很高,而中部同源性低,Cys残基都集中分布在肽链的N端和C端,可见N端和C端序列对金属硫蛋白的结构和功能的重要性。金属硫蛋白基因结构典型的特征是Cys含量高(Hamer,1986)。该结构也是金属硫蛋白对重金属胁迫应答的结构基础(刘瑜等,2011;Liu et al,2016)。
金属硫蛋白与生物体内的多种生理功能相关,其最为主要的功能就是解除重金属离子的毒害作用,提高植物的重金属耐性。金属硫蛋白富含Cys残基,肽链中巯基(SH)含量高因而导致其对重金属的亲和力高,该蛋白可以螯合Cu、Zn、Pb等18种重金属,所以金属硫蛋白在解除重金属毒害方面起着重要作用(赵之伟等,2013)。龙葵的金属硫蛋白MTS基因家族已被证明涉及重金属铬、铜的解毒(Fidalgo et al, 2013;Teixeira et al, 2013)。植物金属硫蛋白两端富含 Cys 的区域在中间区的帮助下相互接近,与金属离子结合形成一个结构域(Jordi et al,2006;孟红恩等,2014)。在植物对Zn2+和Cu2+的解毒过程中,金属硫蛋白是通过巯基与金属离子结合,从而降低重金属离子的毒性(Nathalie et al,2001)。但到目前为止,金属硫蛋白参与植物重金属解毒的作用机理仍不十分清楚。
植物金属硫蛋白基因的表达具有可诱导性。植物金属硫蛋白基因的表达受金属离子、高盐、干旱、低温、热激等不同环境因子的影响(全先庆等,2006;张艳等,2007)。目前研究最多的是植物金属硫蛋白基因对重金属的胁迫响应。Kumar et al(2012)研究发现,藜科植物海蓬子在高盐、高温和干旱胁迫处理下,金属硫蛋白基因SbMT-2表达量增加;而受冷胁迫处理后,该基因的表达量明显下降,说明SbMT-2基因可能在提高海蓬子抵御逆境方面发挥了重要作用。转基因及基因敲除技术已广泛用于金属硫蛋白的功能研究,结果证实金属硫蛋白不但能降低重金属对植物的毒害,还能提高植物的耐受性(Brkljacic et al,2004;赵之伟等,2013)。Turchi et al(2012)发现,转入菜豌豆金属硫蛋白MTA1基因的白杨,对重金属锌和铜的抗性显著提高;转金属硫蛋白MT基因的矮牵牛对铅的抗性及吸收能力明显增强(李伟等,2001);转木豆MT1基因的拟南芥植株,对重金属Cu2+和Cd2+的抗性明显提高(Sekhar et al,2011)。在拟南芥中表达MT4a基因提高了铜胁迫下植物的金属耐性,使植物体中铜的积累量增加(Rodríguez-Llorente et al,2010)。植物金属硫蛋白既受重金属离子诱导又有重金属解毒的作用,该蛋白可以作为一种重金属污染生物标志物(陈春等,2009)。
新疆阿勒泰富蕴县铜矿区和非铜矿区土壤重金属Cu含量分别为4 035.65和1 100.09 mg·kg-1(前期研究结果)。本研究利用RT-PCR对小蓬NeMT2基因的表达进行分析,发现NeMT2基因在铜矿区小蓬叶片的表达量明显高于非铜矿区。可见,NeMT2

图 8 小蓬金属硫蛋白NeMT2的二级结构预测Fig. 8 The secondary structures predication of metallothionein NeMT2 from Nanophyton erinaceum
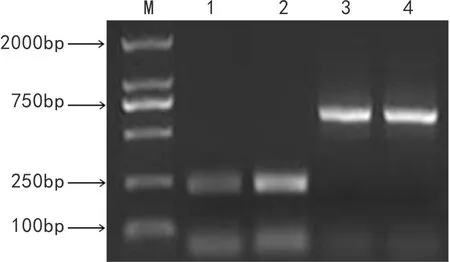
图 9 小蓬NeMT2基因的RT-PCR表达分析 M. 分子量标记DL 2 000; 1. NeMT2基因(非铜矿区); 2. NeMT2基因(铜矿区); 3. Actin基因(非铜矿区); 4. Actin基因(铜矿区)。Fig. 9 RT-PCR expression analysis of NeMT2 from Nanophyton erinaceum M. Marker DL 2 000; 1. NeMT2 gene (nor-mining area); 2. NeMT2 gene (mining area); 3. Actin gene (nor-mining area); 4. Actin gene (mining area).

图10 Escherichia coli DH5a中的载体pCAMBIA1300+NeMT2的酶切验证 M. DNA分子量标记; 1. pCAMBIA1300+NeMT2重组质粒; 2. pCAMBIA1300+NeMT2重组质粒BamH I单酶切产物; 3. pCAMBIA1300+NeMT2重组质粒BamH I和Pst I双酶切产物。Fig. 10 Identification by restriction of vector pCAMBIA1300+NeMT2 in Escherichia coli DH5a M. DNA Marker; 1. Plasmid of pCAMBIA1300+NeMT2; 2. Plasmid of pCAMBIA1300+NeMT2 digestion with BamH I; 3. Plasmid of pCAMBIA1300+NeMT2 digestion with both BamH I and Pst I.
基因的表达随着重金属Cu含量的不同表现出明显的变化,暗示该基因有可能参与小蓬对重金属Cu胁迫的应答过程。鉴于此,该基因可作为培育抗重金属转基因植物的优良基因。当然,该基因参与小蓬重金属胁迫应答的分子机理还有待于更深入的研究。小蓬金属硫蛋白基因NeMT2的克隆与表达载体的构建,将为进一步研究该基因的功能奠定基础。
AKASHI K, NISHIMURA N, ISHIDA Y, et al, 2004. Potent hydroxyl radical-scavenging activity of drought-induced type-2 metallothionein in wild watermelon [J]. Biochem Biophy Res Comm, 323:72-78.
BELGHITH T, ATHMOUNI K, BELLASSOUED K, et al, 2016. Physiological and biochemical response ofDunaliellasalinato cadmium pollution [J]. J Appl Phycol, 28(2):991-999.BRKLJACIC JM, SAMARDZIC JT, TIMOTIJEVIC GS, et al, 2004. Expression analysis of buckwheat (FagopyrumesculentumMoench) metallothionein-like gene (MT3) under different stress and physiological conditions [J]. J Plant Physiol, 161(6):741-746.
CHANG TJ,ZHU Z, 2002a. Study advances of plant metallothionein-classification, characteristics and gene structure [J]. Biotechnol Inform,(3):5-10. [常团结,朱祯, 2002a. 植物金属硫蛋白研究进展一:植物MT的分类、特征及其基因结构 [J]. 生物技术通报, (3):5-10.]
CHANG TJ, ZHU Z, 2002b. Study advances of plant metallothionein expression characteristics and functions of plant MT gene [J]. Biotechnol Inform, 18(5):1-6. [常团结,朱祯,2002b. 植物金属硫蛋白研究进展二: 植物MT基因的表达特征及其功能 [J]. 生物技术通报,18(5):1-6.]
CHARBONNEL-CAMPAA L, LAUGA B, COMBES D, 2000. Isolation of a type 2 metallothionein-like gene preferentially expressed in the tapetum in Zea mays [J]. Gene, 254:199-208.
CHU C, ZHOU QX. 2009. Researching advance in metallothionein and its biomarker of heavy metal contamination [J]. J Agro-Environ Sci, 28(3):425-432. [陈春,周启星,2009. 金属硫蛋白作为重金属污染生物标志物的研究进展 [J] . 农业环境科学学报, 28(3):425-432.]
COBBETT C, GOLDSBROUGH P, 2002. Phytochelatins and metallothioneins: roles in heavy metal detoxification and homeostasis [J]. Ann Rev Plant Biol, 53:159-182.
FAN LM, LIU GS, LIU CL, et al, 2011. Cloning and bioinformatic analysis of metallothionein-like protein gene (MdFjMT2) from apple (Malusdomestica) [J]. J Plant Genet Resour, 12(5):782-789. [樊连梅,刘更森,刘成连,等,2011. 苹果金属硫蛋白基因MdFjMT2克隆及生物信息学分析 [J]. 植物遗传资源学报,12(5):782-789.]
FIDALGO F, AZENHA M, SILVA AF, et al, 2013. Copper-induced stress inSolanumnigrumL. and antioxidant defense system responses [J]. Food Energy Sec, 2:70-80.
GEOURJON C, DELEAGE G, 1995. SOPMA: significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments [J]. Bioinformatics, 11(6):681-684.
HAMER DL, 1986. Metallothionein [J]. Ann Rev Biochem, 55:913-951.
HEGELUND JN, SCHILLER M, KICHEY T, et al, 2012. Barley metallothioneins: MT3 and MT4 are localized in the grain aleurone layer and show differential zinc binding [J]. Plant Physiol, 159:1 125-1 137.
JORDI D, GISELA M, GEMMA H, et al, 2006. Plant metallothionein domains: functional insight into physiological metal binding and protein folding [J]. Biochimie, 88:583-593.
KUMAR CHATURVEDI A, MISHRA A, TIWARI V, et al, 2012. Cloning and transcript analysis of type 2 metallothionein gene (SbMT-2) from extreme halophyteSalicorniabrachiataand its heterologous expression inE.coli[J]. Gene, 499(2):280-287.KYTE J, DOOLITTLE RF, 1982. A simple method for displaying the hydropathic character of a protein [J]. J Mol Biol, 157:105-132.
LI W, ZHANG J, ZHANG XY, et al, 2001. Research of resistance and accumulation to lead in mutant αα Petunia of transgenic metallothionein gene [J]. Prog Biochem Biophys, 28(3):405-407. [李伟,张竞,张晓钰,2001. 转金属硫蛋白αα突变体基因的矮牵牛对铅的抗性及积累的研究 [J]. 生物化学与生物物理进展,28(3):405-407.]
LIU X, CHEN J, WANG GH, et al, 2016. Hydrogen sulfide alleviates zinc toxicity by reducing zinc uptake and regulating genes expression of antioxidative enzymes and metallothioneins in roots of the cadmium/zinc hyperaccumulatorSolanumnigrumL. [J]. Plant Soil, 400:177-192.
LIU Y, CHEN SH, YIN HB, et al, 2011. The cloning and expression analysis of metallothionein ofLimoniumsinenseKuntzeunder high salt stress [J]. J Yantai Univ: Nat Sci Engin Ed, 24(2):121-125. [刘瑜,陈世华,尹海波,2011. 中华补血草金属硫蛋白基因的克隆及高盐处理下的表达模式分析 [J]. 烟台大学学报·自然科学与工程版,24(2):121-125.]
MENG HE, LIU ZY, 2014. Research advance of plant metallothioneins [J]. Guangdong Agric Sci, 15:133-138. [孟红恩,刘忠渊,2014. 植物金属硫蛋白研究进展 [J]. 广东农业科学, 15:133-138.]
NATHALIE ALM, HASSINEN VH, HAKVOORT HWJ, 2001. Enhanced copper tolerance inSilenevulgaris(Moench) garcke populations from coppermines is associated with increased transcript levels of a 2b_type metallothione in gene [J]. Plant Physiol, 126(10):1 519-1 526.
PETERSEN TN, BRUNAK S, von HEIJNE G, et al, 2011. SignalP 4.0: discriminating signal peptides from transmembrane regions [J]. Nat Meth, 8(10):785-786.
RODRIGUEZ-LLORENTE ID, PEREZ-PALACIOS P, DOUKKALI B, et al. 2010. Expression of the seed-specific metallothionein mt4a in plant vegetative tissues increases Cu and Zn tolerance [J]. Plant Sci, 178(3):327-332.
SEKHAR K, PRIYANKA B, REDDY VD, 2011. Metallothionein 1 (CcMT1) of pigeonpea (CajanuscajanL.) confers enhanced tolerance to coppe and cadmium inEscherichiacoliandArabidopsisthaliana[J]. Environ Exp Bot, 72(2):131-139.
SU J, ZHONG C, DING W, et al, 2013. Expression of auxin-repressed protein gene in ‘Dangshansuli’ pear leaves with different degrees of iron-deficiency [J]. Acta Bot Boreal-Occident Sin, 33(2):240-246. [苏军,钟晨,丁伟,等,2013. 砀山酥梨不同程度缺铁叶片生长素抑制蛋白基因表达分析 [J]. 西北植物学报, 33(2):240-246.]
TEIXEIRA J, FERRAZ P, ALMEIDA A, et al, 2013. Metallothionein multigene family expression is differentially affected by chromium (III) and (VI) inSolanumnigrumL. plants [J]. Food Energy Sec, 2:130-140.
TURCHI A, TAMANTINIB I, CAMUSSIA AM, et al, 2012. Expression of a metallothionein A1 gene ofPisumsativumin white poplar enhances tolerance and accumulation of zinc and copper [J].PlantSci, 183:50-56.
WALKER JM, 2005. The proteomics protocols handbook [M]. New York: Humana Press:571-607.
WANG XQ, ZHANG HT, SHAN L, et al, 2006. Advance in plant metallothionein and its heavy metal detoxification mechanisms [J]. Hereditas, 28(3):375-382. [全先庆,张洪涛,单雷,2006. 植物金属硫蛋白及其重金属解毒机制研究进展 [J]. 遗传,28(3):375-382.]
XINJIANG FLORA EDITORIAL, 1994. Xinjiang Flora: Ⅱ [M]. Urumqi: Xinjiang Science and Technology Publishing:107-109. [新疆植物志编委会,1994. 新疆植物志: 第2卷 [M]. 乌鲁木齐: 新疆科技卫生出版: 107-109.]
YAN H, ZHAO W, QIN FM, et al, 2006. The effect of salt stress on seed germination and seedling growth inKochiasieversianaand Kochia scoparia [J]. J NE Normal Univ: Nat Sci Ed, 38(4): 117-123. [颜宏,赵伟,秦峰梅,2006. 盐碱胁迫对碱地肤、地肤种子萌发以及幼苗生长的影响 [J]. 东北师大学报·自然科学版,38( 4):117-123.]
ZHANG Y, YANG CP, 2006. Study advances of metallothionein [J]. Mol Plant Breed, 4(3):73-78. [张艳,杨传平,2006. 金属硫蛋白的研究进展 [J]. 分子植物育种,4(3):73-78.]ZHANG Y, YANG CP, WANG YC, 2007. Cloning and analysis of metallothioneins gene fromTamarixandrossowii[J]. Bull Bot Res, 27(3):293-296. [张艳,杨传平,王玉成,2007. 柽柳金属硫蛋白基因的克隆及序列分析 [J]. 植物研究, 27(3):293-296.]ZHAO ZW, CAO GH, LI T, 2013. Researching advance in metallothionein [J]. J Yunnan Univ: Nat Sci Ed, 35(3):390-398. [赵之伟,曹冠华,李涛,2013. 金属硫蛋白的研究进展 [J]. 云南大学学报·自然科学版,35(3):390-398.]
Cloning and construction of plant expression vector ofNeMT2 gene inNanophytonerinaceum
GEFeng-Wei,ZENGWei-Jun,LIYan-Hong,ZHAOHui-Xin*
( Xinjiang Key Laboratory of Special Species Conservation and Regulatory Biology,College of Life Sciences, Xinjiang Normal University,Urumqi830054 )
Nanophytonerinaceumhas a long living history at Aletai Copper Mine in Xinjiang. In order to analyze the relation between metallothionein gene and heavy metal response stress, a new heavy metal-responsive gene cDNA sequence was successfully cloned by RACE (Rapid amplification of cDNA ends) fromN.erinaceum. The gene was named asNeMT2, and its accession number in GenBank was KT835290. The metallothionein geneNeMT2 was 590 bp in full length, and it had 237 bp ORF (open reading frame) which encoded 78 amino acid residues. There were 14 Cys residues, arranged in the form of C-C, C-X-C and C-X-X-C, in the 78 amino acid residues, and these Cys residues distributed in N terminal and C terminal of peptides. The protein encoding by geneNeMT2 molecular weight was 7.603 6 kD and its isoelectric point was 4.71. Phylogenetic analysis results demonstrated that the deduced amino acid sequence of geneNeMT2 was the highest homology as theSalicorniabrachiata(AEF01492) and theHalostachyscaspica(AHI62953), secondly theBetavulgaris(XP_010667708.1), but the lowest similarity with theNelumbonucifera(XP_010253171). Bioinformation analysis showed that metallothionein NeMT2 had no signal peptide and belonged to the hydrophilic non-transmembrane protein. Hydrophobicity analysis was carried out and the results showed that there was a strong hydrophobicity region between 35 to 45 amino acids, and the 41 Asp had the strongest hydrophobic property (1.444). Predication of structure indicated that random coil was the major components of its secondary structure. Expression analysis ofNeMT2 gene was carried out by RT-PCR. The results showed that expression ofNeMT2 gene was detected both in Copper Mine and nor Copper Mine inNanophytonerinaceumleaves, but the former was more stronger than the latter, which indicated thatNeMT2 gene was responsive to the heavy metal stress. ThenNeMT2 gene inNanophytonerinaceumwas cloned into 35S promoter downstream of plant over-expression vector pCAMBIA1300 in orientation. The plant overexpression vector pCAMBIA1300+NeMT2 was successfully constructed. These findings will provide information for the functional study ofNeMT2 and its molecular mechanism in repnse to the heavy metal stress.
Nanophytonerinaceum,NeMT2, rapid amplification of cDNA ends, sequence analysis, plant expression vector
10.11931/guihaia.gxzw201601029葛风伟, 曾卫军, 李艳红, 等. 小蓬NeMT2基因的克隆及其植物表达载体的构建 [J]. 广西植物, 2016, 36(8):897-905
GE FW, ZENG WJ, LI YH, et al. Cloning and construction of plant expression vector ofNeMT2 gene inNanophytonerinaceum[J]. Guihaia, 2016, 36(8):897-905
2016-01-19
2016-04-21
新疆维吾尔自治区自然科学基金(2013211A024)[Supported by the Natural Science Foundation of Xinjiang (2013211A024)]。
葛风伟(1976-),女,江苏新沂人,博士,讲师,从事植物逆境分子生物学研究,(E-mail)mastergfw@163.com。
赵惠新,博士,副教授,从事植物逆境分子生物学研究,(E-mail)954843437@qq.com。
Q786
A
1000-3142(2016)08-0897-09

