高压氧对神经病理性痛大鼠疼痛行为学及脊髓背角NOS表达的影响
田刚 涂青梅 郑敏 罗兴均 代梦含 冉然 罗俊杰
·论著·
高压氧对神经病理性痛大鼠疼痛行为学及脊髓背角NOS表达的影响
田刚涂青梅郑敏罗兴均代梦含冉然罗俊杰
目的观察高压氧对神经病理性痛大鼠疼痛行为学及脊髓背角NOS表达的影响。方法成年雄性SD大鼠32只,随机分成4组,每组8只,包括:假手术组(S组)、坐骨神经结扎组(CCI组)、HBO预处理组(pre-HBO组)和HBO后处理组(post-HBO组)。所有大鼠CCI术前1 d测量机械痛阈值基线(MWT)。CCI术后第1、2、3、7、14、21和第28天观察疼痛反应行为,测量MWT。CCI术后第28天,对脊髓背角中nNOS、 eNOS及 iNOS阳性神经元进行计数。结果CCI术前4组MWT值无明显差异(P>0.05)。每个时间点,与S组比较,pre-HBO、post-HBO和CCI组MWT值明显降低(P<0.05),且CCI组下降幅度最大。每个时间点,与CCI组比较,pre-HBO组和post-HBO组MWT值明显高于CCI组(P< 0.05)。与S组比较,CCI后第28天CCI组、pre-HBO组和post-HBO组大鼠脊髓nNOS和 iNOS 阳性神经元数量明显增多(P< 0.05)。CCI组大鼠脊髓nNOS和 iNOS阳性神经元数量明显高于pre-HBO组和post-HBO组(P< 0.05)。4组大鼠脊髓eNOS阳性神经元数量未见明显差异(P>0.05)。结论高压氧对神经痛的发生有预防和治疗作用,可能通过降低NOS的表达缓解疼痛。
高压氧;神经病理性痛;疼痛行为学;一氧化氮合酶
神经病理性痛是由躯体感觉神经系统的损伤和疾病引起,其基础是中枢神经系统痛觉过敏。周围神经损伤诱发各种免疫炎性因子的释放,如白介素(IL)-1β、肿瘤坏死因子-α(TNF-α)和IL-6,激活各种细胞内信号分子导致痛觉过敏[1,2]。由于该种疾病的复杂性,当前神经病理性痛的治疗并不令人满意,超过 2/3 的患者不能获得有效的减轻疼痛的治疗[3]。因此,寻找一种新的有效的治疗方法是神经病理性痛领域的一个重要课题。高压氧(hyperbaric oxygen,HBO)可以增强抗氧化活性,加快自由基的清除,提高血氧含量,改善微循环和修复受伤的神经组织。近年来,HBO一直被用于治疗纤维肌痛、复杂区域疼痛综合征、痉挛性头痛和放疗后疼痛[4]。但其对神经病理性痛的影响方面研究较少。对于外周神经损伤引起的神经病理性痛,一氧化氮合酶(nitric oxide synthase,NOS)在受伤神经和相应脊髓起着重要的疼痛调节作用。本项研究旨在观察高压氧对神经病理性痛大鼠疼痛行为学及脊髓背角NOS表达的影响,并确定其对神经病理性痛的治疗效果和作用机制。
1 材料与方法
1.1实验动物与分组成年雄性SD大鼠32只,体重280~350 g,由湖北医药学院实验动物中心提供,随机分成4组,每组8只,包括:假手术组(S组),坐骨神经暴露但不结扎,不进行HBO治疗;坐骨神经结扎组(CCI组),坐骨神经结扎,但不进行HBO治疗;HBO预处理组(pre-HBO组), CCI术前12 h行HBO治疗;HBO后处理组(post-HBO组),CCI术后12 h行HBO治疗。
1.2实验过程所有大鼠CCI术前1 d测量机械痛阈值(mechanical withdrawal threshold,MWT)基线。pre-HBO组大鼠当晚暴露于HBO中。次日上午,所有大鼠行CCI或假手术。手术当晚post-HBO组暴露于HBO中。CCI术后第1、2、3、7、14、21、28天,post-HBO组行HBO治疗,治疗12 h后观察大鼠疼痛反应行为。
1.3CCI模型制备大鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,参照 Bennett 等[5]方法建立 CCI 模型。右下肢后外侧切口确认坐骨神经干,用4-0铬肠线松散结扎右侧坐骨神经,在坐骨神经外膜产生轻微压力,即在神经分布区域产生短暂肌肉收缩,缝合皮肤。意识恢复后大鼠回到笼中。S组大鼠坐骨神经暴露但不结扎。
1.4HBO治疗CCI前12 h或后12 h,pre-HBO或post-HBO组大鼠分别被置于高压氧仓。进舱后先用纯氧充分洗舱10 min,替换舱内空气,使舱内氧浓度≥90%。HBO治疗参数为 0.25 MPa,纯氧通气10 min后,治疗时间为60 min。加压和减压时间为 10 min(以 0.0125 MPa/min的速率匀速增减舱内压力),30 min 内减至正常压力。
1.5标本制备CCI 后第28天,1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,从左心室插管至升主动脉,灌注0.9%氯化钠溶液,直到无红灌流液流出。之后灌注含4%多聚甲醛,0.1 mol/L的磷酸盐缓冲液(PBS,pH值7.4)。灌注结束取 L4~L6 段脊髓,4%多聚甲醛浸泡,4℃固定过夜。用4%多聚甲醛固定新鲜标本4 h,切片厚度40 μm,嵌入石蜡脱水。PBS清洗切片3次,分别加入3%的H2O2和30%的封闭血清。10 min后,分别加入神经元型一氧化氮合酶(nNOS),内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶 (iNOS)抗体,4℃切片孵化48 h。PBS清洗切片3次,二抗37℃孵育1.5 h(羊抗免IgG)。PBS清洗切片3次,加入辣根过氧化物酶标记的链霉亲和素,37℃孵育1.5 h。PBS清洗切片,二氨基联苯胺显色,酒精脱水,二甲苯透明化,树胶密封,显微镜下观察。在阴性对照试验中,PBS取代主要抗体,无阳性神经元呈现。
1.6观察项目根据Dixon描述的方法,使用Von-Frey 纤维细丝测量MWT[6]。大鼠置于测试箱,适应环境30 min,后爪趾面放置Von-Frey 纤维细丝6~8 s,观察后爪退缩反应。每段脊髓从5个切片中选择1个切片,对nNOS、 eNOS及 iNOS阳性神经元进行计数。每只大鼠取四张切片以确定阳性细胞的数量。

2 结果
2.1一般行为学CCI术后第3天,除S组,其余大鼠右下肢脚趾彼此靠拢,伴随背屈、外翻及不负重等动作。CCI组大鼠与测痛仪表面接触的膝关节出现跛行,右脚脚掌偶尔悬空。CCI术后第14天,肌肉明显萎缩,大鼠出现舔爪或摆动患肢动作。
2.2各时间点4组大鼠MWT值变化CCI术前各组MWT无明显差异。每个时间点,与S组比较,pre-HBO、post-HBO和CCI组MWT值明显降低(P<0.05),且CCI组MWT值下降幅度最大。每个时间点,与CCI组比较,pre-HBO组MWT值明显高于CCI组(P<0.05),表明HBO对神经痛的发生有预防作用。CCI术后第1~21天,与CCI组比较,post-HBO组MWT值明显高于CCI组(P<0.05),表明HBO对神经痛有治疗作用。基于这2个最新发现,表明HBO预处理比HBO后处理更有效。见表1。
2.34组大鼠脊髓背角nNOS、iNOS和eNOS阳性细胞数比较
2.3.1nNOS和iNOS变化:与S组比较,CCI后第28天CCI组、pre-HBO组和post-HBO组大鼠脊髓nNOS和 iNOS阳性神经元数量明显增多(P< 0.05);CCI组大鼠脊髓nNOS和iNOS阳性神经元数量明显高于pre-HBO组和post-HBO组(P< 0.05)。见图1、2,表2。
2.3.2eNOS变化:CCI后第28天,4组大鼠脊髓eNOS
组别前1d第1天第2天第3天第7天第14天第21天第28天S组9.8±2.39.2±2.58.8±1.98.3±2.18.6±1.88.7±2.09.0±1.89.0±2.1CCI组9.9±2.54.0±2.3*3.6±1.9*2.4±1.6*2.5±1.6*2.8±1.7*4.1±1.7*4.3±2.2*pre-HBO组10.2±2.47.1±2.1*#7.0±1.5*#6.3±1.6*#7.4±1.8*#7.0±2.7*#6.5±1.7*#6.1±2.1*#post-HBO组9.8±2.16.1±2.1*#6.0±1.6*#5.5±1.5*#6.3±1.7*#5.9±2.2*#4.7±1.6*#4.8±2.3*#
注:与S组比较,*P<0.05;与CCI组比较,#P<0.05
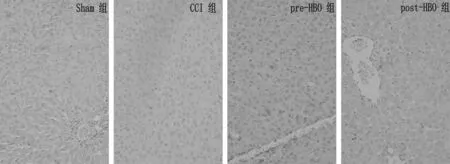
图1 4组大鼠脊髓背角免疫组化切片中nNOS阳性神经元的表达
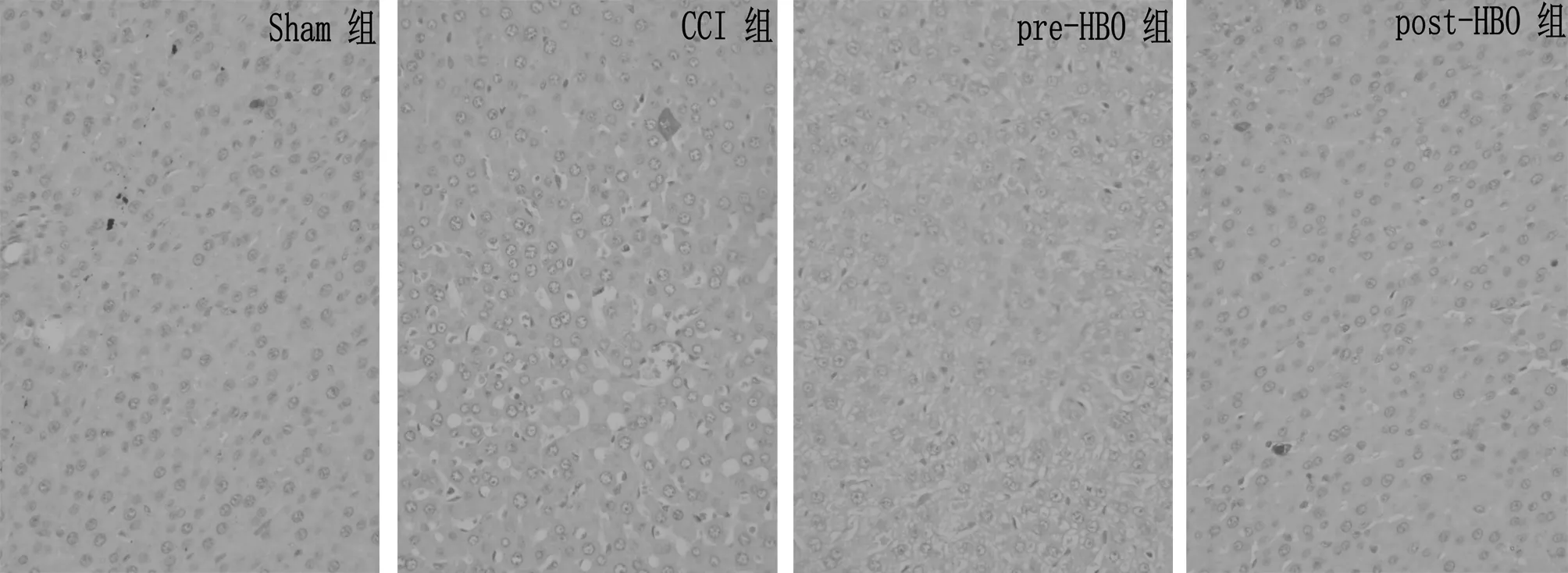
图2 4组大鼠脊髓背角免疫组化切片中iNOS阳性神经元的表达
阳性神经元数量未见明显增多,CCI组、pre-HBO组和post-HBO组组间比较,大鼠脊髓eNOS阳性神经元数量未见明显差异(P>0.05)。见图3,表2。
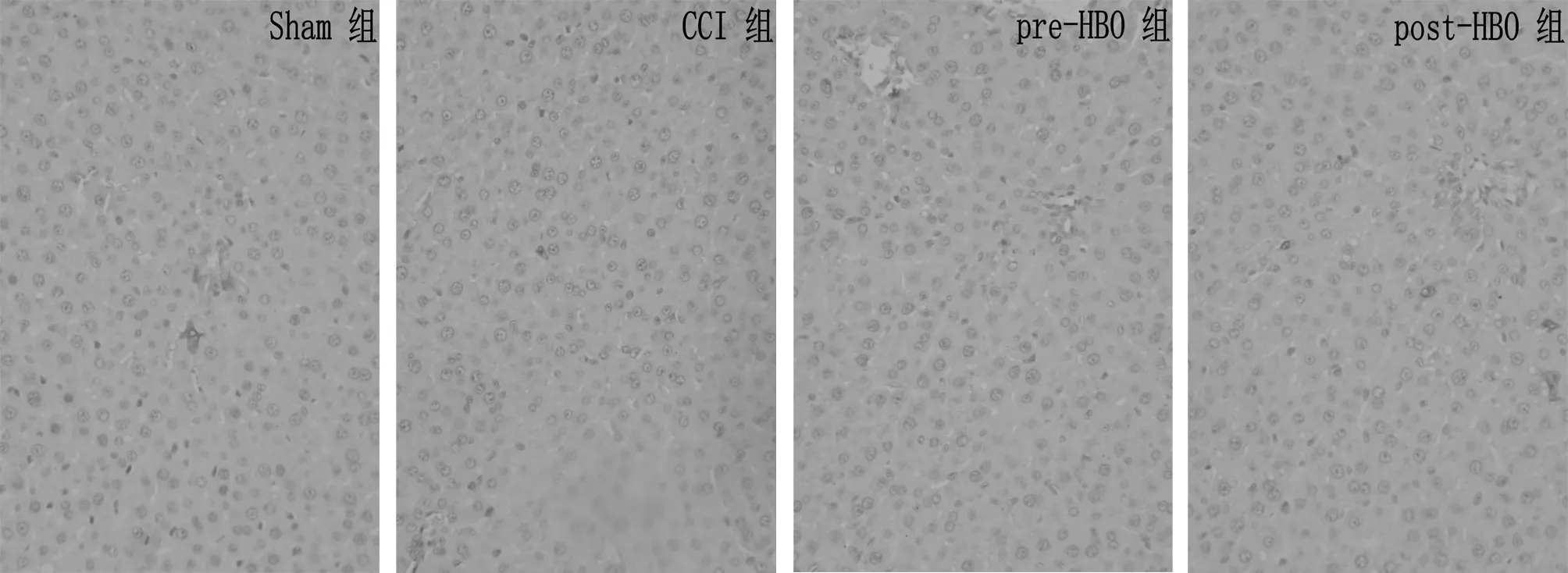
图3 4组大鼠脊髓背角免疫组化切片中eNOS阳性神经元的表达
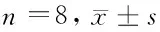

组别nNOS阳性细胞数iNOS阳性细胞数eNOS阳性细胞数S组9.49±2.2111.25±3.7218.54±2.23CCI组48.54±3.20*42.54±4.32*22.43±2.78pre-HBO组28.84±3.35*#28.52±4.12*#21.68±3.05post-HBO组32.86±2.88*#30.74±3.85*#21.34±3.18
注:与 S组比较,*P<0.05;与CCI组比较,#P<0.05
3 讨论
神经病理性疼痛是由中枢或周围神经系统损伤或系统功能障碍引起的慢性疼痛疾病, 是临床治疗的一大难题,严重影响了人们的生活质量,表现为自发性疼痛,痛觉过敏和触诱发痛。神经痛引起中枢神经系统变化,导致痛觉过敏[7-9],目前其发病机制仍不清楚,尚未找到有效的治疗方法,但发病率逐步上升,处理起来异常棘手。周围神经性疼痛最常见也最严重,阿片类药物治疗往往效果不佳。因此,神经痛仍然是疼痛治疗领域一个重要课题。
通过文献回顾和分析,不难发现:感觉神经损伤可能是神经病理性痛的根本病因。2011年,国际疼痛学会(IASP)对神经病理性疼痛疾病进行了重新定义:“神经病理性痛是由躯体感觉神经系统的损伤和疾病而直接造成的疼痛”。因此在感觉神经损伤后,若早期给予有效的保护或治疗,促进神经损伤“更好”地修复,可抑制神经损伤所致病理性痛的产生。即使对那些已经产生神经病理性痛的患者,运用具有神经保护的药物或手段,进一步治疗损伤,亦可缓解神经病理性痛。
HBO能增强抗氧化活性,减轻神经组织水肿,加速自由基的清除,增加血液中的氧含量,产生三磷酸腺苷,促进毛细血管再生和改善微循环[10],因此具有较强的神经保护作用,可促进受损神经的恢复。其神经保护作用机制可能是HBO有效增加血浆氧分压和提高组织氧含量;减轻神经组织水肿,改善神经组织缺氧,促进有氧新陈代谢和毛细血管再生;抑制炎性反应,防止白细胞聚集,减少TNF-α、IL-1和IL-6分泌[11]。
一氧化氮(nitric oxide,NO)是神经元细胞中新发现的一类神经递质,它由NOS催化而形成。在神经系统工作过程中,NOS是NO合成的关键作用酶。由外周神经损伤引起的神经病理性痛,NOS在受损神经和相应脊髓起着重要的疼痛调节作用。有研究表明,疼痛传入神经末梢释放大量谷氨酸,谷氨酸激活NMDA受体和NOS,从而增加兴奋性。NOS介导了NO的生成增加,反过来进一步提高谷氨酸的释放,并导致疼痛[12]。另有学者研究证实,通过调控NO水平,HBO对缺氧、缺血或一氧化碳中毒引起的脑损伤有预防和治疗作用[13]。HBO还可以激活内源性阿片肽,产生镇痛效应[11]。这些研究表明,高压氧治疗不仅可以改善氧供,纠正缺氧,还可调节免疫系统产生治疗效果。
nNOS和eNOS统称为结构型NOS,受钙离子调节,存在于正常组织,而iNOS则不受钙离子调节。在神经病理性痛中,脊髓中iNOS水平升高,转录和翻译后,在NO合成过程中起重要作用。因此,周围神经损伤后,iNOS在脊髓的表达增加可促进痛觉过敏。已经证实,神经病理痛大鼠模型中eNOS水平高于iNOS且eNOS对神经痛有调节作用[14,15]。nNOS受钙离子调节,有许多亚型,分别位于不同的细胞发挥不同的作用。一般来说,由于神经毒性作用,脊髓中的nNOS和iNOS可能是有害的,而在组织损伤后,周围神经中的eNOS经常是有益的。本研究发现,高压氧能有效降低脊髓背角nNOS和iNOS的表达水平,但未能改变eNOS的水平;因此,HBO可能通过调节脊髓背角nNOS和iNOS的表达减轻痛觉过敏。
CCI大鼠脊髓背角NOS阳性神经元表达增加,提示脊髓背角NOS阳性神经元在慢性神经性疼痛的中枢机制中起着重要作用。HBO可能通过降低NOS的表达缓解疼痛。本项研究中,HBO治疗只有一次,因此,HBO治疗的最佳频率尚有待探讨。
1Sacerdote P, Franchi S, Trovato AE. Transient early expression of TNF-alpha in sciatic nerve and dorsal root ganglia in a mouse model of painful peripheral neuropathy. Neurosci Lett,2008,436:210-213.
2Perez-Severiano F, Bermudez-Ocana DY. Spinal nerve ligation reduces nitric oxide synthase activity and expression: Effect of resveratrol. Pharmacol Biochem Behav,2008,90:742-747.
3Finnerup EM,Sindrup SH,Jensen TS.The evidence for pharmacological treatment of neuropathic pain. Pain,2010,150:573-581.
4Wilson HD, Toepfer VE, Senapati AK, et al. Hyperbaric oxygen treatment is comparable to acetylsalicylic acid treatment in an animal model of arthritis. J Pain,2007,8:924-930.
5Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain,1988,33:87-107.
6Dixon WJ. Efficient analysis of experimental observations. Ann Rev Pharmacol Toxicol,1980,20:441-462.
7Milligan ED, Watkins LR. Pathological and protective roles of glia in chronic pain. Nat Rev Neurosci,2009,10:23-36.
8Tan YH,Meng LX,Cui JJ.Changes and relationships of pain threshold and serum IL-6 in rats with sciatic nerve injury induced by chronic constriction.J China Med Univ,2005,34:431-432.
9Chen H,Meng LX,Cui JJ.Intrathecal injection of morphine and ketamine on the NMDAR1 mRNA expression in the spinal cord in a neuropathic pain rat model. Chinese J Anesthesiol,2008,28:644-647.
10Wilson HD, Wilson JR, Fuchs PN. Hyperbaric oxygen treatment decreases inflammation and mechanical hypersensitivity in an animal model of inflammatory pain. Brain Res,2006,1098:12612-12618.
11Zelinski LM, Ohgami Y, Chung E, et al. A prolonged nitric oxide-dependent, opioid-mediated antinociceptive effect of hyperbaric oxygen in mice. J Pain,2009,10:167-172.
12Przewlocki R, Machelska H, Przewlocka B. Inhibition of nitric oxide synthase enhances morphine antinociception in the rat spinal cord. Life Science,1993,53:PL1-5.
13Yu L,Fei L,Zhang HR.Effects of hyperbaric oxygen on free radical and ite scavenging system in the brain of mice with carbon monoxide poisoning. Chinese J Emerg Med,2004,13:441-443.
14Tanabe M, Nagatani Y, Saitoh K, et al. Pharmacological assessments of nitric oxide synthase isoforms and downstream diversity of NO signaling in the maintenance of thermal and mechanical hypersensitivity after peripheral nerve injury in mice. Neuropharmacology,2009,56:702-708.
15Han G,Li L,Meng L.Effects of hyperbaric oxygen on pain-related behaviours and nitric oxide synthase expression in a rat model of neuropathic pain.Pain Res manage,2013,18:137-141.
Effects of hyperbaric oxygen on pain-related behaviours and expression levels of nitric oxide synthase in rats with neuropathic pain
TIANGang*,TUQingmei,ZHENGMin*,etal.
*DepartmentofAnesthesia,People’sHospitalAffiliatedtoHubeiMedicineUniversity,Hubei,Wuhan442000,China
ObjectiveTo investigate the effects of hyperbaric oxygen (HBO) on pain-related behaviours and expression levels of nitric oxide synthase in rats with neuropathic pain.MethodsThirty-two male Sprague Dawley rats were randomly divided into four groups;sham operation group (group S),sciatic nerve ligation group (CCI group),HBO pretreatment group (pre-HBO group) and HBO post-treatment group (post-HBO group),with 8 rats in each group. The baseline mechanical withdrawal thresholds (MWT) were measured one day before CCI for all the rats.The pain-related behaviours were observed on 1d,2d,3d,7d,14d,21d,28d after CCI,and MWT was also measured.Moreover the numbers of nNOS, eNOS and iNOS positive neurons in cornu dorsale medullae spinalis were calculated on 28d after CCI.ResultsThere was no significant difference in MWT before CCI among the 4 groups (P>0.05).The MWT in pre-HBO group, post-HBO group and CCI group in every time point was significantly lower than that in group S (P<0.05),moreover,the decrease degree in CCI group was the most obvious (P<0.05). The MWT in pre-HBO group and post-HBO group in every time point was significantly higher than that in CCI group (P<0.05).As compared with those in group S,the numbers of nNOS and iNOS positive neurons in CCI group,pre-HBO group and post-HBO group on 28d after CCI were significantly increased (P<0.05).The numbers of nNOS and iNOS positive neurons in CCI group were significantly higher than those in pre-HBO group and post-HBO group (P<0.05).However there were no significant differences in numbers of eNOS positive neurons among 4 groups (P>0.05).ConclusionHBO has preventive and therapeutic effects on neuropathic pain,which can relieve pain,and its action mechanism may be correlated to the decrease of the expresion levels of NOS.
hyperbaric oxygen; neuropathic pain;pain ethology; nitric oxide synthase
10.3969/j.issn.1002-7386.2016.18.012
442000湖北省十堰市,湖北医药学院附属人民医院麻醉科(田刚、郑敏、罗兴均、代梦含、冉然),神经外科(罗俊杰);湖北医药学院附属太和医院药学部(涂青梅)
罗俊杰,442000湖北省十堰市,湖北医药学院附属人民医院麻醉科;
E-mail:luozunjie@163.com
R 441.1
A
1002-7386(2016)18-2765-04
2016-03-12)
项目来源:湖北省教育厅科学研究计划项目(编号:B2014052)

