葛根素在减轻创伤性脑损伤氧化应激反应中的作用
陈江生 陈保东 凌毕益 宋明浩 李志祥
·论著·
葛根素在减轻创伤性脑损伤氧化应激反应中的作用
陈江生陈保东凌毕益宋明浩李志祥
目的探究葛根素是否能有效减轻创伤性脑损伤(TBI)中的氧化应激反应。方法选择成年雄性SD大鼠60只构建TBI模型并随机平分为模型组,假手术组及葛根素给药组(给药组),每组20只。检测3组大鼠在不同时间点氧化应激相关指标[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、丙二醛(MDA)]活性及含量变化。结果氧化应激相关指标检测中,给药组与模型组比较,其中第3、7天SOD、CAT活性以及MDA、NO含量与同时间点模型组比较差异有统计学意义(P<0.05)。用药组与模型组比较,均能不同程度升高GSH含量及GSH-Px活性(P<0.05),其中给药组第3天及第7天GSH含量及GSH-Px活性较同时间点模型组比较差异有统计学意义(P<0.05)。结论根据对不同氧化应激指标检测所得结果可以看出葛根素可有效减轻创伤性脑损伤所带来的氧化应激损伤。
葛根素;创伤性脑损伤;氧化应激指标;氧化应激损伤
创伤性脑损伤(traumatic brain injury,TBI)是神经外科的常见病,有高发病率,高致残率和高病死率的特点[1],目前已成为影响人类健康的重要原因。已有研究表明,葛根素作为一种天然抗氧剂可有效减轻TBI动物模型中的神经功能缺损等情况[2,3],但其具体机制尚未得知,因此本研究通过建立经典TBI模型,研究在葛根素给药的条件下,检测脑内各种氧化应激相关指标的变化,以期了解葛根素是否通过清除氧自由基,有效减轻TBI中的氧化应激损伤。
1 材料与方法
1.1主要试剂及仪器超氧化物歧化酶试剂盒(SOD)、 谷胱甘肽过氧化物酶试剂盒 (GSH-Px), 过氧化氢酶试剂盒(CAT)、丙二醛试剂盒(MDA)(南京建成生物工程研究所,批号:20080829,20080801,20071129,20080801)。
1.2实验分组及TBI模型构建[4,5]选择健康成年雄性SD大鼠60只[广东省医学实验动物中心,许可证:SCXK(粤)2015-0035],体重250~300 g,将所选取SD大鼠分为模型组,假手术组及葛根素治疗组(给药组),每组20只。采用BenchmarkTM颅脑损伤撞击器制作TBI模型,将已禁食12 h的大鼠腹腔注入2%戊巴比妥(50 mg/kg)麻醉后,将老鼠俯卧固定于支架处开,将骨膜剥离,暴露出右顶骨。矢状缝中线旁开2.5 mm,在人字缝与冠状缝中钻一直径为5 mm骨孔,暴露出硬脑膜。于脑立体定位仪上安装电磁颅脑损伤撞击器的传动装置,经使用脑立体定位仪操纵臂使撞击头与鼠头矢状面呈80°,与冠状面平行呈垂直在大鼠硬脑膜上固定,使硬脑膜与撞击头末端相垂直。经撞击器设置,用5 mm直径的撞击头,且以 3 m/s 速度,2 mm打击深度,120 ms打击时间中制作中度TBI。后应立即将撞击器移除,缝合头皮切口。在出现自主呼吸恢复后,大鼠重新进入饲养笼,行损伤后观察,假手术大鼠手术与麻醉程序同上,但无冲击损伤过程。对于给药组的大鼠,在模型制作后15 min,腹腔注射葛根素(60 mg/kg)。
1.3测定方法及指标大鼠脑损伤12 h后,提取大鼠损伤侧皮层组织,置于冰上匀浆后,根据南京建成生物工程公司试剂盒说明书方法测定与氧化应激相关指标如 SOD、GSH-Px、CAT、MDA的含量[5]。

2 结果
2.13组不同时间点大鼠脑组织中SOD、CAT活性及MDA含量变化各个时间点模型组与假手术组相比,脑组织中SOD、CAT含量明显降低(P<0.05),MDA含量升高(P<0.05),NO含量降低(P<0.05),表明损伤使机体清除自由基能力下降,呈现氧化应激状态。随着实验时间的延长,模型组SOD及CAT活性上升及MDA含量降低,提示动物体内有一定的自身抗氧化作用。给药组与模型组比较,其中第3、7天SOD、CAT活性以及MDA、NO含量与同时间点模型组比较差异有统计学意义(P<0.05)。见表1、2,图1、2。
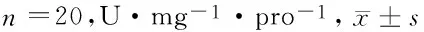

组别SOD1d3d6dCAT1d3d6d假手术组54.81±6.5953.66±7.1252.81±6.4396.12±66.2994.33±68.9193.00±66.33模型组32.26±4.53*35.75±5.80*40.96±7.12*70.23±59.20*72.08±60.22*79.64±60.58*给药组29.33±5.36*44.76±5.72#50.58±7.63#70.10±62.77*85.21±61.10#89.58±66.20#
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05
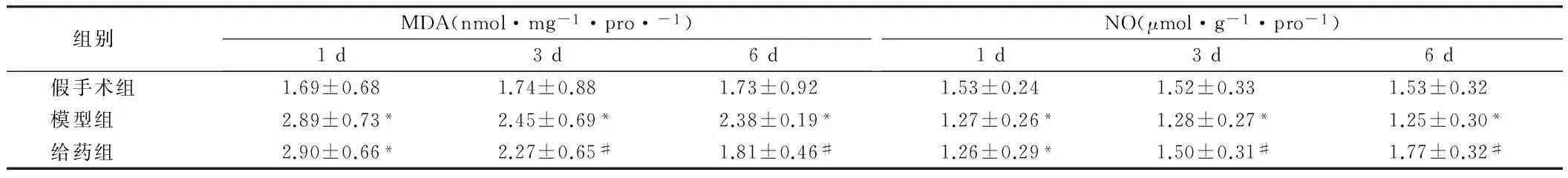
组别MDA(nmol·mg-1·pro·-1)1d3d6dNO(μmol·g-1·pro-1)1d3d6d假手术组1.69±0.681.74±0.881.73±0.921.53±0.241.52±0.331.53±0.32模型组2.89±0.73*2.45±0.69*2.38±0.19*1.27±0.26*1.28±0.27*1.25±0.30*给药组2.90±0.66*2.27±0.65#1.81±0.46#1.26±0.29*1.50±0.31#1.77±0.32#
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05
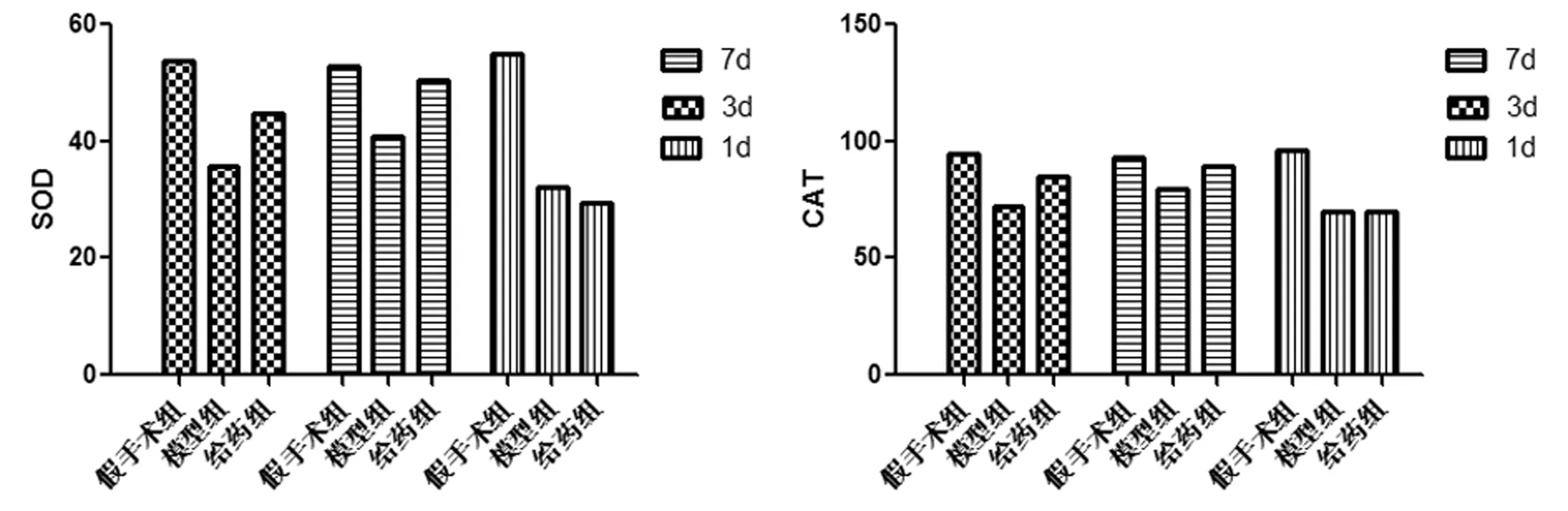
图1 不同时间点3组大鼠脑组织中SOD、CAT活性变化结果
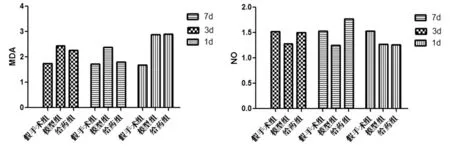
图2 不同时间点3组大鼠脑组织MDA、NO含量变化结果
2.2不同时间点3组大鼠脑组织GSH含量、GSH-Px活性各个时间点模型组与假手术组比,脑组织GSH含量及GSH-Px活性明显降(P<0.05),表明脑损伤造成机体清除自由基能力下降,呈现氧化应激状态。随着实验进程延长,模型组指标有上升趋势。各用药组与模型组比较,均能不同程度明显升高GSH含量及GSH-Px活性(P<0.05),其中给药组第3天第7天两指标均与与同时间点模型组比较差异有统计学意义(P<0.05)。见表3,图3。

组别GSH(nmol/mg)1d3d6dGSH-Px(U/mg)1d3d6d假手术组40.10±3.6839.82±1.2140.67±2.16200.31±34.67205.25±22.84192.89±31.32模型组29.76±3.22*31.15±3.74*33.92±3.30*139.41±26.10*148.27±19.09*161.58±36.41*给药组28.92±2.21*36.83±4.37#36.83±2.15#152.73±41.0*169.63±32.95#191.52±29.42#
注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05
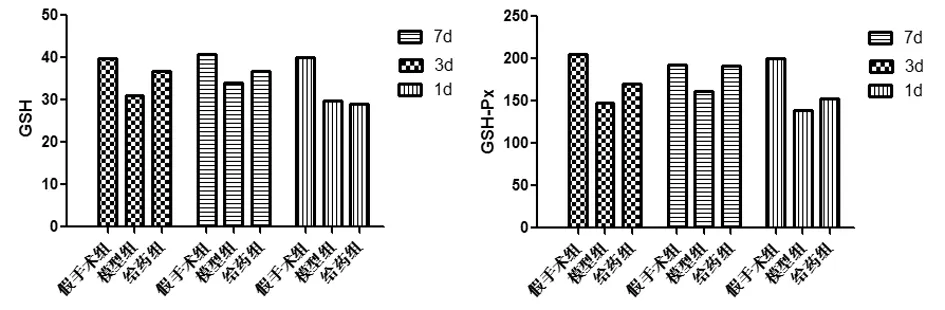
图3 不同时间点各组大鼠脑组织GSH含量和GSH-Px活性结果
3 讨论
TBI专指一类由外伤导致脑组织严重损害的疾病[6],近年来,很多研究表明,氧化应激在TBI中发挥着重要的作用[7]。TBI后,脑组织会发生缺血缺氧等一系列继发性症状,在此过程中会产生大量的氧自由基,当产生的ROS超过机体的抗氧化能力时,就会产生氧化应激反应,最终引起神经元的损伤。血管内皮是对氧化应激最敏感的部位,ROS主要通过对过氧化细胞膜上的脂质及其分解产物丙二醛(MDA)造成对血管内皮细胞的损伤,MDA通过增加胞内Ca2+浓度,消耗Ca2+内流所需ATP,降低一氧化氮的分泌,导致血管内皮功能受损[8]。MDA,NO的含量即可间接反映细胞受损伤的程度,因此本实验一一对各项指标进行检测。正常血管内皮细胞具有清除过量ROS并抗氧化的系统,包括CAT、GSH-Px[9]、SOD等多种抗氧化酶及自由基清除剂,这些抗氧化酶在血管内皮细胞受到氧化应激损伤时发挥重要的保护作用。GSH是人类细胞中自然合成的一种极其重要的非酶类抗氧化物质,可防止体内众多重要酶蛋白琉基被氧化。它可以作为GSH-Px催化反应中的底物,在GSH-Px的催化下使H2O2降解,也可以通过非酶促反应形式与氧自由基结合。从而发挥在氧化应激反应中保护生物大分子作用。本实验结果显示:模型组SOD及CAT活性上升及MDA含量降低,提示动物体内有一定的自身抗氧化作用。给药葛根素组与模型组比较,其中第3、7天SOD,CAT活性与同时间点模型组比活性升高且差异有统计学意义(P<0.05),第3、7天MDA,NO含量与同时间点模型组相比含量降低且各用药组与模型组比较,均能不同程度明显升高GSH含量及GSH-Px活性(P<0.05),这些结果均表明,给药葛根素后,葛根素可有效的激活体内SOD、CAT等酶的抗氧化活性,从而极大的降低了MDA对神经元等的损伤。氧化损伤的敏感性使得机体有一套内源性抗氧化酶防御体系用来调节体内的氧化还原平衡,近年来有研究显示Nrf2-ARE通路是细胞内重要的内源性抗氧化防御机制之一,且Nrf2是细胞调节该抗氧化防御机制的至关重要的转录因子,因此在接下来的研究中通过对模型组和葛根素治疗组中Nrf2蛋白的表达及观察Nrf2-ARE信号通路[10,11]下游抗氧化和解毒酶HO-1、NQO1的表达水平进行研究以探究葛根素通过何种信号通路来对抗氧化所带来的神经元等的损伤,为葛根素的后续研究能提供新的理论基础。
1Wei L,Fraser JL,Lu ZY,et al.Transplantation of hypoxia preconditioned bone marrow mesenchymal stem cells enhances angiogenesis and neurogenesis after cerebral ischemia in rats. Neurobiol Dis,2012,46:635-645.
2Sriram N,Kalayarasan S,Sudhandiran G.Epigallocatechin-3-gallateaugments Antioxidant activities and inhibits inflammation during bleomycin-induced experimental pulmonary fibrosis through Nrf2-Keapl signaling.Pulm Pharmacol Ther,2009,22:221-236.
3Afonyushkin T,Oskolkova OV,Philippova M,et al. Oxidized phospholipids regulate expression of ATF4 and VEGF in endothelialcells via NRF2-dependent mechanism: novel point of convergencebetween electrophilic and unfolded protein stress pathways.Arterioscler Thromb Vase Biol,2010,30:1007-1013.
4杨彦玲,陈雅慧.大鼠大脑中动脉线栓法制备局杜性脑缺血模型的研究现状.临床神经电生理学杂志,2007,16:374-376.
5Shuaib A,Butcher K,Mohammad AA,et al.Collateral blood vesselsin acute ischaemic stroke: a potential therapeutic target. Lancet Neurology,2011,10:909-921.
6Pizent A,Pavlovic M,Jurasovic J,et al.Antioxidants,trace elements andmetabolic Syndrome in elderly subjects.J Nutr Health Aging,2010,14:866-871.
7蔡雅卫,张岫美,魏欣冰.乙酰葛根素对低糖低氧/复供损伤大鼠大脑皮层神经元凋亡的影响.中国中医药科技,2013,20: 155-156.
8Leonarduzzi G,Sottero B,Poli G.Targeting tissue oxidative damage by means of eell signaling modulators:the antioxidant concept revisited. Pharmaeol Ther,2010,128:336-374.
9陈远寿,刘华庆,潘贵书,等.还原型谷腕甘肽对脑缺血大鼠海马神经元泛素蛋白结合物表达的影响.解放军医学杂志,2010,35:1205-1208.
10催俣,马海英,孔力. Nrf2/ARE 通路与机体抗氧化机制的研究进展.吉林大学学报医学版,2011,37:187.
11Chen G,Fang Q, Zhang J, et al. Role of the Nrf2-ARE pathway in early brain injury after experimental subarachnoid hemorrhage.J Neurosci Res,2011,89:515-523.
Effects of puerarin on oxidative stress injury in rats with traumatic brain injury
CHENJiangsheng*,CHENBaodong,LINGBiyi*,etal.
*DepartmentofNeurosurgery,SonggangPeople’sHospital,Bao’anDistrict,Guangdong,Shenzhen518105,China
ObjectiveTo investigate the effects of puerarin on oxidative stress injury in rats with traumatic brain injury (TBI).MethodsSixty adult male SD rats were randomly divided into model group, sham-operation group and puerarin medication group,with 30 rats in each group. The oxidative stress related indexes including superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), catalase (CAT), malondialdehyde (MDA) were detected in different time points for the three groups.ResultsThere were significant differences in the activities of SOD,CAT and the contents of MDA,NO on 3d,7d between model group and puerarin medication group (P<0.05).The contents of GSH and activities of GSH-Px in puerarin medication group were significantly increased,as compared with those in model group (P<0.05),moerover, there were significant differences in contents of GSH and activities of GSH-Px on 3d,7d between model group and puerarin medication group (P<0.05).ConclusionPuerarin can effectively decrease the oxidative stress injury caused by traumatic brain injury in rats.
puerarin; traumatic brain injury; oxidative stress indexes; oxidative stress damage
10.3969/j.issn.1002-7386.2016.18.007
518105广东省深圳市宝安区松岗人民医院神经外科(陈江生、凌毕益、宋明浩、李志祥);广东省深圳市第二人民医院神经外科(陈保东)
R 651.15
A
1002-7386(2016)18-2748-03
2016-02-26)
项目来源:深圳市科技创新委员会科技计划项目(编号:JCYJ20150403115305748)

