苯酚硫酸法测定萌发菌HL-003多糖方法的研究
郑朋朋,李 珊,张 保,杨正涛,戚丽蓉,黄 超,敖新宇(西南林业大学生命科学学院,云南昆明650224)
苯酚硫酸法测定萌发菌HL-003多糖方法的研究
郑朋朋,李 珊,张 保,杨正涛,戚丽蓉,黄 超,敖新宇*
(西南林业大学生命科学学院,云南昆明650224)
为确定苯酚硫酸法测定萌发菌HL-003多糖的最佳参数。选取苯酚浓度和浓硫酸量为自变量,检测不同苯酚浓度和浓硫酸量下的最大吸收波长和吸光值,从而确定最佳的苯酚浓度和浓硫酸量,在此基础上检验方法的显色时间、精密度、线性范围和回收率。结果表明:最佳苯酚浓度为5%,浓硫酸量为3.5 mL,最大吸收波长为488 nm,显色时间15 min;葡萄糖浓度在0~200 mg/mL范围内线性良好;在优化方法下进行精密度实验,葡萄糖、胞内多糖和发酵液多糖测定结果的相对标准偏差(RSD)分别为0.474%、1.015%和0.712%,测定结果稳定可靠;本方法对葡萄糖和葡聚糖的回收率均在99.10%以上,回收率高,与真实值吻合;通过测定,萌发菌HL-003胞内和发酵液多糖的含量分别为2.028% 和2.998 g/L。
苯酚硫酸法,萌发菌HL-003,多糖
真菌多糖是指各种真菌的子实体和菌丝体等所产生的一类高分子化合物[1-3]。国内外已从高等担子菌中筛选到几百种具有生物活性的多糖物质,目前真菌多糖类保健品已有上百种之多[4-5]。真菌多糖可应用于人类的疾病治疗和保健,具有调节机体免疫力、抗肿瘤、抗病毒、抗氧化、抗辐射、抗衰老、健胃保肝、降血糖、血脂、血压等多种功能[6-8]。
萌发菌HL-003是天麻的萌发菌,为真菌界担子菌门小菇属(Mycena sp.),属于高等担子菌[9-11]。其中萌发菌胞内多糖具有镇痛消炎、抗肿瘤、抗菌等生物活性[12-14]。
文献报道中,多糖的测定方法主要分为苯酚硫酸法和蒽酮比色法[15-17],本研究针对苯酚硫酸法进行研究。在不同文献中所使用的方法原理均相同,但在苯酚浓度、浓硫酸量、测定波长和显色时间上存在差异性,没有一个确定的规范,不能很好地进行比较、检验和使用。本文针对以葡萄糖为标准品苯酚硫酸法测定多糖中的参数进行研究。选取苯酚浓度和浓硫酸量为自变量,检测不同浓硫酸量和苯酚浓度下反应的最大吸收波长和吸光值,在此基础上检验方法的显色稳定时间、精密度、线性范围和回收率,从而确定苯酚硫酸法测定萌发菌HL-003多糖的最佳参数。
1 材料与方法
1.1 材料与仪器
萌发菌HL-003菌株 由西南林业大学生命科学学院生化教研组提供,对菌株进行活化扩繁和液体发酵培养,得到萌发菌HL-003菌丝体与发酵液;葡聚糖G-10 Sigma公司;乙醇、浓硫酸、苯酚、葡萄糖 AR,国药集团化学试剂有限公司。
DHG-9240A型电热恒温鼓风干燥箱、HWS-12水浴锅 上海一恒科学仪器有限公司;M20粉碎机KIKA-WERKE公司;BS224S电子天平 SARTORIUS公司;5430R离心机 Eppendorf公司;TU-1901紫外分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 苯酚硫酸法方法的优化 由于在测定过程中,样品浓度和苯酚浓度是可变的,为了不重复讨论变量对测定结果的影响,将样品量和苯酚量固定在1.0 mL。在实验中,选用蒸馏水和50 μg/mL葡萄糖溶液作为供试样品,同时检测不同情况下的最大吸收波长和吸光值。
1.2.1.1 苯酚浓度的确定 取50 μg/mL葡萄糖溶液1.0 mL到10支具塞试管中,分别加入1%、2%、3%、4%、5%、6%、7%、8%、9%、10%的苯酚1.0 mL,再加入98%的浓硫酸4.0 mL,反应20 min后,在400~600 nm波长范围内扫描最大吸收波长,并在最大吸收波长下测定吸光值。对照组用1.0 mL蒸馏水替代葡萄糖溶液,其他操作相同。
1.2.1.2 浓硫酸量的确定 取50 μg/mL葡萄糖溶液各1.0 mL到8支具塞试管中,加入5%苯酚1.0 mL,再分别加入2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5 mL的浓硫酸,反应20 min后,在400~600 nm波长范围内扫描最大吸收波长,并在最大吸收波长下测定吸光值。对照组用1.0 mL蒸馏水替代葡萄糖溶液,其他操作相同。
1.2.1.3 显色时间的确定 取30 μg/mL葡萄糖溶液1.0 mL于试管中,再依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后,迅速倒入比色皿,在488 nm下进行时间扫描,扫描100 min。
1.2.1.4 精密度实验 分别取萌发菌HL-003胞内、胞外多糖待测液和50 μg/mL的葡萄糖溶液1.0 mL于三只试管中,再分别依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后反应15 min,在488 nm下测定吸光值,每组6个重复。
1.2.1.5 线性范围的确定 准确配制500 μg/mL的葡萄糖储备液,将储备液稀释成0、50、100、150、200、250、300、350、400 μg/mL的葡萄糖标准溶液,取各浓度葡萄糖标准溶液1.0 mL,分别依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后反应15 min,在488 nm下测定吸光值,以葡萄糖浓度为横坐标,吸光值为纵坐标绘曲线。
在确定一定的线性范围后,将500 μg/mL的葡萄糖储备液稀释5倍得到100 μg/mL的葡萄糖标准液,再精确配制0、10、20、30、40、50、60 μg/mL的标准葡萄糖溶液,取各浓度葡萄糖标准溶液1.0 mL,分别依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后反应15 min,在488 nm下测定吸光值,以葡萄糖浓度为横坐标,吸光值为纵坐标绘制葡萄糖标准曲线。
1.2.1.6 回收率实验 配制20、40、60 μg/mL的标准葡聚糖溶液和10、30、50 μg/mL的葡萄糖溶液,取不同浓度的标准葡聚糖溶液和葡萄糖溶液各1.0 mL,分别依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后反应15 min,在488 nm下测定吸光值,每组6个重复。
1.2.2 萌发菌HL-003多糖的提取与测定
1.2.2.1 胞内多糖的提取[18]准确称取菌丝体1 g,置于50 mL的离心管中,加入42 mL蒸馏水,在功率为520 W下超声处理19 min后,在72℃电热恒温水浴中浸提2.2 h;5000 r/min离心15 min,将上清液真空旋转蒸发浓缩为5 mL后,加20 mL无水乙醇,4℃静置沉淀15 h;6000 r/min离心10 min,收集多糖沉淀,将沉淀复溶于水中,定容到100 mL待测。
1.2.2.2 发酵液多糖的提取 接种萌发菌HL-003固体培养菌块于液体发酵培养基,在室温条件下,120 r/min摇床上培养18 d,用4层纱布过滤,得到发酵液。准确移取10 mL发酵液,置于50 mL的离心管中,加30 mL无水乙醇,4℃静置沉淀15 h;6000 r/min离心10 min,收集多糖沉淀,将沉淀复溶于水中,定容到100 mL待测。
1.2.2.3 萌发菌 HL-003多糖的测定 胞内多糖待测液和发酵液多糖待测液稀释10倍后,分别取1.0 mL,再依次加入5.0%苯酚1.0 mL,浓硫酸3.5 mL,摇匀后反应15 min,在488 nm下测定吸光值。根据标准曲线方程A=0.19839+0.01292C得到多糖含量计算公式,多糖含量的计算按照(1)和(2)进行。

式中:A为胞内多糖待测液稀释溶液后吸光值;k为稀释倍数,本文k为10。
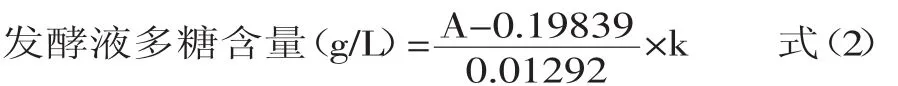
式中:A为发酵液多糖待测液稀释溶液后吸光值;k为稀释倍数,本文k为10。
1.2.3 数据处理 运用Origin 7.5软件对1.2.1和1.2.2中所测定的数据进行数据分析和作图。
2 结果与分析
2.1 苯酚浓度法方法优化
2.1.1 苯酚浓度的确定 不同苯酚浓度对测定结果的影响如图1所示,由图1(A)可知:苯酚浓度小于5%时,随苯酚浓度增加葡萄糖溶液的最大吸收波长逐渐增大,最大为489 nm;5%~9%浓度范围内葡萄糖溶液的最大吸收波长维持在489 nm,大于9%时葡萄糖溶液的最大吸收波长开始增大。苯酚浓度为1%~3%时蒸馏水的最大吸收波长减小1 nm,3%~7%范围内蒸馏水的最大吸收波长维持在490 nm,苯酚浓度继续增加,蒸馏水的最大吸收波长又开始减小。

图1 苯酚浓度对最大波长和吸光值的影响Fig.1 Effect of phenol concentration on the maximum wavelength and absorbance values
由图1(B)可知:随着苯酚浓度增大,葡糖糖溶液的吸光值不断增加,苯酚浓度从1%~5%时,葡萄糖溶液的吸光值与苯酚浓度呈现正相关性,当苯酚浓度大于5%之后,葡萄糖溶液的吸光值不继续增加,而是在一定范围内波动;对于蒸馏水,整体来看,苯酚浓度的增大,吸光值有所增加,但是增加的辐度不明显,整体趋势和葡萄糖溶液的相似;综合对图1的结果分析,5%的苯酚是最佳的苯酚浓度。
2.1.2 浓硫酸量的确定 不同浓硫酸量对测定结果的影响如图2所示。由图2(A)可知,浓硫酸量从2~3.5 mL时,蒸馏水的最大吸收波长由481 nm增加到489 nm,3.5~4.5 mL时蒸馏水的最大吸收波长维持在489 nm,浓硫酸量大于4.5 mL时蒸馏水的最大吸收波长又开始增加;浓硫酸量从2~3 mL时葡萄糖溶液的最大吸收波长从483 nm增大到488 nm,3~4.5 nm时最大吸收波长为488 nm不变,当浓硫酸量大于4.5 mL时,葡萄糖溶液的最大吸收波长开始减小。
由图2(B)可知,浓硫酸量增加,葡萄糖溶液和蒸馏水的吸光值及两者的差值均是先增加,到达最大值后开始下降;浓硫酸量从2~3.5 mL时,葡萄糖溶液的吸光值不断增大,3.5 mL时吸光值到达最大值,浓硫酸量继续增加,葡萄糖溶液的吸光值开始缓慢减小;浓硫酸量从2~4.5 mL时,蒸馏水的吸光值不断增大,吸光值对浓硫酸量呈现正相关性,当浓硫酸量大于5 mL时,蒸馏水的吸光值开始下降,从整体趋势看,蒸馏水的吸光值变化也与葡萄糖溶液的相似。

图2 浓硫酸量对最大波长和吸光值的影响Fig.2 Effect of volume of concentrated sulfuric acid on the maximum wavelength and absorbance values
通过对不同苯酚浓度和不同浓硫酸量对测定结果的分析可知,苯酚浓度5%,浓硫酸量为3.5 mL,葡萄糖溶液和蒸馏水的吸光值差值最大,在此条件下蒸馏水的最大吸收波长为489 nm。葡萄糖溶液的最大吸收波长为488 nm。因此最佳的苯酚浓度为5%,最佳浓硫酸量为3.5 mL,由于蒸馏水与葡萄糖溶液的最大吸收波长只相差1 nm,为统一操作,最佳波长选取葡萄糖溶液的最大吸收波长488 nm。
2.1.3 显色时间 图3为吸光值随显色时间的变化图,由图3可知,0~5 min时,吸光值急剧下降,5~10 min时,吸光值由缓慢下降到维持平衡,10~30 min范围内,吸光值维持在一定值不变,当时间继续延长,吸光值是一个非常缓慢的增大过程。所以10~30 min测定样品吸光值最稳定,考虑到加入浓硫酸需要一定的操作时间,以及确保在显色30 min之前测定完样品,确定15 min为最佳显色时间。

图3 显色时间对吸光值的影响Fig.3 Effect of coloration time of absorbance
2.1.4 精密度实验 精密度实验结果如表1所示,葡萄糖、胞内多糖和发酵液多糖6次重复实验结果的RSD值分别为0.474%、1.015%和0.712%,由此可见,优化的苯酚硫酸法测定结果稳定性好,精密度高,实验数据可靠。
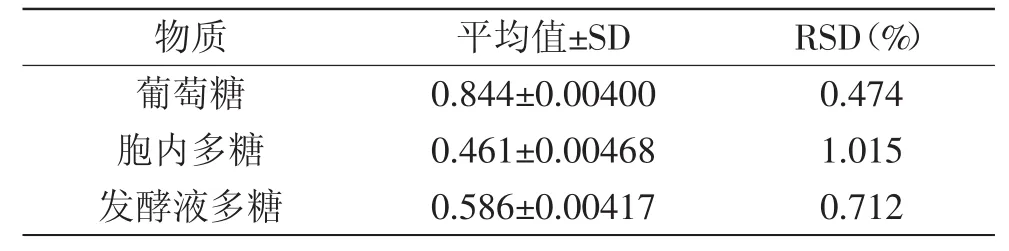
表1 精密度实验结果Table1 Results of precision experiments
2.1.5 线性范围 由朗伯比尔定律可知[19],测定的吸光值随溶液浓度增加而增大,吸光值和溶液浓度成正比关系,但朗伯比尔定律是在一定溶液浓度范围内成立的,若超出一定浓度范围,吸光值与溶液浓度将不再成正比例关系,测定结果将无法进行准确的计算,这个范围即是线性范围。

图4 葡萄糖浓度对吸光值的影响Fig.4 Effect of glucose concentration on the absorbance value
为考察优化后的苯酚硫酸法所适合的葡萄糖浓度的线性范围,测定了从0~500 μg/mL的葡萄糖溶液的吸光值,以葡萄糖溶液浓度为横坐标,吸光值为纵坐标绘图,结果如图4所示。由图4可知,葡萄糖溶液浓度在0~200 μg/mL范围时,吸光值与浓度呈现正比例关系,浓度增加吸光值相应增大;当葡萄糖溶液浓度大于200 μg/mL时,溶液的吸光值偏离先前的直线,吸光值有一个急剧增大的过程,最终超出仪器的检测范围。所以优化后的苯酚硫酸法适用的葡萄糖溶液的线性范围为0~200 μg/mL,在此范围内的R2=0.992。

图5 葡萄糖标准曲线Fig.5 Standard curve of glucose
在上述的线性范围内,降低葡萄糖溶液的浓度,制作葡萄糖的标准曲线,线性系数更大,将可以更加准确地计算实验中的数据,葡萄糖的标准曲线如图5所示。葡萄糖标准曲线方程为:A=0.19839+0.01292C,R2=0.999。
2.1.6 回收率实验 回收率实验结果如表2所示,由表可知:10.00、30.00、50.00 μg/mL的葡萄糖溶液测定结果的RSD值分别为1.3854%、0.7263%和0.5478%,回收率分别为99.10%、99.77%和100.14%;20.00、40.00、60.00 μg/mL的标准葡聚糖溶液测定结果的RSD值分别为2.9034%、1.5929%和1.4497%,回收率分别为99.40%、99.18%和99.15%。可见测定结果相对标准偏差较小,实验数据稳定可靠;葡萄糖与葡聚糖的回收率均大于99.10%,说明测定结果回收率高,测定值能正确反应真实值。

表2 回收率实验结果Table2 Results of recovery experiments
2.2 萌发菌HL-003胞内与发酵液多糖测定结果
运用1.2.2.3中式(1)和式(2)对表1中的胞内多糖和发酵液多糖的测定结果进行计算,计算结果见表3。由表3可知,萌发菌HL-003胞内和发酵液多糖的含量分别为2.028%和2.998 g/L。

表3 萌发菌HL-003胞内与发酵液多糖测定结果Table3 The measurement results of polysaccharide
3 结论
通过实验优化苯酚硫酸法,得到最佳苯酚浓度为5%,浓硫酸量为3.5 mL,最大吸收波长为488 nm,显色时间15 min;葡萄糖浓度在0~200 mg/mL范围内线性良好,在优化方法下进行精密度实验,葡萄糖、胞内多糖和发酵液多糖测定结果的相对标准偏差(RSD)分别为0.474%、1.015%和0.712%,测定结果稳定可靠;本方法对葡萄糖和葡聚糖的回收率均在99.10%以上,回收率高,与真实值吻合;通过测定,萌发菌HL-003胞内和发酵液多糖的含量分别为2.028%和2.998 g/L。因此确定通过优化的苯酚硫酸法具有实用价值,可以运用到萌发菌HL-003多糖的测定以及其他材料中多糖的测定。
[1]S P Wasser.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Applied Microbiology and Biotechnology,2002,60:258-274.
[2]彭述辉,曾援.功能性多糖的研究进展[J].安徽农业科学,2010,38(19):10255-10258.
[3]Vincent ECOoi,Fang Liu.Immunomodulation and Anti-Cancer Activity of Polysaccharide-Protein Complexes[J].Current Medicinal Chemistry,2000(7):715-729.
[4]秦俊哲,陈明,陈合,等.食药用真菌多糖的研究现状与展望[J].中国食用菌,2004,23(2):6-8.
[5]Yuki Masuda,Koichi Ito,Morichika Konishi,et al.A polysaccharide extracted from Grifola frondosa enhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cancer[J].Cancer Immunol Immunother,2010,59:1531-1541.
[6]Jun-Jen Liu,Tien-Shang Huang,Ming-Ling Hsuc,et al.Antitumor effects of the partially purified polysaccharides from Antrodia camphorata and the mechanism of its action[J].Toxicology and Applied Pharmacology,2004,201:186-193.
[7]肖建辉,蒋侬辉,梁宗琦,等.食药用真菌多糖研究进展[J].生命的化学,2002,22(2):148-150.
[8]王雪冰,赵天瑞,樊建.食用菌多糖提取技术研究概况[J].中国食用菌,2010(2):3-6.
[9]徐锦堂.中国天麻栽学[M].北京:北京医科大学中国协和医科大学联合出版社,1993:1-9.
[10]徐锦堂,郭顺星,范黎,等.天麻种子与小菇属真菌共生萌发的研究[J].菌物系统,2001,20(1):137-141.
[11]郭顺星,王秋颖.促进天麻种子萌发的石斛小菇优良菌株特性及作用[J].菌物系统,2001,20(3):408-412.
[12]祁婧,张大为,陈娟,等.五种药用石斛内生真菌抑制HIV-1整合酶活性研究[J].中国医药生物技术,2013,8(1):36-40.
[13]郑朋朋,杨晓波,李珊,等.萌发菌HL-003胞内多糖的提取及抗氧化性研究[J].中国酿造,2015,34(3):71-75.
[14]王春兰,陈晓梅,郭顺星,等.石斛小菇的药理活性研究[J].微生物学通报,2001,28(2):73-76.
[15]郭志烨,韩丽,杨明,等.中药多糖定量测定方法的探讨[J].中成药,2014,36(10):2172-2176.
[16]李计萍.中药新药研究中多糖含量测定方法探讨[J].中国中药杂志,2014,39(17):3392-3394.
[17]陈龙浩,黄雪峰,陈颖珊,等.西番莲果皮多糖2种测定方法的比较研究[J].今日药学,2013(9):573-575.
[18]郑朋朋,李珊,陈玉惠,等.响应面法优化萌发菌HL-003胞内多糖提取工艺[J].食品工业科技,2015,36(15):219-223.
[19]武汉大学化学系.仪器分析[M].北京:高等教育出版社,2001:113-115.
Study on phenol-sulfuric acid method for determination of polysaccharides from germination fungus HL-003
ZHENG Peng-peng,LI Shan,ZHANG Bao,YANG Zheng-tao,QI Li-rong,HUANG Chao,AO Xin-yu*
(Life Science College,Southwest Forestry University,Kunming 650224,China)
In order to determine polysaccharides of germination fungus HL-003,parameters of the phenolsulfuric acid method were optimized.Phenol concentration and volume of concentrated sulfuric acid was the independent variable,the maximum absorption wavelength and absorbance were detected under different concentrations of phenol and concentrated sulfuric acid volume.Immediately,the color of time,precision,linearity and recovery were measured in order to determine the optimum parameters.The results showed that phenol concentration of 5%,concentrated sulfuric acid content of 3.5 mL,the maximum absorption wavelength of 488 nm,coloration time 15 min.The methods had a high precision and recovery results were reliable,and consistent with the true value.The concentration of glucose in the range of 0~200 mg/mL had a good linearity.Intracellular and fermentation of polysaccharide contents were 2.028%and 2.998 g/L,by detecting with optimized method.
phenol-sulfuric acid method;germination fungus HL-003;polysaccharides
TS201.1
A
1002-0306(2016)06-0074-05
10.13386/j.issn1002-0306.2016.06.006
2015-07-02
郑朋朋(1990-),男,硕士研究生,研究方向:生物化学与分子生物学,E-mail:1104663437@qq.com。
敖新宇(1978-),男,硕士,副教授,研究方向:生物化学与分子生物学,E-mail:54700875@qq.com。
云南省优势特色重点学科生物学一级学科建设项目(50097505)。

