258.15 K下五元体系Na+,K+//Cl-,SO42-,NO3-―H2O相平衡研究
廖 玲, 黄雪莉, 宋 欢
258.15 K下五元体系Na+,K+//Cl-,SO42-,NO3-―H2O相平衡研究
廖 玲, 黄雪莉, 宋 欢
(石油天然气精细化工教育部&自治区重点实验室, 新疆大学 化学化工学院, 新疆 乌鲁木齐 830046)
采用等温溶解平衡法研究了258.15 K下五元体系Na+,K+//Cl-,SO42-,NO3-―H2O及其子体系Na+,K+//Cl-, NO3-―H2O的相平衡关系。测定了两个体系各盐的溶解度及溶液密度 (冰相区除外),并绘制相图。研究结果表明:在258.15 K,氯化钠饱和时,该五元体系平衡干盐相图由四个两盐结晶区、五条单变量溶解度曲线和两个零变量点构成, 四个两盐结晶区分别对应于NaCl×2H2O+NaNO3,NaCl×2H2O+KNO3,NaCl×2H2O+KCl,NaCl×2H2O+Na2SO4×10H2O;与该体系298.15 K下的相图相比,K3Na(SO4)2和NaNO3×Na2SO4×H2O结晶区消失,Na2SO4×10H2O 结晶区扩大,相图大为简化;在258.15 K时,上述四元体系的平衡干盐相图由四个单盐结晶区(除冰区外)、五条单变量溶解度曲线和两个零变量点构成,四个单盐结晶区分别对应于NaNO3、NaCl×2H2O、KNO3和KCl;与该体系在298.15 K下的相图相比,硝酸钾结晶区扩大很多。
硝酸盐;四元水盐体系;五元水盐体系;相平衡;溶解度.
1 前 言
盐湖资源开发利用常采用盐田自然蒸发或装置强制蒸发技术,前者水损失量大,冬季不能生产,而后者虽然可以采取各种节能措施,但能耗仍然很高。夏季高温是一种自然能量,冬季低温同样是一种可利用的能量资源,此外从热力学角度分析,溶液降温的显热和水的凝固焓比水的蒸发焓要小得多,这表明开发低温下的盐湖化工工艺技术,既可以充分利用冬季寒冷地区的冷能,又有可能实现生产的节水,降耗以及冬季的连续生产。过去低温下的水盐体系研究集中于海水体系[1~4],近年来科研人员研究了盐湖卤水低温淡化技术,证明了卤水冷冻能实现浓淡分离[5~7]。
我国新疆是继智利阿塔卡玛以来发现的第二个具有工业开采价值的天然硝酸盐矿富集区[8],其产品硝酸钠,硝酸钾等是重要的化工原料。目前此地区开发利用的主要途径是溶解蒸发浓缩[9],如上所述,此途径对于干旱缺水、冬季漫长寒冷的新疆来说不合理,有必要进行低温下的基础研究,为开发低温下的工艺提供理论指导。
水盐体系相图是盐湖化工工艺开发的重要依据。新疆硝酸盐固体矿开发利用过程中涉及的水盐体系主要有Na+//Cl-,SO42-,NO3-―H2O和Na+,K+//Cl-,SO42-,NO3-―H2O体系[9]。之前的研究者着重于常高温的相平衡研究,如25、75℃下氯化钠饱和的Na+,K+//Cl-,SO42-,NO3-―H2O体系相平衡[10,11];50℃下的Na+,K+//Cl-,SO42-,NO3-―H2O体系相平衡[12];25、50、75℃下的Na+//Cl-, SO42-, NO3-―H2O体系相平衡[12];以及5、25、50、75、100℃下的Na+,K+//Cl-,NO3-―H2O体系相平衡等[12],而对于低温相图研究较少新疆硝酸盐矿浸取液等温及自然蒸发过程进行研究,结果表明氯化钠首先且始终饱和析出[13],并对 -15、-5、0℃下Na+//Cl-, SO42-, NO3-―H2O体系相平衡进行了研究[14],关于低温下Na+,K+//Cl-,SO42-NO3-―H2O体系相平衡关系研究目前未见报道。但要研究该五元体系,需知道其子体系的相平衡关系,Na+,K+//Cl-,NO3-―H2O体系即是其中之一,该体系也是复分解法生产硝酸钾的基础理论体系,目前亦未有低温下相平衡研究报道。
本文采用等温溶解平衡法研究258.15 K下,Na+,K+//Cl-,NO3-―H2O体系和Na+,K+//Cl-,SO42-, NO3-―H2O体系氯化钠饱和时的液固相平衡,绘制了相图,并进行讨论。
2 实 验
2.1 实验试剂和仪器
实验所用试剂均为市售分析纯及基准纯试剂;实验仪器包括DHJF-低温(恒温)搅拌反应浴(郑州长城科工贸,±0.2℃)、754紫外-可见分光光度计(上海菁华科技仪器有限公司)、体视显微镜、X衍射仪等。
2.2 实验方法
本实验采用等温溶解平衡法[15]进行。通过预实验确定258.15 K下所涉及的体系的平衡时间为14 h。选择合适的相图点,计算组成配制卤水,放入DHJF-低温(恒温)搅拌反应浴,在258.15 K下搅拌溶解达到平衡(平衡时间以预实验为准)。平衡后静置30 min至溶液充分澄清,取液相和平衡固相,并对其进行化学分析和鉴别,(分析方法见下节)。密度用密度瓶法测定。
2.3 分析方法
液相分析方法[16,17]:SO42-: 硫酸钡比浊法;Cl-: 银量法;K+: 四苯硼钠重量法;NO3-: 重铬酸钾氧化法;Na+: 差减法。以上分析方法相对偏差均 < 0.4%。
固相采用体视显微镜、X衍射法进行鉴别。
3 结果与讨论
3.1 Na+,K+//Cl-,NO3-―H2O 四元体系相平衡
实验研究结果见表1,其中耶涅克指数(Jänecke index)为四元体系绘制相图的干盐指数,即干盐摩尔百分数。据此绘制出该体系258.15 K的干盐相图和水含量图见图1~2。为方便比较,根据文献数据[11],图1中同时绘出了298.15 K时的相图。
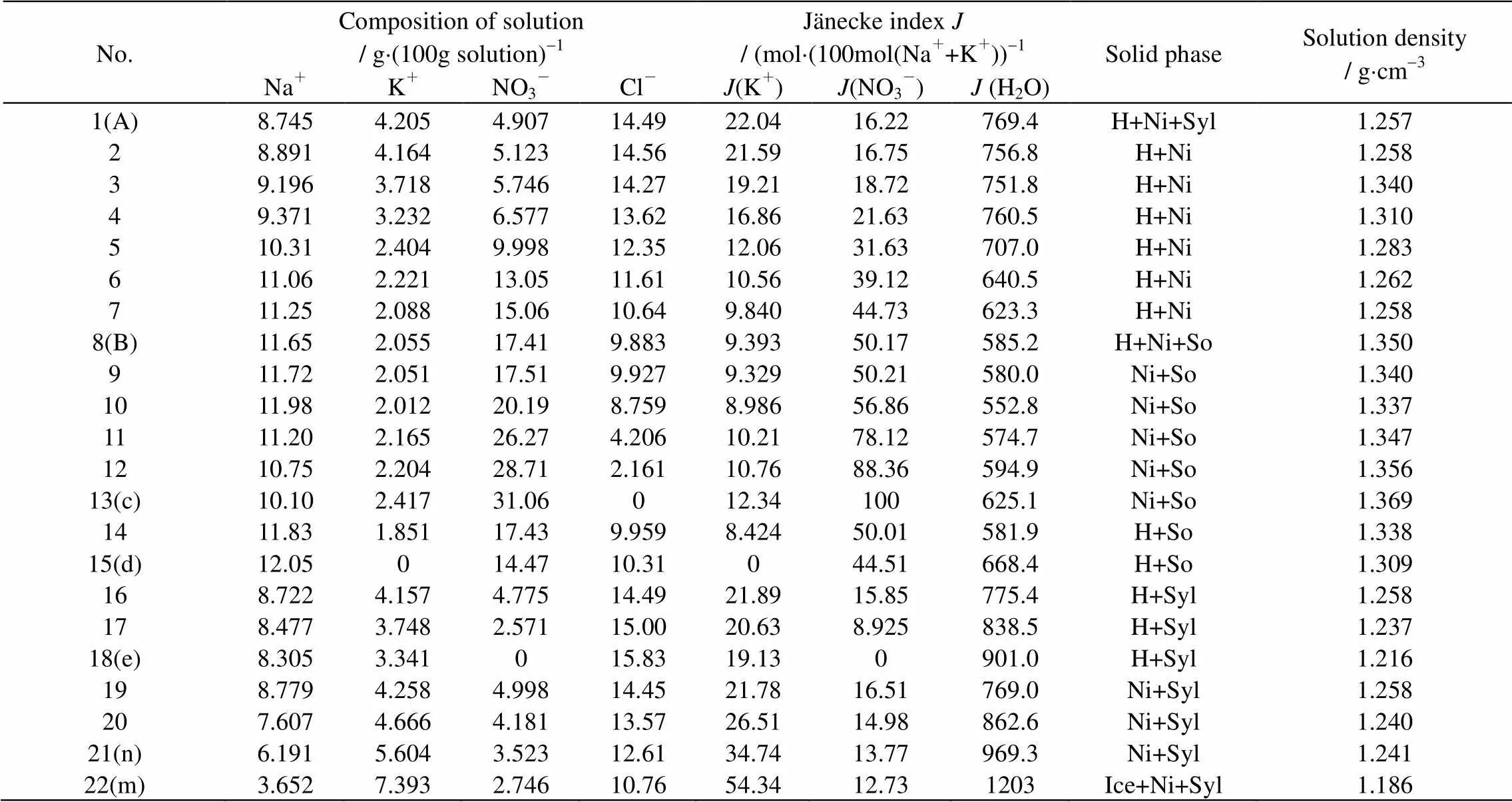
表1 258.15 K下, 四元体系 Na+,K+//Cl-,NO3-―H2O 相平衡溶解度数据
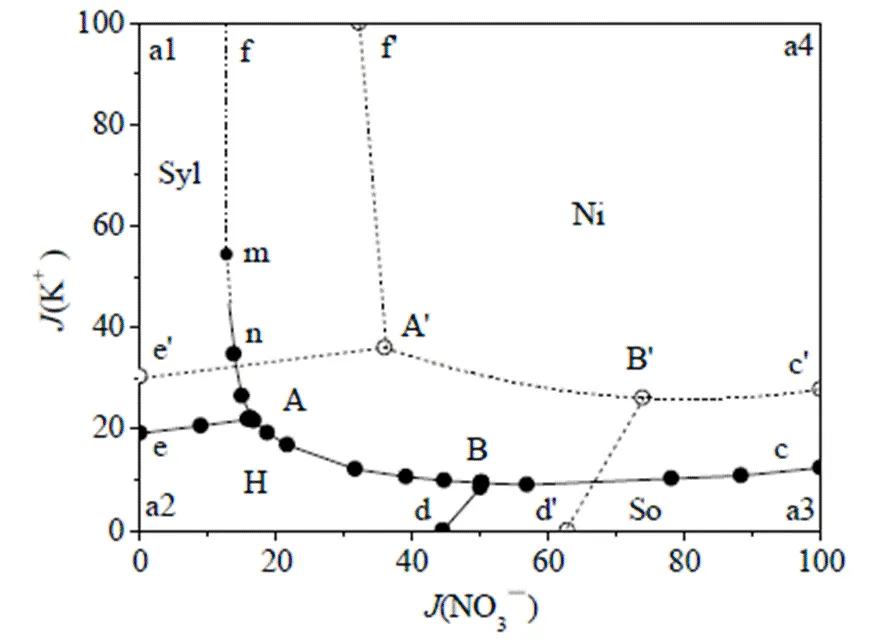
图1 Na+,K+//Cl-,NO3-―H2O体系干盐图
----- 298.15 K —— 258.15 K
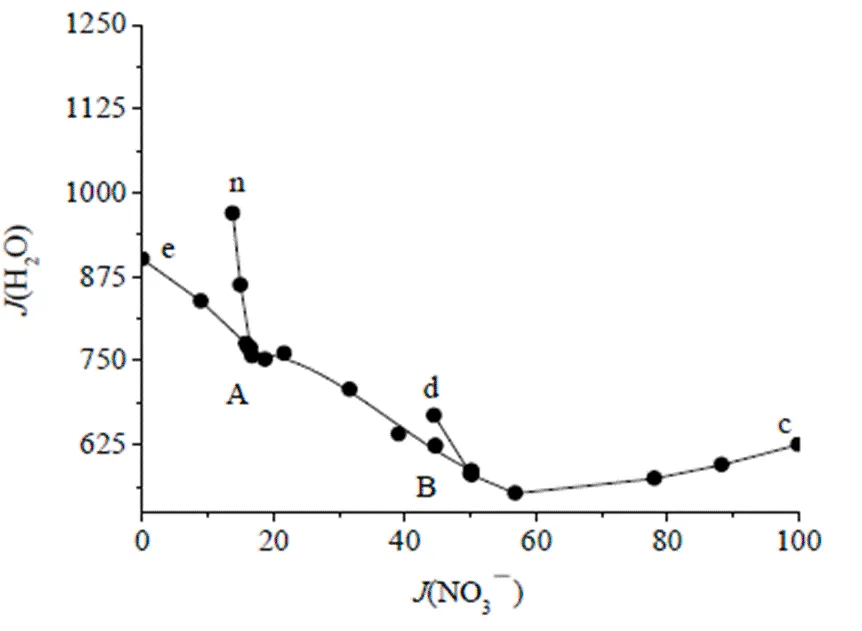
图2 258.15 K Na+,K+//Cl-,NO3--H2O体系水图
由表1和图1可见,该四元体系258.15 K时相图有四个单盐结晶区(冰相区除外),五条单变量溶解度曲线和两个零变量点。和高常温相图一样,体系中未发现复盐区。四个单盐结晶区分别对应平衡固相NaNO3(d-B-c-a3), NaCl•2H2O(e-A-B-d-a2), KNO3(f-m-A-B-c-a4)和KCl(f-m-A-e-a1);两个零变量点为图1~2中的A,B点,平衡固相分别对应NaCl•2H2O+KNO3+KCl及NaCl•2H2O+KNO3+NaNO3。图1中m~f之间虚线部分平衡固相为Ice+KNO3+KCl,n~m之间有可能有部分平衡固相含有冰,因此用半实线和半虚线表示。图2为该体系除冰相区外的水含量图。考虑到本工作重点在于研究低温下盐类相平衡,故未对出现冰相的区域进行详细研究。
由图1可见,在258.15 K时,KNO3结晶区最大,溶解度最小;与298.15 K时的相图对比发现,两温度下相图结构相似,但KNO3溶解度显著降低,结晶区扩大。经分析相图变化原因为温度变化对各盐溶解度均有影响,但温度对NaCl溶解度影响较KNO3小。以上研究结果表明,在利用硝酸钠和氯化钾复分解法生产硝酸钾的过程中,可实现常温析出NaCl,低温析出KNO3,从而避免目前工艺中的蒸发过程。
3.2 Na+, K+//Cl-, SO42-, NO3-―H2O五元体系相平衡
前期研究表明新疆硝酸盐矿浸取液在等温及自然蒸发过程中,氯化钠首先且始终饱和析出[13],因此本工作只研究了Na+, K+//Cl-, SO42-, NO3-―H2O体系中和氯化钠共饱的区域的相图,以满足指导工艺研究的需要。实验研究结果及计算获得的耶涅克指数见表2,上述五元体系在258.15 K时的干盐相图、氯图、水图见图3~5。同样为方便比较,根据文献数据[10],图3中同时绘出了298.15 K时的相图。
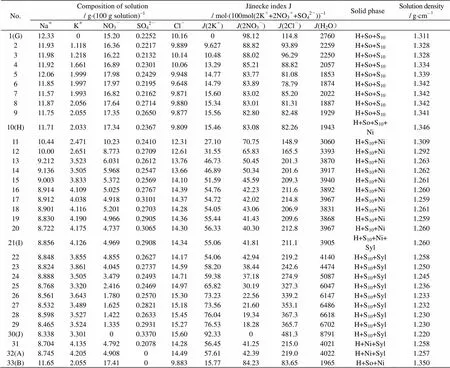
表2 258.15 K五元体系Na+, K+//Cl-, SO42-, NO3――H2O相平衡实验数据
由表2和图3可知,该五元体系258.15 K时的相图含有四个两盐结晶区,五条单变量溶解度曲线和两个零变量点。此体系中未发现复盐区。两个零变量点为图3中的H,I点,均为相称共饱点,平衡固相分别为NaCl•2H2O+KNO3+NaNO3+Na2SO4•10H2O及NaCl•2H2O+KCl+KNO3+Na2SO4•10H2O。四个两盐结晶区分别对应于平衡固相: NaNO3+ NaCl•2H2O(G-H-B-k1), KNO3+NaCl•2H2O(H-B-A-I), Na2SO4•10H2O+NaCl•2H2O(G-H-I-J-k2), KCl+ NaCl•2H2O(A-I-J-k3),其中NaCl•2H2O+ NaNO3结晶区最小,Na2SO4•10H2O+ NaCl•2H2O结晶区最大。

图3 Na+, K+//Cl-, SO42-, NO3--H2O体系干盐图
----- 298.15 K —— 258.15 K
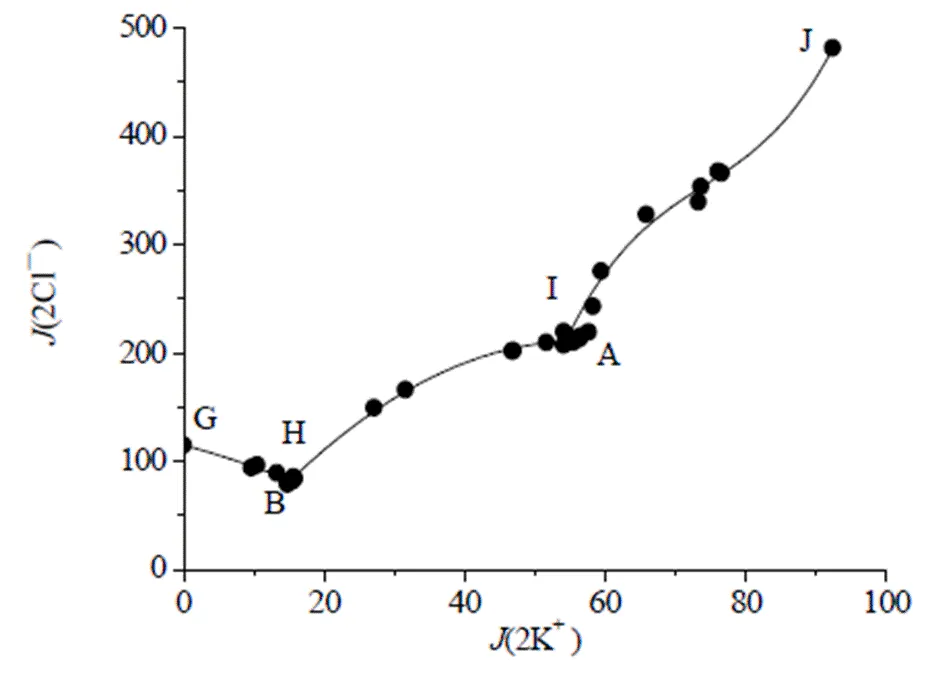
图4 258.15 K Na+, K+//Cl-, SO42-, NO3--H2O体系氯图
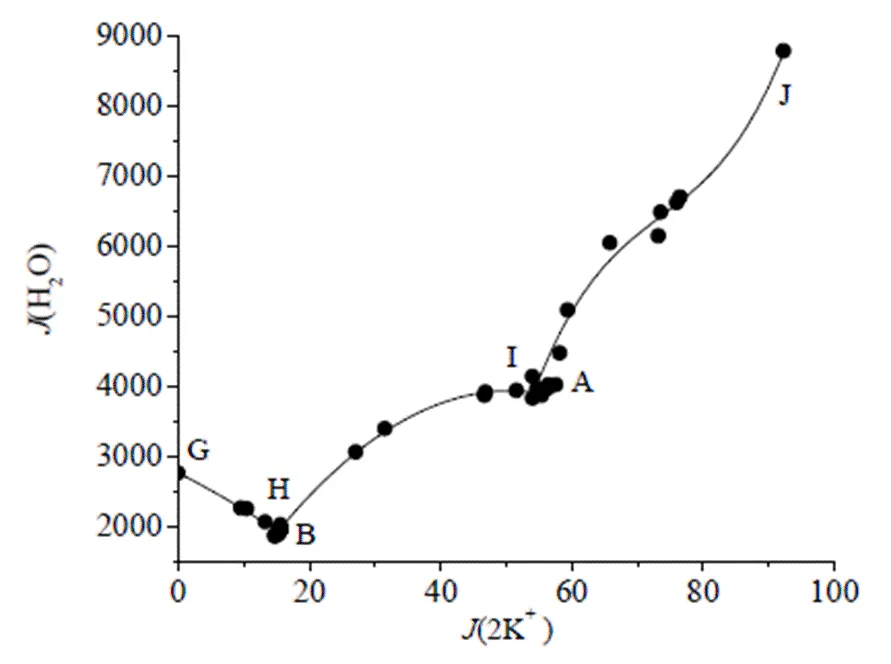
图5 258.15 K Na+, K+//Cl-, SO42-, NO3--H2O体系水图
该体系298.15 K时的相图有六个两盐结晶区,包括钠硝矾NaNO3•Na2SO4•H2O (b1-b2-b3-b8-b9)和钾芒硝K3Na(SO4)2(b3-b4-b5-b6-b8)的结晶区,但在258.15 K的相图中,这两种复盐的结晶区消失,相图大为简化。这一现象极其有利于简化生产工艺,减少控制参数,提高产品质量。作者认为出现此现象的可能原因为钠硝矾和钾芒硝两种复盐都含有硫酸钠,低温下硫酸钠单盐的溶解度非常低,易于结晶析出,也可能是低温下硫酸钠比其复盐稳定,更易存在,因而排斥了含硫酸钠复盐的形成。
分析图5和表2可知,在B点处水含量最低,密度最大,这是由于B点对应的固相是KNO3+NaNO3+NaCl•2H2O,溶液中硝酸盐含量较高;J点处水含量最高,密度最小,这是由于J点所对应的平衡固相为NaCl•2H2O+KCl+Na2SO4•10H2O,溶解度相对均较低。
4 结 论
(1) 在258.15 K时,四元体系Na+, K+//Cl-, NO3-―H2O的相图中含有四个单盐结晶区,五条单变量溶解度曲线和两个零变量点;未发现复盐区;相图中,KNO3结晶区最大,溶解度最小;与298.15 K下的相图相比,相图结构相似,但KNO3结晶区显著扩大。
(2) 在258.15 K、氯化钠饱和时的五元体系Na+,K+//Cl-,SO42-,NO3-―H2O的平衡相图中,存在四个两盐结晶区,五条单变量溶解度曲线和两个零变量点;四个两盐结晶区分别对应于NaCl•2H2O+NaNO3, NaCl•2H2O +KNO3, NaCl•2H2O+KCl, NaCl•2H2O+ Na2SO4•10H2O,未发现复盐区;与298.15 K时的相图相比,相图结构大为简化;相图中绝大部分区域为Na2SO4•10H2O结晶区。
符号说明:

H¾ NaCl×2H2ONi¾ KNO3 So¾ NaNO3Syl¾ KCl S10¾ Na2SO4×10H2O
[1] Ringer W E. De verande ringen in sam enstelling van zeewater bij het bevriezen [J]. Chemisch Weekblad, 1906(3): 223-249.
[2] Nelson K H, Thompson T G.. Deposition of salts from sea water by frigid concentration[R]. Seattle: Office of Naval Research, University of Washington, Department of Oceanography, 1977:1-30.
[3] Thompson T G, Nelson K H. Concentration of brines and deposition of salts from sea water under frigid conditions[J]. Amer J Sci,1956,254(4): 227-238.
[4] Gitteman K E. Thermal analysis of sea water [R]. Hanover: USA Cold Regions Research and Engineering Laboratory, 1937.
[5] WU Zhi-ming (乌志明), DENG Xiao-chuan (邓小川). Study on desalination of salt water by the refrigeration method (盐水冷冻淡化研究). Inorganic Chemical Industry (无机盐工业), 2001, 33(2): 6-8.
[6] NIE Zhen (乜贞), ZHANG Yong-sheng (张永生), BU Ling-zhong (卜令忠),. Experimental study on concentration of winter brines in Zabuye Salt Lake,Tibet. (西藏扎布耶盐湖卤水冬季制卤试验研究) [J]. Geological Bulletin of China (地质通报), 2005, 24(4): 386-390.
[7] WU Zhi-ming (乌志明), ZHENG Mian-ping (郑绵平), LIU Xi-fang (刘喜芳),. Concentration of brines from the Dogai Coring Lake, Northern Tibet, by using the two·step process: freezing and solar evaporation (多格错仁盐湖卤水冷冻、日晒两步法浓缩制卤研究) [J]. Chinese Journal of Inorganic Chemistry (无机化学学报), 2012, 28(5), 995-1000.
[8] ZHENG Mian-Ping (郑绵平). On saline lakes of china (论中国盐湖) [J]. Mineral Deposits (矿床地质), 2001, 20(2):181-189.
[9] HUANG Xue-li (黄雪莉). The liquid-solid equilibria of the system Na+,K+,Mg2+//Cl–,SO42-,NO3――H2O at 298.16 K and its application (298.16 K下, Na+,K+,Mg2+//Cl–,SO42-,NO3――H2O体系液固相平衡及应用基础研究) [D]. Dalian(大连): Dalian University of Technology (大连理工大学), 2008.
[10] LI Ya-wen (李亚文), HAN Wei-tian (韩蔚田). Study on the liquid-solid equilibrium of the quinary system Na+, K+//Cl-, SO42-, NO3-―H2O(Na+, K+//Cl-, SO42-, NO3-―H2O五元体系的卤水-矿物平衡研究) [J]. Chinese Science Bulletin (科学通报), 1998,43(19): 2089- 2091.
[11] SU Yu-guang (苏裕光), LÜ Bing-ling (吕秉玲), WANG Xiang-rong (王向荣). Study on phase diagram of inorganic chemical production(一)theoretical foundation (无机化工生产相图分析(一)理论基础) [M]. Beijing (北京):Chemical Industry Press (化学工业出版社), 1985.
[12] Silcock H L. Solubililies of inorganic and organic compounds: Vol.1~3 [M]. Pergamon: Oxford, New York Pergamon Press, 1979.
[13] HUANG Xue-li (黄雪莉), HU Zi-zhao (胡子昭), MA Feng-yun (马风云). Study on the preparation of KNO3from the brine—research and calculation of phase diagram (罗布泊卤水生产硝酸钾半成品工艺研究—相图分析及计算) [J]. Industrial Minerals & Processing (化工矿物与加工), 2002(12), 1-4.
[14] ZHANG Xia (张霞). Study on phase equilibrium of nitrate-containing brine in Xinjiang at low temperatures (新疆含硝酸盐卤水低温相平衡研究) [D]. Urumqi (乌鲁木齐): Xinjiang University (新疆大学), 2014.
[15] HUANG Xue-li (黄雪莉), SONG Peng-sheng (宋彭生), WANG Xue-feng (王雪枫),. Study on liquid-solid equilibrium of Na+, K+,Mg2+// Cl-, SO42-, NO3--H2O system at 298.16 K (Na+, K+,Mg2+// Cl-, SO42-, NO3--H2O体系液固相平衡研究) [J]. J Chem Eng of Chinese Univ (高校化学工程学报), 2008, 22(2): 188-192.
[16] Analytical Department of Qinghai Institute of Salt-lake, Chinese Academy of Sciences (中国科学院青海盐湖研究所分析室). The analyses of brines and salts (卤水和盐的分析方法) [M]. Beijing (北京): Science Press (科学出版社), 1988.
[17] Standard examination methods for drinking water-nonmetal parameters(生活饮用水标准检验方法无机非金属指标) GB/T 5750.5-2006 [S]. Beijing (北京): China Standards Press (中国标准出版社), 2006.
Phase Equilibria of a Na+,K+//Cl-,SO42-,NO3-―H2O Quinary System at 258.15 K
LIAO Ling, HUANG Xue-li, SONG Huan
(Key Laboratory of Oil & Gas Fine Chemicals, Ministry of Education and Xinjiang Uyghur Autonomous Region, College of Chemistry and Chemical Engineering, Xinjiang University, Urumqi 830046, China)
The phase equilibria of a quinary system Na+,K+//Cl-,SO42-,NO3-―H2O and one of its subsystems (a quaternary system Na+, K+//Cl-, NO3-―H2O) were investigated by an isothermal method at 258.15 K. Solubilities and densities of the quinary system and its quaternary subsystem (except ice phase zone) were determined experimentally, and the equilibrium phase diagrams were plotted. The results show that the phase diagram of the system Na+,K+//Cl-,SO42-,NO3-―H2O saturated with NaCl consists of five univariant curves, two invariant points and four crystallization regions corresponding to NaCl×2H2O+NaNO3, NaCl×2H2O+KNO3,NaCl×2H2O+KCl and NaCl×2H2O+Na2SO4×10H2O. Compared with the phase diagram of the quinary system at 298.15 K, the crystalline regions of the double salts (K3Na(SO4)2and NaNO3×Na2SO4×H2O) disappeared, and the crystalline region of Na2SO4×10H2O became larger. Therefore, the phase diagram of the quinary system was greatly simplified at 258.15 K. For the Na+,K+//Cl-,NO3-―H2O system, the phase diagram consisted of five univariant curves, two invariant points and four crystallization regions (except ice phase zone) corresponding to NaNO3, NaCl×2H2O, KNO3and KCl. In addition, compared with the phase diagram of the quaternary system at 298.15 K, the crystalline region of KNO3became larger.
nitrate; quaternary salt-water system; quinary salt-water system; phase equilibrium; solubility
1003-9015(2016)01-0007-06
O642.42
A
10.3969/j.issn.1003-9015.2016.01.002
2014-09-24;
2014-12-23。
国家自然科学基金(21166022);新疆大学创新团队(培育)资助项目。
廖玲(1990-),女,四川资中人,新疆大学硕士生。 通讯联系人:黄雪莉,E-mail:xuelih@163.com

