内蒙古马铃薯枯萎病病原菌鉴定及其生物学特性
陈慧,薛玉凤,蒙美莲,马志伟,刘智慧,胡俊
(内蒙古农业大学农学院,内蒙古呼和浩特010019)
病虫防治
内蒙古马铃薯枯萎病病原菌鉴定及其生物学特性
陈慧,薛玉凤,蒙美莲,马志伟,刘智慧,胡俊*
(内蒙古农业大学农学院,内蒙古呼和浩特010019)
马铃薯枯萎病在内蒙古马铃薯种植区发生日趋严重。为明确其病原,2009~2014年对采自内蒙古各地的马铃薯枯萎病病样进行病原菌分离和鉴定。通过形态学鉴定和rDNA-ITS测序、同源性比对,得知引起内蒙古马铃薯枯萎病病原菌主要为尖孢镰刀菌(Fusarium oxysporum)、三线镰刀菌(F.tricinctum)和茄病镰刀菌(F.solani)。生物学特性研究结果表明,尖孢镰刀菌的最适生长温度为25℃,最适pH为7,最适合生长的培养基为PDA、PSA、Bilais培养基,最适碳源为淀粉和麦芽糖,最适氮源为蛋白胨;三线镰刀菌的最适生长温度为20℃,最适pH为7,最适生长的培养基为玉米粉和燕麦粉培养基,最适碳源为淀粉,最适氮源为尿素;茄病镰刀菌的最适温度为30℃,最适pH为7,最适合生长的培养基为PSA培养基,最适碳源为葡萄糖和蔗糖,最适氮源为硝酸钾。
马铃薯枯萎病;镰刀菌;鉴定;生物学特性
马铃薯是一种具有较大优势的作物,生育期短,适应性强,产量高,用途广。马铃薯除用做日常膳食直接食用消费外,还在更为广泛的领域被开发利用,是世界性的农业资源与多种食品加工和工业原料。进一步推动马铃薯产业的发展,对产区农民脱贫致富和缓解中国粮食安全压力具有重要战略意义和现实意义。
随着马铃薯栽培面积的不断增长,轮作倒茬变得困难,使得马铃薯病害种类不断增加且危害也日渐加重,严重制约着马铃薯产业的健康稳步发展。马铃薯枯萎病是近几年新发现的一种由镰刀菌侵染引起的土传病害,在全国各地均有发生,据调查在内蒙古自治区的一些种植区严重地块发病率达78.0%,导致马铃薯减产并影响其经济效益。
据Rakhimov和Khakimov[1]报道,马铃薯枯萎病是由镰刀菌的5个不同种引起的,即茄病镰刀菌(Fusarium solani)、雪腐镰刀菌(F.nivale)、尖孢镰刀菌(F.oxysporum)、串珠镰刀菌(F.moniliforme)和接骨木镰刀菌(F.sambucinum)。彭学文和朱杰华[2]报道,河北省马铃薯枯萎病是由F.solani、F.moniliforme以及F.oxysporum引起的。王玉琴等[3]报道,甘肃省马铃薯枯萎病是由燕麦镰刀菌(F.avenaceum)引起的。王丽丽等[4]报道,新疆马铃薯枯萎病的病原菌由F.moniliforme、F.solani和F.oxysporum 3个种引起。
为明确内蒙古马铃薯枯萎病的病原,2009~2014年对采自内蒙古各地的马铃薯枯萎病病样进行病原菌分离和鉴定,同时对其生物学特性进行研究,奠定了马铃薯枯萎病防治研究的基础。
1 材料与方法
1.1病原菌的分离与纯化
2009~2014年对从内蒙古包头市、乌兰察布市、呼和浩特市和锡林郭勒盟等地采集到的具有典型马铃薯枯萎病症状的病株和病薯用组织分离法进行分离[5]。在PSA培养基上进行培养纯化,将纯化的菌株采用琼胶平板表面单孢子挑取法进行单孢分离[5],进一步纯化后于PSA斜面培养基上4℃保存备用。
1.2致病性测定
将在PSA培养基上生长7~10 d的菌株分别制取菌饼(5~6片)接入装有麦麸培养基的三角瓶(500 mL)中,25℃下培养7~15 d,待菌丝长满培养基后,以1%(质量比)比例与灭菌土混匀制成菌土。
马铃薯‘夏波蒂’种薯在5‰高锰酸钾溶液中浸泡10 min,用清水冲洗干净后播种于盛有菌土的花盆中,置于温室中培养。以无菌土为对照,3次重复,每个重复5株。植株发病后进行再次分离,将分离物的菌落形态和孢子形态等与接种菌株进行比较。
1.3病原菌鉴定
1.3.1形态学鉴定
病原菌接种于PSA培养基上培养4 d后,观察菌落形态和产生色素情况,并测量菌落大小,计算菌丝生长速率。7 d后在显微镜下观测孢子及产孢细胞的形态和大小,厚垣孢子的有无等。大型分生孢子测量50个,小型分生孢子测量20~30个,厚垣孢子测量10个。不产孢的病原菌接种于Bilais培养基上培养7 d产孢后进行观测。根据所得结果参照Booth[6]《镰刀菌属》分类系统进行形态学鉴定。
1.3.2分子生物学鉴定
将纯化后的菌株接种到PSA平板上培养5~7 d,刮取菌丝,在液氮中充分研磨后,用Ezup柱式基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司)提取病原菌的DNA。利用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4 (5'-TCCTCCGCTTATTGATATGC-3')对菌株进行PCR扩增。
扩增体系为:10×PCR buffer 5 μL(含Mg2+),10mmoL/LdNTP(10mmoL/Leach)0.75μL,ExTaqDNA polymerase 0.25 μL,引物对2 μL,模板DNA 1 μL,无菌ddH2O41μL,总体系50μL。
扩增条件为:94℃预变性3 min,94℃变性40 s,56℃退火40 s,72℃延伸1 min,共35个循环;最终72℃延伸10 min,放置在4℃下保存。
对获得的扩增产物利用琼脂糖凝胶电泳检测并进行测序,将得到的序列在GenBank中进行比对,通过同源性分析在分子水平上对病原菌的种进行鉴定。
1.4病原菌生物学特性研究
1.4.1不同温度对病原菌生长的影响
设8个温度梯度,分别为5,10,15,20,25,30,35和40℃。用打孔器取直径0.7 cm菌饼接于PSA平板培养基上,每个处理重复5次,置于不同温度的温箱内培养,6 d后用十字交叉法测量菌落直径。
1.4.2不同pH对病原菌生长的影响
设10个pH值梯度,分别为3,4,5,6,7,8,9,10,11和12。用打孔器取直径0.7 cm菌饼接于PSA平板培养基上,每个处理重复5次,置于25℃温箱内培养,6 d后用十字交叉法测量菌落直径。
1.4.3不同培养基对病原菌生长的影响
选取7种不同的培养基,分别为PDA培养基、PSA培养基、水琼脂培养基、燕麦培养基、玉米粉培养基、查彼培养基、Bilais培养基。用打孔器取直径0.7 cm菌饼接于不同平板培养基,每个处理重复5次,置于25℃温箱内培养,6 d后用十字交叉法测量菌落直径,并观察菌落形态。
1.4.4不同碳、氮源对病原菌生长的影响
以Czapek培养基为基础培养基,用碳百分含量相当的葡萄糖、麦芽糖、乳糖、淀粉、D-果糖、D-甘露醇、D-木糖、甘露糖、半乳糖分别作为碳源代替蔗糖;用氮百分含量相当的硝酸钾、硝酸铵、尿素、蛋白胨、碳酸铵、碳酸氢铵、氯化铵、L-精氨酸分别作为氮源代替硝酸钠,制成固体培养基。用打孔器取直径0.7 cm菌饼接于不同平板培养基上,每个处理重复5次,置于25℃温箱内培养,6 d后用十字交叉法测菌落直径。
1.5数据处理与分析
试验结果采用Excel 2003与SAS 9.0软件进行数据处理与分析。
2 结果与分析
2.1病原菌分离及致病性测定
从279个具有马铃薯枯萎病典型症状的病样中分得43株分离物,对这些分离物进行了初步的菌丝形态和孢子形态的鉴定,将这些分离物分为3大类。第1类D有20株,所占的比例为46.5%;第2 类D1有8株,所占比例为18.6%;第3类D2有2株,所占比例为4.7%。这些分离物采用土壤接种后,马铃薯植株在生长中后期开始发病,发病初期,下部叶片萎蔫,随着病情的发展,叶片由下而上逐渐萎蔫枯死(图1a和b),剖开根茎部可见维管束变褐色或黑褐色(图1c);切开染病的块茎维管束呈虚线状褐变(图1d)。对发病的植株进行再分离,得到的分离物与所接菌株形态相同,依据科赫氏法则,证明所接菌株为马铃薯枯萎病的病原菌。
2.2病原菌鉴定
2.2.1形态学鉴定

图1 马铃薯枯萎病症状Figure 1Symptoms of potato wilt
病原菌D在PSA培养基上培养4 d后菌落直径为6.3~6.5 cm。菌落正面(图2a)为规则的圆形,边缘菌丝则呈放射状,菌丝较细,菌落绒毡状,背面(图2b)分泌淡紫色的色素;以单出瓶梗为方式产孢。大型分生孢子(图2c)相对小型分生孢子稀少,3~5个分隔,纺锤形,两端尖,大小为11.5~ 28 μm×3.1~4.0 μm。小型分生孢子(图2c)无色,椭圆形或卵形,大小为3.9~6.4 μm×2.3~2.9 μm。厚垣孢子(图2d)单独生长,球形,表面光滑。
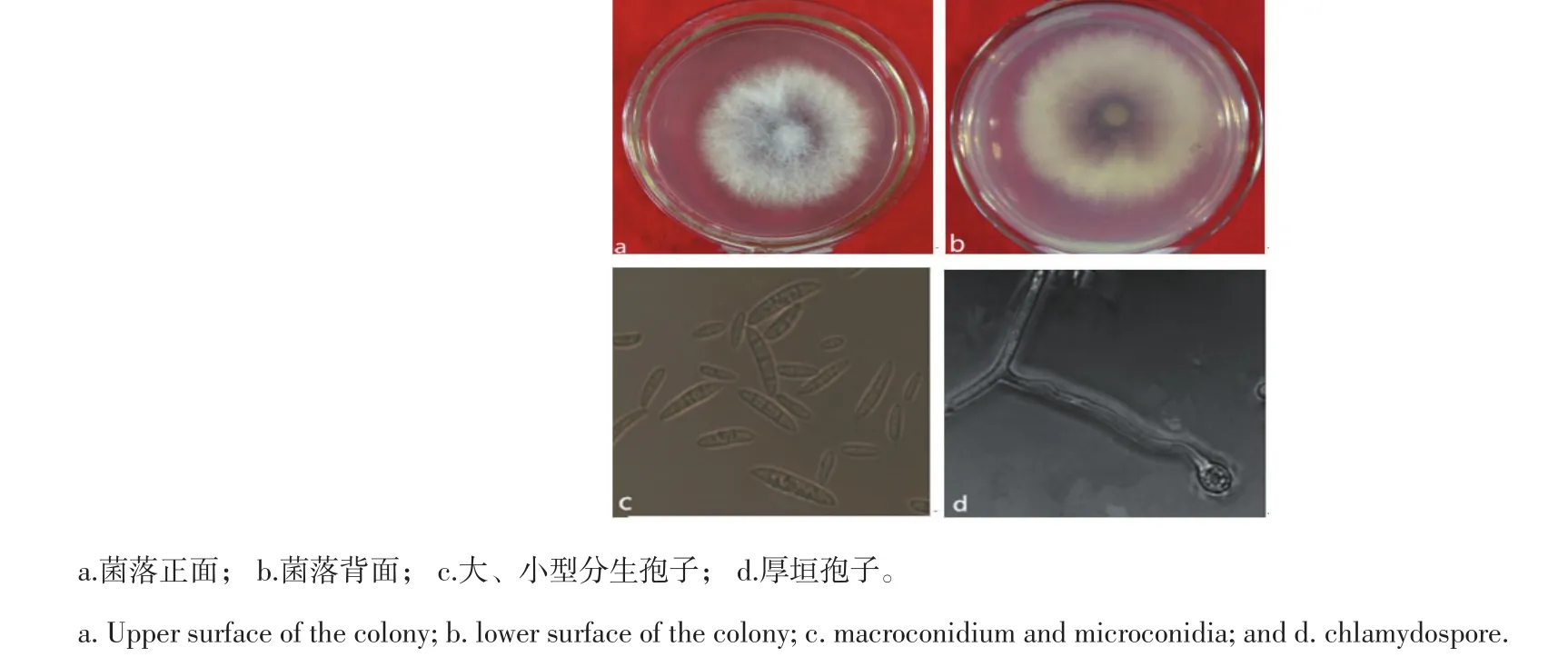
图2 病原菌D形态特征Figure 2Morphological characters of pathogen D
病原菌D1(图3a)在PSA培养基上培养4 d后的菌落平均直径为4.2~4.5 cm,菌丝茂盛,棉絮状,粉红色,上有橘黄色分生孢子座产生,背面(图3b)培养基变为暗红葡萄酒色。大型分生孢子(图3c)镰刀状,弯曲,顶端渐细,有明显的足孢,3~5隔,大小为10.64~20.88 μm×2.66~4.12 μm。小型分生孢子(图3d)最初至单生瓶状小梗上形成,以后分生孢子梗产生茂盛的分枝,卵圆形、梨形,0~1个分隔,大小为7.2~9.31 μm×2.4~3.5 μm。厚垣孢子(图3e)稀少,单生或串生,偶尔生于短侧枝的顶端,球形,大小为6.25~13.75 μm×6.88~18.75 μm。
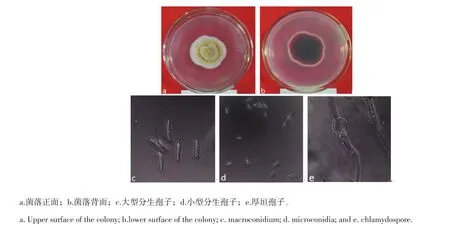
图3 病原菌D1形态特征Figure 3Morphological characters of pathogen D1
病原菌D2(图4a)在PSA培养基上培养4 d后菌落直径为3.6~4.3 cm,边缘比较整齐,气生菌丝较少,薄绒状,白色至浅灰色;后期背面(图4b)在菌落中心形成棕色的色素。分生孢子梗为瓶状小梗。大型分生孢子(图4c)纺锤形,稍弯,顶端细胞短,稍窄细或变钝,壁厚,2~8个隔膜,大小为15~55 μm×3~5.1 μm。小型分生孢子(图4c)呈卵形或肾形,大小为4.9~11 μm×2.4~4 μm。厚垣孢子(图4d)表面粗糙,球形,对生、单生、串生或顶生。
根据上述形态学特征,结合Booth《镰刀菌属》分类系统进行鉴定,将D、D1、D2初步确定为尖孢镰刀菌(F.oxysporum)、三线镰刀菌(F.tricinctum)、茄病镰刀菌(F.solani)。
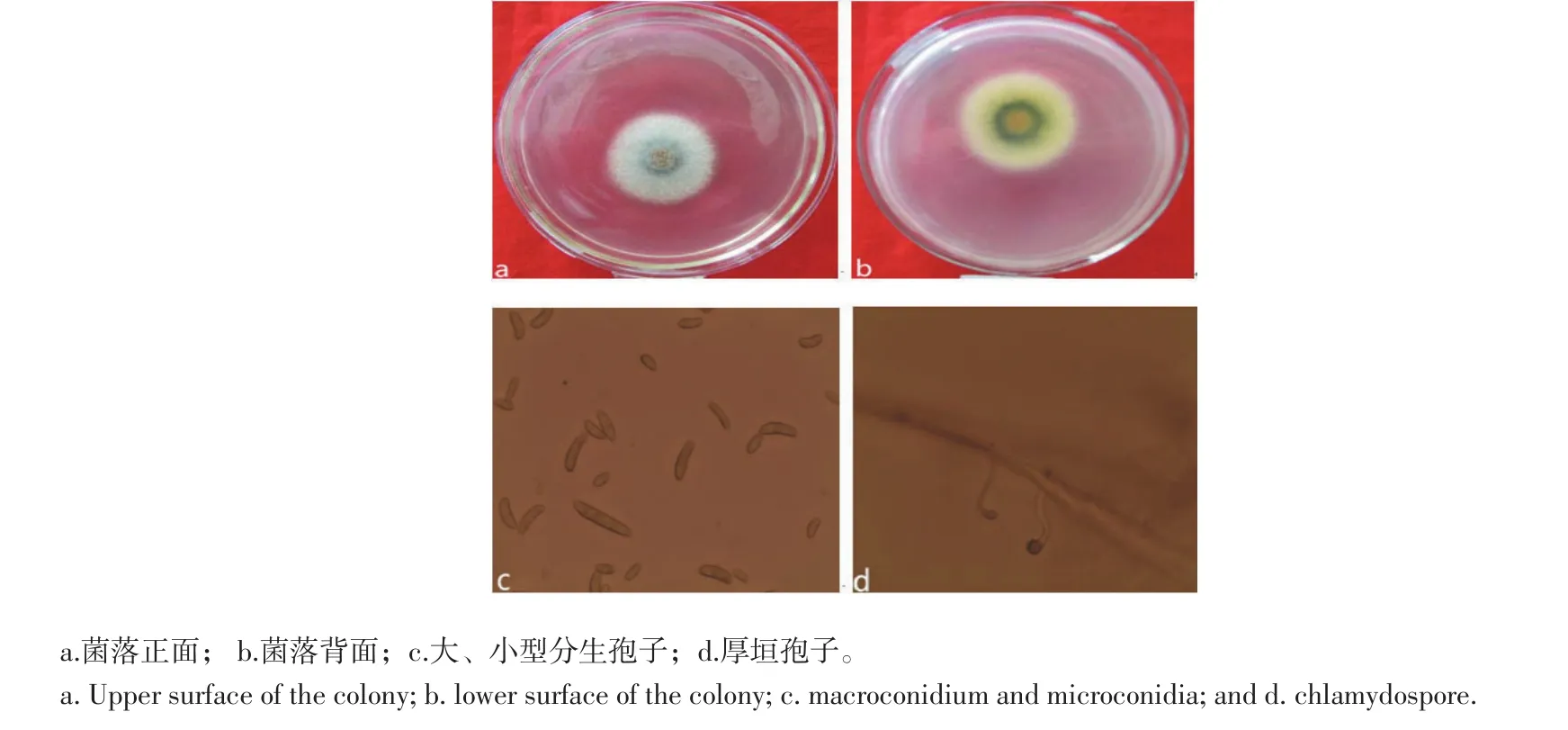
图4 病原菌D2形态特征Figure 4Morphological characters of pathogen D2
2.2.2分子生物学鉴定
提取3种病原菌的基因组DNA,以真菌通用引物ITS1和ITS4进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测,以DNA Marker-DL2 000为对照,在500 bp左右有明显的扩增条带(图5)。扩增产物送上海生工测序,将测序结果与GenBank中所登陆的其他同源序列进行比对,结果发现,3种菌D、D1、D2的rDNA-ITS序列分别与GenBank中的F.oxysporum、F.tricinctum、F.solani同源性达100%、99%、99%,利用MEGA 6.06软件构建了系统发育树,发现3种菌D、D1、D2分别与尖孢镰刀菌(F.oxysporum JF807396)、三线镰刀菌(F.tricinctum EF611092)、茄病镰刀菌(F.solani JF912885)亲缘关系最近,聚在一起(图6)。结合形态学鉴定结果,可以确定这3种病原菌分别为尖孢镰刀菌、三线镰刀菌、茄病镰刀菌。
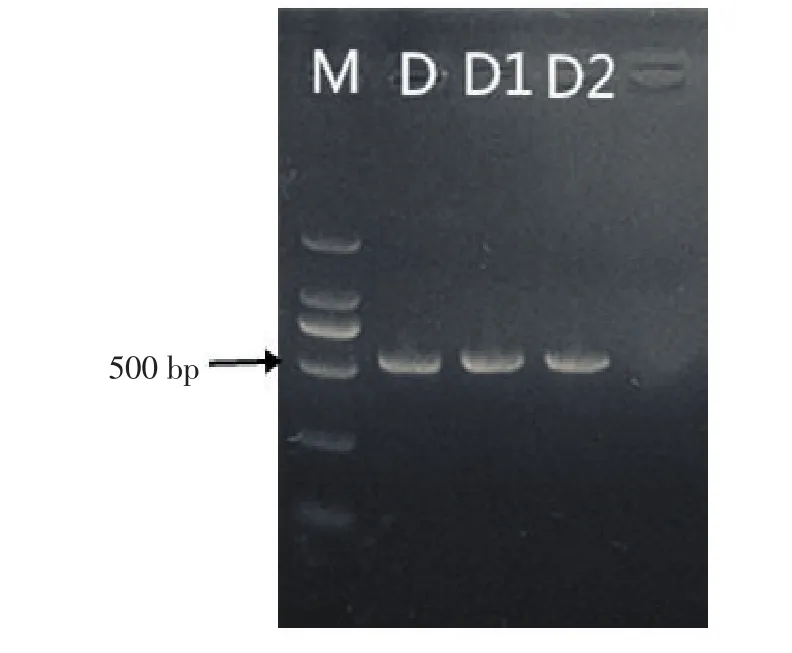
图5 病原菌DNA的PCR扩增产物电泳图Figure 5Electrophoresis of PCR production with DNA extract of pathogen
2.3病原菌生物学特性研究
2.3.1不同温度对病原菌生长的影响
图7结果所示,3种病原菌在10~35℃均可生长,病原菌D、D1、D2分别在25,20和30℃时菌落的生长速率显著高于其他温度,为病原菌最适生长温度。温度为5℃时病原菌D与D2不长,在40℃时3种病原菌均停止生长。
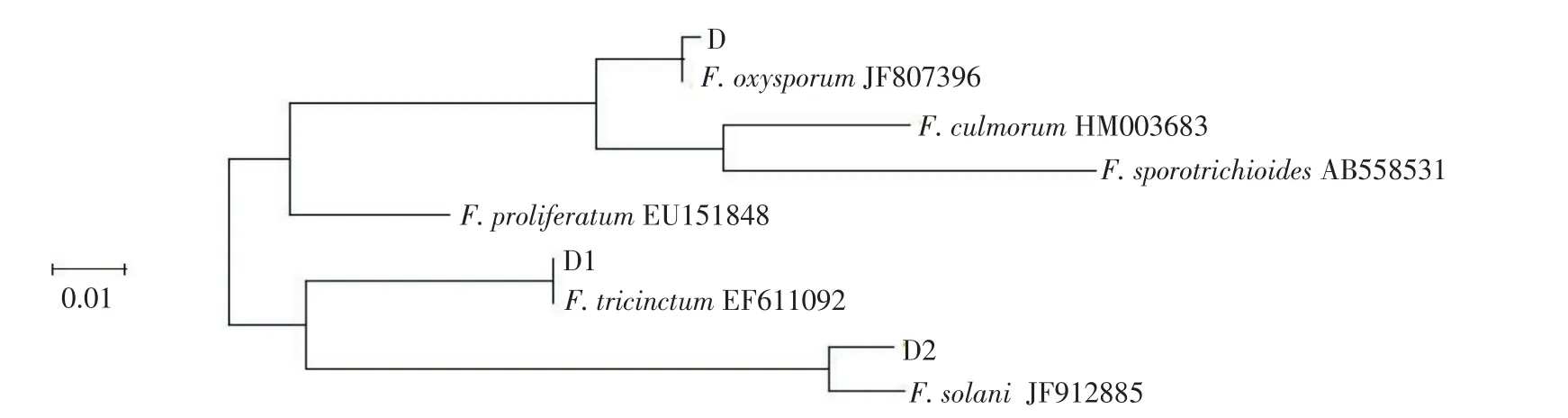
图6 基于rDNA-ITS序列构建的系统发育树Figure 6Phylogenetic tree based on rDNA-ITS sequences
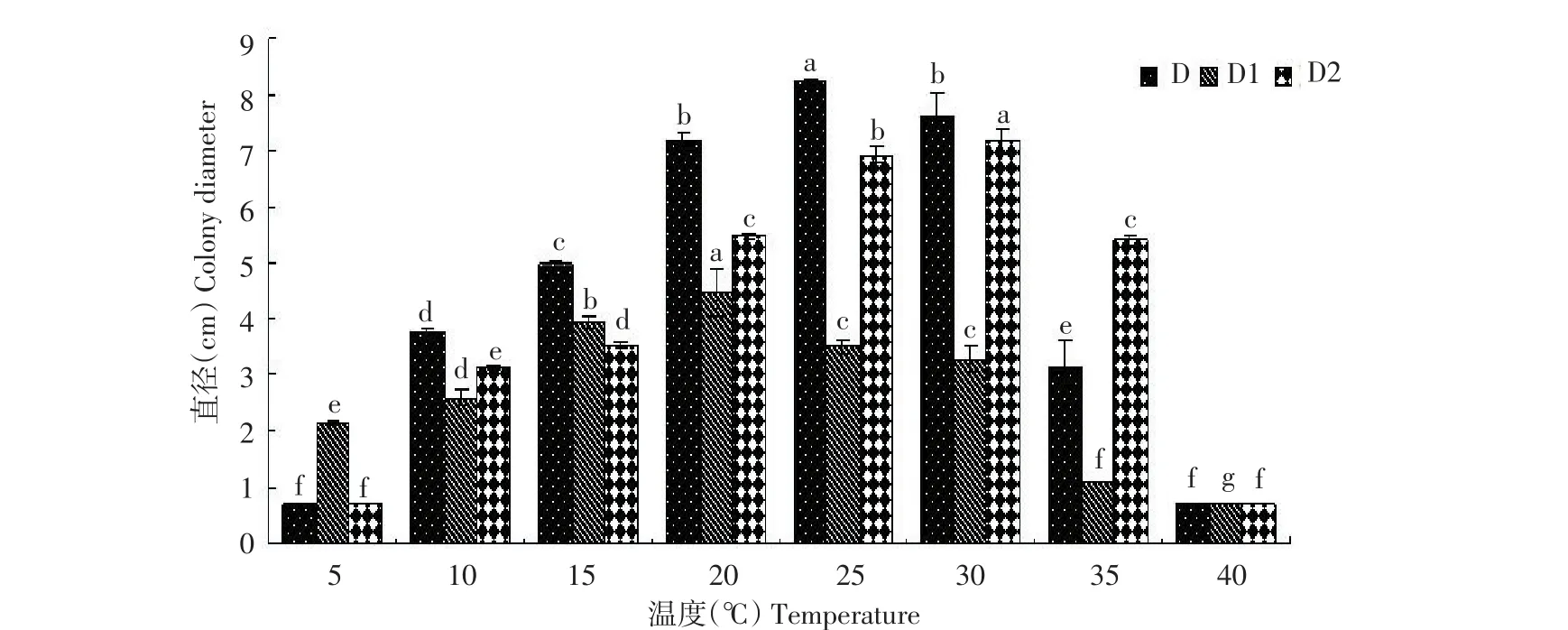
图7 温度对病原菌生长的影响Figure7Effects of temperature on pathogen growth
2.3.2不同pH对病原菌生长的影响
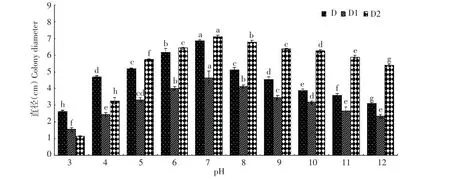
由图8结果可知,3种病原菌在pH 3~12均可生长,pH 6~8时,适合菌丝生长,pH 7时的生长速率显著高于其他处理;病原菌D、D1在最适pH时的菌落直径与pH3、pH4、pH11、pH12的菌落直径差异显著,说明强酸、强碱不适合该菌的生长;病原菌D2,强酸可以稍抑制其生长,但在强碱环境下基本不影响其生长。在pH为3时,病原菌D培养基变为红色,不产生紫色色素;病原菌D1的菌丝与培养基均为黄色,不产生酒红色的色素;病原菌D2的培养基变为橙黄色,不产生绿色色素,均与其他处理的正常生长性状不同,说明强酸环境会影响病原菌色素的形成。
2.3.3不同培养基对病原菌生长的影响
由图9结果可知,3种病原菌在7种不同的培养基上均可生长。病原菌D的最适培养基为PDA、PSA、Bilais,在Bilais培养基上菌丝稀疏,查彼培养基不适合该病菌的生长;D1的最适培养基为玉米粉与燕麦粉培养基,这2种培养基菌落生长的直径较大但是菌丝生长稀疏,Bilais与水琼脂培养基不适合该病原菌的生长,生长速率较慢,但是Bilais培养基促进该病原菌产孢;D2的最适培养基为PSA,在燕麦粉培养基上该病原菌生长较慢。
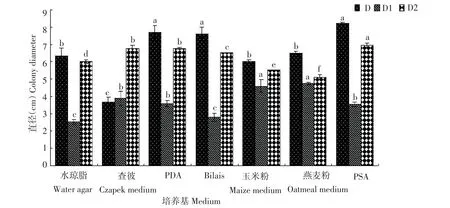
图9 不同培养基对病原菌生长的影响Figure 9Effects of different media on pathogen growth
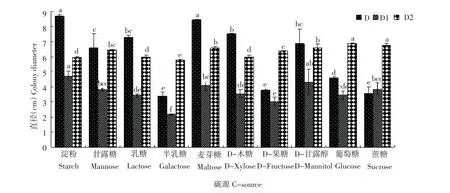
图10 不同碳源对病原菌生长的影响Figure 10Effects of different C-source on pathogen growth
2.3.4不同碳、氮源对病原菌生长的影响
由图10结果可知,病原菌D的最适碳源为淀粉和麦芽糖,其次为木糖、乳糖、甘露醇,且之间差异不显著,菌丝生长速度最慢的是半乳糖、果糖、蔗糖;病原菌D1以淀粉为最适碳源,其次为甘露糖、麦芽糖、甘露醇、蔗糖,且之间无显著差异,在半乳糖为碳源时病菌生长速度最慢,该碳源与其他碳源差异显著;病原菌D2的最适碳源是葡萄糖与蔗糖,半乳糖为碳源时菌丝生长速度最慢。
由图11可知,病原菌D的最适氮源为蛋白胨,其次为碳酸氢铵、硝酸钾,且与最适氮源差异不显著,病原菌以尿素为氮源时停止生长;病原菌D1的最适氮源为尿素,且与其他氮源处理差异显著,其次适合该病原菌生长的氮源为硝酸钾、硝酸钠,且之间差异不显著,氮源为硫酸铵、碳酸氢铵、氯化铵时菌丝生长速度最慢,说明该病原菌对铵态氮的利用率不高;病原菌D2的最适氮源是硝酸钾,氮源为氯化铵时病菌菌丝生长缓慢。

图11 不同氮源对病原菌的影响Figure 11Effects of different N-source on pathogen growth
3 讨论
中国是马铃薯生产大国,近几年来马铃薯的种植面积不断增加,马铃薯病害种类逐年增多,危害也渐重。马铃薯枯萎病近年来已经逐渐成为制约马铃薯生产的一大病害,由于该病是由多种镰刀菌侵染引起的土传病害,而且镰刀菌的寄主范围较广泛,因此对于该病的防治比较困难。
本文通过对马铃薯枯萎病病原菌的分离及鉴定得知,内蒙古地区引起马铃薯枯萎病的病原菌为尖孢镰刀菌、三线镰刀菌和茄病镰刀菌3种。据报道[1,2,4]马铃薯枯萎病可以由尖孢镰刀菌与茄病镰刀菌引起,而且这2种病原菌也是引起中国新疆和河北地区马铃薯枯萎病的病原菌;对于三线镰刀菌引起内蒙古地区的马铃薯枯萎病还是首次发现,尚不清楚该病原菌是否会导致其他马铃薯种植区的枯萎病发生,而且内蒙古地区是否还存在其他类型病原菌还需研究。本研究发现,在所有分离物中,尖孢镰刀菌所占的比例最大,为46.5%,是内蒙古地区最主要优势的致病菌。
据王勇等[7]报道,茄病镰刀菌的最适生长温度为26~30℃,最适培养基为PSA和察氏培养基。杨静美等[8]报道,番木瓜上的茄病镰刀菌的最适生长温度为25~30℃,最适碳源为葡萄糖,淀粉为碳源时不适合其生长,最适氮源为蛋白胨,氯化铵、硫酸铵、磷酸二氢铵抑制其生长。孔琼等[9]报道了香荚兰上尖孢镰刀菌的生物学特性,报道称该菌的最适生长温度28℃,5℃和37℃均抑制其生长,最适的pH为7,强酸强碱对其生长有抑制作用。本试验结果与前人的研究略有差异,可能是病原菌的地理来源及寄主不同,也可能是镰刀菌的遗传差异较大,几种镰刀菌为不同的变种。
3种病菌适应性较广,在温度为15~30℃时均能正常生长,说明马铃薯枯萎病在整个马铃薯生长季节均可发生;强酸、强碱环境抑制尖孢镰刀菌与三线镰刀菌的生长,但是茄病镰刀菌对pH不敏感,比较耐碱,在强碱的环境中仍然可以生长。这可能是导致各生态区马铃薯枯萎病都有发生的生物学基础。
本文通过对马铃薯枯萎病病原菌的基本形态特征及生物学特性的研究,初步阐明了病原菌生长与环境条件的关系,为进一步研究马铃薯枯萎病病害发生规律及病害防治提供了一定的理论依据。
[1]Rakhimov U Kh,Khakimov A Kh.Wilt of potatoes in Uzbekistan[J]. Zashchital Karantin Rastenii,2000,3:46.
[2]彭学文,朱杰华.河北省马铃薯真菌病害种类及分布[J].中国马铃薯,2008,22(1):31-33.
[3]王玉琴,杨成德,陈秀蓉,等.甘肃省马铃薯枯萎病(Fusarium avenaceum)鉴定及其病原生物学特性[J].植物保护,2014,40 (1):48-53.
[4]王丽丽,日孜旺古丽,苏皮,等.乌昌地区马铃薯真菌性病害种类及5种新记录[J].新疆农业科学,2011,48(2):266-270.
[5]方中达.植病研究法[M].北京:中国农业出版社,2003:124,138.
[6]Booth C.The Genus of Fusarium[M].Kew,England:CMI,1971: 100-101.
[7]王勇,杨秀荣,杨依军,等.茄根腐病致病病原—茄病镰刀菌及其蓝色变种的生物学特性研究[J].天津农学院学报,2002,9 (2):21-25.
[8]杨静美,陈健,罗金棠,等.番木瓜茄病镰刀菌的生物学特性研究[J].中国热带农业,2011,38(1):56-58.
[9]孔琼,王云月,朱有勇,等.香荚兰尖孢镰刀菌生物学特性[J].西南农业学报,2005,18(1):47-49.
Pathogen Identification and Biological Characteristics of Potato Wilt in Inner Mongolia
CHEN Hui,XUE Yufeng,MENG Meilian,MA Zhiwei,LIU Zhihui,HU Jun*
(College of Agronomy,Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010019,China)
In recent years,the potato wilt is becoming more and more serious in Inner Mongolia.In order to identify the pathogen,some suspected samples were collected,isolated and identified in Inner Mongolia from 2009 to 2014. Morphologic characteristics,pathogenicity test and molecular method were used to identify the pathogen.The results showed that the main pathogen causing potato wilt was Fusarium oxysporum,F.tricinctum and F.solani in Inner Mongolia.For the growth of F.oxysporum,its optimal temperature was 25℃;the optimal pH was 7;the best culture medium was PDA,PSA and Bilais;the optimal carbon source was starch and maltose,and nitrogen source was peptone.For the growth of F.tricinctum,its optimal temperature was 20℃;the optimal pH was 7;the best culture medium was cornmeal agar and oatmeal media;and the optimal carbon source and nitrogen source were starch and carbamide.For the growth of F.solani,its optimal temperature was 30℃;the optimal pH was 7;the best culture medium was PSA;the optimal carbon source were glucose and sucrose,and nitrogen source was potassium nitrate.
potato wilt;Fusarium;pathogen identification;biological characteristic
S532
A
1672-3635(2016)04-0226-09
2015-03-12
国家现代马铃薯产业技术体系建设岗位专家专项(nycytx-15,gwzj-20)。
陈慧(1990-),女,硕士研究生,研究方向为马铃薯病害。
(Corresponding author):胡俊,教授,研究方向为植物病害综合防治,E-mail:hujun6202@126.com。

