非小细胞肺癌少见的EGFR外显子21 L858R复合突变与单一突变的分析研究
周 欣 朱红革 王秀丽 展翼翼 卡哈尔江·阿不都外力 卢素琼 刘春玲
非小细胞肺癌少见的EGFR外显子21 L858R复合突变与单一突变的分析研究
周欣朱红革王秀丽展翼翼卡哈尔江·阿不都外力卢素琼刘春玲
目的比较了少见EGFR外显子21 L858R复合突变与单一突变的临床特征及研究两组对TKI治疗的反应。方法回顾性分析799例非小细胞肺癌患者,接受EGFR突变测试,443例患者发现有EGFR突变,其中22例(4.97%)有复合突变,详细描述6例EGFR外显子21 L858R复合突变患者和18例单一L858R突变患者的临床特征。结果疾病控制率和客观反应率L858R复合突变组和单一突变组之间没有差别。log-rank test发现,两组总生存或无疾病进展生存方面比较无显著性差异。结论复合突变组和单一突变组对EGFR TKIs反应和患者预后无显著差异。
非小细胞肺癌;EGFR突变;复合突变
(The Practical Journal of Cancer,2016,31:1242~1246)
肺癌,是中国最常见的癌症,往往诊断时已是晚期。非小细胞肺癌(NSCLC)占了肺癌的80%~85%[1]。晚期非小细胞肺癌患者一定程度上受益于细胞毒化疗;更确切地说,化疗的疗效是20%~35%,中位生存期大约是10~12个月[2-4]。最新的靶向疗法的应用为我们提供了这种疾病治疗的新的选择。
非小细胞肺癌经常有EGFR(EGFR) 突变。EGFR酪氨酸激酶中,发现有突变的四个外显子18~21,其中19和21外显子突变是两大经典的突变[5-7]。小分子EGFR酪氨酸激酶抑制剂(TKIs),包括厄洛替尼及吉非替尼,最早在中国用于晚期非小细胞肺癌患者的药物。最近的数据表明,EGFR突变与NSCLC标准一线化疗相比,改善了无进展生存(PFS)并提高了疗效[5]。
单一突变为EGFR突变中只有一种突变形式,复合突变为EGFR突变中两个或更多的突变在肿瘤共存。值得注意的是,已经有证据表明,不同的突变状态可能导致对EGFR TKI治疗不一致的疗效及结果。Iressa泛亚研究(IPASS)表明,使用吉非替尼的PFS和客观缓解率 (ORR),外显子19缺失和21外显子点突变L858R亚群没有发现显著差异[5]。然而,Won 等[6]的研究观察到外显子19缺失和L858R突变的总生存期(OS)和ORR虽然没有统计的差异,EGFR TKI治疗晚期非小细胞肺癌,外显子19缺失可以预测更有利的PFS。除了主要的EGFR突变,仍有一些罕见的突变。Sequist等[7]筛选98例患者,来自11个中心并得出结论:外显子19缺失和21外显子点突变L858R分别占53%和26%的突变。剩下的21%非典型突变包括20外显子的T790M,18外显子的G719A,21外显子的L861Q。L858R和外显子19缺失患者的ORR和TTP(进展时间)并没有统计学差异。
最经典的突变已被广泛研究,而很少有研究关注其他不常见的EGFR突变的临床意义,例如EGFR突变中两个或更多的突变在肿瘤共存。本研究旨在进一步了解复合突变包括EGFR TKI L858R突变的临床意义。
1 材料与方法
1.1研究对象
从2007年11月1日至2014年11月1日就诊于新疆肿瘤医院接受EGFR基因检测的原发性肺癌患者。入选标准:①患者完整的医疗记录(包括PS评分、家族史、吸烟史、组织学、治疗史,疗效评价);②必要的相关检测数据[组织学检查,计算机断层扫描(CT)的头部、胸部、腹部,血液检查];③EGFR复合突变或单一突变中有21 L858R出现的患者,这些患者接受EGFR TKIs治疗和定期随访。④通过原发病灶或转移病灶取得细胞学或组织学标本进行EGFR突变测试。临床分期根据美国癌症联合委员会第七版(AJCC)TNM分类决定。研究得到新疆肿瘤医院伦理委员会批准并得到患者或家属知情同意。
1.2治疗和评价
晚期肺癌患者每天口服吉非替尼(250 mg)或厄洛替尼(150 mg),直到进展或出现无法耐受的副作用,开始及随后每月评估有效性需进行胸部CT检查。有相关症状的患者需进行脑CT、腹部CT或骨骼扫描。
肿瘤疗效是根据实体瘤疗效评价标准(RECIST) (版本1.1) 评估,其中包括部分缓解(PR),进展(PD),稳定 (SD),完全缓解(CR)。肿瘤客观缓解率被定义为CR和PR的总和[8]。疾病控制率(DCR)包括CR、PR、SD。
OS为从治疗到任何原因死亡的日期,最后随访或失访的时间。PFS为从开始治疗到进展时间或因各种原因引起死亡的时间。
1.3EGFR突变检测
所有检测在治疗前进行。主要使用来源于原发或转移性肿瘤的细胞学或组织学标本。应用苏木精伊红染色进行初始病理形态学诊断后,EGFR突变应用DNA直接测序技术检测到[9]。简言之,非小细胞肺癌蜡块被切成5 μm厚切片。DNA被分离的部分被烘烤脱蜡和梯度乙醇脱水,然后用第18~21外显子的EGFR量化和扩增引物聚合酶链反应(PCR)。一旦纯化,直接DNA测序的PCR产物进行了分析。突变被两个独立的PCR反应证实。
1.4统计学分析
应用SPSS 17.0进行数据分析。Fisher's确切概率法比较DCR和ORR的差异。通过Kaplan-Meier分析方法比较两组生存率的差异。
2 结果
2.1EGFR突变的频率
从2007年11月1日到2014年11月1日共有799例肺癌患者接受了EGFR突变测试,包括461例男性和338例女性。最终443例患者发现突变,其中421例(95.03%)单一突变和22例(4.97%)复合突变。
在病例中发现有22例(2.75%)复合突变,22例患者中有16例存在21外显子突变。
16例患者中,7例为Ⅰ期(T1N0M0)。其中1例患者确诊为Ⅰ期(T1N0M0)右肺上叶肺腺癌同时合并Ⅰ期(T1N0M0)右肺下叶支气管肺泡癌。患者坚持治疗手术后辅助治疗和使用EGFR TKI治疗2年,随访33个月没有发现复发或转移。随访其他6例未接受辅助治疗的Ⅰ期患者也未检测到手术后复发或转移。9例患者为晚期,其中3例21外显子L833V+L833F突变,6例21外显子L858R加上另一个突变。所有的9例患者接受了EGFR TKI治疗。主要特点和突变状态见表1。另外的突变,包括T790M delE746-A750、P753S S768I和E709K,证实为相邻的非癌变组织检测到的体细胞突变。
2.2基线特征对比
目前研究分析了6例L858R加上另一个突变和18例单一突变,基线特征见表2。
在复合突变和单一突变组之间的年龄、种族、性别、吸烟状态、性能状态、组织学、EGFR TKIs和手术史无显著差异(P均>0.05)。
2.3疗效和生存
复合突变组,6例患者中5例获得SD,1例获得PR。单一突变组,4例获得PR,13例获得SD,1例获得PD。通过精确概率法复合突变组和单一突变组治疗效果没有区别,DCR分别为100.0%(6/6 )和94.4%(17/18)(P=1.0);ORR分别为16.7%(1/6)和22.2%(4/18)(P=0.5392)。
随访至2013年12月,复合突变组中位PFS为12.2个月。单一突变组中位PFS超过8个月,两组比较无明显差异(P=0.779)(图1)。
1年生存率复合突变组为66.7%,单一突变组为55.6%,2年生存率两组分别为50.0%和33.4%。
复合突变组中位OS为28.6个月。单一突变组中位OS已超过28个月。两组OS比较无显著差异 (P=0.833)(图2)。

表1 21外显子L858R复合突变主要特征
注:EGFR TKIs为表皮生长因子受体络氨酸激酶抑制剂;PFS为无疾病进展生存期;OS为总生存期;SD为疾病稳定;PR为部分缓解。

表2 复合突变和单一突变的基线特征/例
注:a为不吸烟或吸烟量不到10年包。一线:TKI作为一线治疗;二线:TKI作为二线治疗。ECOG PS为东部肿瘤合作组体能状态;EGFR TKIs为表皮生长因子酪氨酸激酶抑制剂。
3 讨论
EGFR复合突变是少见突变,数量较少。最近,有较多的研究都集中在这些非典型的突变[10-12]。本研究比较了中国肺癌患者复合突变L858R同时伴有另一个突变与单一L858R突变的临床意义。结果表明,DCR,OR,PFS和OS在这两个组没有明显差异。
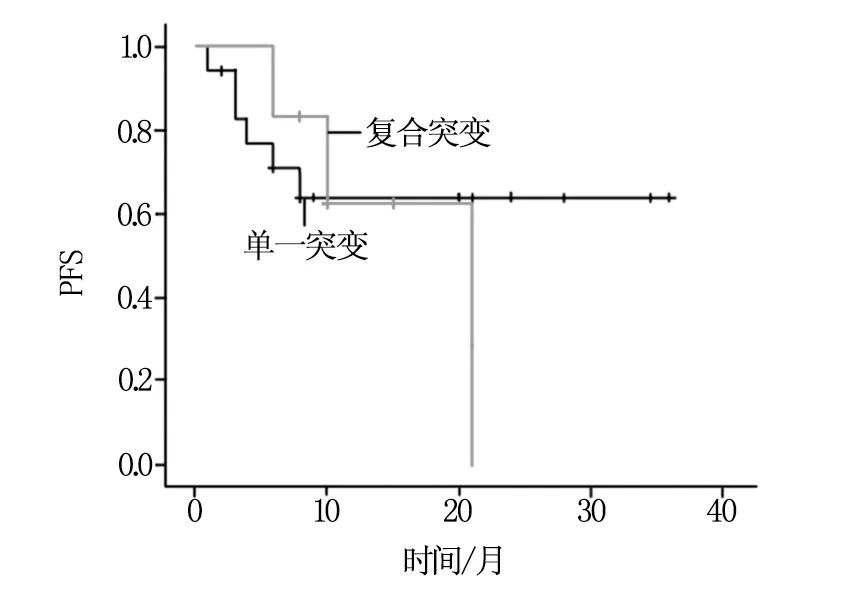
图1 两组PFS比较

图2 两组生存情况比较
本研究较早的关注了中国患者EGFR TKIs的疗效,有关复合L858R突变和单一突变的不同,这可能对优化EGFR TKIs的使用有帮助。约10%~20%高加索人种和30%~60%的亚洲非小细胞肺癌患者中检测到EGFR突变,而且在女性,非吸烟者,腺癌突变率更高[13-17]。最常见的突变包括外显子19和21外显子(L858R),并且已经证实这些突变患者使用EGFR TKIs与标准的化疗药物相比有较好的疗效和PFS[18-19]。然而,与常见的EGFR突变相比,相对很少有人了解罕见的EGFR突变。在本研究中,发现有22例(2.75%)患者具有复合突变。同样,Wu 等[10]也报告有20(3.19%)例复合突变。此外,Kobayashi等[11]在79例非小细胞肺癌病例检测到EGFR突变模式,发现11例(14%)患者有复合突变。Liu等人的研究中,140例病人中21例(21/140,15.0%)有多个突变[12]。根据上述研究,复合突变在非小细胞肺癌发生率很低。复合突变对EGFR TKIs疗效和对患者的预后影响目前还不明确。Kobayashi等[11]报道三例患者L858R复合突变,使用EGFR TKIs其中L747V联合L858R和R776H联合L858R疗效均取得PR,而L858R联合A871G疗效为 PD 。分别获得6月以上,3 月以上和2月的PFS和6月以上,3月以上,和3个月的OS。在本研究中,6例有复合L858R突变晚期非小细胞肺癌患者接受TKI治疗;其中5位患者疗效SD,1例疗效PR。这6例患者的中位PFS和OS 分别为12.2个月和28.6个月。
研究表明T790M与EGFR TKI 耐药密切相关[20-21],视为位于外显子20的第二体细胞突变。林动等[22]发现患者基线EGFR T790M突变限制了由TKI治疗中获益[23]。此外,Kim等[24]报道,1例L858R+T790M双突变患者使用EGFR TKI 1月内出现PD,同时 1个月PFS和17.4个月OS。然而,在本研究中,1例T790M+L858R突变患者获得SD,同时PFS 10个月和OS18个月(仍生存)。这些不同的结果的研究表明,还有其他因素参与和影响患者对治疗的疗效和结果。
此外,我们还发现其他四个其他复合突变包括L858R+delE746-A750/P753S/S768I/E709K,而这些复合突变未见其他的研究报告。先前的研究表明,delE746-A750是一个常见的外显子19激活EGFR的体细胞突变并且在药物对吉非替尼敏感性中发挥了关键作用[25-26]。S768I是1种罕见的EGFR外显子20的体细胞突变并且对吉非替尼显示较好的临床疗效[27]。相同的是,我们发现患者L858R+delE746-A750/S768I复合突变有对EGFR TKIs有很好的疗效。P753S E709K,罕见的体细胞EGFR突变相应在外显子19和18,分别被发现在皮肤鳞状细胞癌患者和头颈部鳞状细胞癌。然而,本研究表明,L858R + P753S/E709K复合突变对EGFR TKIs有很好的客观疗效。这些结果表明,L858R可能在EGFR TKIs的客观反应中发挥主要作用,并且复合突变之间的相互作用机制应进一步研究。
本研究有一些局限性。由于复合突变很少发生,仅22例参与这项研究。这可能会增加假阴性的机会。作为回顾性研究,患者治疗策略会不一致。有些病人EGFR TKIs作为一线治疗,而有些是二或三线治疗。这种不一致可能会影响对治疗的反应和病人的预后。需要对更多有复合突变患者行进一步的研究。
本研究通过比较少见的L858R复合突变与L858R单一突变的临床意义及对EGFR TKIs的疗效,证明两组之间的未发现显著差异。
[1]Li C,Hu D,Shi X,et al.A Multicentre Prospective Evaluation of the Impact of Renal Insufficiency on In-hospital and Long-term Mortality of Patients with Acute ST-elevation Myocardial Infarction〔J〕.Chin Med J (Engl),2015,128(1):1-6.
[2]Gu Y,Zhang M,Li GH,et al.Diagnostic Values of Vascular Endothelial Growth Factor and Epidermal Growth Factor Receptor for Benign and Malignant Hydrothorax〔J〕.Chin Med J (Engl),2015,128(3):305-309.
[3]Zhou CZ,Qin YY,Xie ZH,et al.Efficacy of third-line pemetrexed monotherapy versus pemetrexed combination with bevacizumab in patients with advanced EGFR mutation-positive lung adenocarcinoma〔J〕.Chin J Cancer Res,2014,26(6):705-710.
[4]Yu D,Li J,Han Y,et al.Gene expression profiles of ERCC1,TYMS,RRM1,TUBB3 and EGFR in tumor tissue from non-small cell lung cancer patients〔J〕.Chin Med J (Engl),2014,127(8):1464-1468.
[5]Chen L,Chen R,Zhu Z,et al.Predictive factors associated with gefitinib response in patients with advanced non-small-cell lung cancer (NSCLC)〔J〕.Chin J Cancer Res,2014,26(4):466-470.
[6]Schuler PJ,Boeckers P,Engers R,et al.EGFR-specific T cell frequencies correlate with EGFR expression in head and neck squamous cell carcinoma〔J〕.J Transl Med,2011,9:168.
[7]谢亚琳,梁继珍,苏宁,等.吉非替尼与厄洛替尼在EGFR基因敏感突变晚期NSCLC患者一线治疗中的疗效比较〔J〕.南方医科大学学报,2015,35(3):446-449.
[8]张全,谭群友,王如文,等.非小细胞肺癌 EGFR基因突变与ERCC1、TYMS mRNA表达相关性的研究〔J〕.重庆医学,2015,44(9):1177-1179,1183.
[9]汤雪璐,孙青.非小细胞肺癌组织中 EGFR 基因扩增情况观察〔J〕.山东医药,2015,55(15):42-43.
[10]Li L,Zhang Z1,Bie Z,et al.Epidermal growth factor receptor mutation analysis in cytological specimens and responsiveness to gefitinib in advanced non-small cell lung cancer patients〔J〕.Chin J Cancer Res,2015,27(3):294-300.
[11]胡述提,金冰,林涛,等.合并恶性胸腔积液的晚期肺腺癌患者胸水表皮生长因子受体基因突变检测〔J〕.中华实验外科杂志,2015,32(4):900-902.
[12]方健.EGFR突变NSCLC二线TKIs治疗优化选择〔J〕.医学与哲学,2014,35(22):20-23.
[13]刘晓晴,李治桦.EGFR基因突变NSCLC全程管理〔J〕.医学与哲学,2014,35(22):15-19.
[14]郭元杰,汪威,付莎,等.xTAG液相芯片技术用于肺癌 EGFR基因突变检测的临床适用性〔J〕.临床与实验病理学杂志,2014,30(11):1242.
[15]夏国豪,曾赟,方瑛,等.化疗后再使用EGFR-TKI治疗晚期非小细胞肺癌的临床研究〔J〕.中国肿瘤临床,2014,41(22):1454-1458.
[16]王星星,邵铭心,孙宏伟,等.伴 EGFR-T790M 突变非小细胞肺癌的治疗新进展〔J〕.中国老年学杂志,2015,35(1):272-274.
[17]应希慧,纪建松,涂建飞,等.表皮生长因子受体酪氨酸激酶抑制剂联合放射性粒子植入治疗肺癌的疗效分析〔J〕.介入放射学杂志,2015,24(3):226-230.
[18]李学真,邹文,马进安,等.EGFR-T790M突变所致吉非替尼耐药肺腺癌细胞化疗药物敏感性变化的研究〔J〕.中国癌症杂志,2015,25(2):129-134.
[19]邓飞鸿,聂飚,左俊华,等.AAV-HGFK1抑制EGFR磷酸化拮抗大肠癌细胞生长〔J〕.重庆医学,2014,43(33):4447-4449,4453.
[20]王芬,王洁,白桦,等.晚期非小细胞肺癌EGFR蛋白磷酸化、基因突变与EGFR-TKI疗效相关性的研究〔J〕.中国癌症杂志,2014,24(9):657-668.
[21]张琰,马玲,单莉,等.新疆维吾尔族非小细胞肺癌表皮生长因子受体基因突变与临床病理特征的关系〔J〕.实用肿瘤杂志,2013,28(5):469-472.
[22]林动,许凌,林景辉,等.埃克替尼一线治疗EGFR敏感性突变的晚期非小细胞肺癌的疗效观察〔J〕.实用肿瘤杂志,2015,30(3):220-224.
[23]蔡开灿.非小细胞肺癌术后EGFR基因状态对化疗、靶向治疗疗效影响的临床研究〔D〕.南方医科大学,2013.
[24]于飞.EGFR突变细胞系HCC827-TR获得性耐药机制及Afatinib逆转耐药研究〔D〕.天津医科大学,2014.
[25]孙莹莹.新型EGFR靶向性小分子NXG对肺癌敏感性判定〔D〕.哈尔滨医科大学,2014.
[26]李耀勇.厄罗替尼对含不同EGFR变异的人肺癌细胞以及基质细胞的抑制实验研究〔D〕.中国医科大学,2014.
[27]张铁梅.EGFR突变状态对NSCLC预后的影响〔D〕.天津医科大学,2013.
(编辑:吴小红)
Analysis of Rare Compound EGFR Exon 21 L858R Mutations and a Single Mutation of NSCLC Patients
ZHOU Xin,ZHU Hongge,WANG Xiuli,et al.
Affiliated Tumor Hospital of Xinjiang Medical University,Urumqi,830011
ObjectiveTo compare the rare EGFR exon 21 L858R mutation and the clinical features of a single mutation and study response of the 2 groups to TKI treatment.MethodsA retrospective analysis of 799 cases of patients with non-small cell lung cancer were conducted,patients received EGFR mutation testing,443 patients had EGFR mutations,22 cases (4.97%) had multiple mutations,detailed description of clinical features of 6 patients with compound EGFR exon 21 L858R mutations and 18 cases of patients with single L858R mutations were conducted.ResultsDisease control rates and objective response rate of compound L858R mutations and a single mutation had no difference.Log-rank test found that total survival or disease-free progression survival had no significant difference.ConclusionCompound group and a single mutation of EGFR TKIs response and prognosis in patients have no significant difference.
NSCLC;EGFR mutation;Compound mutation
830011 新疆医科大学附属肿瘤医院
刘春玲
10.3969/j.issn.1001-5930.2016.08.008
R734.2
A
1001-5930(2016)08-1242-05
2015-07-24
2016-06-20)

