几种天然吡喃酮衍生物的抗肿瘤活性分析
郑旭升,李慧慧,李 琦,唐 宇,王毅刚,许传莲
(1.浙江理工大学生命科学学院,杭州 310018;2.天津大学药学院,天津 300072)
几种天然吡喃酮衍生物的抗肿瘤活性分析
郑旭升1,李慧慧2,李琦2,唐宇2,王毅刚1,许传莲1
(1.浙江理工大学生命科学学院,杭州 310018;2.天津大学药学院,天津 300072)
通过对几种天然吡喃酮衍生物的抗肿瘤活性分析,获得具有较强抗肿瘤活性的该类化合物。利用MTT法检测6种结构经修饰与改造的天然吡喃酮类化合物对多种肿瘤细胞的细胞毒性,结果显示化合物LiQ-1与LiH-Ⅳ-80的抗肿瘤活性最为显著。利用化合物LiQ-1分析其对人红白血病K562细胞的生长影响,结果呈剂量依赖关系。通过对化合物的结构分析比较证明,对于化合物LiH-IV-80、LiH-IV-50-2和LiH-III-122-2,在7-位形成的内酯环对抑制肿瘤细胞增殖有着重要的影响,而对于化合物LiQ-1、LiQ-2和LiQ-4,4-位OH对化合物的抗肿瘤活性影响较大。
天然吡喃酮;结构修饰;MTT法;抗肿瘤活性
0 引言
肿瘤是严重威胁人类健康和高致死率的疾病之一[1]。在传统的癌症治疗方法中,化学药物具有举足轻重的地位,而绝大部分化学合成类抗肿瘤药物都是以具有抗肿瘤活性的天然产物为先导化合物。目前临床上使用的抗肿瘤药物62.9%来源于天然产物[2-3],由此可见天然产物在肿瘤化学药物这一领域中具有不可代替的作用。
二氢吡喃类化合物广泛存在于植物和微生物中,且具有多种的生物活性,主要包括免疫调节、抗炎、抗菌、抗病毒、抗肿瘤、抗氧化等[4],其中抗肿瘤活性更是研究热点。此外曾有报道显示,人们对天然吡喃类化合物进行结构修饰,得到的衍生物也具有抗肿瘤活性[5-6],如高浓度的苯并二氢吡喃衍生物xy9902能够抑制乳腺癌细胞MCF-7细胞的增殖[7]。在二氢吡喃类化合物中,苯并二氢吡喃环不仅是其重要的结构单元,也是发挥活性的主要结构。因此以二氢吡喃为母核,对其结构进行修饰和改造[8],并通过体外活性筛选,以期获得抗肿瘤活性更好的二氢吡喃类衍生物。
本实验检测了6种结构经修饰的苯并二氢吡喃类化合物的抗肿瘤活性,并分析比较化合物的不同结构修饰对肿瘤细胞的细胞毒性影响,筛选出抗肿瘤活性好的衍生物,为苯并二氢吡喃类化合物的进一步结构修饰以及开发研制新型抗肿瘤药物提供实验依据。
1 实验
1.1实验材料与仪器
1.1.1主要试剂材料
本实验所用6种结构经修饰的天然吡喃类衍生物,由天津大学药学院唐宇教授课题组提供,其结构式如图1所示。DMEM、RPMI-1640,FBS(胎牛血清)购自Gibco公司,MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐),胰酶购自杭州都泰生物科技有限公司,DMSO(二甲基亚砜)购于sigma-Aldrich公司,紫杉醇购自杭州长征化学试剂有限公司。
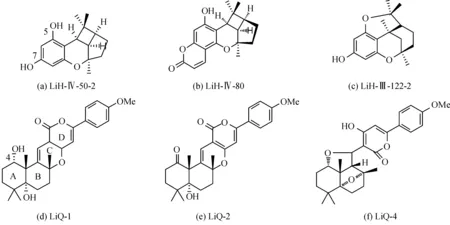
图1 6种待测天然吡喃酮衍生物结构式
1.1.2细胞株
人红白血病细胞株K562、人肝癌细胞株BEL-7404和SMMC-7721、人胃癌细胞株SGC-7901、人乳腺癌细胞株MCF-7、人肺癌细胞株A549购自中科院上海生物化学和细胞生物学研究所,K562细胞Akt1过表达株、BEL-7404细胞Akt1过表达株由本研究组构建完成[9]。
1.1.3主要仪器
XDS-1B倒置显微镜(重庆光仪公司);ELX800酶标仪(美国Biotek公司);HERA CELL 150二氧化碳培养箱(德国Heraeus公司);MS403S/01电子天平(METTLER TOLEDO公司);1300 series A2生物安全柜(Thermo公司)。
1.2方法
1.2.16种化合物细胞毒性测试
分别取对数生长期的K562、K562/Akt1、BEL-7404、BEL-7404/Akt1以及A549细胞,按3×103个细胞/孔植入96孔板中,每孔加入95μL的细胞液。对于悬浮细胞K562和K562/Akt1,待细胞铺板之后立即加入20、40、60、80、100μM的5种待测化合物各5μL,对于BEL-7404、BEL-7404/Akt1和A549,待细胞贴壁后,加入相同浓度梯度的各个化合物各5μL。同时设置终浓度为0.5%的DMSO溶剂对照组和空白调零组,各组均设置三个复孔,终体积均为100μL。于37℃,5%CO2培养箱中培养72h,每孔加入浓度为5mg/mL MTT溶液10μL,继续培养4h,弃掉培养基并于每孔加入150μL DMSO溶液,震荡10min,用酶标仪测定490nm波长处各孔OD值,并按以下公式计算化合物对细胞的抑制率:
抑制率=[1-(OD实验组-OD调零组)/(OD对照组-OD调零组)]×100%。
1.2.2化合物LiQ-1对K562细胞的生长抑制作用
取对数生长期的K562,按3×103个细胞/孔植入96孔板中,每孔加入95 μL的细胞液,待细胞铺板之后立即加入浓度分别为10、20、40 μM的化合物LiQ-1各5μL。同时设置终浓度为0.5%的DMSO溶剂对照组和空白调零组,各组均设置三个复孔,终体积均为100 μL。于37 ℃,5%CO2培养箱中培养。待化合物处理时间达24、48、72、96和120 h时,每孔加入浓度为5 mg/mL MTT溶液10 μL,继续培养4 h,弃掉培养基并于每孔加入150 μL DMSO溶液,震荡10 min,用酶标仪测定490 nm波长处各孔OD值,以天数为横轴,平均OD值为纵轴,绘制K562细胞生长曲线。
1.2.3化合物LiQ-1对多种肿瘤细胞的增值抑制作用
分别取对数生产期的K562、K562/Akt、SGC-7901、MCF-7、A549和SMMC-7721,其中MCF-7按照6×103细胞/孔,SGC-7901按5×103细胞/孔,其余细胞按3×103细胞/孔植入96孔板中,每孔加入95 μL的细胞液,对于悬浮细胞组,待细胞铺板之后立即加入5、10、20、40、80 μM的化合物LiQ-1各5 μL,对于贴壁细胞组,待细胞贴壁后,再分别加入5 μL不同浓度的化合物LiQ-1,同时设置终浓度为0.5%的DMSO溶剂对照组和空白调零组,各组均设置3个复孔,终体积均为100 μL。于37 ℃,5%CO2培养箱中培养72 h,采用MTT法检测化合物LiQ-1对不同肿瘤细胞的抑制率,具体方法参照实验1.2.1。实验重复3次,利用SPSS软件计算IC50值。
2 实验结果
2.16种化合物对不同肿瘤细胞的细胞毒性
采用MTT法检测6种吡喃酮类衍生物对K562、K562/Akt1、BEL-7404、BEL-7404/Akt1以及A549细胞生长的抑制作用,结果如表1所示。可知部分化合物抑制肿瘤细胞增殖活性具有选择性,化合物LiH-Ⅳ-50-2仅对K562细胞和BEL-7404细胞有明显抑制作用;化合物LiQ-4仅对K562和A549细胞具有明显的抑制作用;化合物LiH-Ⅲ-122-2,LiQ-2仅对K562细胞有明显抑制作用;化合物LiQ-1和LiH-IV-80的抗肿瘤活性最为显著,80μM的化合物LiQ-1和40μM LiH-IV-80的对各个受试肿瘤细胞的抑制率均达到了90%以上。
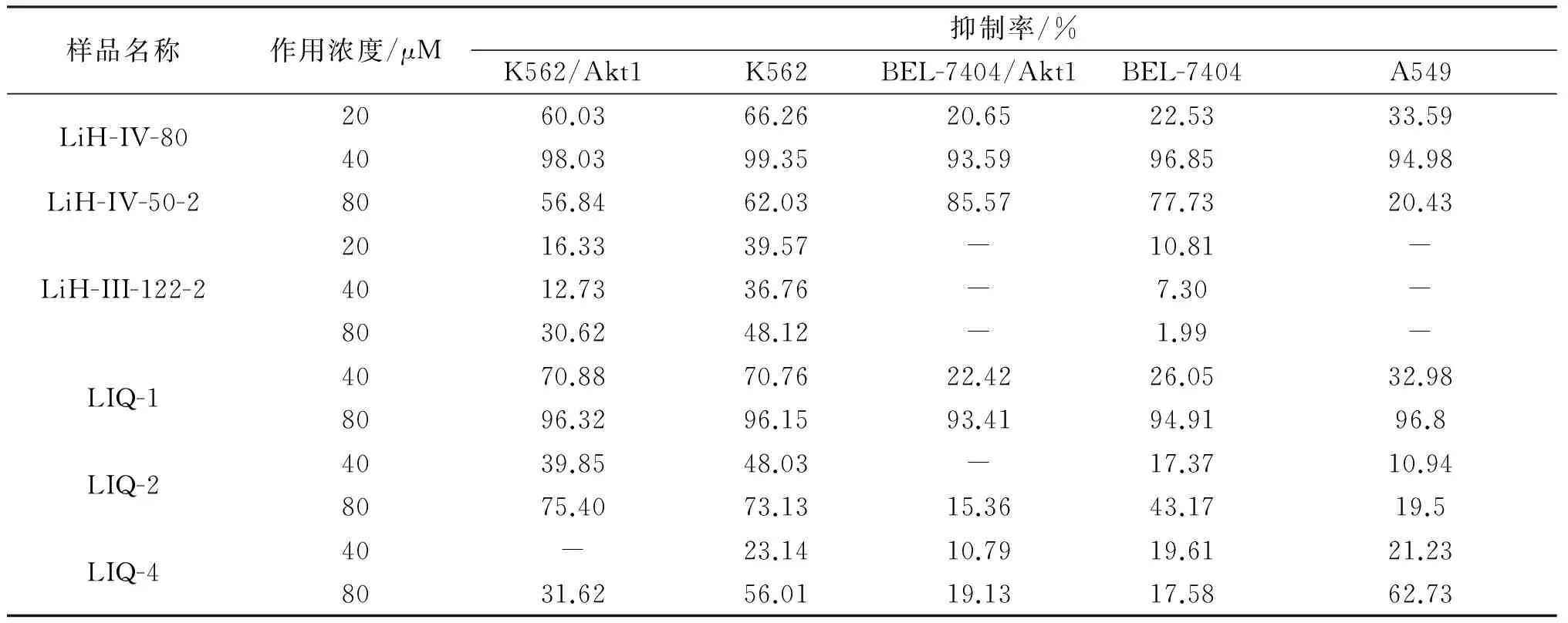
表1 6种不同化合物对5种肿瘤细胞株的抑制率
2.2化合物LiQ-1对K562细胞生长作用的影响
利用MTT比色法分析化合物LiQ-1对K562细胞生长作用的影响,实验结果如图2所示。从图2可知,化合物LiQ-1对K562细胞增长有显著的抑制作用,随着化合物浓度的上升,化合物LiQ-1对K562细胞的生长抑制越明显,呈剂量依赖性关系。
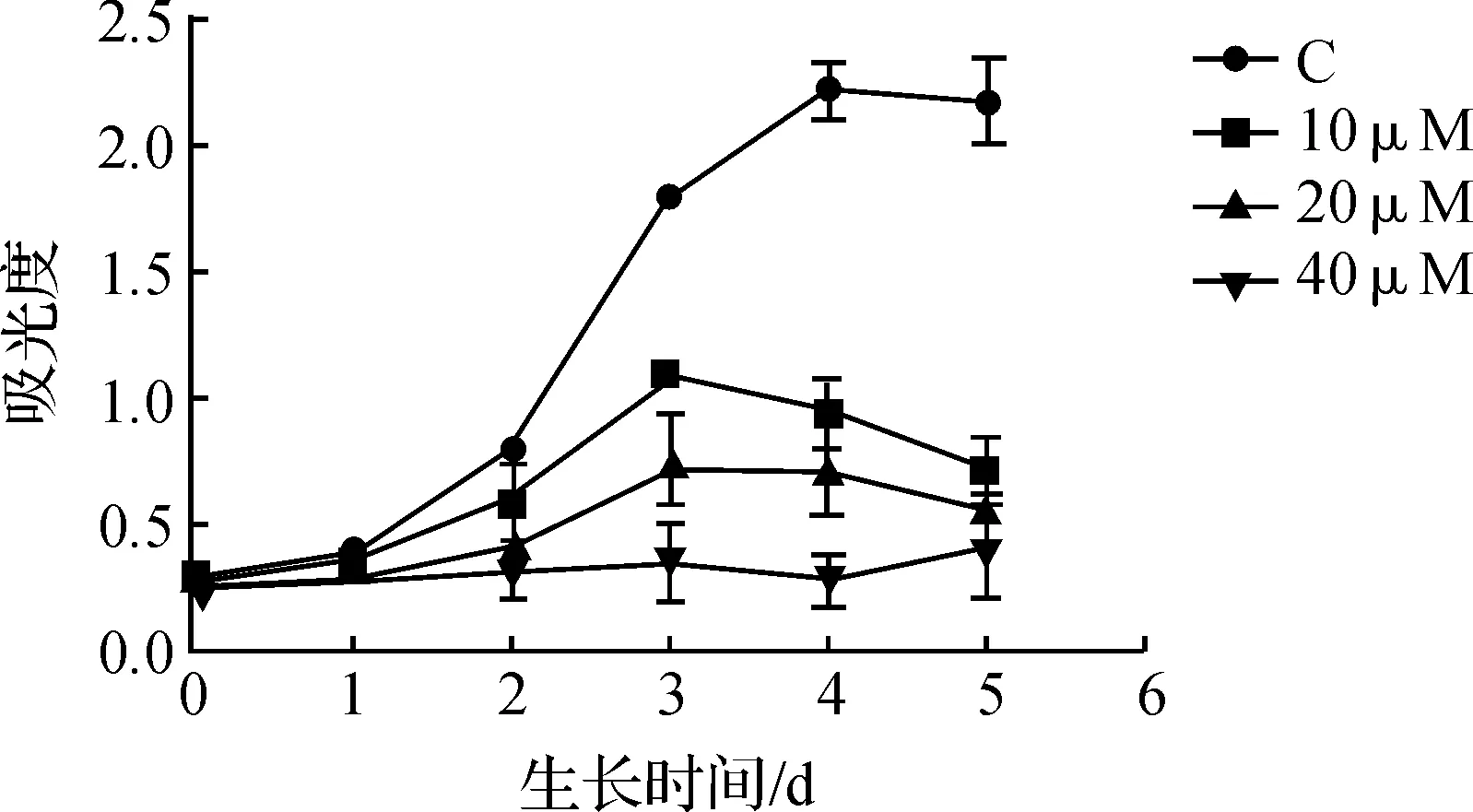
图2 化合物LiQ-1对K562细胞生长作用的影响
2.3化合物LiQ-1 对对多种肿瘤细胞的增值抑制作用
检测化合物LiQ-1对不同肿瘤细胞的抑制作用,结果表明,化合物对不同肿瘤细胞的IC50值在30~70μM之间(表2),表现出了良好的抗肿瘤活性,其中对A549、K562和K562/Akt这3种细胞的抑制作用较强,IC50值在30~40 μM之间,而SMMC-7721、SGC-7901和MCF-7的IC50值在50~70 μM之间。

表2 化合物LiQ-1对A549、SMMC-7721、SGC-7901、
3 讨 论
天然二氢吡喃类化合物广泛存在于植物和微生物中,具有丰富的生理活性,其中抗肿瘤活性是研究的热点。关于这类化合物经结构修饰与改造以增强其抗肿瘤活性的研究很多,如石磊等[10]曾设计合成了一系列全新二氢黄酮类化合物,其中有5种化合物具有很好的抗肿瘤活性,聂爱华等[11]设计并合成了2H-1苯并吡喃衍生物,发现部分化合物具有较为理想的抗肿瘤活性。本实验对6种结构经修饰的苯并吡喃类衍生物进行肿瘤细胞毒性分析,结果以化合物LiQ-1和LiH-Ⅳ-80的抗肿瘤活性最为显著,而其他4种化合物对肿瘤细胞的细胞毒性存在差异性和选择性。利用MTT法检测化合物LiQ-1对不同肿瘤细胞的抑制作用,其IC50皆介于30~70μM之间,表现出了良好的抗肿瘤活性,且通过化合物LiQ-1对K562细胞生长作用抑制的实验发现,化合物对肿瘤细胞的抑制作用呈剂量依赖关系,此外,这6种化合物对人红白血病K562细胞均具有较明显的细胞毒性,为开发研制新型的治疗人红白血病药物提供了先导化合物。
有研究实验表明,苯并吡喃类化合物对白血病、乳腺癌、肺癌、肝癌、胃癌、结肠癌等多种癌细胞均具有抑制作用[12],其中苯并二氢吡喃环是该类化合物中发挥活性的主要结构部件,本实验通过对苯并二氢吡喃类衍生物的结构比较,希望发现能够增强该类化合物抗肿瘤活性的结构修饰。通过对化合物的结构分析比较,在同系物LiH-IV-80、LiH-IV-50-2和LiH-III-122-2中化合物LiH-IV-80的活性最好,说明7-位OH形成内酯环对活性影响至关重要,通过比较化合物LiH-IV-50-2和LiH-III-122-2发现,5-位OH有利于提高化合物的生物活性(图1a)。同系物LiQ-1、LiQ-2和LiQ-4中化合物LiQ-1的活性最强,说明A环4-位OH对活性影响较为重要;而化合物LiQ-2活性优于化合物LiQ-4,说明C环的存在有利于活性的提高(图1d)。
以天然产物结构为模板进行结构修饰与改造,一直以来是人们寻找并发现新药的重要途径之一[13-15]。本实验最终筛选结果表明化合物LiQ-1和LiH-Ⅳ-80均具有较为理想的抗肿瘤活性,对这两种化合物的进一步修饰与研究,将为开发出高效低毒的新型天然吡喃酮类抗肿瘤药物提供新的线索和实验依据。
[1] HAINAUT P, PLYMOTH A. Targeting the hallmarks of cancer: towards a rational approach to next-generation cancer therapy[J]. Curr Opin Oncol, 2013, 25(1): 50-51.
[2] CRAGG G M, GROTHAUSP G, NEWMAN D J. Impact of natural products on developing new anti-cancer agents[J]. Chemical Reviews, 2009, 109(7): 3012-3043.
[3] LIU R, ZHANG H, YUAN M, et al. Synthesis and biological evaluation of apigenin derivatives as antibacterial and antiproliferative agents[J]. Molecules, 2013, 18 (9): 11496-11511.
[4] NEWMAN D J, Cragg G M. Natural products as sources of new drugs over the last 25 years[J]. Journal of Natural Products, 2007, 70(3): 461-477.
[5] YAN F, LIU Y, WANG W. Matrine inhibited the growth of rat osteosarcoma UMR-108 cells by inducing apoptosis in a mitochondrial-caspase-dependent pathway[J]. Tumor Biology, 2013, 34 (4): 2135-2140.
[6] WEI J, LIU M, LIU H, et al. Oleanolic acid arrests cell cycle and induces apoptosis via ROS-mediated mitochondrial depolarization and lysosomal membrane permeabilization in human pancreatic cancer cells[J]. Journal of Applied Toxicology, 2013, 33 (8): 756-765.
[7] YEOM H S, LI H, TANG Y, et al. Total syntheses of cannabicyclol, clusiacyclol A and B, iso-eriobrucinol A and B, and eriobrucinol[J]. Organic Letters,2013, 15 (12): 3130-3133.
[8] KIMURA Y. New anticancer agents: in vitro and in vivo evaluation of the antitumor and antimetastatic actions of various compounds isolated from medicinal plants[J]. In Vivo, 2005, 19(1): 37-60.
[9] 潘姝花, 郑婷婷, 郑旭升, 等. 过表达Akt1细胞株的构建及鉴定[J]. 浙江理工大学学报:自然科学版, 2014, 31(4): 462-466.
[10] 石磊, 班树荣, 冯秀娥, 等. 二氢黄酮类衍生物的合成及抗肿瘤活性研究[J]. 中国药物化学杂志, 2010, 20(3): 176-180.
[11] 聂爱华, 顾为, 王勇俊, 等. 2H-1-苯并吡喃衍生物的合成及其体外抗癌活性的初步评价[J]. 中国药物化学杂志, 2008, 18(2): 81-89.
[12] EL-SEEDI H R, EI-GHORAD D M H, EI-BARBARY M A. Naturally occurring xanthones; latest investigations: isolation, structure elucidation and chemosystematic significance[J]. Current Medicinal Chemistry, 2009, 16(20): 2581-2626.
[13] 郭宗儒. 天然产物的结构改造[J]. 药学学报, 2012, 47(2): 144-157.
[14] 庾石山, 冯孝章. 新型结构活性天然产物的化学研究[J]. 中国医学科学院学报, 2004, 26(4): 347-350.
[15] 黄华艺,查锡良. 黄酮类化合物抗肿瘤作用研究进展[J]. 中国新药与临床杂志, 2002, 21 (7): 428-433.
(责任编辑: 许惠儿)
Anti-tumor Activity Anaysis of Several Natural Pyrones Derivatives
ZHENGXusheng1,LIHuihui2,LIQi2,TANGYu2,WANGYigang1,XUChuanlian1
(1. College of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China;2. School of Pharmacy, Tianjin University, Tianjin 300072, China)
Natural pyrones derivatives with stronger anti-tumor activity were gained through antitumor activity analysis of several such compounds. MTT was used to detect the cytotoxicity of 6 natural pyrone compounds on tumor cells after structural modification and reconstruction. The results show that the antitumor activity of LiQ-1 and LiH-Ⅳ-80 is significantly strong. LiQ-1 was used to analyze its infleunce on erythroleukemia K562 cell growth, and the result presented dose-dependent relaitonship. Through analysis and comparison of compound structure, it is proven that for LiH-IV-80, LiH-IV-50-2 and LiH-III-122-2, lactonic ring formed in 7-position plays an important role on tumor inhibition cell proliferation. For LiQ-1, LiQ-2 and LiQ-4, 4-position OH has a great affect on tumor activity.
natural pyrone; structural modification; MTT; anti-tumor activity
10.3969/j.issn.1673-3851.2016.01.016
2015-01-21
国家自然科学基金项目(81272687);浙江省生物学重中之重学科开放基金项目(11610032211201/002/008)
郑旭升(1989-),男,浙江余姚人,硕士研究生,主要从事天然产物抗肿瘤活性方面的研究。
许传莲,E-mail:chuanlianxu@163.com
R285.5
A
1673- 3851 (2016) 01- 0099- 04 引用页码: 010702

