有机溶剂对桦褐孔菌液体深层发酵多酚和多糖的产生与活性的影响
沈梦薇,全丽丽,徐向群
(浙江理工大学理学院,杭州 310018)
有机溶剂对桦褐孔菌液体深层发酵多酚和多糖的产生与活性的影响
沈梦薇,全丽丽,徐向群
(浙江理工大学理学院,杭州 310018)
在培养基中添加1g/L的不同有机溶剂(丙酮、甲醇、氯仿、甲苯和乙醇),讨论了有机溶剂对桦褐孔菌液体深层发酵多酚和多糖的产生的影响,并通过测定多酚的DPPH自由基清除率来探究有机溶剂对多酚抗氧化活性的影响。研究结果证明,添加有丙酮、甲苯与乙醇的培养基能显著提高桦褐孔菌生物量,比对照组提高2.68%、2.27%和3.98%;以胞内外多酚含量和活性为指标,丙酮有机溶剂,胞内、胞外乙酸乙酯层和胞外正丁醇层多酚的产量分别为对照组的2.5、5.3和1.7倍,相对应的活性分别是对照组的1.3、1.3和3.0倍;以胞内外多糖含量为指标,有机溶剂均对胞外多糖有抑制作用,乙醇为最佳的添加剂使胞内多糖(在95 ℃、121 ℃下提取)的增加率达到9.67%和15.20%。推测可能是有机溶剂能有效地促进细胞膜的相容性,从而改变了细胞膜通透性,影响了细胞对培养基营养物质的吸收。同时,不同有机溶剂又会对不同种类次级代谢产物的合成产生不同的影响。
桦褐孔菌;多酚;有机溶剂;多糖;抗氧化活性
0 引 言
桦褐孔菌(Inonotusobliquus)是一类分布于北半球45~50°地区(我国主要集中在长白山地区[1])的药用真菌。几个世纪以来,这类纤孔菌属的白腐真菌素有“西伯利亚灵芝”之美称,主要用于糖尿病、心血管疾病[2]等人类难于治愈的疾病。这归因于此种真菌含有多种次级代谢产物,如多酚、多糖、三萜以及甾体等具有强活性的物质。这些具有生物活性的物质对降血糖、降血脂、肝病、抗菌治疗以及抗癌治疗有显著的效果[3-4]。其中,桦褐孔菌合成的一部分酚类化合物(如小分子酚类[5]、水溶性单宁[6]、黄酮、多酚、黑色素[7]等),都体现了良好的自由基清除能力[8-9],进而能够减少氧化应激导致的疾病。
由于天然桦褐孔菌的子实体生长环境恶劣,生长周期长,产量小且不确定因素较多,次级代谢产物的获取难上加难。近几年,越来越多的学者[10-14]开始研究液体深层发酵桦褐孔菌次级代谢产物,主要将注意力集中在培养基的配制。为了增加次级代谢产物的产量以及菌丝体量,有机溶剂被证实为一种可以经济易得的可提高次级代谢产物和菌丝体量的有效添加剂[15]。当有机溶剂加入到培养基并与细胞膜作用时,促进了部分脂肪酶的产生,并释放次级代谢产物[16]。通常选取的有机溶剂主要包括甲苯、甲醇、丙酮、乙醇等。氯仿、乙醇、甲苯等[17]已被证实对不同菌种的次级代谢产物有一定的促进效果。本文在此基础上探究培养基中有机溶剂的添加对桦褐孔菌液体深层发酵多酚、多糖产量及其DPPH自由基清除率的影响,筛选出最佳有机溶剂。
1 试验
1.1实验材料与仪器
1.1.1实验原料
用于发酵的桦褐孔菌菌种购于徐州师范大学。
1.1.2实验试剂和仪器
试剂:DPPH、福林酚试剂等,购于美国sigma公司;氯仿、乙酸乙酯、正丁醇、丙酮、乙醇、甲醇、甲苯(均为分析纯),购于杭州高晶精细化工有限公司。
主要仪器:UV1100紫外分光光度计(上海美普达),SW-CJ-IF超净台 、YX-280高压蒸汽灭菌锅、SPX-250L生化培养箱(上海博迅实业有限公司医疗设备厂),TG16-WS高速离心机(长沙湘智离心机仪器有限公司),Scientz-ⅡD超声波破碎仪(浙江宁波新芝生物科技股份有限公司)。
1.2试验方法
1.2.1实验培养基
实验中涉及到的培养基有液体种子培养基、发酵对照培养基、有机溶剂培养基。具体配比如下:
a) 液体种子培养基(g/L):葡萄糖20,蛋白胨3,酵母浸膏2,KH2PO41,MgSO41.5,CaCl20.1,pH调至6.0,用蒸馏水定容至100 mL;
b) 对照培养基(g/L):玉米粉53,蛋白胨3,KH2PO41,MgSO40.2,ZnSO4·7H2O 0.01,K2HPO4·3H2O 0.5,FeSO4·7H2O 0.05,CuSO4·5H2O 0.02,CoCl2·6H2O 0.02,MnCl2·4H2O 0.09,同上;
c) 有机溶剂培养基(g/L):有机溶剂 1,其余同对照培养基。
1.2.2液体种子的培养与液体发酵
按照液体种子培养基配制所需培养液。取出低温保存的桦褐孔菌菌种,并将之在25 ℃的恒温箱中振荡摇匀20 min。紫外灭菌超净台,将摇匀后的液体种子接种至种子培养基中,并将其于摇床中(温度为25 ℃,相对湿度为80%)进行恒温振荡培养。4 d后,待种子长满80%左右的培养液后取出。
按照对照培养基配制培养液并按每100 mL培养液的体积注入250 mL锥形瓶中。然后将其继续放入摇床进行培养。在发酵9 d时,取出所有摇瓶,进行后续分析。实验3次。有机溶剂培养基在对照培养基的基础上分别加入不同有机溶剂,其余操作方法同对照培养基。
1.2.3桦褐孔菌生物量的分析
取出摇床中的摇瓶,将菌丝体连同培养液通过抽滤的方法将之分离。反复冲洗菌丝体直至洗出液为无色,将菌丝体放置于培养皿中,恒温干燥至恒重。然后将其称重,记录菌丝体的重量,即桦褐孔菌生物量。
1.2.4桦褐孔菌胞内外多酚和多糖的提取
将烘干至恒重的菌丝体研磨成粉末,然后将粉末溶于10倍体积70%的丙酮,并在冰水浴中用超声波细胞破碎仪破壁。匀浆液再用体积比为70%的丙酮中萃取24 h,萃取3次。之后将混合物离心得上层清液。浓缩干燥上清液,即得胞内多酚,记为IPC。
将抽滤后得到的发酵培养液减压蒸馏并浓缩,同时加入4倍体积95%的乙醇。充分搅拌后,静置24 h并离心分离。将上层的溶液减压浓缩至1/4体积,用蒸馏水将体积调至最初。分别用氯仿、乙酸乙酯各20 mL萃取3次,同时冷冻干燥乙酸乙酯层,即得乙酸乙酯层胞外多酚,记为EA-EPC。继续将萃取后得到的液体用正丁醇萃取3次,冷冻干燥正丁醇层,即得正丁醇层胞外多酚,记为NB-EPC。
将之前提取胞内多酚后剩余的固体部分溶于5倍蒸馏水于95 ℃加热2 h后,冷却离心得上清液,重复操作,合并清液。继续在残渣中加入蒸馏水后于121℃加热1.5 h,重复上述操作。在两种不同清液中加入4倍95%的乙醇,充分搅拌沉淀,静置过夜,离心并冷冻干燥得胞内粗多糖并储存备用,分别记为IPS1(95℃)、IPS2(121 ℃)。
为了除去掺杂于多糖沉淀中的小分子物质和还原糖,在提取过程中离心得到的残渣中加入新的95%的无水乙醇。离心(10 min,转速为6500 r/min)并冷冻干燥得到干燥的胞外粗多糖,记为EPS。
1.2.5桦褐孔菌胞内外多酚、多糖和还原糖的测定
桦褐孔菌胞内外多酚含量的测定采用福林—酚法(Folin-Ciocalteu reagent method[18])。以没食子酸浓度(μg/mL)为横坐标,以吸光值为纵坐标绘制标准曲线。将提取的胞内外多酚样品溶解,按照标准曲线的方法测定并计算胞内外多酚的含量。
胞内外多糖含量采用苯酚硫酸法。以葡萄糖浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线[19]。配制0.1 mg/mL的多糖溶液(采用干燥得到的粗多糖),按照上述方法检测并计算胞内外多糖的含量。
还原糖的测定采用3,5-二硝基水杨酸法(DNS法)。以葡萄糖含量(mg/mL)为横坐标,以吸光值为纵坐标绘制标准曲线。将一定体积的抽滤发酵液稀释到适当浓度,按上述方法,测定并计算还原糖含量[20]。
1.2.6DPPH自由基清除率的测定
参考Yang等[21]的方法检测胞内外多酚的DPPH清除率并适当改进。配制0.4mM/L的DPPH甲醇溶液,并取0.8 mL的DPPH的甲醇溶液于试管中,同时加入2.4 mL有机溶剂培养基发酵所得胞内外多酚样品 (浓度为10 mg(GAE)/L),振荡摇匀并于暗处静置。30 min后于波长为517 nm处测AX值。与此同时,空白对照组加入等量的DPPH的甲醇溶液,并在相同的波长下测定其A0值。样品对照组用甲醇替代DPPH,其余加入物质的量与之前相同,并在相同条件下测定其AX0值。 DPPH清除率的计算公式如下:
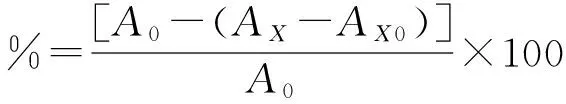
式中:A0为空白DPPH清除率,AX为样品DPPH清除率,AX0为对照DPPH清除率。
2 结果与讨论
2.1桦褐孔菌生物量
有机溶剂通常被作为一种很好的溶剂促使物质之间的相容。这些溶剂能够重组细胞膜的结构也有可能直接影响次级代谢产物所需要的酶的合成[22]。表1显示了有机溶剂对生物量的变化。

表1 有机溶剂对桦褐孔菌生物量的影响(P<0.05)
注:生物量的显著性差异用小写字母标注相同的字母代表无显著性差异(P<0.05)。
由表1生物量的差异可知,丙酮、甲苯和乙醇的效果显著,分别在对照组的基础上提高了2.68%、2.27%和3.98%(P<0.05)。这三种有机溶剂能增强细胞膜通透性,促使培养液中营养快速被细胞所利用,达到菌丝体生长的效果。
2.2桦褐孔菌胞内外多酚的产量
胞外多酚用两种不同萃取剂萃取,分别为乙酸乙酯和正丁醇。正丁醇中含有极性较强的多酚组分,乙酸乙酯层中含有极性较弱的多酚组分。测定不同萃取剂提取的多酚的含量,具体结果如图1。
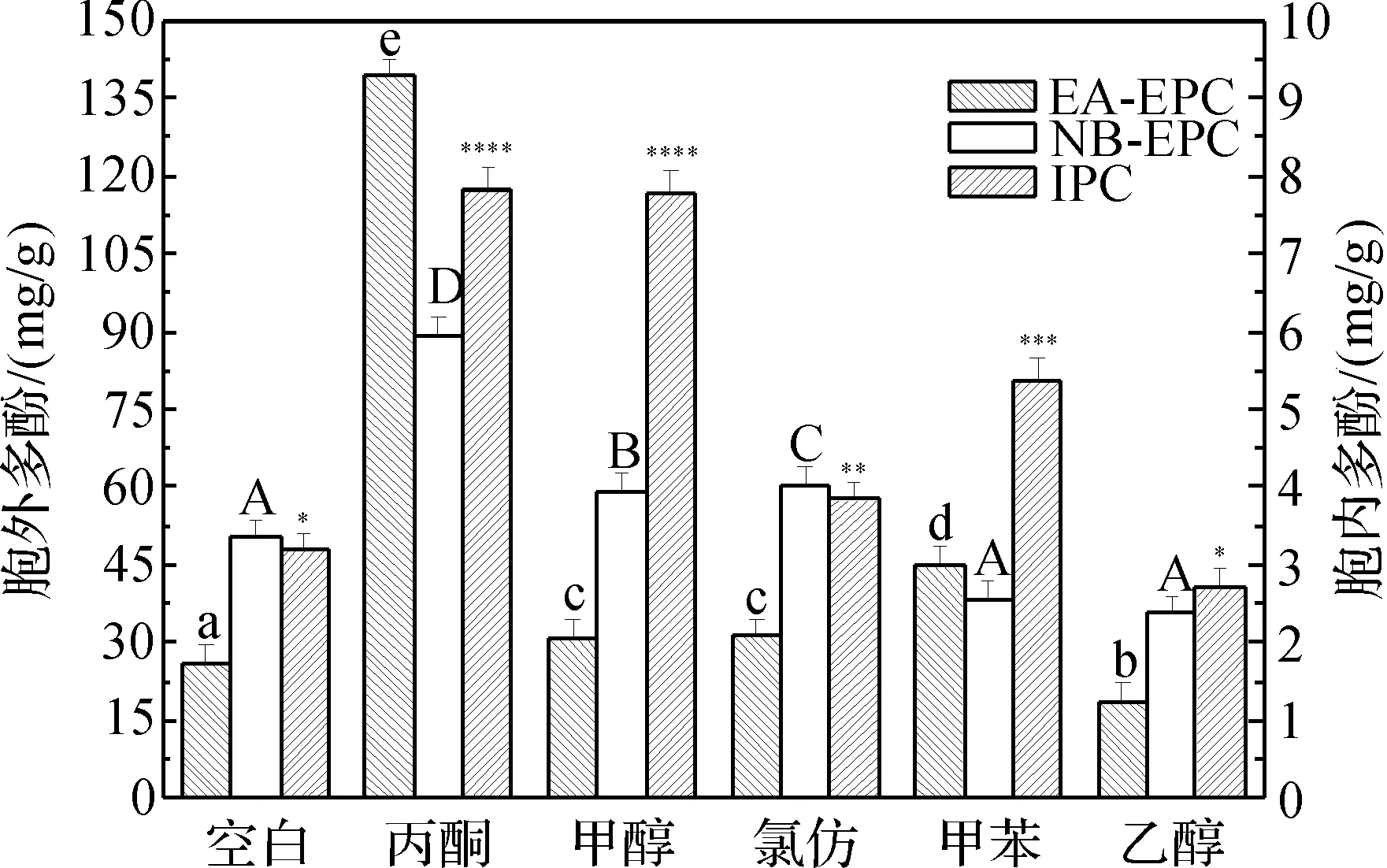
图1 有机溶剂对桦褐孔菌胞内外多酚产量的影响注:胞内外多酚的显著性差异分别用*和大小写字母标注,相同的字母代表无显著性差异(P<0.05)。
由图1可知这5种有机溶剂中丙酮对桦褐孔菌胞内外多酚含量的促进作用最强。乙酸乙酯层、正丁醇层以及胞内分别达到了139.33 mg/L、88.85 mg/L、7.84 mg/g,是对照组的5.3、1.7、2.5倍。其中,正丁醇层的多酚含量少于乙酸乙酯层,说明丙酮能促进脂溶性的多酚的释放。此外,丙酮与甲醇均能较强地促进胞内多酚的含量,两者分别达到了7.84 mg/g、7.77 mg/g,两者无显著性差异。添加有甲醇的培养基发酵所得的胞外多酚含量并不高,而胞内多酚含量相较于其他培养基促进作用明显,这可能是因为甲醇能促进脂溶性的多酚,但并不能很好地将多酚释放到培养液中,从而使多酚在细胞内进行堆积,使胞内的多酚含量大大增加,该结果具有显著性差异(P<0.05)。
2.3桦褐孔菌发酵液还原糖量与胞内外多糖量
按照上述方法测定发酵培养液中还原糖量与胞内外多糖量,具体结果如图2、图3。
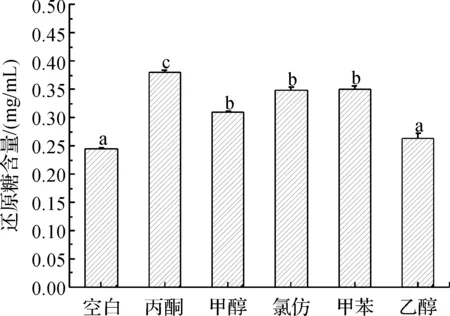
图2 有机溶剂对桦褐孔菌发酵液中还原糖量的影响注:还原糖含量的显著性差异用小写字母标注,相同的字母代表无显著性差异(P<0.05)。
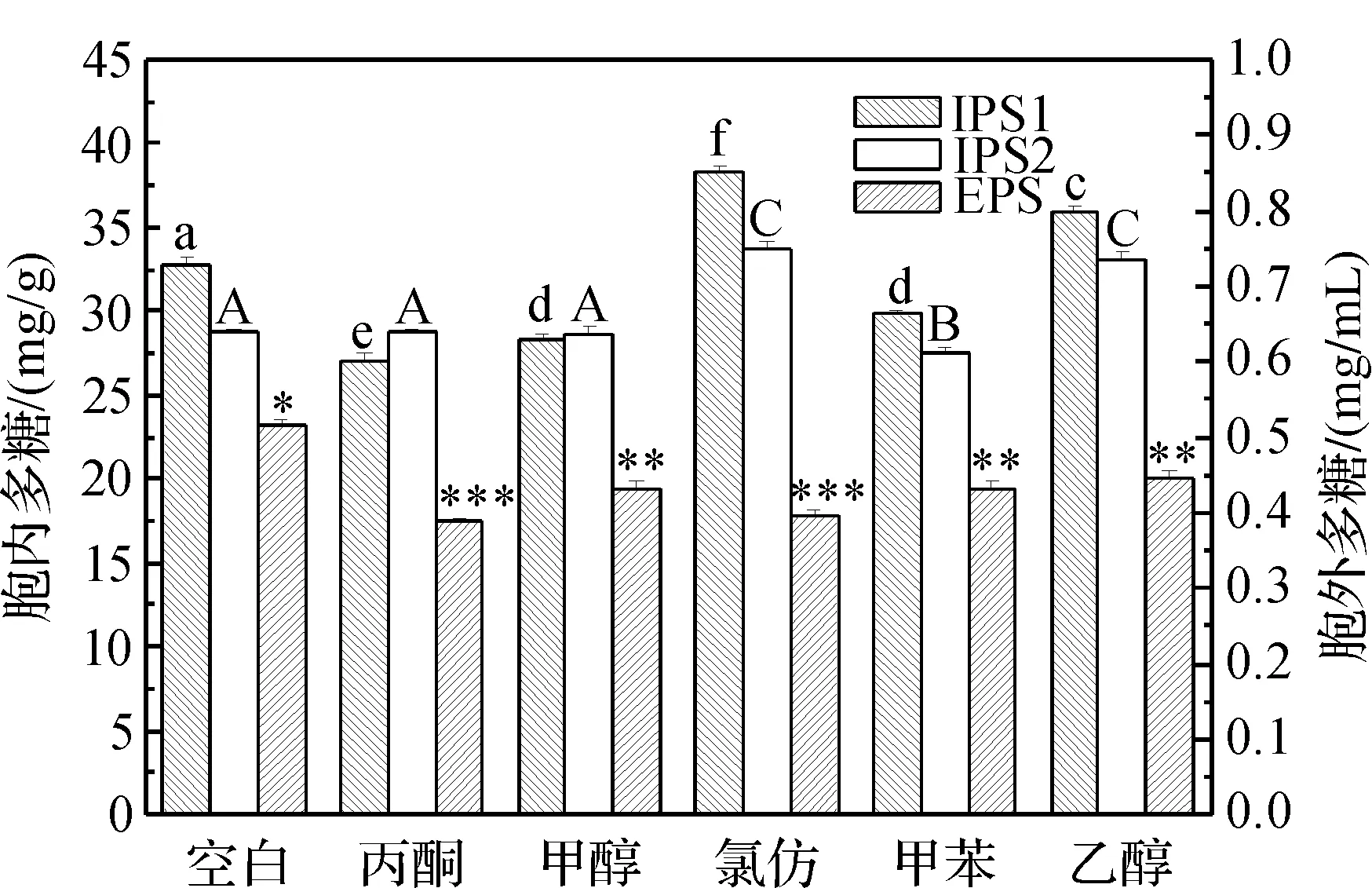
图3 有机溶剂对桦褐孔胞内外多糖产量的影响注:胞内外多糖的显著性差异用*和大小写字母标注,相同的字母代表无显著性差异(P<0.05)。
图2、图3显示的是添加体积分数为0.1%的有机溶剂(甲醇、乙醇、氯仿、丙酮、甲苯)对于桦褐孔菌培养液中还原糖量和胞内外多糖量的影响。从图2可看出5种有机溶剂使培养液中剩余还原糖量增加。此外,5种有机溶剂抑制了EPS的产量,尤其是氯仿和丙酮抑制效果最明显,EPS的产量分别仅为对照组的76.70%和75.34%。与对EPS的影响相反,氯仿和乙醇对IPS1有很大的促进作用,增长率为16.86%和9.67% (p<0.05);对IPS2的增长率为17.22%和15.20%(p<0.05)。
以上采取的几种溶剂中氯仿和甲苯对桦褐孔菌细胞的毒性大于甲醇、乙醇和丙酮,导致EPS量减少。另一方面,为了抵制外来物质对自身的伤害,细胞会分泌更多的次级代谢产物作为防护机制。
2.4桦褐孔菌胞内外多酚的抗氧化活性
多酚由于其具有清除各种活性氧化自由基的特性而被广泛应用于抗衰老保健品或者护肤品中。通过检测多酚的DPPH自由基清除率,鉴定出有机溶剂对多酚抗氧化活性的强弱的影响。具体结果如下图4:

图4 有机溶剂对桦褐孔菌胞内外多酚DPPH自由基清除率的影响注:胞内外多酚DPPH自由基清除率的显著性差异用*和大小写字母标注,相同的字母代表无显著性差异(P<0.05)。
如图4所示,有机溶剂对桦褐孔菌胞内多酚的DPPH自由基清除率有显著地提高。其中,添加丙酮后胞内多酚达到85.97%,是空白3.0倍。氯仿次之,清除率达78.25%,甲醇、乙醇、甲苯分别为75.48%、73.71%、70.64%。因此,有机溶剂能促进胞内多酚中强活性的组分的合成。然而有机溶剂对桦褐孔菌胞外多酚的效果不如胞内,对于胞外乙酸乙酯层多酚来说,甲醇与甲苯的效果最佳,分别达到63.17%和60.04%。这两种有机溶剂对正丁醇层的作用要弱于乙酸乙酯层多酚的多酚,分别达到了57.97%和53.43%,说明甲醇与甲苯能较好地促进极性较小的多酚组分的合成。其余3种有机溶剂正丁醇层多酚的清除率要强于乙酸乙酯层的多酚,其中乙醇达到正丁醇多酚的最大值(68.06%),因此,乙醇、氯仿、丙酮能促进胞外更多极性大的多酚组分的合成(P<0.05)。
3 结 论
桦褐孔菌次级代谢产物(多酚、多糖)对多种疾病有较好的治疗效果。但是由于其天然资源有限,液体深层发酵有着良好的前景。有机溶剂作为一种促进剂,能够增加细胞膜通透性,探究其对次级代谢产物的产生有一定的意义。本研究5种有机溶剂中丙酮、甲苯与乙醇能促进桦褐孔菌生物量,其中乙醇最佳;有机溶剂对胞内外多酚的促进效果要强于多糖,其中,丙酮、甲醇能显著提高胞内外多酚的产量,然而强烈抑制了胞内外多糖的产量;5种有机溶剂均能提高胞内外多酚的DPPH自由基清除率,尤其是对胞内多酚,丙酮效果最佳。综上所述,以桦褐孔菌胞内外多酚产量及活性为指标,筛选出丙酮为最佳有机溶剂;以胞内外多糖产量为指标,乙醇为最佳有机溶剂。该结果为提高桦褐孔菌次级代谢产物产量及活性筛选了最佳有机溶剂,也为药物和保健品领域的开发提供广阔的前景,同时也为后续多酚与多糖合成途径提供了有力的依据。
[1] ZHENG W, ZHANG M, ZHAO Y, et al. Accumulation of antioxidant phenolic constituentsin submerged cultures of Inonotus obliquus [J]. Bioresource Technology, 2009, 100(3): 1327-1335.
[2] CHEN C, ZHENG W, GA X, et al. Aqueous extract of Inonotus Obliquus (Fr.) Pilat (Hymenochaetaceae) significantly inhibits the growth of Sarcoma 180 by inducing apoptosis[J]. American Journal of Pharmacology and Toxicology, 2007, 2(1): 10-17.
[3] MIZUNO T, ZHUANG C, ABE K, et al. Antitumor and hypoglycermic activities of polysaccharides from the sclerotia and mycelia of Inonotus obliquus (Pers.:Fr.) Pil.(Aphyllophoromycetideae)[J]. International Journal of Medicinal Mushroom, 1999, 1(4): 301-316.
[4] WANG R J, WANG S, XIAY J, et al. Antitumor effects and immune regulation activities of a purified polysaccharide extracted from Juglan regia[J]. International Journal of Biological Macromolecules, 2015, 72: 771-775.
[5] NAKAJIMA Y, SATO Y, KONISHI T. Antioxidant small phenolic ingredients in Inonotus obliquus (persoon) Pilat (Chaga)[J]. Chemical and Pharmaceutical Bulletin, 2007, 55(8): 1222-1226.
[6] YANG S, ZHENG W. Factors affecting accumulation of hydrolysable tannins in cultured mycelia of Inonotus obliquus[J]. Chinese Traditional and Herbal Drugs, 2007, 38(12): 1874.
[7] BABITSKAIA V G, SHCHERBA V V, IKONNIKOVA N V. Melanin complex of the fungus Inonotus obliquus[J]. Prikladnaia Biokhimiia I Mikrobiologiia, 1999, 36(4): 439-444.
[8] XU X, ZHU J. Enhanced phenolic antioxidants production in submerged cultures of Inonotus obliquus in a ground corn stover medium[J]. Biochemical Engineering Journal, 2011, 58: 103-109.
[9] GARAGUSO I, NARDINI M. Polyphenols content, phenolics profile and antioxidant activity of organic red wines produced without sulfur dioxide/sulfites addition in comparison to conventional red wines[J]. Food Chemistry, 2015, 179: 336-342.
[10] QIAN M S, JING J, YE M, et al. Effect of nitric oxide on Lachnum YMU50 extracellular polyphenol accumulation and antioxidant defense system[J]. Applied Biochemistry and Biotechnology, 2014, 174(5):1761-1770.
[11] GASSARA F, AJILA C M, BRAR S K, et al. Liquid state fermentation of apple pomace sludge for the production of ligninolytic enzymes and liberation of polyphenolic compounds[J]. Process Biochemistry, 2012, 47(6): 999-1004.
[12] ZHU L, XU X. Stimulatory effect of different lignocellulosic materials for phenolic compound production and antioxidant activity from Inonotus obliquus in submerged fermentation[J]. Applied Biochenmistry and Biotechnology, 2013, 169(7): 2138-2152.
[13] XU X, HU Y, ZHU L. The capability of Inonotus obliquus for lignocellulosic biomass degradation in peanut shell and for simultaneous production of bioactive polysaccharides and polyphenols in submerged fermentation[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(6): 2851-2858.
[14] BAI Y H, FENG Y Q, MAO D B, et al. Optimization for betulin production from mycelial culture of Inonotus obliquus by orthogonal design and evaluation of its antioxidant activity[J]. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43(5): 663-669.
[15] ZHANG B B, CHEUNG P C K. Use of stimulatory agents to enhance the production of bioactive exopolysaccharide from Pleurotus tuber-regium by submerged fermentation[J]. Journal of Agricultural and Food Chemistry, 2011, 59(4): 1210-1216.
[16] HSIEH C, TSAI M J, HSU T H, et al. Medium optimization for polysaccharide production of Cordyceps sinensis[J]. Applied Biochemistry and Biotechnology, 2005, 120(2): 145-157.
[17] DE LEON A, GARCA B, DE LA ROSA A P B, et al. Periplasmic penicillin G acylase activity in recombinant Escherichia coli cells permeabilized with organic solvents[J]. Process Biochemistry, 2003, 39(3): 301-305.
[18] SINGLETON V L, ROSSI J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158.
[19] 萧能庚, 余瑞元, 袁明秀,等. 生物化学实验原理和方法 [M]. 北京: 北京大学出版社, 2005: 195-196
[20] 丛峰松. 生物化学实验[M]. 上海: 上海交通大学出版社, 2005: 91-93.
[21] YANG Z, TU Y, XIA H, et al. Suppression of free-radicals and protection against H2O2-induced oxidative damage in HPF-1 cell by oxidized phenolic compounds present in black tea[J]. Food Chemistry, 2007, 105(4): 1349-1356.
[22] CHOI K O, SONG S H, YOO Y J. Permeabilization of Ochrobactrum anthropi SY509 cells with organic solvents for whole cell biocatalyst[J]. Biotechnology and Bioprocess Engineering, 2004, 9(3): 147-150.
(责任编辑: 许惠儿)
Effect of Organic Solvents on Production and Activity of Polyphenol and Polysaccharides fromInonotusObliquusby Submerged Fermentation
SHENMengwei,QUANLili,XUXiangqun
(School of Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
1 g/L organic solvents (acetone, methanol, chloroform, toluene, ethanol) were added in the medium, and the effects of organic solvents on production of polyphenol and polysaccharides were discussed. Meanwhile, the effect of organic solvents on the antioxidant activity of polyphenol was studied through determining DPPH radical-scavenging activity of polyphenol. The experimental results show that the medium where acetone, toluene and ethanol are added can significantly improve biomass ofInonotusobliquus, and the growth rates are 2.68%、2.27% and 3.98%, compared with the control group. When polyphenol content in and outside the cells and activity serve as the indexes, and acetone serves as the optimal organic solvent, polyphenol output at ethyl acetate layer and normal butanol layer is 2.5 times, 5.3 times and 1.7 times more than the control group, respectively; corresponding activity is 1.3 times, 1.3 times and 3.0 times higher than the control group, respectively. When polysaccharide content in and outside cells serves as the index, all organic solvents have organic solvent on exopolysaccharides. When ethyl alcohol is used as the optimal organic solvent, growth rate of intercellular polysaccharide (extracted under 95℃ and 121℃) reaches 9.67% and 15.20%, compared with control group. The reason may be that organic solvents can effectively promote cell consistency, then changes membrane permeability and influences absorption of cells on nutrient substances in the medium. Meanwhile, different organic solvents will generate different effects on synthesis of various secondary metabolites.
Inonotusobliquus; polyphenol; organic solvents; polysaccharides; antioxidant activity
10.3969/j.issn.1673-3851.2016.01.015
2015-01-13
浙江省科技厅公益技术项目(2012C20375)
沈梦薇(1990-),女,浙江舟山人,硕士研究生,主要从事生物化学方面的研究。
徐向群,E-mail:xuxiangqun@zstu.edu.cn
Q936
A
1673- 3851 (2016) 01- 0093- 06 引用页码: 010701

