锦叶栾黄酮含量及叶绿素荧光参数动态分析
李小雨,梅广云,李 扬,黄诗扬,任建武,肖楚妍
(1.北京林业大学生物科学与技术学院,北京 100083; 2.北京市林业种子苗木管理总站,北京 100029)
锦叶栾黄酮含量及叶绿素荧光参数动态分析
李小雨1,梅广云1,李 扬2,黄诗扬1,任建武1,肖楚妍1
(1.北京林业大学生物科学与技术学院,北京 100083; 2.北京市林业种子苗木管理总站,北京 100029)
以锦叶栾新鲜叶片为试材,采用L9(34)正交试验确定锦叶栾叶片内总黄酮的最佳提取方案,即以60%丙酮为提取剂,新鲜叶片与丙酮料液比1∶20,60 ℃下回流提取2 h。后通过分光光度法探究锦叶栾叶片内总黄酮含量的季节性变化规律,结果表明:在其旺盛生长阶段,叶片中均具有较高的黄酮含量,总黄酮含量在5月底达到峰值(36.72 mg·g-1),6月底之后含量逐渐降低到平均值(22.06 mg·g-1)以下。利用Handy PEA测定锦叶栾叶片叶绿素荧光参数以分析其黄酮含量在7月之后下降的主要原因,发现锦叶栾不完全适应北京地区的夏季高温,由此引起光合作用效率下降,次生代谢产物黄酮积累减少。
锦叶栾;黄酮;叶绿素荧光参数
黄酮类化合物广泛存在于植物体内[1-2],作为次生代谢产物在植物花、果以及叶片中呈现黄色、红色等色彩,同时这类物质具有抗氧化活性,可以清除氧自由基[3]。陆瑞利等[4]在一次大规模的植物提取物清除自由基活性物质筛选中,发现黄山栾鲜叶的甲醇提取物具有很强的清除DPPH有机自由基的活性。对北京栾树叶的乙酸乙酯提取物进行生物活性测定,证明其有抗癌、免疫抑制、抗病毒、自由基清除和活血化淤等作用。杨小凤等[5]从栾树叶、种子中分离鉴定出16种栾树黄酮类化合物[6-7]。栾树中化学成分结构类型主要为黄酮类、木脂素类、有机酸类、氰脂类和甾醇类[6,8-9]。其中,黄酮类物质具有众多优良的生物学活性和极其重要的药用价值。作为次生代谢产物,黄酮类化合物的积累与光合作用关系密切[10-12]。但是有关黄酮积累与光合作用的关系尚未见报道。
锦叶栾(Koelreuteriapaniculata′Jinye′)也是栾树属植物,是由普通栾树产生芽变后选育而来的,于2007年被国家林业局认定为新品种,其叶片为鲜艳的金黄色。本试验探究栾树新品种锦叶栾叶片内总黄酮含量的季节性变化规律及显著优势,使其观赏价值与药用价值相得益彰,为锦叶栾叶片黄酮成分的开发利用提供参考。
1 材料与方法
1.1 材料
材料:锦叶栾(5年生)新鲜叶片(采自北京市顺义区苗圃)。试剂:芦丁标准品(Sigma);无水乙醇,丙酮,甲醇,石油醚,亚硝酸钠,硝酸铝,氢氧化钠等试剂均为分析纯。仪器:可见-紫外分光光度计(上海元析),分析天平,Handy PEA植物效率分析仪(Hansatech,UK),PANTONE ColorCue-2/色差计。
1.2 方法
1.2.1 芦丁标准曲线绘制 精确称取0.00612 g芦丁标准品,用70%乙醇溶解,于50 mL容量瓶中定容。分别移取0、0.5、1.0、1.5、2.0、2.5 mL芦丁标准溶液于5 mL容量瓶中,编号1~6。分别加入5% NaNO2溶液0.15 mL,振荡摇匀,静置6 min后加入10% Al(NO3)3溶液0.15 mL,振荡摇匀,静置6 min后加入1 mol·L-1NaOH溶液2.0 mL,振荡摇匀,静置6 min后用70%乙醇定容至5 mL,振荡摇匀,静置10 min。以1号作为参比,分别于λ500、501、502、503、504、505、506、507、508、509、510 nm处测定其他组的吸光度,确定最大吸收波长并绘制芦丁标准曲线。
1.2.2 锦叶栾叶片中黄酮最佳提取方案的确定 采用正交试验[7,13-15],正交表L9(34)水平、因素见表1。称取9份锦叶栾新鲜叶片(采于2013年4月10日),每份约2 g。转入研钵中,加石油醚充分研磨后转入小烧杯中,静置20 min,倒去石油醚,按照试验设计添料回流。完毕后,待回流液充分冷却,取上层清液,按1.2.1中所述方法测量吸光度。分析试验结果,确定锦叶栾叶片中总黄酮的最佳提取方案。
1.2.3 逐月测定锦叶栾叶片中总黄酮的含量 按1.2.2确定的最佳方案,2013年4—10月每月30日进行取样,逐月测定锦叶栾叶片中总黄酮的含量。称取锦叶栾新鲜叶片3份,每份约2 g。转入研钵中,加石油醚充分研磨后转入小烧杯中,静置20 min,倒去石油醚,分别加入60%丙酮溶液40 mL,将烧杯用保鲜膜封口,静置过夜。60 ℃水浴下,回流2 h。完毕后,待回流液充分冷却,取上层清液,按1.2.1中所述方法测量吸光度,并折算当月叶片中总黄酮含量的平均值。
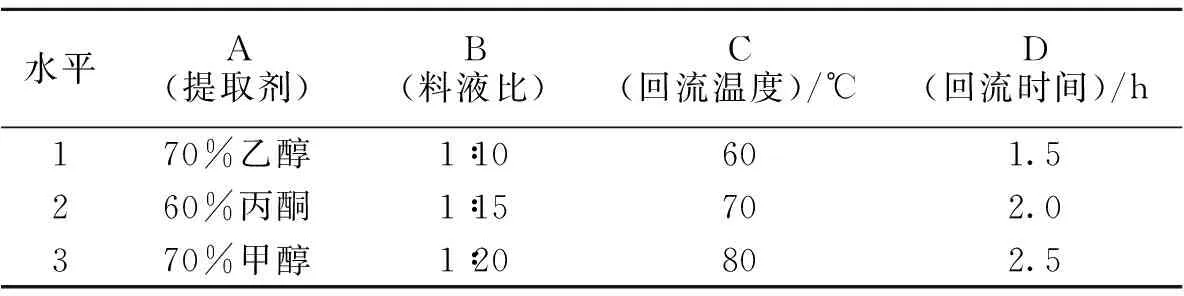
表1 锦叶栾叶片中黄酮提取的正交试验因素与水平
1.2.4 锦叶栾叶片叶绿素荧光参数的测定 利用Handy PEA(Hansatech,UK)植物效率分析仪于2013年4—10月30日,每月30日的9∶00—11∶30测定自然条件下锦叶栾叶片的叶绿素荧光参数。选取具有代表性的长势中庸枝条上的中部叶片进行活体测定。首先叶夹子夹住叶片中部,暗处理20 min,后给以3000 μmol·m-2·s-1的饱和光照射,照光300 μs之内,每隔10 μs记录1次,获得30个点;随后在3 ms之前,每隔100 μs记录1次,得到27个点;接着在30 ms之前,每隔1 ms记录1次,获得27个点;到300 ms之前,每隔10 ms记录1次,获得27个点;到1 s之前,每隔100 ms记录1次,得到9个点,共计记录120个点的荧光信号,测得快速叶绿素荧光动力学曲线及其参数,包括FO、FJ、FI、Fm和300 μs时的荧光(F300μs)。
2 结果与分析
2.1 芦丁标准曲线
试验结果表明,λ=505 nm为最大吸收波长。以吸光度A为纵坐标,溶液质量浓度c(mg·mL-1)为横坐标,绘制标准曲线(图1),线性关系为y=16.93x-0.0159,R2=0.9987。
2.2 锦叶栾叶片中黄酮最佳提取方案确定
由表2可知,锦叶栾叶片中黄酮的最佳提取方案是A2B3C1D2,即以60%丙酮为提取剂,锦叶栾新鲜叶片与丙酮的料液比为1∶20,在60 ℃下回流提取2 h(即处理6)。从极差分析可知,各因素对黄酮提取效率的影响顺序为:提取剂>回流时间>回流温度>料液比。
2.3 锦叶栾叶片中黄酮含量随时间的变化
由图2可以看出,锦叶栾在其旺盛生长阶段(5—6月),叶片中均具有较高的黄酮含量。锦叶栾叶片内总黄酮含量在5月底时达到峰值(36.72 mg·g-1),在6月时,叶片总黄酮含量也保持较高水平,黄酮含量高达35.26 mg·g-1,含量虽然比5月底略有降低,但下降幅度不明显。之后含量逐渐降低,到10月下旬,含量降至4月的幼叶黄酮含量的水平。显然在经过7—8月的高温之后,锦叶栾的黄酮含量呈现明显降低的趋势。原因可能在于夏季高温高湿造成了锦叶栾生长逆境,植株健康受到胁迫,叶片色素受到影响,可以利用叶绿素荧光探针作出进一步的判断。
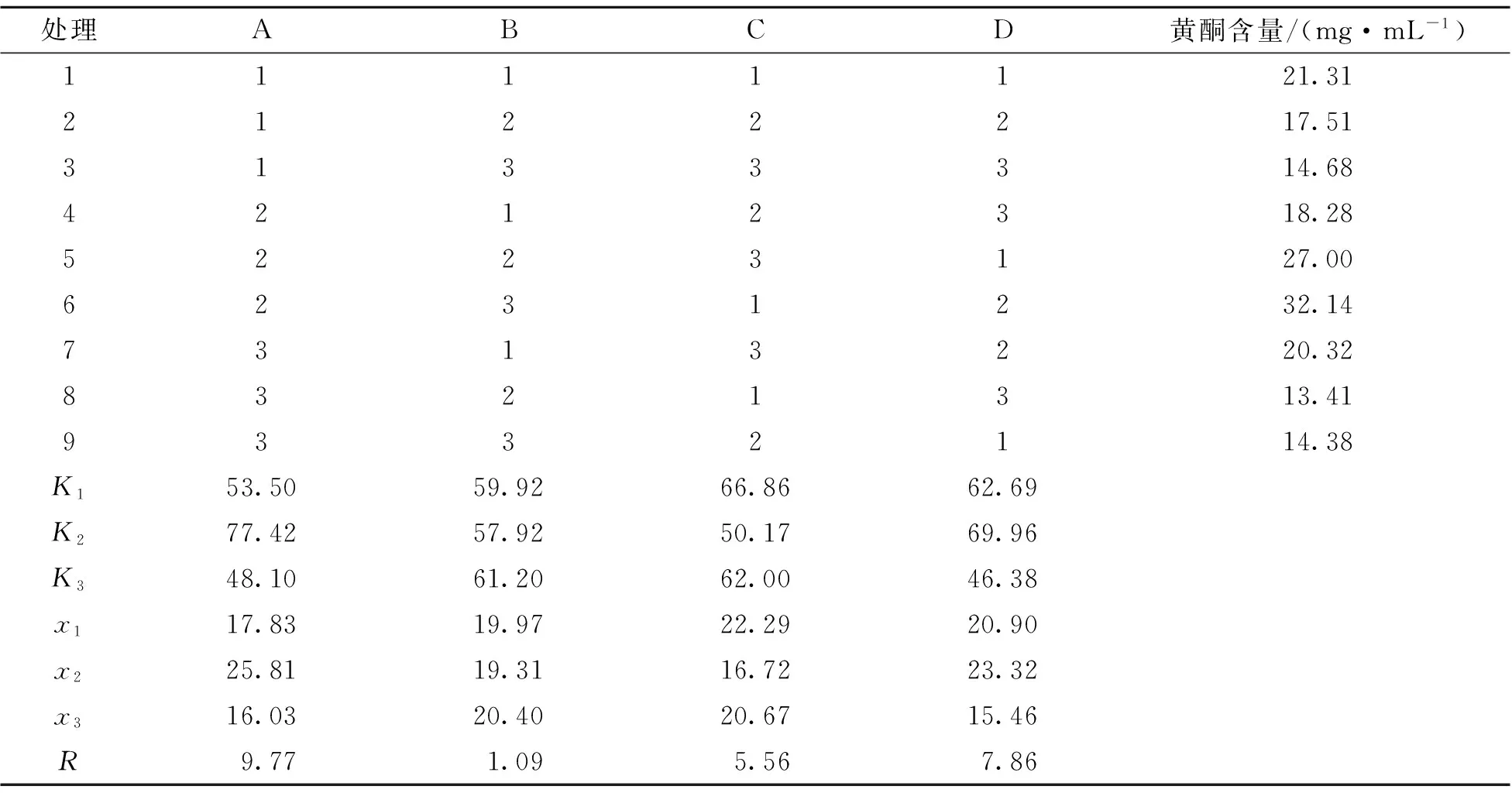
表2 锦叶栾叶片中黄酮提取正交试验结果
2.4 锦叶栾叶片叶绿素荧光诱导动力学曲线分析
通过高速连续激发光照射得到的叶绿素快速荧光动力学曲线(OJIP曲线)蕴含着PSII原初光化学反应的丰富信息,能全面反映PSII的光反应过程、效率和结构[16-17]。由于原始荧光数据绘制的OJIP曲线变异性较大,易受叶片表面附属物、照光面积、色素含量、材料厚度、仪器电压等各种因素的影响,不同叶位的OJIP 曲线往往不具可比性。通过数学方法把荧光信号数据标准化,使所有曲线具有相同的起点,这样无论测定样品的形态、属性、大小是否相同,都可以进行比较[16-17]。其中一种方法是用Fm-Fo进行标准化,标准化的荧光信号数据用V(O-P)表示,V(O-P)=(Ft-Fo)/(Fm-Fo)(Ft为任意时刻的荧光数值),用V(O-P)绘制的OJIP曲线O相的荧光强度均为0。由图3的OJIP曲线可以看出,在生长季节,锦叶栾叶片的OJIP曲线形态从6月下旬—10月上旬发生了较大变化,说明叶片的光合作用系统PSII受到环境条件变化的影响。通常初始荧光F0出现在照光后的50 s,J点出现在2 ms,I点出现在30 ms。若在300 s时出现K点,说明光合放氧复合体OEC(oxygen evolving complex)受到损伤,致损伤因子可能是热胁迫、氮素胁迫以及水胁迫等[18]。为了更清楚地了解叶绿素快速荧光曲线初始阶段状况,对生长季节不同月份锦叶栾叶片的快速荧光动力学曲线用FJ-F0进行标准化。
用FJ-Fo进行标准化,标准化的荧光信号数据用V(O-J)表示,V(O-J)=(Ft-Fo)/(FJ-Fo),用V(O-J)绘制的OJIP曲线O相的荧光强度均为0。O—J段上升过程是一个光化学阶段,主要与光合作用系统PSII的原初电子受体质体醌QA的还原有关,荧光的上升依赖于吸收的光量子数量[19]。由图4的OJIP曲线形态可见,相对初始斜率M0明显不同,其中4月30日的数值最高,原因在于叶片的光合作用机构未发育完全;10月30日的数值次之,但显著高于5月30日的数值,这是秋季低温对光合作用机构造成伤害的结果;5月30日的数值最低,6月30日以后明显升高,说明锦叶栾在经历北京夏季高温高湿之后,叶片PSII反应中心受到负面影响,处于关闭状态的反应中心比率处于高位状态。在J点的相对荧光强度以4月30日的测定结果最高,10月30的日次之,此二者的数值明显高于其他时间测定结果,表明PSII电子供体侧表现出一定程度的限制。但是K点在10月30日的荧光动力学曲线上出现(图4),说明光合作用机构已经受到实质性损伤;而7—8月的高温并导致K点未明显显现,亦即光合放氧复合体还未遭到高温高湿环境的不可逆伤害。
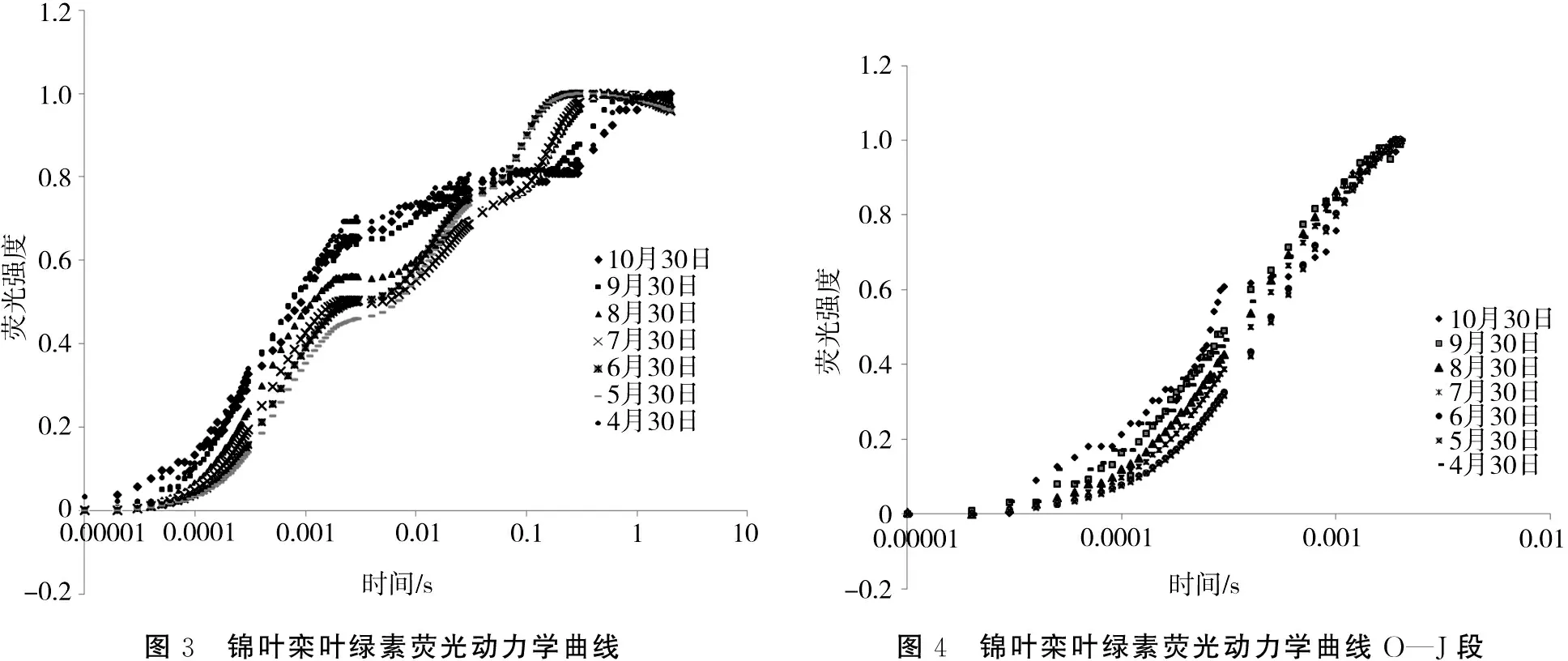
图3 锦叶栾叶绿素荧光动力学曲线图4 锦叶栾叶绿素荧光动力学曲线O—J段
在叶绿素荧光相关的表观通量或者表观活性(Phynomenological fluxes or phynomenological activities)方面,图5有9个参数,表3选择列举了4个参数,分别是:ABS/CSo、DIo/CSo、TRo/CSo和ETo/CSo,其中ABS/CSo表示单位面积吸收的能量,5月、6月、7月锦叶栾叶片单位面积吸收光量子能量明显高于其他时段。但是7月,ABS/CSo已经表现出一定程度的下降。其他3个指标,单位面积能量耗散DIo/CSo、单位面积捕获的能量TRo/CSo、单位面积用于电子传递的能量ETo/CSo均表现出相似的变化趋势。
单位面积具有活性的PSII反应中心数量以RC/CSo表示,5月30日和6月30日测得数值显著高于其他时间点,表3显示8月底以后和4月底以前的锦叶栾叶片,活跃的PSII反应中心密度极低。
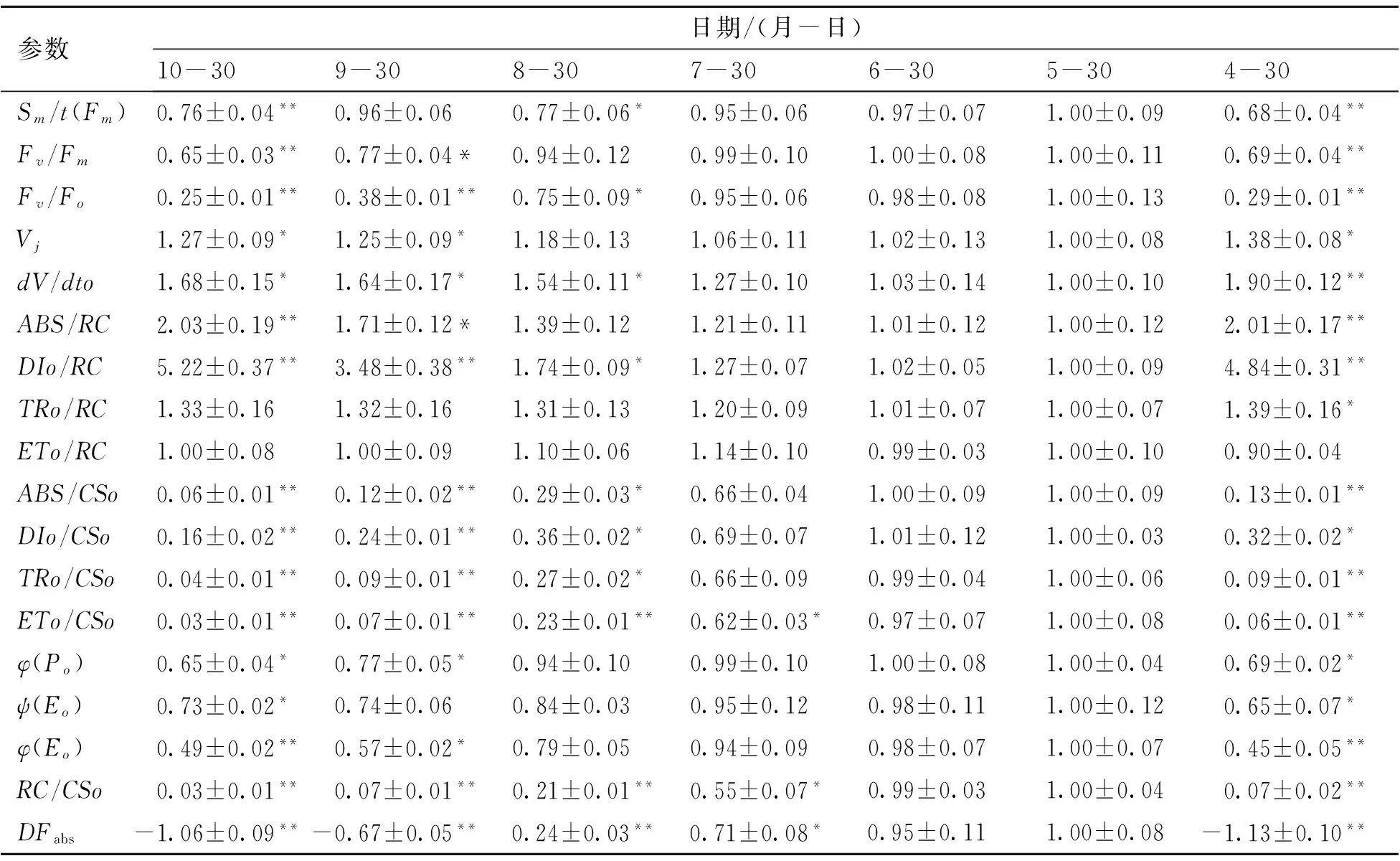
表3 锦叶栾叶片主要荧光参数在生长期内的变化动态
*:数据为平均值±标准误差;*为显著性水平P<0.05;**为著性水平P<0.01。
3 结论与讨论
光合驱动力参数DFabs表明,只有5月底和6月底2个时间点锦叶栾叶片处于光合作用旺盛的健康状态,其他各时间点的光合作用机构均或多或少受到一定程度的胁迫。该参数是一个重要的表征测试样品活性的重要指标,实质上是表示植物内在的抵御外界胁迫限制的综合能力。比最大光化学效率Fv/Fm更灵敏地反映外界环境因子的胁迫。本试验中,7月底观测到的光合驱动力参数比6月明显降低,说明锦叶栾对高温敏感。事实上,盛夏季节顶端叶片以及靠近树冠外围的叶片,因长时间接受强烈光照几乎枯黄脱落,而树冠内侧叶片外观上少有焦叶卷边现象。在光能的吸收、传递与转换效率上优于靠外侧的叶片,因此依然能保持相对正常的生理代谢。
本研究中表明,锦叶栾光合作用最旺盛的时期在5—6月,同样地,叶片内总黄酮含量也最高。7月的高温天气对锦叶栾光合作用机构造成了损伤,致使其光合作用能力下降,相应地,叶片内黄酮含量也随之下降。因此锦叶栾叶片内黄酮的积累与光合作用状态存在对应关系。至于高温以何种方式、多大程度上造成对锦叶栾的胁迫有待进一步研究。
[1]Richard A.Dixon,Giulio M.Pasinetti.Flavonoids and Isoflavonoids:From Plant Biology to Agriculture and Neuroscience[J].Plant Physiology,2010,154(2):453-457.
[2]Cecilia Brunetti,Martina Di Ferdinando,Alessio Fini,et al.Flavonoids as Antioxidants and Developmental Regulators:Relative Significance in Plants and Humans[J].International Journal of Molecular Science,2013,14(2):3540-3555.
[3]Agati G,Azzarello E,Pollastri S,et al.Flavonoids as antioxidants in plants:Location and functional significance[J].Plant Science,2012(196):67-76.
[4]陆瑞利,胡丰林,丁晓娟.黄山栾树叶中具有清除自由基活性物质的分离和制备[J].安徽农业大学学报,2004,31(2):207-211.
[5]杨小凤,付宏征,雷海民,等.栾树的化学成分[J].药学学报,1999,34(6):457-462.
[6]梁淑芳,马柏林.栾树化学成分的研究进展[J].西北林学院学报,2004,19(1):119-122.
[7]翟梅枝,郭景丽,王磊,等.栾树花黄酮类化合物的提取工艺研究[J].西北林学院学报,2010,25(2):136-139.
[8]Mahmoud I,Moharram F A,Marzouk M S,et al.Two new flavonol glycosides from leaves of Koelreuteria paniculata[J].Pharmazie,2001,56(7):580-582.
[9]杨小凤,雷海民,付宏征,等.栾树种子中黄酮类化学成分[J].药学学报,2000,35(3):208-211.
[10]冷平生,苏淑钗,王天华,等.光强与光质对银杏光合作用及黄酮苷与萜类内酯含量的影响[J].植物资源与环境学报,2002,11(1):1-4.
[11]Ibrahim M H,Jaafar H Z E.Abscisic Acid Induced Changes in Production of Primary and Secondary Metabolites,Photosynthetic Capacity,Antioxidant Capability,Antioxidant Enzymes and Lipoxygenase Inhibitory Activity of Orthosiphon stamineus Benth[J].Molecules,2013,18(7):7957-7976.
[12]Ibrahim M H,Jaafar H Z E.Reduced photoinhibition under low irradiance enhanced Kacip Fatimah (Labisia pumila Benth) secondary metabolites,phenyl alanine lyase and antioxidant activity[J].International journal of molecular sciences,2012,13(5):5290-5306.
[13]梁淑芳,韩冰,帖周峰,等.栾树黄酮类化合物的提取及微乳薄层色谱分析[J].西北植物学报,2005,25(1):186-190.
[14]唐纯翼,丁文,高中松.栾树不同部位总黄酮的提取及含量测定[J].中国农学通报,2005,21(5):159-163.
[15]郭璇华,戴文娟,梁博,等.分光光度法测定火龙果茎中黄酮类化合物的含量[J].中国食品添加剂,2010(2):210-213.
[16]张子山,杨程,高辉远,等.保绿玉米与早衰玉米叶片衰老过程中叶绿素降解与光合作用光化学活性的关系[J].中国农业科学,2012,45(23):4794-4800.
[17]邱念伟,周峰,顾祝军,等.5种松属树种光合功能及叶绿素快相荧光动力学特征比较[J].应用生态学报,2012,23(5):1181-1187.
[18]Strasser R J,Tsimilli-Michael M,Srivastava A.Analysis of the chlorophyll a fluorescence transient[M].Dordrecht,The Netherlands:Springer-Verlag,2004:321-362.
[19]Stirbet A.Chlorophyll a fluorescence induction:a personal perspective of the thermal phase,the J-I-P rise[J].Photosynthesis research,2012,113(1-3):15-61.
[20]Zhu X G,Baker N R,Ort D R,et al.Chlorophyll a fluorescence induction kinetics in leaves predicted from a model describing each discrete step of excitation energy and electron transfer associated with photosystem II[J].Planta,2005,223(1):114-133.
[21]Stirbet A.On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem II:Basics and applications of the OJIP fluorescence transient[J].Journal of Photochemistry and Photobiology B:Biology,2011,104(1):236-257.
[22]李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
[23]Jiang C D,Li P M,Gao H Y,et al.Enhanced photoprotection at the early stages of leaf expansion in field-grown soybean plants[J].Plant science,2005,168(4):911-919.
Dynamic Analysis of Total Flavonoids and Chlorophyll Fluorescence Parameters ofKoelreuteriapaniculata′Jinye′
LI Xiao-yu1,MEI Guang-yun1,LI Yang2,HUANG Shi-yang1,REN Jian-wu1,XIAO Chu-yan1
(1.CollegeofBiologicalScienceandTechnology,BeijingForestryUniversity,Beijing100083,China;2.ForestSeedandSeedingCenterofBeijing,Beijing100029,China)
Fresh leaves ofKoelreuteriapaniculata′Jinye′ were probed to determine the best extraction scheme of total flavonoids from the leaf blade.Orthogonal experimental design was implemented,with 60% acetone as extraction agent,1∶20 ratio of was fresh leaves and acetone solid-liquid 60 ℃ and refluxing for 2 hours.Seasonal variation of total flavonoids content in the leaves was measured by Spectrophotometry.The results demonstrated that:in the vigorous growth period,the blades had high content of total flavonoids,and the value reached the peak at the end of May(36.72 mg·g-1fresh weight of leaves),keeping in high and stable level beyond June,and then decreased gradually below the average value (22.06 mg·g-1fresh weight of leaves) when entering into the hot July.In the aim at investigating the reason for decrease of flavonoids content after experiencing midsummer heat in Beijing,JIP-test on chlorophyll fluorescence was carried out.The chlorophyll fluorescence parameters in leaves were determined using Handy PEA,and the results demonstrated that the photosynthetic apparatus was stressed to some certain when exposed to high temperature in July.The heat stress curtain the photosynthetic vitality of leaves,which might further lead to a decreased accumulation of flavonoids in the leaves ofKoelreuteriapaniculata′Jinye′.
Koelreuteriapaniculata′Jinye′;flavonoids;chlorophyll fluorescence parameters
10.13428/j.cnki.fjlk.2016.02.012
2015-06-23;
2015-08-01
首都增彩延绿科技示范工程(D111100000911001);北京市大学生科学研究与创业行动计划(S1310022017)
李小雨(1993—),男,北京人,北京林业大学生物科学与技术学院本科生,从事生物技术研究。E-mail:hongyang905@sina.com。
任建武(1967—),男,山西大同人,北京林业大学生物科学与技术学院副教授,博士,从事植物生物技术研究。E-mail:jianwur@sina.com。
S718.43
A
1002-7351(2016)02-0066-07

