家蝇肽聚糖识别蛋白(PGRP-SA)的克隆表达及细菌结合研究
罗嫚王宇,2胡亚修江帆王涛彭建尚小丽吴建伟
(1. 贵州医科大学寄生虫学教研室,贵阳 550004;2. 贵州省疾病预防控制中心,贵阳 550004)
家蝇肽聚糖识别蛋白(PGRP-SA)的克隆表达及细菌结合研究
罗嫚1王宇1,2胡亚1修江帆1王涛1彭建1尚小丽1吴建伟1
(1. 贵州医科大学寄生虫学教研室,贵阳 550004;2. 贵州省疾病预防控制中心,贵阳 550004)
对家蝇PGRP-SA 基因进行克隆表达以及研究其重组蛋白与细菌结合能力。从构建的家蝇(Musca domestica)幼虫cDNA 质粒文库中筛选到PGRP-SA基因,以cDNA 质粒为模板设计引物,通过PCR 扩增,获得PGRP-SA 基因完整编码序列。运用生物信息学方法对该基因及其编码蛋白进行预测和分析。构建pET-28a(+)-PGRP-SA重组质粒,转化到大肠杆菌BL21(DE3)中进行诱导表达及蛋白纯化。利用半定量RT-PCR 检测PGRP-SA在家蝇3龄幼虫不同组织中的表达量差异。PGRP-SA重组蛋白进行微生物结合实验。结果表明,PGRP-SA基因ORF 全长615 bp,编码204个氨基酸,理论分子量22.8 kD,等电点9.11,具有保守的PGRP结构域。成功构建了pET-28a(+)-PGRP-SA重组质粒,蛋白经IPTG 诱导后在大肠杆菌中获得表达,经亲和层析柱纯化获得目的蛋白,利用Western blot 检测证明纯化蛋白与预期大小相符。PGRP-SA在家蝇3龄幼虫血淋巴、脂肪体、前肠、中肠、气管、马氏管都有表达,血淋巴组织中表达量最高,后肠无表达,由此说明PGRP-SA基因的表达具有一定的组织性。PGRP-SA重组蛋白能与金黄色葡萄球菌和大肠杆菌结合,与白色念珠菌不能结合。成功表达及纯化家蝇PGRP-SA蛋白,证实家蝇PGRP-SA能与金黄色葡萄球菌和大肠杆菌结合。
家蝇;先天免疫;肽聚糖识别蛋白;原核表达;微生物结合实验
先天免疫是多细胞生物抵御微生物入侵的第一道防线,机体的识别受体通过识别入侵的微生物来引发免疫反应。对于昆虫来说,它是直接且唯一的应对微生物感染的途径。其中,肽聚糖识别蛋白(peptidoglycan recognition proteins,PGRPs)家族是昆虫先天免疫系统中重要的模式识别受体,从昆虫到人类都高度保守,其在识别入侵病原物和激活免疫途径的调控方面起着重要作用[1]。肽聚糖识别蛋白具有一个约为165个氨基酸的保守的肽聚糖(peptidoglycan,PGN)结合结构域,称为PGRP结构域,其序列与T7溶菌酶有30%的相似性[2]。有些PGRPs能够识别细菌所独有的肽聚糖结构,并且启动抗菌肽基因的转录及合成[3-5];PGRPs对肽聚糖的识别也会启动酚氧化酶原途径的激活,引起黑化反应。具有酰胺酶活性的PGRPs可以促进吞噬作用,还可以抑制抗菌肽合成从而减弱过度的免疫反应所带来的损害。还有一些PGRPs可作为效应因子直接将细菌杀死[6-8]。
目前,果蝇已鉴定的PGRPs有13个。其中,PGRP-SA是果蝇第一个被鉴定为主要在血淋巴中表达的PGRP[9],它主要与革兰氏阳性菌肽聚糖结合,然后和PGRP-SD以及GNBP1 共同作用于Spatzle,Spatzle能激活Toll信号通路诱导抗菌肽产生从而消灭病原体[10]。果蝇的PGRP-LC是Imd信号通路上游一个重要的跨膜受体,主要识别革兰氏阴性菌肽聚糖激活抗菌肽的合成[11]。另外,研究表明果蝇的PGRP-SC1a/b,LB,SB1/2,SC2具有酰胺酶活性,能对Imd途径进行负调控,消除过多的抗菌肽,避免过度免疫反应造成的损害,其对果蝇幼虫的发育是至关重要的[12]。
家蝇在地球上广泛分布,长期暴露于比果蝇生存条件更恶劣的环境中,家蝇能够携带大量的致病微生物而健康的生活,具有强大的先天性免疫系统,是研究昆虫与病原物互作机制的理想模型之一[13,14]。家蝇肽聚糖识别蛋白功能的研究有助于理解家蝇的先天性免疫机制。此外,家蝇PGRPs的鉴定及功能研究对了解果蝇和家蝇之间的共性和差异是有所帮助的。对家蝇的PGRP-SC研究表明,PGRP-SC的下调导致抗菌肽的高表达以及抑制家蝇幼虫的化蛹[15]。果蝇PGRP-SC的相关研究表明PGRP-SC能延长衰老苍蝇的寿命,未见抑制蛹化的报道。目前关于果蝇的PGRP-SA有很多报道,但家蝇肽聚糖识别蛋白SA类基因的研究鲜有报道。本研究以家蝇为研究对象,克隆得到PGRP家族的基因PGRP-SA及对其进行不同组织的表达分析,并进行蛋白的表达纯化,利用重组蛋白进行微生物结合实验,以期为进一步揭示该基因在家蝇免疫防御体系中的功能提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物和菌株 家蝇3 龄幼虫由贵州医科大学病原生物学实验室饲养。pET-28a(+)质粒,大肠杆菌BL21(DE3),金黄色葡萄球菌,大肠杆菌,白色念珠菌均由贵州医科大学病原生物学实验室常规保存。
1.1.2主要试剂和仪器 总RNA 提取试剂TRIzol Reagent、rTaq 酶、T4连接酶、逆转录试剂盒、DNA凝胶回收试剂盒、DL2000及DL10000 DNA Marker、蛋白Marker、抗His标签抗体、羊抗兔IgG/HRP等购置于TaKaRa 公司;所用引物由上海生工生物工程公司合成。无水乙醇、甲醇、异丙醇、三氯甲烷等均为国产分析纯试剂。PCR扩增仪(德国Eppendorf公司),凝胶成像系统IQuant400(美国Amersham Pharmacia公司),冷冻高速离心机(美国德国Eppendorf公司)。
1.2方法
1.2.1生物信息学分析 通过NCBI Blast(http//www.ncbi.blastX)检测PGRP-SA基因的完整编码序列和开放阅读框;运用Signal P4.1(http://www. cbs. dtu. Dk/services/SignalP/)分析信号肽位点;利用蛋白分析专家系统(ExPASy)分析预测PGR-SA基因编码蛋白的理化性质;用Smart软件分析PGRP-SA的功能结构域。
1.2.2总RNA提取及cDNA合成 按照TakaRa公司TRIzol说明书分别提取家蝇3龄幼虫的不同组织(血淋巴、脂肪体、前肠、中肠、后肠、气管、马氏管)及整虫的总RNA。总RNA经电泳检测,并利用GeneQuant核酸定量分析仪测定A260/A280比值及浓度,以1 μg总RNA为模板按照cDNA合成试剂盒说明书合成cDNA。
1.2.3引物的设计及基因扩增 设计引物的软件为Premier 5.0 软件,PGRP-SA-F:5'-AAACATATG TCGAATGATTCGCAGCCATCGTC-3'(下划线为Nde I)酶切位点;PGRP-SA-R:5'-CGCCTCGAGTCAT TTTTTATTCGACGCATT-3'(下划线为Xho I酶切位点)。以整虫cDNA为模板,应用上述引物进行目的基因扩增,PCR条件:94℃预变性5 min;94℃ 30 s,54℃ 30 s,72℃ 1 min,共30个循环;72℃延伸10 min。PCR 产物行1.5%琼脂糖凝胶电泳鉴定,并利用DNA凝胶回收试剂盒进行DNA回收。
1.2.4重组原核表达质粒的构建 将回收的PCR产物和pET-28a(+)质粒分别双酶切后回收,利用T4连接酶连接,连接产物转化至DH5α感受态细胞,涂布于含Kan+抗性的LB平板上筛选阳性单克隆,扩大培养后对阳性克隆提取重组质粒,测序鉴定。
1.2.5重组蛋白的诱导表达、纯化及Western blot 鉴定 将鉴定正确的pET-28a(+)-PGRP-SA 重组质粒转至E.coli BL21/ DE3感受态细胞中,涂布于含Kan+抗性的LB平板上筛选阳性单克隆,然后接种于含卡那霉素的5 mL LB液体培养基中,放入37℃摇床培养,摇至OD600约为0.6 时,加入IPTG 至终浓度为0.4 mmol/L,继续37℃摇5 h,进行15%SDS-PAGE电泳分析表达情况。对阳性克隆进行大量的诱导表达,超声裂解后离心收集沉淀,用强变性剂尿素进行蛋白沉淀的溶解及透析复性,根据Ni-IDA Agarose说明书进行蛋白纯化,进行15% SDS-PAGE电泳分析,将蛋白于-80℃保存备用。利用兔来源的抗His标签的抗体为一抗,辣根过氧化物酶标记的羊抗兔IgG 抗体为二抗,Western blot 鉴定纯化的PGRP-SA重组蛋白。
1.2.6PGRP-SA在不同组织的半定量RT-PCR分析 以家蝇RPSl8基因为内参,其引物为RPS18-F:5'-ATGTCGCTCGTTATCCCAGAAAAG-3',RPS18-R:5'-TTACTTCTTCTTGGATACACCGACA-3'。以家蝇3龄幼虫不同组织cDNA为模板,应用RTPCR分别扩增PGRP-SA基因及RPSl8基因。PCR条件为:94℃预变性5 min;94℃ 30 s,54℃ 30 s,72℃ 45 s,30个循环;72℃延伸10 min。PCR产物行1.5%琼脂糖凝胶电泳鉴定。
1.2.7PGRP-SA重组蛋白与微生物的结合实验 将进行微生物结合实验的目的菌株(大肠杆菌、金黄色葡萄球菌、白色念珠菌)进行过夜培养,第2天以6 000 r/min的转速离心5 min收集菌体,用1 mL TBS 缓冲液悬起,洗涤两次,弃上清,分别加入1 mL重组蛋白PGRP-SA,室温条件(25℃)下摇床孵育1 h;6 000 r/min离心5 min后弃上清,用1 mL TBS缓冲液洗涤沉淀,重复3次。离心后收集最后的菌体沉淀和洗涤液。处理样品后利用Western blot方法检测结合实验的效果[16]。使用抗His 标签的抗体为一抗,辣根过氧化物酶标记的羊抗兔IgG 抗体为二抗。
2 结果
2.1家蝇PGRP-SA基因的生物信息学分析
该cDNA序列ORF 长为615 bp(登录号:XM_005186981),编码204个氨基酸(图1)。预测家蝇PGRP-SA蛋白的理论分子量为22 821.1 Da,等电点为9.11,属于碱性蛋白质。预测在溶液中性质稳定。运用Signal P结果显示该编码蛋白存在信号肽序列,位于 1-24位氨基酸之间,因此判定该编码蛋白为分泌型蛋白。运用Smart 软件分析PGRP-SA的功能结构,发现了它的功能结构域PGRP结构域位于第35-第177位氨基酸,推测此蛋白可能具有能与肽聚糖结合并在信号通路中发挥作用的功能。
2.2原核重组质粒的鉴定
将切除信号肽后的目的基因PCR扩增,分别将PGRP-SA 的PCR 产物和pET-28a(+)双酶切回收后,通过T4 连接酶连接并转入表达宿主菌。对阳性克隆提取重组质粒双酶切鉴定,琼脂糖凝胶电泳结果(图2)显示约500 bp处有一目的条带,大小与目的基因基本相符,测序结果显示重组质粒构建成功。

图1 PGRP-SA基因开放阅读框cDNA序列及对应编码的氨基酸序列

图2 pET-28a(+)-PGRP-SA重组质粒 PCR 鉴定
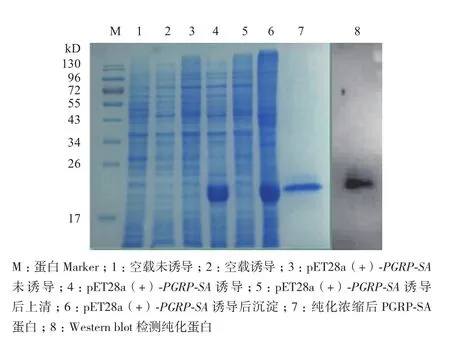
图3 PGRP-SA重组蛋白的诱导表达
2.3蛋白表达、纯化及鉴定
将构建好的pET-28a(+)-PGRP-SA转化到表达宿主菌中经0.4 mmol/L的IPTG诱导表达,进行15% SDS-PAGE 电泳。结果(图3第4、6泳道)所示,约在 24 kD左右出现蛋白表达条带,纯化后的重组蛋白为单一条带(第7泳道),表明目的蛋白纯化成功。对纯化蛋白做Western blot 验证,结果显示目的条带单一且清晰(第8泳道),说明目的蛋白表达正确。
2.4家蝇3龄幼虫不同组织PGRP-SA基因的表达分析
以家蝇3龄幼虫不同组织(血淋巴、脂肪体、前肠、中肠、后肠、气管、马氏管)cDNA为模板,进行RT-PCR扩增,结果(图4)显示内参基因RPS18呈一致性表达,且表达量较为稳定。PGRPSA在血淋巴、脂肪体、前肠、中肠、气管、马氏管都有表达,血淋巴中表达量最高,后肠组织无表达。

图4 家蝇不同组织PGRP-SA基因的扩增结果
2.5PGRP-SA重组蛋白与微生物的结合实验
PGRP-SA蛋白分别与金黄色葡萄球菌、大肠杆菌、白色念珠菌进行结合实验,分别收集细菌沉淀及最后一次洗涤液,利用Western blot检测实验结果。如图5第2、4泳道所示约在24 kD大小有蛋白目的条带,且第3、5泳道显示最后一次洗涤液都没有目的蛋白,蛋白与第1泳道的PGRP-SA蛋白位置相一致。说明PGRP-SA能与金黄色葡萄球菌、大肠杆菌结合。第6泳道显示PGRP-SA不能与真菌白色念珠菌结合。
3 讨论
当细菌、病毒等病原体入侵昆虫时,昆虫首先靠自身的模式识别受体(pattern recognition receptors,PRRs)来识别病原体相关分子模式(pathogen associated molecular patterns,PAMPs),从而激活相关先天免疫通路消除病原物[17]。在昆虫先天免疫系统中,模式识别受体主要有PGRPs、β-葡聚糖识别蛋白(β-glucan recognitionprotein,β-GRP)和革兰氏阴性菌结合蛋白(Gram-negative binding protein,GNBP)[18]。但其中最主要的模式识别受体是PGRPs,它通过识别病原生物表面的病原相关分子模式如肽聚糖,从而启动先天免疫反应,激活Toll途径、JAK-STAT途径、IMD等途径来产生抗菌肽对病原物进行清除。PGRPs是国内外学者研究昆虫免疫调控关键因子的热点之一。

图5 PGRP-SA蛋白微生物结合实验
PGRPs是于1996年由Yoshida 等[19]首次在家蚕体内发现,对革兰氏阳性菌的肽聚糖结构有较高的结合能力,并且能导致黑化反应。对PGRPs识别肽聚糖的机制研究发现革兰氏阳性菌和革兰氏阴性菌的识别机制并不完全相同,革兰氏阳性菌的肽聚糖是直接暴露在细胞壁的外层,PGRPs 直接与其结合;但革兰氏阴性菌的肽聚糖则被细胞壁外层膜包被,PGRPs 如何识别革兰氏阴性菌肽聚糖的机制还不完全清楚,目前有两种假设,一种是革兰氏阴性菌的部分肽聚糖发生了脱离,PGRPs 通过识别脱离的肽聚糖来激活免疫反应[20]。另外一种是吞噬细胞对革兰氏阴性菌进行吞噬的时候,肽聚糖被暴露出来从而被果蝇PGRP所识别[21]。这两种观点还需要更多的实验验证。在关于PGRPs杀菌活性机制研究中,发现哺乳动物的肽聚糖识别蛋白没有酰胺酶活性也能使细菌死亡,原因是在革兰氏阳性菌分裂时哺乳动物PGRP能进入细菌细胞壁终止胞内肽聚糖的合成[22]。果蝇PGRP的杀菌机制是利用其特异的酰胺酶活性杀死细菌。说明肽聚糖识别蛋白的杀菌机制存在物种间的差异,是否所有昆虫的PGRPs杀菌机制都相似也是未知的。
革兰氏阳性菌的肽聚糖主要被PGRP-SA或PGRP-SD识别从而激活Toll信号通路,启动抗菌肽的合成。孙强[23]运用RT-PCR技术对亚洲玉米螟PGRP-SA基因在不同组织表达进行研究,结果显示PGRP-SA的主要表达部位为中肠、表皮、脂肪体,并且对玉米螟4龄幼虫进行革兰氏阳性菌和革兰氏阴性菌感染,发现PGRP-SA表达上调,革兰氏阳性菌诱导后PGRP-SA上调量高于革兰氏阴性菌。Zheng[24]对小菜蛾PGRP-SA研究发现PGRP-SA主要在血淋巴和脂肪体表达,与本研究结果相同。说明家蝇PGRP-SA基因的表达具有一定的组织性,显示该基因可能在对病原生物表面的病原体相关分子模式的相互识别和作用并启动家蝇先天性免疫应答进而抵御微生物发挥关键作用。对果蝇肽聚糖识别蛋白的研究发现果蝇PGRP-SA能够激活Toll途径,果蝇PGRP-SA(Cys80Tyr)的突变会导致其激活Toll途径的活性失效。PGRP-SA能与Lys型肽聚糖和DAP型肽聚糖发生结合,但Toll途径优先被Lys型肽聚糖激活,对DAP型反应较弱[25]。Lys型肽聚糖即主要存在于革兰氏阳性菌中。本研究表明家蝇PGRP-SA能与革兰氏阳性菌金黄色葡萄球菌、革兰氏阴性菌大肠杆菌结合,推测PGRP-SA可能是家蝇先天免疫系统中应对细菌感染的一个重要因子。为下一步研究家蝇PGRP-SA参与激活Toll信号通路及抗菌肽的合成奠定了基础。与果蝇同属双翅目的家蝇是否与果蝇具有相似的免疫识别机制呢?
本研究从家蝇幼虫cDNA 文库中筛选到并成功克隆了家蝇PGRP-SA基因,全长615 bp,编码204个氨基酸,构建pET-28a(+)-PGRP-SA 重组质粒并在大肠杆菌中成功表达,利用亲和层析法纯化了PGRP-SA蛋白,继而用Western blot 验证目的蛋白表达正确。RT-PCR检测发现PGRP-SA在家蝇血淋巴、脂肪体、前肠、中肠、气管、马氏管均有表达,血淋巴组织中表达量最高。细菌结合实验表明PGRPSA能与金黄色葡萄球菌和大肠杆菌结合。
4 结论
本研究成功构建pET-28a(+)-PGRP-SA重组原核表达载体并表达出PGRP-SA蛋白,获得纯化蛋白。发现PGRP-SA在家蝇血淋巴中表达量最高,血淋巴是家蝇主要的免疫组织之一。证实了家蝇PGRP-SA能与金黄色葡萄球菌和大肠杆菌结合。
[1]Steiner H. Peptidoglycan recognition proteins:on and off switches for innate immunity[J]. Immunol Rev, 2004, 198:83-96.
[2]许平震, 张美蓉, 程延才, 等. 家蚕模式识别受体PGRP、βGRP编码基因的克隆鉴定及表达谱分析[J]. 蚕业科学, 2010, 36 (3):383-390.
[3]Dziarski R. Recognition of bacterial peptidoglycan by the innate immune system[J]. Cell Mol Life Sci, 2003, 60:1793-1804.
[4]Ligoxygakis P, Pelte N, Hoffmann JA, et al. Activation of Drosophila toll during fungal infection by a blood serine protease[J]. Science,2002, 297:114-116.
[5]Michel T, Reichhart JM, Hoffmann JA, et al. Drosophila toll is activated by gram positive bacteria through a circulating peptidoglycan recognition protion[J]. Nature, 2001, 414:756-759.
[6]Chen KK, Liu C, He Y, et al. A short-type peptidoglycan recognition protein from the silkworm:expression, characterization and involvement in the prophenoloxidase activation pathway[J]. Dev Comp Immunol, 2014, 45:1-9.
[7]Yang DQ, Su ZL, Qiao C, et al. Identification and characterizattion of two peptidoglycan recognition proteins with zinc-dependent antibacterial activity from the cotton Bollworm, Helicoverpa armigera[J]. Dev Comp Immunol, 2013, 39:343-351.
[8]Iizuka M, Nagasaki T, Takahashi KG, et al. Involvement of pacific oyster CgPGRP-S1S in bacterial recognition, agglutination and granulocyte degranulation[J]. Dev Comp Immunol, 2014, 43:30-34.
[9] Kurata S. Peptidoglycan recognition proteins in Drosophila Immunity[J]. Dev Comp Immunol, 2014, 42:36-41.
[10] Lemaitre B, Hoffmann J. The host defense of Drosophila melanogaster[J]. Annu Rev Immunol, 2007, 25:697-743.
[11]Royet J, Reichhart JM, Hoffmann JA. Sensing and signaling during infection in Drosophila[J]. Curr Opin Immunol, 2005, 17(1):11-17.
[12]Mellroth P, Karlsson J, Steiner H. A scavenger function for aDrosophila peptidoglycan recognition protein[J]. J Biol Chem,2003, 278:7059-7064.
[13]侯利霞, 翟培, 施用晖, 等. 不同细菌对家蝇幼虫抗菌蛋白肽的诱导效应[J]. 应用昆虫学报, 2006, 43(6):827-831.
[14]王宇, 吴高吉, 罗曼, 等. 家蝇Thymosin(THY)基因的克隆及原核表达[J]. 生物技术通报, 2015, 31(2):143-147.
[15]Gao YF, Tang T, Gu JH, et al. Downregulation of the Musca domestica peptidoglycan recognition protein SC(PGRP-SC)leads to overexpression of antimicrobial peptides and tardy pupation[J]. Molecular Immunology, 2015, 67:465-474.
[16]Huang Y, Ma FT, Wang W, et al. Identification and molecular characterization of a peritrophin-like gene, involved in the antibacterial response in Chinese mitten crab, Eriocheir sinensis[J]. Developmental and Comparative Immunology, 2015 (50):129-138.
[17]Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4):783-801.
[18]陈康康, 吕志强. 昆虫肽聚糖识别蛋白研究进展[J]. 昆虫学报, 2014, 57(8):969-978.
[19]Yoshida H, Kinoshita K, Ashida M. Purification of a peptidoglycan recognition protein from hemolymph of the silkworm, Bombyx mori[J]. J Biol Chem, 1996, 271:13854-13860.
[20] Leulier F, Parquet C, Pili-Floury S, et al. The Drosophila immune system detects bacteria through specific peptidoglycan recognition [J]. Nat Immunol, 2003, 4:478-484.
[21]Garver LS, Wu JL, Wu LP. The peptidoglycan recognition protein PGRP-SC1a is essential for Toll signaling and phagocytosis of Staphylococcus aureus in Drosophila[J]. Proc Natl Acad. Sci USA, 2006, 103:660-665.
[22]Kashyap DR, Wang M, Liu LH, et al. Peptidoglycan recognition proteins kill bacteria by activating protein-sensing two-component systems[J]. Nat Med, 2011, 17:676-683.
[23]孙强. 亚洲玉米螟PGRP-SA的克隆、表达及其组织表达差异性分析[D]. 广州:华南农业大学, 2009.
[24]Zheng ZH, Xu XX, wang S, et al. Molecular cloning and characterization of a short peptidoglycan recognition protein (PGRP-SA)from Plutella xylostella[C]. The 4th International Conference of Insect Physiology, Biochemistry and Molecular Biology. Nanjing Agricultural University:2013.
[25]Werner T, Borge-Renberg K, Mellroth P, et al. Functional diversity of the Drosophila PGRP-LC gene cluster in the response to lipopolysaccharide and peptidoglycan[J]. J Biol Chem, 2003,278(29):26319-26322.
(责任编辑 李楠)
Cloning,Expression and Bacterial Binding of Peptidoglycan Recognition Proteins-SA Gene from Musca domestica
LUO Man1WANG Yu1,2HU Ya1XIU Jiang-fan1WANG Tao1PENG Jian1SHANG Xiao-li1WU Jian-wei1
(1. Department of Parasitology,Guizhou Medical University,Guiyang 550004;2. Guizhou Provincial Center for Disease Control and Prevention,Guiyang 550004)
This work is to clone and express the Musca domestica peptidoglycan recognition proteins-SA(PGRP-SA)gene and research the microbial binding activity of it. The PGRP-SA gene was isolated from M. domestica larvae cDNA library,then primers were designed using cDNA plasmid as the template,and the complete encoding sequence of PGRP-SA was acquired by PCR. The bioinformatics methods were employed to predict and analyze the gene and its encoded proteins. The recombinant plasmid pET-28a(+)-PGRP-SA was expressed in Escherichia coli for induced expression and protein purification. RT-PCR was used to test the varied transcription levels of PGRP-SA gene in different tissues. The microbial binding activity of PGRP-SA protein was studied by the microorganism binding assay. The results indicated that the ORF full-length of PGRP-SA gene was 615 bp,encoding 204 amino acids. The molecular weight was 22.8 kD and pI 9.11 and had the conserved PGRP domain. After the recombinant plasmid pET-28a(+)-PGRP-SA was successfully constructed,it was expressed in E. coli by IPTG. SDS-PAGE and Western blot analysis showed that the functional protein purified by Ni2+affinity chromatography was in consistent as the predicted in size. PGRP-SA was expressed in three instars hemolymph,fat body,foregut,midgut,trachea,malpighian tube excepthindgut,the highest in the hemolymph,indicating that the expression of PGRP-SA was tissue-specific. Recombinant PGRP-SA protein bound to Staphylococcus aureus and E. coli,but not Monilia albica. Conclusively,the M. domestica PGRP-SA protein was successfully expressed and purified,and also it was confirmed that PGRP-SA protein from M. domestica bound to S. aureus and E. coli.
Musca domestica;innate immunity;peptidoglycan recognition proteins;prokaryotic expression;microorganism binding assay
10.13560/j.cnki.biotech.bull.1985.2016.08.022
2016-03-08
国家自然科学基金项目(81360254),贵州省农业攻关项目(NY[2014]3054)
罗嫚,女,硕士研究生,研究方向:医学昆虫免疫及应用;E-mail:214722912@qq.com
吴建伟,男,博士生导师,研究方向:医学昆虫免疫及应用;E-mail:wjw@gmc.edu.cn

