胰酶酶解珍珠贝分离蛋白制备低苯丙氨酸寡肽制品
郑惠娜,周春霞,陈志成,苏伟明,章超桦,秦小明(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),广东湛江524088)
胰酶酶解珍珠贝分离蛋白制备低苯丙氨酸寡肽制品
郑惠娜,周春霞,陈志成,苏伟明,章超桦,秦小明
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),广东湛江524088)
苯丙酮酸尿症(PKU)是一种常见的氨基酸代谢性疾病,低苯丙氨酸饮食对于PKU患者非常重要。本研究以珍珠产业副产物马氏珠母贝肉为原料,提取分离蛋白后,采用胰酶酶解、超滤分级及活性炭吸附分离技术制备低苯丙氨酸寡肽营养功能基料。研究结果显示:随着酶解时间的进行,酶解液中<5 ku的寡肽含量呈现先增加后减少趋势(p<0.05),酶解1 h时,酶解液中所含的寡肽含量最多;经过超滤分级后,>5 ku和<300 u的酶解液中仍存在一些寡肽残留,其中>5 ku组分中寡肽含量为10.43%,<300 u组分含量为24.52%,而300 u~5 ku组分中寡肽含量达到了68.38%;<300 u组分的苯丙氨酸含量最高达到9.52%,活性炭对芳香族氨基酸的吸附量均高于其他氨基酸,300 u~5 ku组分经过活性炭吸附后得到1.29%的低苯丙氨酸寡肽溶液。可以以此为基料开发辅助治疗苯丙酮尿症、吸收率高的低苯丙氨酸寡肽营养功能制品。
胰酶,珍珠贝,低苯丙氨酸,寡肽
苯丙酮酸尿症(PKU)是一种常见的氨基酸代谢性疾病,是由于染色体基因突变导致肝脏中苯丙氨酸羟化酶(PAH)缺陷从而引起苯丙氨酸(PA)代谢障碍,导致苯丙氨酸在人血液中积聚[1]。根据1983年左
启华教授报告,我国发病率约为1/16500,并且出现了逐年递增的趋势。如果忽视了此疾病的治疗或治疗时间较迟均会导致患者智力和神经系统的损害。然而,如果在最初就开始控制苯丙氨酸的摄入量,PKU患儿即能够像正常儿童那样成长。对于PKU患者,这种饮食上的控制必须是长期的,因此低苯丙氨酸饮食对于PKU患者非常重要[2]。然而,目前市面上的低苯丙氨酸食品非常少,主要以不含有苯丙氨酸的配方奶粉为主。市面上低苯丙氨酸制品非常缺乏,无法满足苯丙酮尿症患者的需求。寡肽是氨基酸药物、保健品发展的趋势[3]。而开发新的蛋白资源用于制备低苯丙氨酸寡肽具有重要的现实意义。马氏珠母贝肉是珍珠养殖采珠后的副产品,也是一种高蛋白、低脂肪的海产品,并具有清热解毒、平肝潜阳等功效,其蛋白含量高达74.9%(干基计)[4],以马氏珠母贝肉为原料开发具有辅助治疗PKU疾病的寡肽功能制品还未见报道。因此,本研究在前期研究基础上,提取马氏珠母贝分离蛋白后,选择合适的蛋白酶种类进行酶解、进一步利用超滤分级及活性炭吸附分离技术制备具有辅助治疗苯丙酮尿症、吸收率高的低苯丙氨酸寡肽营养功能基料,以期为进一步开发利用马氏珠母贝肉提供参考。
1 材料与方法
1.1 材料与仪器
马氏珠母贝 购于湛江市东风市场,新鲜贝肉去壳取肉清洗干净,-18℃贮藏备用;胰酶(400 U/g)
南宁庞博生物工程有限公司;Folin-酚试剂盒 北京鼎国生物技术有限公司;活性炭 江西丰城市荣丰活性炭厂;牛血清白蛋白BSA 广州市齐云生物科技有限公司;其他试剂 均为分析纯。
pH-25数显pH酸度计 上海康仪仪器有限公司;DL6M大容量冷冻离心机 湖南赛特湘仪离心机仪器有限公司;T18 basic高速分散机 德国IKA公司;Sigma 3K3离心机 德国Brawn Biotech International公司;UV-2550紫外可见分光光度计 日本岛津公司;LD-50G-D超纯水机 重庆利迪实验仪器设备有限公司;HL-2电脑恒流泵 上海泸西分析仪器厂;N1001+S+W旋转蒸发仪 浙江托普仪器有限公司;WTM-1812G膜分离设备 杭州沃腾膜工程有限公司;QJ-100酶解罐 温州明科机械有限公司;S450三足立式离心机 上海地元离心机有限公司;FPLC制备型蛋白纯化系统 美国GE公司;5 ku超滤离心管 美国Millipore公司;Superdex Peptide 10/300 GL凝胶过滤层析柱 美国GE公司。
1.2 实验方法
1.2.1 分离蛋白的制备 参考资料[5],准确称取5 kg的珍珠贝肉,按1∶3(w/v)比例加入蒸馏水,采用0.1 mol/L NaOH调节溶液至pH12,搅拌3 h,然后4000 r/min离心20 min,取上清液,0.1 mol/L HCl调节至最佳酸沉pH4.5~5.0,静置1 h,4000 r/min离心15 min,取沉淀,然后加入蒸馏水溶解后,0.1 mol/L NaOH调节分离蛋白溶液pH至7.5。
1.2.2 分离蛋白的酶解及寡肽含量的测定 调节分离蛋白浓度为5 mg/mL,分别取250 mL于5个锥形瓶中,按照2000 U/g蛋白加入酶量,在55℃水浴锅中酶解0、1、2、3、4、5 h,酶解完成后在95℃下水浴锅灭酶10 min,冷却至室温,10000 r/min离心20 min。然后,取上述离心后的上清液6 mL,于5 ku的超滤离心管,4000 r/min离心超滤30 min后,取全部过滤液,采用50 mL容量瓶定容后,双缩脲法测定滤液中寡肽含量,并确定酶解时间。
以谷胱甘肽为标准品绘制标准曲线,Y=0.1608x+6E-17,R2=0.9946。
1.2.3 样品分子量分布的确定 样品分子量分布测定采用凝胶过滤层析法,使用Superdex Peptide 10/ 300 GL分析柱进行样品分析,流动相为0.05 mol/L pH7.4的Tris-HCl缓冲液(含0.5%NaCl)。进样量:20 μL;流速:0.7 mL/min;检测波长:214 nm;柱子温度:25℃。
1.2.4 超滤系统对酶解液进行分级 根据1.2.2分析结果确定最佳酶解时间制备酶解产物。首先,将酶解产物以1 mL/min流速经过陶瓷膜,收集过滤液,进一步采用截留分子量为5 ku超滤膜进行超滤,收集5 ku以下的超滤液,再采用截留分子量为300 u的纳滤膜进行纳滤,酶解上清液超滤后分别得到分子量范围为>5 ku、300 u~5 ku和<300 u的三种不同分子量组成的酶解超滤液。
1.2.5 蛋白及寡肽含量计算 分别采用福林酚法和超滤结合双缩脲法对酶解分级液进行蛋白质和寡肽含量的测定。然后根据下列公式计算各级超滤酶解液的寡肽百分含量。
计算公式如下:P(%)=N/M×100
式中:P—酶解液寡肽占蛋白百分含量;N—各级酶解液寡肽含量g/L;M—各级酶解液蛋白含量g/L。
1.2.6 活性炭脱除酶解液中苯丙氨酸 将活性碳填充入色谱柱中,含有300 u~5 ku组分的酶解超滤液以流速8 mL/min流经活性炭色谱柱进行脱色及苯丙氨酸脱除。
1.2.7 氨基酸组成分析 氨基酸分析送至广东分析测试中心进行检测。具体分析步骤:称取样品数毫升,加入2 mL 5.7 mol/L HCl,置于110℃烘箱内水解24 h,然后除去过量的HCl,加缓冲溶液稀释到50 mL,摇匀。采用氨基酸自动分析仪分析,上机条件:流动相为专用缓冲液PI-1、2、3、4(分别为pH2.2、3.3、4.0、6.4柠檬酸钠缓冲液),流速:0.225 mL/min,温度:25℃,上样量50 μL[6]。
1.2.8 实验数据分析 实验数据采用SPSS 13.0进行方差(ANOVA)显著性(p<0.05)分析,Excel 2007软件进行数据处理及绘图。
2 结果与分析
2.1 最佳胰酶酶解时间的确定
低苯丙氨酸寡肽制品应同时具备寡肽含量高而苯丙氨酸含量低的特点,因此,如何通过酶解获得高含量的寡肽是制备的关键。前期研究已经确定胰酶为最佳释放芳香族氨基酸的酶类,其含有胰蛋白酶、胰凝乳蛋白酶和羧肽酶,是以Phe-、Tyr-、Trp-、Leu-
COOH等基团为酶切位点的复合酶[7]。因此,以提纯的珍珠贝分离蛋白为底物,采用胰酶进行酶解,确定最佳寡肽得率的酶解时间,结果见图1。

图1 不同酶解时间对超滤后酶解液<5 ku寡肽含量的影响Fig.1 Effect of different enzymatic hydrolysis time on<5 ku oligopeptide content after ultrafiltration
从图1可知,随着酶解时间的进行,酶解液中<5 ku的寡肽含量呈现先增加后降低的趋势(p<0.05)。酶解过程是一种复杂的生化反应过程,在酶解开始阶段,分子量较大的蛋白被酶解为多肽,随着酶解反应的进行,多肽又被酶解为短肽,同时也有部分水解成氨基酸,所以,短肽在酶解液中的含量随着蛋白及多肽的降解而增加,但是同时,也随着其被降解成氨基酸而减少[8-9]。在酶解的开始1~2 h阶段,大部分蛋白已经被酶解为多肽和寡肽,在随后的酶解时间段内,一部分多肽和寡肽逐渐水解成氨基酸,因此,酶解液中寡肽含量并不是随着酶解时间的进行呈增加,而是达到一个最大峰值后开始下降,从结果分析,确定最佳酶解时间为1 h。
2.2 酶解液分子量分布分析
图2显示了不同酶解时间制备的酶解液的分子量分布图谱,选择接近10000 u和5000 u的两个标准分子量物质红细胞色素C(12355 u),抑肽酶(6512 u)为界限分析分子量分布情况。结果分析显示,酶解前的蛋白溶液只有一个色谱峰,本实验采用的分析柱是Superdex Peptide 10/300 GL,只能有效分离分子量在100~7000 u之间的蛋白或多肽,大于7000 u的蛋白或多肽在同一保留时间出峰。因此,酶解前的蛋白溶液大部分的分子量均大于7000 u。而随着酶解时间的进行,第一个大峰消失,逐渐酶解成多肽和寡肽,从图中1~5 h酶解液的图谱分析,随着酶解时间的进行,大分子的肽峰面积逐渐减小,小分子的肽或氨基酸峰面积逐渐增加,说明酶解过程的进行,然而,这种变化趋势在开始的1 h内变化较为明显,随后的水解5 h过程中虽然峰图谱有所变化,但是变化程度较小,因此,确定酶解时间为1 h。
超滤分级是蛋白酶解液常用的分离方法[10]。图3比较分析了酶解1 h酶解液和采用5 ku超滤膜超滤后酶解液的分子量分布图。从图中结果可以看出,采用5 ku超滤膜超滤后,大分子的蛋白峰明显被超滤截留。
2.3 超滤各级酶解液寡肽含量分析

图2 不同酶解时间对酶解液分子量分布的影响Fig.2 Effect of different enzymatic hydrolysis time on the molecular weight distribution of the hydrolyzate
根据上述研究结果,确定最佳酶解时间为1 h,大量制备酶解液进行下一步的超滤分级分离。研究显示,超滤膜能够对酶解产物进行有效分离分级[10]。本研究采用5 ku、300 u截留分子量的超滤膜对酶解液进行分级分离,获得三种分级酶解液:>5 ku酶解液、300 u~5ku酶解液和<300 u酶解液。>5 ku酶解液主要是一些蛋白和多肽,<300 u酶解液主要是氨基酸和盐类物质,300 u~5 ku酶解液主要是<5 ku的寡肽,这部分为目标产物。

图3 酶解液及5 ku超滤后酶解液分子量分布对比图Fig..3 Comparison of the molecular weight distribution of hydrolyzate and<5 ku hydrolyzate
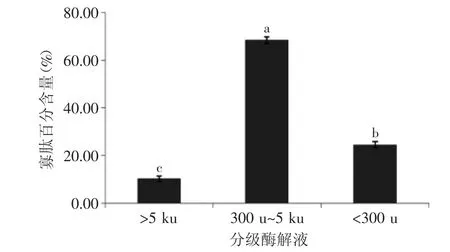
图4 酶解液各分级组分<5 ku寡肽含量比较Fig.4 Comparison of<5 ku oligopeptide content each grade hydrolyzate
本研究分别分析了各分级酶解液中<5 ku的寡肽占溶液蛋白的百分含量,结果见图4。从图中结果分析,经过超滤分级后,>5 ku和<300 u的酶解液中仍存在一些寡肽残留。其中>5 ku组分中寡肽含量为10.43%,<300 u组分中24.52%,而300 u~5 ku组分中寡肽含量达到了68.38%,其余部分可能是一些氨基酸和蛋白。

表1 氨基酸组成及含量(%,n=2)Table1 Amino acid components and contents(%,n=2)
2.4 活性炭吸附前后酶解液氨基酸组成分析
活性炭表面具有特殊的乱层石墨结构微晶区,碳原子呈六角形排列,这种非极性结构使其对有机物碳氢部分有强烈的范德华力作用,并能使大多数含芳环化合物的芳环部分以平躺方式吸附[11]。因此,活性炭对氨基酸的吸附既受氨基酸自身性质影响也受氨基酸存在体系影响。
表1显示了酶解前后、三种分级酶解液及活性炭吸附后寡肽溶液的氨基酸组成,从表中结果分析,酶解前蛋白溶液苯丙氨酸含量为4.23%,酶解后酶解液的苯丙氨酸含量为3.59%,相比于其他两个超滤组分,<300 u组分的苯丙氨酸含量最高达到9.52%,由于采用胰酶的酶切位点特点,酶解后产生较多游离苯丙氨酸,<300 u组分主要含有游离氨基酸,因此,被酶解出的游离苯丙氨酸在这部分中含量较高,通过分级分离可以适当分离出一些苯丙氨酸组分,然而,经过分级后300 u~5 ku的苯丙氨酸含量仍较高,因此采用活性炭进一步对其进行吸附,前期研究显示[12-13],无论是处于结合状态还是游离状态,活性炭对芳香族氨基酸的吸附量均高于其他氨基酸,吸附后获得苯丙氨酸含量约为1.29%的低苯丙氨酸寡肽溶液。
3 结论
采用胰酶酶解珍珠贝分离蛋白,酶解1 h可以获得最佳寡肽含量酶解产物,采用超滤分级和活性炭吸附对酶解产物进行分级及吸附分离得到苯丙氨酸含量约为1.29%的低苯丙氨酸寡肽,可以以此为基料通过营养调配开发辅助治疗苯丙酮尿症、吸收率高的低苯丙氨酸寡肽营养功能制品。
[1]Moszczynski P,Idziac J.Preparation of enzymatic hydrolysatesofcasein depleted in phenyllalanine[J].Biochemistry and Microbiology,1993,29:302-306.
[2]Mira N V M,Marquez U M L.Importancia do diagnosticoe tratamento da fenilcetonuria[J].Revista Sau de Publica,2000,34:86-96.
[3]李永青,赵祥忠,张合亮,等.酶法制备贝类寡肽生产技术研究[J].食品与机械,2014,30(3):206-210.
[4]章超桦,吴红棉.马氏珠母贝肉的营养成分及其游离氨基酸组成[J].水产学报,2000,24(2):180-184.
[5]郑惠娜,张晶晶,周春霞,等.pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J].中国食品学报,2014,14(7):230-235.
[6]傅润泽,刘俊荣,王帅,等.采用酸碱提取法对鲢肌肉蛋白分离特性的影响[J].大连海洋大学学报,2011,26(6):540-543.
[7]Huina Zheng,Chaohua Zhang,Wenghong Cao,et al.Preparation and characterization of Pinctada martensii meat protein hydrolysates with a high Fischer ratio[J].International Journal of Food Science and Technology,2009,44(6):1183-1191.
[8]任娇艳,赵谋明,崔春,等.基于响应面分析法的草鱼蛋白酶解工艺[J].华南理工大学学报:自然科学版,2006,34(3):95-100.
[9]Qi W,He Z,Shi D.Product distribution of casein tryptic hydrolysis based on HPSEC analysis and molecular mechanism [J].Chemical Engineering Science,2003,58(3-6):767-775.
[10]Myung S W,Choi I H,Lee S M,et al.Separation of silk proteins and silk oligopeptides by thin film composite ultrafiltration membrane[J].Desalination,2008,234:158-165.
[11]赵振国,樊艾星.硅烷化活性炭的表面性质[J].高等学校化学学报,1989(11):1119-1123.
[12]郑惠娜,章超桦,秦小明,等.活性炭静态吸附马氏珠母贝胰酶水解产物中氨基酸特性研究[J].食品工业科技,2011,32 (2):98-103.
[13]Daniella C F L,Fernanda M D,Marialice P C S.Use of activated carbon for removing phenylalanine from reconstituted skim milk powder hydrolysates[J].LWT-Food Science and Technology,2005,38:447-453.
Preparation of low-phenylalanine oligopeptide from Pinctada martensii protein isolates by pancreatin
ZHENG Hui-na,ZHOU Chun-xia,CHEN Zhi-cheng,SU Wei-ming,ZHANG Chao-hua,QIN Xiao-ming
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,National Research and Development Branch Center for Shellfish Processing(Zhanjiang),Zhanjiang 524088,China)
Phenylketonuria(PKU)was a common amino acid metabolic diseases,low-phenylalanine diet was important for PKU patients.In this study,the pearl industry byproducts-pearl oyster meat was as raw meat,and the low-phenylalanine oligopeptides were preparation by separation of proteins,pancreatin digestion,ultrafiltration grade and activated carbon adsorption separation.The results showed that with the advance of hydrolysis time,the content of<5 ku oligopeptide first increased and then decreased(p<0.05),the oligopeptide content reached the highest when hydrolysis 1 h.There was still some residual oligopeptide in the>5 ku and<300 u hydrolyzate after ultrafiltration,which>5 ku components oligopeptide content was 10.43%,<300 u component 24.52%,while 300 u~5 ku component oligopeptide content reached 68.38%.Phenylalanine component of <300 u component was up to 9.52%,activated carbon adsorption of aromatic amino acids were higher than other amino acids,the phenylalanine component of 300 u~5 ku was reached 1.29%after the activated carbon adsorption.This could be used as the base material to prepare of low phenylalanine oligopeptide nutritional function products for phenylketonuria.
pancreatin;Pinctada martensii;low phenylalanine;oligopeptide
TS254.1
A
1002-0306(2016)08-0215-05
10.13386/j.issn1002-0306.2016.08.036
2015-09-10
郑惠娜(1979-),女,博士,副教授,主要从事水产贝类高值化利用的研究,E-mail:margaretpaper@126.com。
现代农业产业技术体系建设专项资金资助(CARS-48-07B);广东省高校重大科研项目培育计划(GDOU2013050245);广东省高等学校优秀青年教师培养计划(Yq2014005);湛江市科技攻关项目(2010C3112004)。

