水杨酸对盐胁迫下沙打旺幼苗生长的影响
王宝增,张一名,张江丽,秘树青,孔红
(廊坊师范学院生命科学学院,河北 廊坊065000)
水杨酸对盐胁迫下沙打旺幼苗生长的影响
王宝增,张一名,张江丽,秘树青,孔红
(廊坊师范学院生命科学学院,河北 廊坊065000)
水杨酸(salicylic acid,SA)作为一种植物激素,不仅参与植物生长和发育等过程,而且还能诱导植物的抗逆性。为研究外源水杨酸对盐胁迫下沙打旺幼苗生长的影响,以沙打旺幼苗为材料,采用200 mmol/L NaCl 并添加不同浓度SA(0.2,0.4,0.6,0.8,1.0 mmol/L)的处理方法,通过测定沙打旺生长及生理指标,以确定外源SA对沙打旺幼苗生长的影响。结果表明,与单纯盐胁迫相比,一定浓度的SA(0.4~0.8 mmol/L)能提高盐胁迫下沙打旺叶片可溶性蛋白含量, 0.6和0.8 mmol/L SA处理分别增加了51.9%和42.6%;增强盐胁迫下沙打旺叶片超氧化物歧化酶(SOD)活性,0.4和0.6 mmol/L SA处理分别提高了1.58和1.68倍;降低叶片质膜透性, 0.4,0.6和0.8 mmol/L SA处理,叶片相对电导率依次降低了19.2%,26.6%和18.1%;提高盐胁迫下沙打旺的光合能力,0.4和0.6 mmol/L SA处理,净光合速率分别增加了1.21和1.43倍;使株高和干重增加。其中,0.6 mmol/L SA处理效果最为明显。表明外源SA能够在一定程度上促进盐胁迫下沙打旺幼苗的生长。
沙打旺;水杨酸;盐胁迫;生长
土壤盐渍化是农业生产中面临的严重问题,全球有20%的耕地和近半数的灌溉土地都受到不同程度的盐害威胁,盐胁迫已成为影响植物生长发育的重要环境因素[1]。如何使植物在盐渍环境中正常生长,已成为科研工作者共同关注的问题。研究表明,通过添加外源物质调控植物代谢可以缓解盐渍对植物的伤害。例如,外源钙可通过提高黄瓜(Cucumissativus)光合色素含量,减少碳水化合物积累对光合作用的负反馈作用,缓解盐胁迫对光合作用的伤害[2]。外源亚精氨可提高大豆(Glycinemax)叶片抗氧化酶活性,降低叶片活性氧含量,从而减轻盐胁迫伤害[3]。叶面喷施6-苄氨基嘌呤和脱落酸可通过调控脯氨酸代谢提高苦马豆(Swainsoniasalsula)的抗盐性[4]。
水杨酸(salicylic acid, SA)是一种广泛存在于植物体内的激素,作为信号分子,SA可通过复杂的信号转导网络调节植物对各种逆境的反应[5]。近年,关于SA在提高植物抗盐性方面的报道较多,汤菊香等[6]研究发现,0.9 mmol/L的SA可降低盐胁迫对玉米(Zeamays)的伤害;董慧等[7]报道0.25和0.50 mmol/L的SA能提高盐胁迫下多年生黑麦草(Loliumperenne)的耐盐性;韩海霞等[8]发现添加外源SA可通过提高黄瓜抗氧化能力改善盐胁迫下黄瓜的生长状况。Hao等[9]通过对模式植物拟南芥(Arabidopsisthaliana)突变体的研究也揭示了水杨酸在植物耐盐方面的作用。由此可见,SA在植物抗逆生产栽培中具有广阔的应用前景。
沙打旺(Astragalusadsurgens),别名直立黄芪,为多年生草本植物,是我国特有的栽培牧草、绿肥,其适应性强,具有抗旱、耐贫瘠、固沙等特点,是水土保持、恢复沙地荒地的重要物种[10]。近年来,生态环境建设及畜草业发展对沙打旺的需求不断增大。关于沙打旺抗逆性的研究,主要集中在抗旱[11]、抗病[12]方面,在沙打旺抗盐方面,本课题组已做过初步探讨[13]。而外源SA是否有利于盐胁迫下沙打旺幼苗的生长,尚未见报道。本实验通过研究不同浓度SA对盐处理下沙打旺幼苗光合、活性氧代谢等指标的影响,探讨SA与盐胁迫下沙打旺生长的关系,为利用外源SA调控沙打旺的抗盐能力提供理论依据,也可为盐渍土壤地区沙打旺的栽培提供借鉴。
1 材料与方法
1.1材料
沙打旺种子由内蒙古农业大学提供。
1.2沙打旺的培养与处理
挑选均匀饱满无病虫害的沙打旺种子,用2%的次氯酸钠消毒8 min,然后用蒸馏水冲洗干净。将种子置于垫有湿纱布的培养皿中,26 ℃培养箱培养。待幼苗长到3 cm左右,移栽到盛有干净细沙的塑料盆(高20 cm,直径18 cm)中,每盆5株,浇灌Hoagland营养液,于温室中培养。温室昼夜温度(25±5) ℃/(15±5) ℃,每天光照14 h,光照强度约为(700±100) μmol/(m2·s),相对湿度60%~70%。培养4周后,选取长势整齐一致、生长健壮的植株,分成3组:第1组只浇灌Hoagland营养液,作对照处理;第2组浇灌200 mmol/L NaCl 溶液(NaCl 溶于Hoagland 营养液),作NaCl 处理;第3组浇灌200 mmol/L NaCl溶液,同时对叶面喷施不同浓度SA (0.2,0.4,0.6,0.8,1.0 mmol/L)至湿润为止(每株喷施10 mL),作SA+NaCl 处理。每个处理设3个重复,处理7 d后进行生理指标测定。
1.3生理指标测定
可溶性蛋白含量参考陈建勋等[14]的方法:取沙打旺叶片0.2 g,加5 mL磷酸缓冲液(pH 7.0)冰浴研磨成匀浆,离心10 min(4000 r/min),上清液转移到10 mL容量瓶,再向残渣中加2 mL磷酸缓冲液,离心10 min,合并上清液,并定容至刻度,每个处理重复3次。采用考马斯亮蓝染色法测定蛋白质含量。
SOD活性参考李合生[15]的方法:取沙打旺叶片0.5 g,加5 mL磷酸缓冲液(pH 7.8)冰浴研磨,4 ℃离心20 min (13000 r/min),上清液即为粗酶提取液,每个处理重复3次。采用氮蓝四唑还原法测定,以抑制氮蓝四唑光化还原的50%为1个酶活性单位(U)。
质膜透性采用电导率法[16]:用打孔器将沙打旺叶片打成直径约为5.5 mm的叶圆片,用重蒸水迅速冲洗两次,并用吸水纸吸干。取10片叶圆片放入盛有10 mL重蒸水的试管中,真空渗透。待样品沉入液面以下,净置1 h,用DDS-W型电导率仪测定溶液电导率S1,然后将试管放入沸水浴加热15 min,冷却后测溶液的电导率S2,按下列公式计算质膜透性:相对电导率(%)=S1/S2×100。每个处理重复3次。
光合作用气体交换参数的测定:采用LCpro+便携式光合仪(英国)测定沙打旺顶部数第2片功能叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci),测定时光强设定为1000 μmol/(m2·s),叶室温度设定为25 ℃。以上测定重复5次。
叶绿素荧光参数测定:采用OS5p叶绿素荧光仪(美国)测定沙打旺顶部数第2片功能叶的荧光参数。测定前首先将叶片暗适应30 min,照射检测光后测得初始荧光(Fo),之后用强饱和脉冲光激发,测定最大荧光(Fm)。以上测定重复5次。
1.4株高、干重测定
SA处理后第15天,每个处理选取5株幼苗,测定株高和单株干重。
1.5数据处理
所有数据以平均值±标准差表示,使用Excel软件作图,采用SPSS 15.0进行方差分析和差异显著性检验。
2 结果与分析
2.1外源SA处理对盐胁迫下沙打旺叶片可溶性蛋白含量的影响
由图1可知,单纯盐胁迫使沙打旺幼苗叶片可溶性蛋白含量显著降低,添加不同浓度SA后,其可溶性蛋白含量均有所上升。各SA处理组可溶性蛋白含量均高于单纯NaCl处理,其中,0.6和0.8 mmol/L处理组增幅明显,分别比单纯盐胁迫增加了51.9%和42.6%。
2.2外源SA处理对盐胁迫下沙打旺叶片SOD活性的影响
单纯盐处理使沙打旺幼苗叶片SOD活性降低,添加不同浓度的SA后,SOD活性上升,和单纯NaCl处理比较,其活性随SA浓度递增呈先增大后减小的趋势(图2)。其中,0.4和0.6 mmol/L SA处理组SOD活性增幅较大,分别比单纯盐胁迫增加了1.58和1.68倍。与对照组相比较,除了1.0 mmol/L SA处理组SOD活性下降外,其他浓度SA处理组的SOD活性均高于对照。

图1 SA处理对盐胁迫下沙打旺叶片可溶性蛋白含量的影响Fig.1 Effects of salicylic acid on soluble protein content in leaves of A. adsurgens under salt stress

图2 SA处理对盐胁迫下沙打旺叶片SOD活性的影响Fig.2 Effects of salicylic acid on SOD activity in leaves of A. adsurgens under salt stress
不同字母表示各处理间差异显著(P<0.05),下同。Different letters indicate significant differences among treatments at 0.05 level, the same below.
2.3外源SA处理对盐胁迫下沙打旺叶片质膜透性的影响
单纯盐胁迫使沙打旺叶片质膜透性增大,添加不同浓度SA后,叶片质膜透性与单纯NaCl处理相比,均有不同程度降低(图3)。从低到高5个SA浓度处理组,质膜透性呈先降后升的趋势,0.4~0.8 mmol/L SA处理组质膜透性降低较显著,比单纯NaCl处理分别降低了19.2%,26.6%和18.1%。
2.4外源SA处理对盐胁迫下沙打旺净光合速率、气孔导度和胞间CO2浓度的影响
如图4所示,单纯盐胁迫降低沙打旺叶片净光合速率,添加SA的处理组,其净光合速率均高于单纯NaCl处理组,但1.0 mmol/L SA处理组差异未达到显著水平。其中,0.6 mmol/L SA处理组净光合速率增加最为明显,比单纯盐处理增加了1.43倍,0.4 mmol/L SA 处理组次之,比单纯盐处理增加了1.21倍,0.2和0.8 mmol/L SA处理组的净光合速率与对照基本持平,但也显著高于单纯NaCl处理组。
单纯盐处理降低沙打旺叶片气孔导度,SA处理可使气孔导度有一定程度的增加,在5个SA浓度梯度处理下,气孔导度增幅先上升后下降(图5),变化趋势与净光合速率基本一致。0.4和0.6 mmol/L SA处理组增幅较为明显,与单纯NaCl处理相比,气孔导度分别增加了90.9%和133.3%,且差异均达到显著水平。
由图6可知,单纯盐胁迫降低了沙打旺叶肉胞间CO2浓度,一定浓度的SA处理,缓解了这种抑制效应。在各处理组中,中等浓度的SA缓解作用较为显著,0.4,0.6和0.8 mmol/L SA处理组,其胞间CO2浓度分别比单纯盐处理增加了31.7%,29.8%和15.5%。而且,0.4和0.6 mmol/L SA处理组与对照组基本持平。
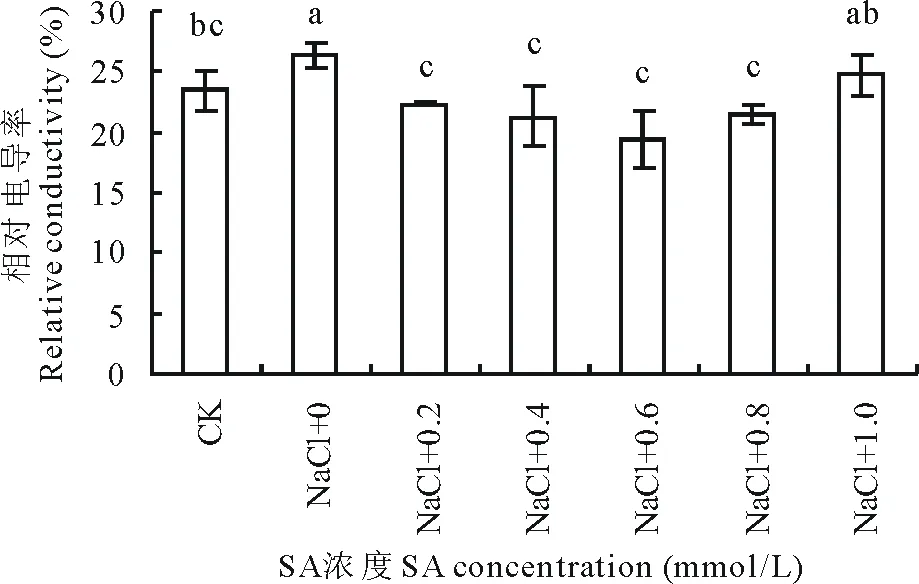
图3 SA处理对盐胁迫下沙打旺叶片质膜透性的影响Fig.3 Effects of salicylic acid on membrane permeability in leaves of A. adsurgens under salt stress

图4 SA处理对盐胁迫下沙打旺净光合速率的影响Fig.4 Effects of salicylic acid on net photosynthetic rate of A. adsurgens under salt stress
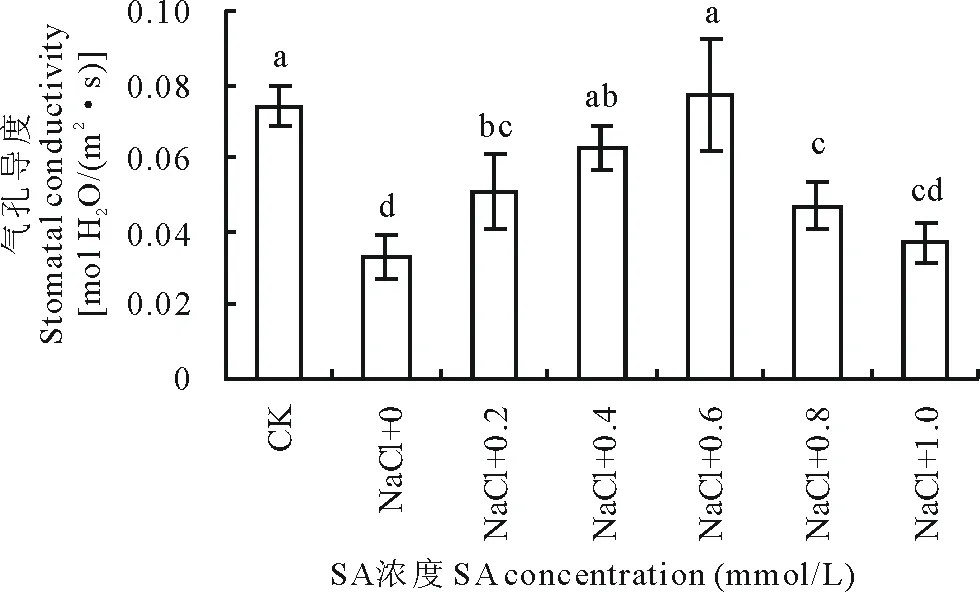
图5 SA处理对盐胁迫下沙打旺气孔导度的影响Fig.5 Effects of salicylic acid on stomatal conductivity of A. adsurgens under salt stress
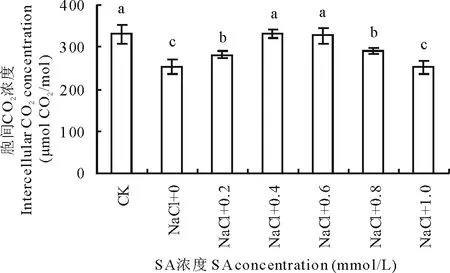
图6 SA处理对盐胁迫下沙打旺胞间CO2浓度的影响Fig.6 Effects of salicylic acid on intercellular CO2concentration of A. adsurgens under salt stress
2.5外源SA处理对盐胁迫下沙打旺叶绿素荧光的影响
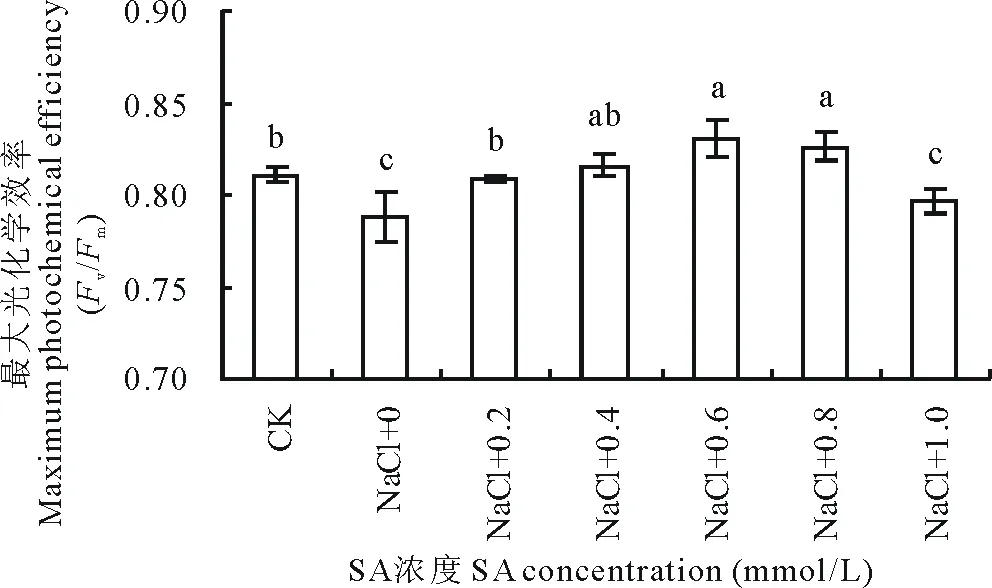
图7 SA处理对盐胁迫下沙打旺叶绿素荧光的影响Fig.7 Effects of salicylic acid on chlorophyll fluorescence of A. adsurgens under salt stress
Fv/Fm反映PSⅡ原初最大光能利用效率,单纯盐胁迫使沙打旺Fv/Fm降低,添加外源SA后,其值有所回升(图7)。和单纯盐处理相比较,0.4~0.8 mmol/L SA处理组,Fv/Fm增幅显著,依次增加了3.6%,5.3%和4.8%,差异均达到显著水平。
2.6外源SA处理对盐胁迫下沙打旺株高、干重的影响
由表1可知,单纯NaCl处理组,沙打旺幼苗株高、干物质积累显著低于对照,表明盐胁迫明显抑制植株的生长发育,同时也说明本研究设置的盐浓度比较合理。而SA处理组,沙打旺株高、干重均有不同程度的提高,说明SA可以有效缓解盐分对沙打旺幼苗的胁迫作用。其中,0.4~0.8mmol/LSA缓解效果比较明显,株高比单纯NaCl处理依次增加9.3%,14.0%和12.8%,干重比单纯NaCl处理依次增加12.0%,16.0%和14.0%,且均达到差异显著水平。
3 讨论
本实验中,单纯盐处理使沙打旺叶片可溶性蛋白较对照处理显著下降,添加SA后导致可溶性蛋白含量回升,且在0.6mmol/LSA处理下达到最高值(图1),表明适宜浓度的SA可以有效提高沙打旺在盐渍环境下蛋白质的合成,这与姚侠妹等[17]在栀子幼苗中的研究结果一致。可溶性蛋白有较强的持水力,植物在逆境下增加可溶性蛋白含量可以提高渗透调节能力,降低因渗透胁迫造成的伤害[18],故外源SA处理可通过增加沙打旺幼苗可溶性蛋白含量以适应盐渍胁迫。

表1 SA处理对盐胁迫下沙打旺幼苗生长参数的影响Table1 EffectsofsalicylicacidongrowthparametersofA.adsurgensundersaltstressSA浓度SAconcentration(mmol/L)株高Plantheight(cm)单株干重Plantdryweight(g)CK10.6±0.3a0.62±0.045aNaCl+08.6±0.2c0.50±0.015cNaCl+0.29.1±0.4bc0.52±0.026bcNaCl+0.49.4±0.5b0.56±0.035abNaCl+0.69.8±0.7ab0.58±0.046abNaCl+0.89.7±0.6ab0.57±0.045abNaCl+1.09.2±0.5bc0.55±0.043abc 注:同列不同字母表示处理间差异显著(P<0.05)。 Note:Differentlettersinthesamecolumnindicatesignificantdiffer-encesat0.05level.
盐胁迫下,抗氧化酶系统中的SOD能有效清除自由基,避免植物因自由基积累造成氧化损伤,维持细胞膜的完整性和稳定性,从而提高植物对逆境的适应能力[19]。本研究表明,中等浓度的SA可显著提高盐胁迫下沙打旺幼苗SOD活性,且以0.6 mmol/L SA效果最佳(图2)。再结合质膜透性的变化,0.4~0.8 mmol/L SA处理组降低了沙打旺叶肉细胞的相对电导率(图3),也佐证了SA能够维持质膜完整性的作用。SA之所以能够提高盐胁迫下植物的抗氧化能力,具体机制尚不明确,推测可能与SA激活了抗氧化酶共同的转录因子,诱导抗氧化酶的表达有关[20]。Pancheva等[21]的研究认为,SA能够积累在植物细胞膜疏水区,通过降低膜脂过氧化作用,维持膜结构的完整性,从而缓解胁迫造成的膜损伤。
光合能力大小与植物的生长密切相关,在胁迫条件下保持较高的光合速率尤为重要。外源SA能够提高盐胁迫下植物的光合作用,目前已有相关报道。Stevens等[22]在番茄(Lycopersiconesculentum)、Nazar等[23]在绿豆(Vignaradiata)的研究中都证实了SA处理可降低盐分对番茄、绿豆光合的抑制,提高光合速率、CO2的固定速率。Li等[24]通过对香榧(Torreyagrandis)幼苗叶片喷施SA,也观测到了其净光合速率的增加。从本实验也可看出,外源SA处理显著提升了盐胁迫下沙打旺幼苗的净光合速率(图4),SA对气孔导度和胞间CO2浓度的影响与净光合速率基本一致(图5,6),说明SA对盐胁迫下沙打旺幼苗光合能力的缓解可能与气孔因素有关。Fv/Fm表征开放的PSⅡ反应中心的能量捕捉效率,Fv/Fm的变化可用来鉴别植物对逆境的耐受能力[25]。盐处理使沙打旺幼苗Fv/Fm降低(图7),表明了PSⅡ反应中心的最大光能转化效率下降,外源SA处理使Fv/Fm回升甚至高于对照,说明SA可以提高沙打旺幼苗的光能转化效率,进而提高光合效率。
本研究发现,在NaCl胁迫下,沙打旺幼苗的生长明显下降,而外源SA处理后对盐胁迫下沙打旺幼苗的生长具有明显的改善作用,表现为株高以及干物质积累的增加(表1)。这与尚庆茂等[26]在黄瓜、周万海等[27]在苜蓿(Medicagosativa)以及徐芬芬等[28]在水稻(Oryzasativa)中的研究结果一致,表明外源 SA 在缓解盐害、促进盐胁迫下植物生长的效应是比较普遍的。
4 结论
外源施用SA,能够提高盐胁迫下沙打旺幼苗可溶性蛋白含量,增强SOD活性,降低质膜透性,提高光合能力,进而使株高和干重增加。SA对于缓解盐胁迫,改善沙打旺的生长发育具有重要作用。从本研究可知,0.4~0.8 mmol/L SA 处理效果显著,且以0.6 mmol/L SA处理效果最佳。
References:
[1]Zhu J K. Plant salt tolerance. Trends in Plant Science, 2001, 6(2): 66-71.
[2]Yan B, Sun J, Shu S,etal. Effects of exogenous calcium on photosynthetic characteristics and carbohydrate metabolism in leaves of cucumber (CucumissativusL.) seedlings under NaCl stress. Journal of Nanjing Agricultural University, 2014, 37(1): 31-36.
[3]Du H Y, Hu C H, Liu H P. Regulating effects of exogenous spermidine on photosynthetic character and antioxidant metabolism of soybean seedling leaves under salt stress. Soybean Science, 2016, 35(1): 80-85.
[4]Wang R M, Dong K H, Li Y Y,etal. Effects of applying exogenous plant hormone on praline metabolism ofSwainsoniasalsulaseedlings under NaCl stress. Acta Prataculturae Sinica, 2014, 23(2): 189-195.
[5]Horváth E, Szalai G, Janda T. Induction of abiotic stress tolerance by salicylic acid signaling. Journal of Plant Growth Regulation, 2007, 26(3): 290-300.
[6]Tang J X, Zhao Y Z, Shan C J. Effects of salicylic acid on physiological characteristics of maize Xindan 29 seedling under salt stress. Jiangsu Agricultural Sciences, 2015, 43(6): 93-95.
[7]Dong H, Duan X C, Chang Z H. Effect of exogenous salicylic acid on salt tolerance in perennial ryegrass. Journal of Beijing Forestry University, 2015, 37(2): 128-135.
[8]Han H X, Yao L B, Tang Y N. Effect of exogenous salicylic acid on growth and peroxidase activity ofCucumissativusunder salt stress. Guizhou Agricultural Sciences, 2015, 43(12): 69-71.
[9]Hao L, Zhao Y, Jin D,etal. Salicylic acid alteringArabidopsismutants response to salt stress. Plant and Soil, 2012, 354: 81-95.
[10]He W P, Wang C J, Zhang P. Breeding report on hybridAstragalusadsurgensPall. “Lvdi No.1”. Grassland and Prataculture, 2014, 26(1): 44-48.
[11]Guo H J, He X L. Effects of AM fungi on the growth and drought resistance ofAstragalusadsurgensPall. under water stress. Acta Ecologica Sinica, 2010, 30(21): 5933-5940.
[12]Huang B M, Nan Z B, Zhang Z X. Effect of exogenous hydrogen peroxide on resistance ofAstragalusadsurgensto yellow stunt and root rot disease. Acta Prataculturae Sinica, 2015, 24(3): 108-114.
[13]Wang B Z, Wang M, Tian W,etal. Physiological effects of salt stress onAstragalusadsurgensPall. Guangdong Agricultural Sciences, 2013, 40(19): 57-59.
[14]Chen J X, Wang X F. Plant Physiology Experimental Guidance[M]. Second edition. Guangzhou: South China University of Technology Press, 2006: 24-25.
[15]Li H S. Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 167-169.
[16]Zhang S Q. Experimental Techniques on Plant Physiology[M]. Beijing: Science Press, 2011: 203-204.
[17]Yao X M, Ou C, Zhang R E,etal. Ameliorating effects of exogenous salicylic acid onGardeniajasminoidesseedlings under salt stress. Acta Agriculturae Zhejiangensis, 2015, 27(11): 1939-1944.
[18]Du C X, Li J, Guo S R,etal. Effects of exogenous sperm dine on the growth and soluble protein expression in cucumber seedlings under NaCl stress. Acta Bot Boreal-Occident Sinica, 2007, 27(6): 1179-1184.
[19]Huang Y M, Zhang Y X, Liu Q L,etal. Effects of salicylic acid on seed germination and seedling physiological characteristics ofZinniaelegansunder salt stress. Acta Prataculturae Sinica, 2015, 24(7): 97-105.
[20]Agarwal S, Sairam R K, Srivastava G C,etal. Role of ABA, salicylic acid, calcium and hydrogen peroxide on antioxidant enzymes induction in wheat seedlings. Plant Science, 2005, 169(3): 559-570.
[21]Pancheva T V, Popova L P, Uzunova A N. Effects of salicylic acid on growth and photosynthesis in barley plants. Journal of Plant Physiology, 1996, 149(1/2): 57-63.
[22]Stevens J, Senaratna T, Sivasithamparam K. Salicylic acid induces salinity tolerance in tomato (Lycopersiconesculentumcv. Roma): associated changes in gas exchange, water relations and membrane stabilisation. Plant Growth Regulation, 2006, 49(1): 77-83.
[23]Nazar R, Iqbal N, Syeed S,etal. Salicylic acid alleviates decreases in photosynthesis under salt stress by enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars. Journal of Plant Physiology, 2011, 168(8): 807-815.
[24]Li T, Hu Y, Du X,etal. Salicylic acid alleviates the adverse effects of salt stress inTorreyagrandiscv.Merrilliiseedlings by activating photosynthesis and enhancing antioxidant systems. PLoS ONE, 2014, 9(10): e109492.
[25]Wang F L, Huang Z F, Liang S Z,etal. Effects of exogenous salicylic acid on physiological characteristics ofEuphorbiapulcherrimaWilld under drought stress. Journal of Southwest China Normal University: Natural Science Edition, 2016, 41(2): 53-57.
[26]Shang Q M, Song S Q, Zhang Z G,etal. Physiological mechanisms of salicylic acid enhancing the salt tolerance of cucumber seedling. Scientia Agricultura Sinica, 2007, 40(1): 147-152.
[27]Zhou W H, Shi S L, Kou J T. Exogenous salicylic acid on alleviating salt stress in alfalfa seedlings. Acta Prataculturae Sinica, 2012, 21(3): 171-176.
[28]Xu F F, Ye L M, Pan W H. Effect of salicylic acid on rice growth under salt stress. Guangdong Agricultural Sciences, 2009, 36(9): 22-24,33.
[2]严蓓, 孙锦, 束胜, 等. 外源钙对NaCl胁迫下黄瓜幼苗叶片光合特性及碳水化合物代谢的影响. 南京农业大学学报, 2014, 37(1): 31-36.
[3]杜红阳, 胡春红, 刘怀攀. 外源亚精胺对盐胁迫下大豆幼苗叶片光合性能和抗氧化代谢的调控效应. 大豆科学, 2016, 35(1): 80-85.
[4]王若梦, 董宽虎, 李钰莹, 等. 外源植物激素对NaCl胁迫下苦马豆苗期脯氨酸代谢的影响. 草业学报, 2014, 23(2): 189-195.
[6]汤菊香, 赵元增, 单长卷. 水杨酸对盐胁迫下新单29玉米幼苗生理特性的影响. 江苏农业科学, 2015, 43(6): 93-95.
[7]董慧, 段小春, 常智慧. 外源水杨酸对多年生黑麦草耐盐性的影响. 北京林业大学学报, 2015, 37(2): 128-135.
[8]韩海霞, 姚岭柏, 唐亚楠. 外源水杨酸对盐胁迫黄瓜生长及过氧化物酶活性的影响. 贵州农业科学, 2015, 43(12): 69-71.
[10]河为平, 王春疆, 张鹏. 绿帝1号杂交沙打旺选育报告. 草原与草业, 2014, 26(1): 44-48.
[11]郭辉娟, 贺学礼. 水分胁迫下AM真菌对沙打旺生长和抗旱性的影响. 生态学报, 2010, 30(21): 5933-5940.
[12]黄贝梅, 南志标, 张志新. 外源H2O2对沙打旺抗黄矮根腐病的影响. 草业学报, 2015, 24(3): 108-114.
[13]王宝增, 王棉, 田薇, 等. 沙打旺对盐胁迫的生理响应. 广东农业科学, 2013, 40(19): 57-59.
[14]陈建勋, 王晓峰. 植物生理学实验指导[M]. 第二版. 广州:华南理工大学出版社, 2006: 24-25.
[15]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169.
[16]张蜀秋. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011: 203-204.
[17]姚侠妹, 偶春, 张瑞娥, 等. 外源水杨酸对盐胁迫栀子幼苗的缓解效应. 浙江农业学报, 2015, 27(11): 1939-1944.
[18]杜长霞, 李娟, 郭世荣, 等. 外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响. 西北植物学报, 2007, 27(6): 1179-1184.
[19]黄玉梅, 张杨雪, 刘庆林, 等. 水杨酸对盐胁迫下百日草种子萌发及幼苗生理特性的影响. 草业学报, 2015, 24(7): 97-105.
[25]王凤兰, 黄子锋, 梁淑贞, 等. 外源水杨酸对干旱胁迫下一品红生理特性的影响.西南师范大学学报: 自然科学版, 2016, 41(2): 53-57.
[26]尚庆茂, 宋士清, 张志刚, 等. 水杨酸增强黄瓜幼苗耐盐性的生理机制. 中国农业科学, 2007, 40(1): 147-152.
[27]周万海, 师尚礼, 寇江涛. 外源水杨酸对苜蓿幼苗盐胁迫的缓解效应. 草业学报, 2012, 21(3): 171-176.
[28]徐芬芬, 叶利民, 潘维华. 外源水杨酸对盐胁迫下水稻幼苗生长的影响. 广东农业科学, 2009, 36(9): 22-24, 33.
Effects of salicylic acid on growth ofAstragalusadsurgensseedlings under salt stress
WANG Bao-Zeng, ZHANG Yi-Ming, ZHANG Jiang-Li, BI Shu-Qing, KONG Hong
CollegeofLifeSciences,LangfangTeachersUniversity,Langfang065000,China
Salicylic acid (SA) has emerged as a plant hormone involved in the processes of growth and development, and induced resistance to various abiotic stresses in plants. Studies of the effects of exogenous SA on the growth ofAstragalusadsurgensunder salt stress will uncover the underlying mechanisms of stress relief. Seedlings ofA.adsurgenswere treated with 200 mmol/L NaCl and different concentrations of SA (0.2, 0.4, 0.6, 0.8 & 1.0 mmol/L); growth and physiological indexes were subsequently determined. The results showed that, compared with NaCl treatment without SA, exogenous SA ranging from 0.4 to 0.8 mmol/L increased soluble protein content and the activity of superoxide dismutase (SOD) in leaves ofA.adsurgens. Soluble protein content increased by 51.9% and 42.6% respectively under 0.6 and 0.8 mmol/L exogenous SA treatments and the activity of SOD increased significantly by 1.58 and 1.68 times under 0.4 and 0.6 mmol/L SA concentrations. Leaf membrane permeability was reduced by SA. SA at 0.4, 0.6 and 0.8 mmol/L reduced leaf conductivity by 19.2%, 26.6% and 18.1% respectively. The photosynthetic capacity ofA.adsurgenswas also enhanced by exogenous SA treatment. For example, the net photosynthetic rate increased by 1.21 and 1.43 times under 0.4 and 0.6 mmol/L SA treatment. All SA treatments resulted in increased plant height and dry weight inA.adsurgensseedlings. The optimal level of exogenous SA was 0.6 mmol/L. These results indicated that the growth ofA.adsurgensunder salt stress was enhanced by exogenous SA.
Astragalusadsurgens; salicylic acid; salt stress; growth
10.11686/cyxb2016085http://cyxb.lzu.edu.cn
王宝增, 张一名, 张江丽, 秘树青, 孔红. 水杨酸对盐胁迫下沙打旺幼苗生长的影响. 草业学报, 2016, 25(8): 74-80.
WANG Bao-Zeng, ZHANG Yi-Ming, ZHANG Jiang-Li, BI Shu-Qing, KONG Hong. Effects of salicylic acid on growth ofAstragalusadsurgensseedlings under salt stress. Acta Prataculturae Sinica, 2016, 25(8): 74-80.
2016-03-03;改回日期:2016-04-12
廊坊师范学院科学研究项目(LSLY201403)和河北省科技支撑计划项目(13226430)资助。
王宝增(1975-),男,河北大城人,讲师,硕士。E-mail: wangbz666@126.com

