不同盐生境下硅对高羊茅生物量及生理生化特征的影响
宋锐,林丽果,王康英,宋浩然,蒋勇斌,刘慧霞
(西北民族大学生命科学与工程学院,甘肃 兰州 730030)
不同盐生境下硅对高羊茅生物量及生理生化特征的影响
宋锐,林丽果,王康英,宋浩然,蒋勇斌,刘慧霞*
(西北民族大学生命科学与工程学院,甘肃 兰州 730030)
利用水培实验研究了不同盐生境下硅对高羊茅幼苗生物量及生理生化特征的影响。研究结果表明,高羊茅幼苗生物量随着盐浓度增加而逐渐降低,200 mmol/L的盐浓度为高羊茅幼苗的临界盐浓度,盐浓度小于该临界值时,添加硅显著增加了高羊茅幼苗生物量;盐浓度大于该临界值时,硅对高羊茅幼苗生物量没有明显影响,说明硅调节盐生境下高羊茅的生长能力与环境内的盐浓度密切相关。在盐浓度临界值之内,水培条件下硅通过增加盐胁迫下高羊茅幼苗体内SOD、CAT、POD活性,降低盐胁迫条件下高羊茅幼苗体内的丙二醛、脯氨酸、可溶性糖含量和相对电导率,其中盐浓度为100 mmol/L时,丙二醛含量降幅最大,为18.05%,当盐浓度为50 mmol/L时,脯氨酸含量降幅最大,为23.63%。这不仅说明了硅可增强高羊茅幼苗适应盐生境的能力,而且证明了硅直接参与了盐胁迫条件下高羊茅的生理生化过程。
高羊茅;盐生境;硅;酶活性;渗透调节
灌溉是草坪绿地维持健康的主要手段[1],而长期的、多频的灌溉往往导致土壤发生盐渍化,主要是因为草坪草的蒸腾作用会促进土壤深层可溶性盐往浅层转移,增加浅层土壤中可溶性盐的含量[2],因此草坪草往往生长在不同盐渍化程度的生境中。多年生冷季丛生禾草高羊茅(Festucaarundinacea),是我国北方干旱半干旱区草坪绿地建设的主要草坪之一[3]。当高羊茅生长在轻度盐渍化生境中时,其往往通过调整自身形态特征和生理特征,适应盐渍环境[4],维持其正常生长,但当高羊茅生长在重度盐渍化生境中时,往往会由于盐的过度胁迫效应,造成其膜结构受损、抗氧化能力降低、生物量下降,甚至会导致植株干枯或死亡[5-6]。因此提高高羊茅在盐生境下的生长性能,是高羊茅草坪绿地管理中不可避免的重要科学问题之一。
虽然提高高羊茅在盐生境下生长性能的途径有多种,但施肥是最基本、最易操作的途径[7]。增施氮磷肥能够增强作物在盐生境下生长性能,维持或增加产量[8],但由于氮磷的过量使用会引起土壤和水体的污染,迫使人们寻求环境友好型的矿质元素作为肥源[9-11]。已有研究表明,添加环境友好型矿质元素硅能够提高盐生境下大麦(Hordeumvulgare)、玉米(Zeamays)、水稻(Oryzasativa)的产量,其主要原因是降低了作物体内丙二醛(MDA)含量,减轻了盐渍环境对细胞膜的伤害,提高了作物体内的超氧化物歧化酶(SOD),过氧化物酶(POD),过氧化氢酶(CAT)等酶活性,增强了盐渍环境下作物消除自由基的能力,从而降低了膜脂过氧化作用的伤害[3,10,12-13]。目前关于硅提高禾本科植物耐盐性的观点有2种,一种认为硅参与了植物的生理生化过程,其作用是直接的,另一种认为硅通过抑制植物对盐离子的吸收而提高植物耐盐性,其作用是间接的[13-14]。目前已经证实盆栽试验条件下硅能够提高高羊茅在盐生境下的出苗率以及保苗率,促进其生长[14],这虽然说明硅能够提高高羊茅幼苗在盐生境下的生长潜势,但硅究竟在多大盐浓度的生境内对高羊茅的生长是有利的,尚需要科学鉴定。本研究采用无土水培法,分析了不同盐生境下添加硅对高羊茅幼苗的生物量、丙二醛含量、相对电导率、SOD活性、CAT活性、POD活性、脯氨酸和可溶性糖含量的影响,以期阐明硅提高高羊茅幼苗在盐生境下生长性能的途径。
1 材料与方法
1.1试验设计
供试的高羊茅品种为引自美国的红象,来源于北京百绿集团。实验采用盐浓度和硅双因素处理,其中盐浓度0,50,100,150,200和250 mmol/L 6个梯度,每个盐浓度下设置加硅(+Si)和不加硅(-Si)2个处理,共计12个处理,每个处理10个重复。已有研究表明,盐生境下硅浓度为2 mmol/L时高羊茅的种子发芽率和保苗率最高[14],因此本研究硅处理的硅离子浓度设置为2 mmol/L。硅源采用硅酸钠。盐浓度处理以NaCl为盐离子来源,计算Na+浓度时包含了硅酸钠所携带的Na+量,因此盐浓度的Na+来源于硅酸钠和氯化钠。本试验2015年4月2日在GZ-025型全自动培养箱[温度为(20±1) ℃,昼夜光照时间为16 h/8 h,光照强度15000 lx]中采用纸床发芽法,选取饱满的高羊茅种子,先将其浸泡在5%次氯酸钾溶液中,待10 min后,用自来水冲洗6次,再用蒸馏水冲洗3次,然后用滤纸将种子表面的水吸干。选用直径为12 cm培养皿,培养皿内铺置双层滤纸作为发芽床,再将配好的氯化钠和硅酸钠溶液加入培养皿内,至滤纸饱和为止,对每个培养皿进行编号和标记。每个培养皿内放入处理好的种子各100粒,摆放时,种子为均匀分布状态,记录每个培养皿重量,然后将其置于培养箱内。试验期间每天17:00,采用称重法加入蒸馏水,弥补蒸发失水,以维持盐和硅的处理浓度。以种子着床的当天为第1天,第21天开始间苗(高羊茅发芽时间为21 d),以同处理发芽率最低的幼苗数为标准,保留各培养皿中长势相对一致的幼苗,其余幼苗整株移出培养皿,将保留植株均匀地分布于培养皿内,同时移去培养皿的盖子,避免机械伤害,然后在培养皿中继续培养20 d以后开始取样,此时盐浓度低于150 mmol/L的平均有2片真叶,高于150 mmol/L的有1片真叶。
1.2指标测定
每个处理采用5个培养皿内的植株测定高羊茅幼苗生物量,测定生物量时将子叶剪除,然后测定整株(包括根系和叶)生物量;其余5个培养皿内的植株仅收集其幼苗叶片,用来测定电导率、丙二醛含量、保护酶(SOD、POD、CAT)活性和可溶性糖、脯氨酸含量。
盐浓度对禾本科植物生物量影响很大,当盐处理的生物量低于对照生物量的50%时,即低于了盐浓度的临界值[15]。因此本研究中当某个处理的生物量低于盐浓度临界值时,其高羊茅生长不良,生产上意义不大,放弃该处理的后续研究。生物量测定采用常规烘干法[16];丙二醛、SOD活性、CAT活性、可溶性糖和脯氨酸含量分别采用硫代巴比妥酸比色法、NBT法、硫代巴比妥酸滴定法、蒽酮法和酸性茚三酮比色法测定[17],POD活性采用比色法测定[18];电导率采用煮沸法测定[19]。
1.3数据分析
先采用Two-Way ANOVA 进行双因素方差分析,若差异显著,再采用Duncan分析法进行多重比较,统计软件为SPSS 19.0。
2 结果与分析
2.1不同盐浓度生境下硅对高羊茅幼苗叶片生物量的影响
硅和盐浓度均明显影响了高羊茅幼苗生物量(图1)。盐浓度小于等于50 mmol/L时高羊茅幼苗生物量没有显著变化,当盐浓度超过50 mmol/L时,高羊茅幼苗生物量随着盐浓度增加逐渐显著降低(P<0.01),盐浓度200 mmol/L时,为对照生物量的50%,达到了盐浓度的临界值,而盐浓度250 mmol/L时,低于对照生物量的25%,超过了盐浓度的极限值[15],说明高羊茅不适宜生长在盐浓度超过200 mmol/L的生境内。但在不同盐浓度增幅不同,200 mmol/L时增幅最大,为33%。硅与盐浓度的交互作用对高羊茅幼苗生物量没有明显的影响。
2.2不同盐浓度生境下硅对高羊茅幼苗SOD、CAT和POD活性的影响
硅和盐浓度均显著影响了高羊茅幼苗体内SOD、CAT和POD的活性(图2)。高羊茅幼苗体内SOD、CAT和POD活性均随盐浓度增加而显著降低(P<0.01);硅显著增加了高羊茅幼苗体内SOD活性(P<0.05),同时极显著提高了CAT和POD活性(P<0.01),但硅与盐浓度互作没有明显影响高羊茅幼苗叶片SOD、CAT和POD的活性。
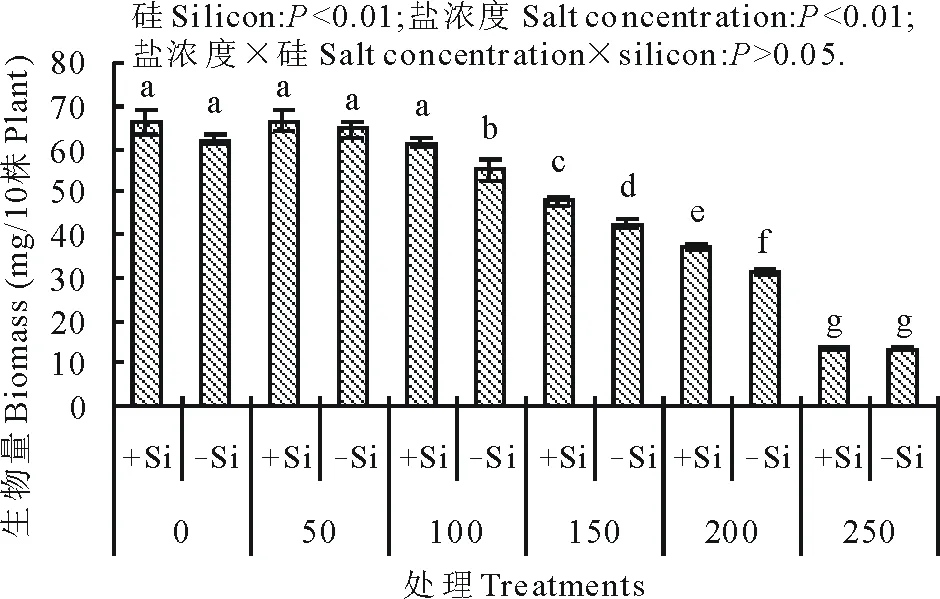
图1 不同盐浓度下硅对高羊茅幼苗生物量的影响Fig.1 Effect of addition of silicon on biomass of tall fescue seedling at different concentration of salt solution conditions +Si:添加硅Silicon addition;-Si:不添加硅No silicon addition;0,50,…,250:盐浓度Salt concentration 0,50,…,250 mmol/L;不同小写字母表示不同处理间的差异显著(P<0.05),下同。Different lower case letters indicate significant differences among treatments at 0.05 levels, the same below.
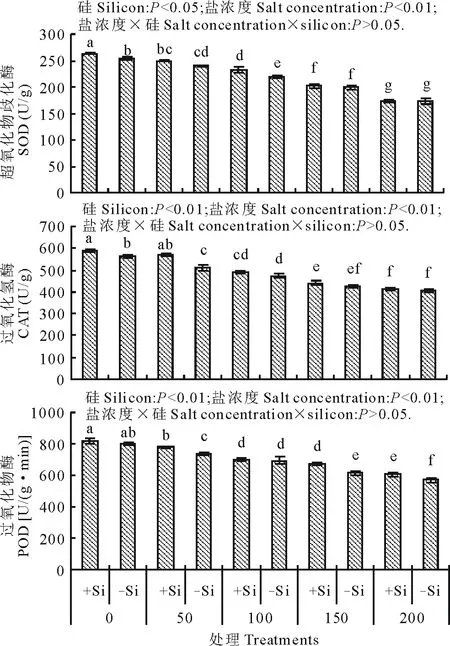
图2 不同盐浓度下硅对高羊茅叶片SOD、CAT和POD活性的影响Fig.2 Effect of addition of silicon on SOD, CAT and POD of tall fescue at different concentration of salt solution conditions
2.3不同盐浓度生境下硅对高羊茅幼苗体内相对电导率的影响
硅和盐浓度均明显影响了高羊茅幼苗的相对电导率(图3)。随盐浓度增加,高羊茅幼苗的相对电导率显著增加(P<0.01),硅却显著降低了高羊茅幼苗叶片相对电导率(P<0.01),但硅与盐浓度互作对高羊茅幼苗相对电导率没有明显影响。
2.4不同盐浓度生境下硅对高羊茅幼苗叶片丙二醛、脯氨酸和可溶性糖含量的影响
硅、盐浓度及其交互作用均明显影响了高羊茅幼苗叶片丙二醛和脯氨酸含量(图4)。随着盐浓度增加,高羊茅幼苗体内丙二醛和脯氨酸含量显著逐渐增加(P<0.01)。当盐浓度为0 mmol/L时,硅对高羊茅体内丙二醛和脯氨酸含量没有显著影响, 但当盐浓度超过50 mmol/L时, 硅却极显著降低了高羊茅幼苗体内丙二醛和脯氨酸含量(P<0.01)。 盐浓度为100 mmol/L时, 丙二醛含量降幅最大,为18.05%,盐浓度为150 mmol/L时, 丙二醛含量降幅最小,为6.91%。当盐浓度分别为50,100,150和200 mmol/L时,硅使高羊茅幼苗体内脯氨酸含量分别降低23.63%,16.77%,12.25%,2.78%。硅和盐浓度互作极显著减少了高羊茅幼苗体内脯氨酸含量(P<0.01),也显著降低了高羊茅幼苗体内丙二醛的含量(P<0.05)。
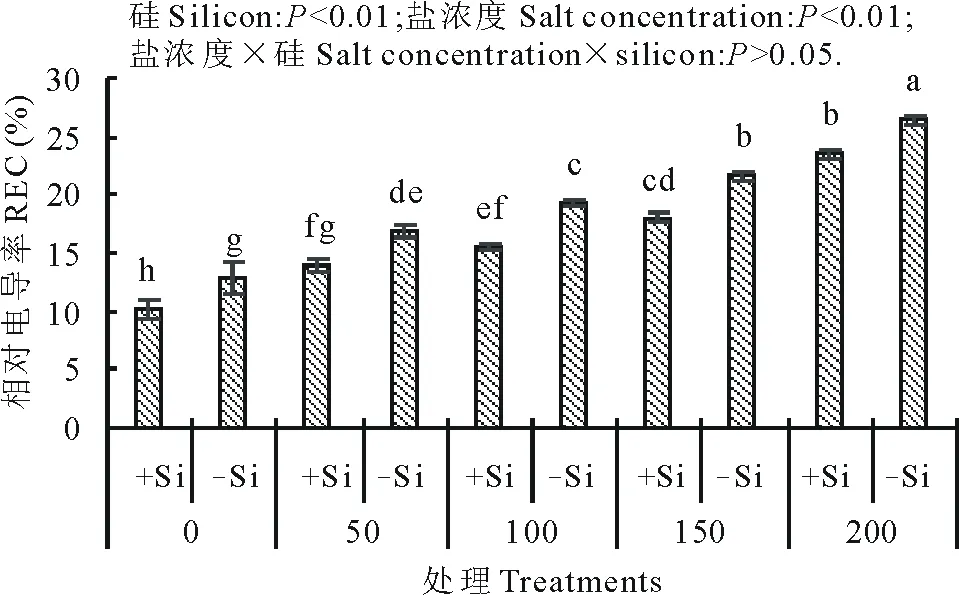
图3 不同盐浓度下硅对高羊茅叶片相对电导率的影响Fig.3 Effect of addition of silicon on the relative conductivity (REC) of tall fescue at different concentration of salt solution conditions
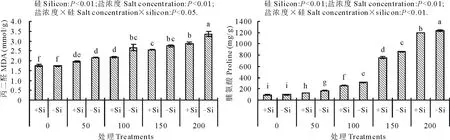
图4 不同盐浓度下硅对高羊茅叶片丙二醛和脯氨酸含量的影响Fig.4 Effect of addition of silicon on MDA and proline of tall fescue at different concentration of salt solution conditions
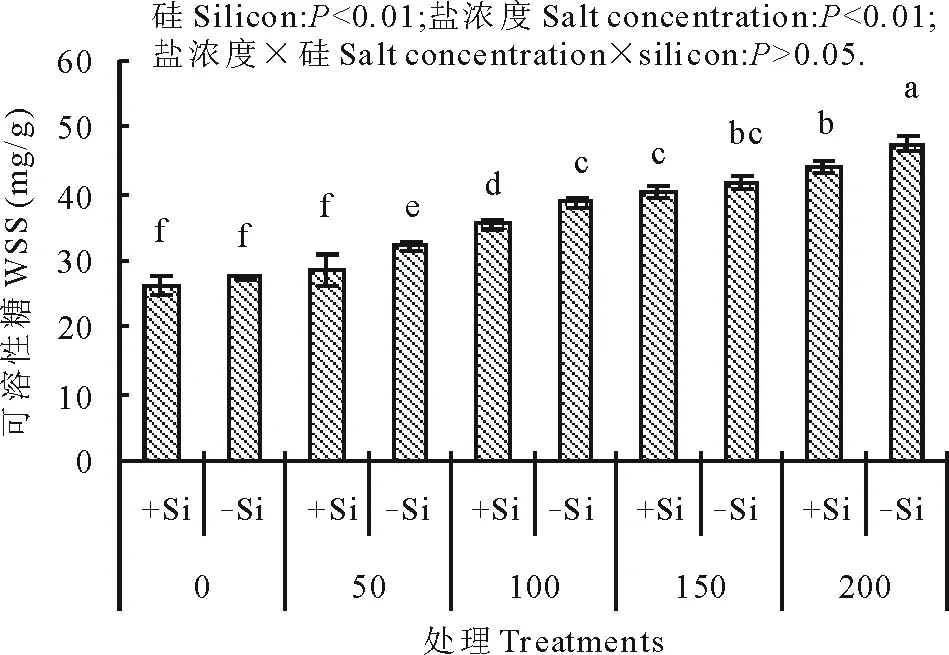
图5 不同盐浓度下硅对高羊茅叶片可溶性糖含量的影响Fig.5 Effect of addition of silicon on water soluble sugars (WSS) of tall fescue at different concentration of salt solution conditions
硅和盐浓度均明显影响了高羊茅幼苗体内可溶性糖含量(图5)。随着盐浓度增加,高羊茅幼苗叶片可溶性糖含量显著增加(P<0.01),硅显著降低了高羊茅幼苗叶片可溶性糖含量(P<0.01),但硅与盐浓度互作对高羊茅幼苗体内可溶性糖含量没有明显影响。
3 讨论
草坪草高羊茅因长期灌溉容易生长在不同盐渍化程度的生境中,为适应盐渍化生境,其生理生化过程会做出一系列的响应,以维持其正常生长[4-6,20]。增加外源性矿质元素时,会刺激高羊茅的生理生化过程,增强其适宜盐渍化生境[21]。本研究结果表明,无土栽培条件下高羊茅幼苗对不同的盐生境具有一定的适应能力,而添加硅则增强了高羊茅幼苗适应盐生境的能力,但硅增强高羊茅幼苗适应盐生境的能力具有一定的限度,当盐浓度小于200 mmol/L时,硅通过提高高羊茅幼苗生物量,增强其适应盐生境的能力,而当盐浓度达到250 mmol/L时,硅对高羊茅幼苗适应盐生境的能力没有明显的促进作用。因此,在盐浓度的临界值之内[15],硅能够显著增加高羊茅幼苗的生物量,减轻盐渍化对幼苗的伤害效应,这与盆栽试验条件下硅显著提高0.9 g/kg(钠/土壤)盐生境下高羊茅幼苗生物量的结果一致[3]。无土栽培条件下,当盐浓度小于200 mmol/L时,硅增加了高羊茅幼苗的生物量,较盆栽试验而言,该结果至少证明了硅是通过直接参与高羊茅幼苗的生理生化过程,增强其在盐生境下的生长性能,提高其适应盐渍化环境的能力,但实际生产中,硅究竟在多大土壤盐浓度下提高高羊茅适应盐生境内的生长能力,尚需大田试验和土培试验继续验证。
硅提高高羊茅幼苗适应盐渍化生境的生理生化过程涉及众多方面,但参与渗透调节和减弱质膜氧化伤害是两个重要的方面[22-23]。从质膜氧化伤害方面分析,本研究中虽然高羊茅幼苗叶片内SOD、CAT、POD活性随盐浓度增加显著降低,但硅却显著增加了SOD、CAT、POD的活性,说明硅增加了高羊茅幼苗消除超氧阴离子(O2-)和过氧化氢(H2O2)的能力,使高羊茅幼苗体内活性氧自由基维持在较低的水平,降低了脂质过氧化强度,维持了高羊茅正常的生长和代谢[24-25],这与大麦[12,26]、玉米幼苗[27]、黄瓜(Cucumissativus)幼苗[28-29]在盐胁迫生境下的反应结果一致。从调节渗透方面分析,本研究中高羊茅体内相对电导率、丙二醛、可溶性糖、脯氨酸含量均随着盐浓度增加而升高,说明盐胁迫程度的增加,加大了细胞膜透性的程度,而硅显著降低相对电导率、丙二醛、可溶性糖、脯氨酸的含量,这是因为添加硅后,硅提高了高羊茅的生长能力,增强了其耐盐性,实质上减轻了高羊茅遭受盐胁迫的程度,从而表现为可溶性糖、脯氨酸含量的下降,说明外源性硅通过增强高羊茅的耐盐性,其体内细胞电解质外渗量减少,维持了胞内溶质浓度,防止细胞过度脱水[30-31],这与添加硅对黑果枸杞(Lyciumruthenicum)幼苗[32]和黄瓜幼苗[33]影响一致,说明了硅能够抑制因盐渍化伤害而造成高羊茅幼苗膜透性增大的趋势。因此,添加外源性硅有利于高羊茅幼苗在盐生境下吸收和利用水分,增强了其自我保护的能力。
综上所述,当盐浓度小于200 mmol/L时,硅可通过减轻高羊茅幼苗质膜氧化作用和增加渗透调节能力,提高高羊茅幼苗的生长性能,增加生物量;但当盐浓度超过200 mmol/L时,此时盐浓度应为高羊茅临界盐浓度,添加硅对高羊茅生长性能影响不明显。添加硅在无土水培条件下,影响了高羊茅幼苗体内SOD、CAT、POD的活性以及脯氨酸、丙二醛、可溶性糖的含量,说明硅直接参与了高羊茅幼苗的生理生化过程,但其参与机制尚需进一步研究。
References:
[1]Lorite I J, García-Vila M, Carmona M,etal. Assessment of the irrigation advisory services’ recommendations and farmers’ irrigation management: A case study in southern Spain. Water Resources Management, 2012, 26: 2397-2419.
[2]Rozema J, Flowers T. Crops for a salinized world. Science, 2008, 322: 1478-1480.
[3]Liu H X, Guo X H, Guo Z G. Effect of silicon supply on tall fescue (Festucaarundinacea) growth under the salinization conditions. Acta Ecologica Sinica, 2011, 31(23): 7039-7046.
[4]Farshidi M, Abdolzadeh A, Sadeghipour H R. Silicon nutrition alleviates physiological disorders imposed by salinity in hydroponically grown canola (BrassicanapusL.) plants. Acta Physiology Plant, 2012, 34: 1779-1788.
[5]Liao Y, Peng Y G, Chen G Z. Research advances in plant salt tolerance mechanism. Acta Ecologica Sinica, 2007, 27(5): 2077-2089.
[6]Zuccarini P. Effects of silicon on photosynthesis, water relations and nutrient uptake ofPhaseolusvulgarisunder NaCl stress. Biologia Plantarum, 2008, 52(1): 157-160.
[7]Qian Q Q, Zai W S, Zhu Z J,etal. Effects of exogenous silicon on active oxygen scavenging systems in chloroplasts of cucumber (CucumissativusL.) seedlings under salt stress. Journal of Plant Physiology and Molecular Biology, 2006, 32(1): 107-112.
[8]Dai Z F, Wang J Z, Cheng J. A study on soil phosphorus non-point source pollution and environmental influence. Journal of Agro-Environment Science, 2006, 25(supplement): 323-327.
[9]Gao C, Zhu J G, Zhu J Y,etal. Nitrogen export from an agriculture watershed in the Taihu Lake area, China. Environmental Geochemistry and Health, 2004, 26(2): 199-207.
[10]Liang Y C, Sun W C, Zhu Y G,etal. Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants: A review. Environmental Pollution, 2007, 147: 422-428.
[11]Currie H A, Perry C. Silica in plants: biological, biochemical and chemical studies. Annals of Botany, 2007, 100: 1383-1389.
[12]Liang Y C. Effect of silicon on enzyme activity and sodium, potassium and calcium concentration in barley under salt stress. Plant and Soil, 1999, 209: 217-224.
[13]Ashraf M, Rahmatullah M, Afzal R,etal. Alleviation of detrimental effects of NaCl by silicon nutrition in salt-sensitive and salt-tolerant genotypes of sugarcane (SaccharumofficinarumL.). Plant and Soil, 2010, 326: 381-391.
[14]Liu H X, Wang K Y, Guo X H. Effect of addition of silicon on seed emergence and growth of tall fescue (Festucaarundinacea) under the different soil moistures. Acta Prataculturae Sinica, 2012, 21(1): 199-205.
[15]Liu C F, Su J K, Huang W H. Studies on the salt-tolerant forage grass cultivars. Chinese Journal of Grassland, 1992, 6: 12-17.
[16]Liu H X, Wang K Y, Guo Z G. Effect of silicon on some physiological-biochemical characteristics and quality of alfalfa under different soil moistures. Chinese Journal of Grassland, 2011, 33(3): 21-27.
[17]Li H S. Plant Physiology and Biochemistry Experimental Principles and Techniques[M]. Beijing: Higher Education Press, 2006.
[18]Zhang Z L, Qu W Q. Plant Physiology Experiment Instruction[M]. Third edition. Beijing: Higher Education Press, 2003.
[19]Xiao L T, Wang S G. Plant Physiology Experimental Techniques[M]. Beijing: China Agriculture Press, 2005.
[20]Zhang H S, Zhao G Q, Li M F,etal. Physiological responses ofPennisetumlongissimumvar.intermediumseedlings to PEG, low temperature and salt stress treatments. Acta Prataculturae Sinica, 2014, 23(2): 180-188.
[21]Guntzer F, Keller C, Meunie J D. Benefits of plant silicon for crops: a review. Agronomy for Sustainable Development, 2012, 32: 201-213.
[22]Zhu Y X, Li H L, Hu Y H,etal. Effect of silicate on salt resistance in tomato and underlying physiological mechanisms. Journal of Agro-Environment Science, 2015, 34(2): 213-220.
[23]Lu Y, Lei J Q, Zeng F J,etal. Effect of salt treatments on the growth and ecophysiological characteristics ofHaloxylonammodendron. Acta Prataculturae Sinica, 2014, 23(3): 152-159.
[24]Chen T, Wang G M, Shen W W,etal. Effect of salt stress on the growth and antioxidant enzyme activity of Kenaf seedlings. Plant Science Journal, 2011, 29(4): 493-501.
[25]Cui J J, Zhang X H, Li Y T,etal. Effects of silicon addition on seedling morphological and physiological indicators ofGlycyrrhizauralensisunder salt stress. Acta Prataculturae Sinica, 2015, 24(10): 214-220.
[26]Liang Y C. Effect of silicon on leaf ultrastructure, chlorophyll content and photosynthetic activity of barley under salt stress. Pedosphere, 1998, 8(4): 289-296.
[27]Shu L Z, Liu Y H. Effects of silicon on membrane lipid peroxidation and protective systems in the leaves of maize seedlings under salt stress. Journal of Xiamen University: Nat. Sci. Ed., 2001, 40(6): 1295-1300.
[28]Hou Y H, Han X R, Yang J J,etal. Effects of silicon on cell membrane injury and the protective enzymes activity of cucumber seedling under salt stress. Chinese Agricultural Science Bulletin, 2005, 21(9): 252-254.
[29]Wang X Y, Zhang Y L, Zhang H M,etal. Influence of silicon on activities of protective enzymes and MDA content in cucumber under salt stress soil. Acta Agriculturae Boreali-occidentalis Sinica, 2009, 18(1): 221-224.
[30]Wang Y J, Wang H X, Liu M D. Effect of silicon on physiological characteristics of kentucky bluegrass under salt stress. Chinese Journal of Grassland, 2012, 34(6): 13-17.
[31]Liu H X, Song R, Guo P H,etal.Influences of interaction of soil moisture and silicon on photosynthetic characteristics and water use efficiency of tall fescue. Chinese Journal of Grassland, 2014, 36(6): 66-71.
[32]Shen H, Mi Y W, Wang L. Effects of exogenous silicon on physiological characteristics ofLyciumruthenicumseedling under salt stress. Acta Agrestia Sinica, 2012, 5(3): 553-558.
[33]Liu Y, Wang S W, Yin L N,etal. Studies on physiological mechanism of salt resistance improved by silicon in cucumber. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(5): 988-994.
[3]刘慧霞, 郭兴华, 郭正刚. 盐生境下硅对坪用高羊茅生物学特性的影响. 生态学报, 2011, 31(23): 7039-7046.
[5]廖岩, 彭友贵, 陈桂珠. 植物耐盐性机理研究进展. 生态学报, 2007, 27(5): 2077-2089.
[7]钱琼秋, 宰文珊, 朱祝军, 等. 外源硅对盐胁迫下黄瓜幼苗叶绿体活性氧清除系统的影响. 植物生理与分子生物学学报, 2006, 32(1): 107-112.
[8]戴照福, 王继增, 程炯. 土壤磷素非点源污染及其对环境影响的研究. 农业环境科学学报, 2006, 25(增刊): 323-327.
[14]刘慧霞, 王康英, 郭兴华. 不同土壤水分条件下硅对坪用高羊茅种子出苗及生物学特性的影响. 草业学报, 2012, 21(1): 199-205.
[15]刘春芳, 苏加楷, 黄文惠. 禾本科牧草耐盐性的研究. 中国草地, 1992, 6: 12-17.
[16]刘慧霞, 王康英, 郭正刚. 不同水分条件下硅对紫花苜蓿生理特性及品质的影响. 中国草地学报, 2011, 33(3): 21-27.
[17]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[18]张志良, 瞿伟菁. 植物生理学实验指导[M]. 第3版. 北京: 高等教育出版社, 2003.
[19]萧浪涛, 王三根. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2005.
[20]张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答. 草业学报, 2014, 23(2): 180-188.
[22]朱永兴, 李换丽, 胡彦宏, 等. 硅酸盐提高番茄抗盐性的效应与生理机制. 农业环境科学学报, 2015, 34(2): 213-220.
[23]鲁艳, 雷加强, 曾凡江, 等. NaCl处理对梭梭生长及生理生态特征的影响. 草业学报, 2014, 23(3): 152-159
[24]陈涛, 王贵美, 沈伟伟, 等. 盐胁迫对红麻幼苗生长及抗氧化酶活性的影响. 植物科学学报, 2011, 29(4): 493-501.
[25]崔佳佳, 张新慧, 李月彤, 等. 外源Si对盐胁迫下甘草幼苗形态及生理指标的影响. 草业学报, 2015, 24(10): 214-220.
[27]束良佐, 刘英惠. 硅对盐胁迫下玉米幼苗叶片膜脂过氧化和保护系统的影响. 厦门大学学报:自然科学版, 2001, 40(6): 1295-1300.
[28]侯玉慧, 韩晓日, 杨家佳, 等. 硅对盐胁迫下黄瓜幼苗细胞膜伤害及其保护酶活性的影响. 中国农学通报, 2005, 21(9): 252-254.
[29]王喜艳, 张玉龙, 张恒明, 等. 盐胁迫下硅对黄瓜保护酶活性和膜质过氧化物的影响. 西北农业学报, 2009, 18(1): 221-224.
[30]王耀晶, 王厚鑫, 刘鸣达. 盐胁迫下硅对草地早熟禾生理特性的影响. 中国草地学报, 2012, 34(6): 13-17.
[31]刘慧霞, 宋锐, 郭鹏辉, 等. 硅和土壤水分互作对高羊茅苗期光合生理特性的影响. 中国草地学报, 2014, 36(6): 66-71.
[32]沈慧, 米永伟, 王龙. 外源硅对盐胁迫下黑果枸杞幼苗生理特性的影响. 草地学报, 2012, 5(3): 553-558.
[33]刘媛, 王仕稳, 殷俐娜, 等. 硅提高黄瓜幼苗抗盐能力的生理机制研究. 西北植物学报, 2014, 34(5): 988-994.
Effects of silicon supply on the biomass and physiochemical features of tall fescue seedlings under different salinization conditions
SONG Rui, LIN Li-Guo, WANG Kang-Ying, SONG Hao-Ran, JIANG Yong-Bin, LIU Hui-Xia*
CollegeofLifeScienceandEngineering,NorthwestUniversityforNationalities,Lanzhou730030,China
The effect of silicon supply on the biomass and physiochemical features of tall fescue seedlings was investigated under different salinization conditions using a water culture experiment. Biomass decreased as salt concentration increased, with 200 mmol/L proving to be the critical concentration for tall fescue seedlings. When salt concentration was less than 200 mmol/L, silicon addition significantly increased seedling biomass, indicating that the effectiveness of silicon on tall fescue is closely related to salt concentration. If the concentration was more than 200 mmol/L, there was no significant effect of silicon addition on biomass. Under water culture, the activities of SOD, CAT and POD were increased and the contents of malondialdehyde, proline and water soluble sugars, and relative conductivity, were decreased by adding silicon to seedlings under salt stress below the critical concentration. The most significant reduction in MDA content (18.05%) was when salt concentration was 100 mmol/L. The most significant decline in proline content (23.63%) was when salt concentration was 50 mmol/L. The results indicate that the adaptability to salinization of tall fescue seedlings is improved by adding silicon and that silicon may be directly involved in the seedlings’ physiochemical processes.
tall fescue; salinization conditions; silicon; enzyme activities; osmotic adjustment
10.11686/cyxb2015501http://cyxb.lzu.edu.cn
宋锐, 林丽果, 王康英, 宋浩然, 蒋勇斌, 刘慧霞. 不同盐生境下硅对高羊茅生物量及生理生化特征的影响. 草业学报, 2016, 25(8): 91-97.
SONG Rui, LIN Li-Guo, WANG Kang-Ying, SONG Hao-Ran, JIANG Yong-Bin, LIU Hui-Xia. Effects of silicon supply on the biomass and physiochemical features of tall fescue seedlings under different salinization conditions. Acta Prataculturae Sinica, 2016, 25(8): 91-97.
2015-11-03;改回日期:2016-01-26
国家自然科学基金项目(31360581),中央高校基本科研业务费项目(31920130050),西北民族大学研究生科研创新项目(Yxm2014181),西北民族大学本科生众创空间项目和西北民族大学创新团队计划项目资助。
宋锐(1989-),男,山西大同人,在读硕士。E-mail: 616679167@qq.com
Corresponding author. E-mail: liuhuixia2@aliyun.com

