响应面法优化酶解马铃薯淀粉工艺
魏玉梅,李奇兵,刘 华(.西北民族大学实验中心,甘肃兰州730030;.西北民族大学生命科学与工程学院,甘肃兰州730030;3.西北民族大学数学与计算机学院,甘肃兰州730030)
响应面法优化酶解马铃薯淀粉工艺
魏玉梅1,李奇兵2,刘 华3,*
(1.西北民族大学实验中心,甘肃兰州730030;
2.西北民族大学生命科学与工程学院,甘肃兰州730030;
3.西北民族大学数学与计算机学院,甘肃兰州730030)
采用中温型α-淀粉酶对马铃薯淀粉进行水解,以马铃薯淀粉水解液的DE值为评价指标,在pH、酶解温度、酶解时间单因素实验的基础上,采用响应面法优化了马铃薯淀粉酶解工艺条件。结果表明:pH7.90,酶解温度62℃,酶解时间60 min,在此最优条件下酶解马铃薯淀粉的DE值达57.93%。
响应面法,马铃薯淀粉,酶解
马铃薯又名洋芋、土豆,为一年生草本植物,含丰富而齐全的营养素,是世界上仅次于小麦、水稻和玉米的第四种主要农作物。目前我国的马铃薯常年种植面积467万公顷左右,是世界上马铃薯生产的第一大国[1]。马铃薯是生产马铃薯淀粉的重要工业原料,但加工利用至今仍处于初级阶段[2]。我国马铃薯约30%用于鲜食,30%用于制淀粉,15%直接用作饲料,10%用作种薯,而用于深加工却不到5%。在美国,马铃薯用于鲜食占30%,饲料仅占2%,而用于深加工则高达50%[3]。而加工后马铃薯渣中的淀粉含量占干基含量的37%,纤维素类占干基总量的31%,果胶占干基含量的17%,蛋白质或氨基酸仅占干基含量的4%[4-5]。本文以实验室提取的马铃薯淀粉为原料,采用中温型α-淀粉酶,通过响应面实验设计方法,建立酶解模型,对淀粉酶解条件进行优化,旨在为马铃薯及马铃薯渣的加工再利用提供技术支持。
1 材料与方法
1.1 材料与仪器
马铃薯淀粉 市售马铃薯实验室提取;中温型a-淀粉酶 天津市大茂化学试剂厂,活力为3000~5000 U/g;柠檬酸、磷酸二氢钠、碘、碘化钾、硫代硫酸钠、重铬酸钾、硫酸、氢氧化钠、高氯酸钾、氯化钙 均为分析纯;可溶性淀粉。
玻璃仪器气流烘干器 长城科工贸有限公司;BCD-212KA冰箱 Haier公司;DHG-9240型电热鼓风干燥箱 上海-恒科技有限公司;HH-4数显恒温水浴锅 常用国华电器有限公司;DELTA-320实验室PH计 METTLER TOLEDO公司;PL-203型电子分析天平 瑞士梅特勒-托力多公司;SK-1快速混匀器 金坛市恒丰仪器制造有限公司。
1.2 实验方法
1.2.1 DE值的测定 按照郝晓敏等[6]研究方法测定还原糖含量。称取淀粉酶解液约10 mL移入250 mL的容量瓶中,用蒸馏水定容,摇匀。用移液管吸取10 mL,置于碘量瓶中,加入15 mL 0.1 mol/L碘液,再用滴定管慢慢加入15 mL 0.15 mol/L氢氧化钠,边加边摇匀。在暗室放置20 min,温度在20℃为宜,加入2 mol/L硫酸2 mL酸化,用0.05 mol/L硫代硫酸钠溶液滴定过量的碘,记录消耗的硫代硫酸钠体积V1,同时做空白实验,用10 mL水代替10 mL液化液,并记录消耗的硫代硫酸钠的体积V0。
还原糖含量(g/100mL)={[(V0-V1)×N×90.05]/ (V×1000)}×H×100
式中:V0—空白滴定消耗的标准硫代硫酸钠溶液的毫升数;V1—样品滴定消耗的标准硫代硫酸钠溶液的毫升数;V—反应试样的吸取量毫升数;N—标准硫代硫酸钠的溶液当量浓度;90.05—1 mL硫代硫酸钠所相当的葡萄糖毫克数;H—被测样品的稀释倍数。
DE值(%)=水解液中还原糖的含量/干物质含量×100
1.2.2 α-淀粉酶活力测定 按照郝晓敏等[6]的研究方法测定α-淀粉酶活力。在150 mL锥形瓶中加入2%可溶性淀粉溶液20 mL,加入缓冲液5 mL,在60℃水浴中平衡4~5 min,加入0.5 mL稀释酶液,立即计时,充分混匀,定时取出1 mL反应液于预先盛有3 mL比色碘液的试管内,当颜色由紫色逐渐变为红棕色,与标准比色试管颜色相同时,即达到终点,记录时间为液化时间。
1.2.3 酶解马铃薯淀粉的制备 以新鲜马铃薯为原料,洗净、切块,将其放入打浆机打浆,然后用100目的滤布过滤,静置1~2 h后除去上清液,室温干燥得实验淀粉备用。
1.3 单因素实验
1.3.1 酶解时间对马铃薯淀粉DE值的影响 取2.0 g干马铃薯淀粉于25 mL锥形瓶中,加入10 mL(硫酸-氢氧化钠)pH7.5溶液混匀,加入2 mol/L CaCl2溶液50 μL保持溶液中Ca2+离子浓度为0.01 mol/L[7],加入60℃水浴温酶液800 μL(0.8%),充分混匀,在60℃下分别水解40、50、60、70、80 min后,灭酶冷却定容测定液化液DE值及还原糖含量。
1.3.2 pH对马铃薯淀粉DE值的影响 基本操作同
1.3.1 ,硫酸-氢氧化钠pH分别设为7.0、7.5、8.0、8.5、9.0,在60℃下水解70 min后,灭酶冷却定容测定液化液DE值及还原糖含量。
1.3.3 酶解温度对马铃薯淀粉DE值的影响 基本操作同1.3.1,加入保温酶液温度分别设为40、50、60、70、80℃,并在以上温度下水解70 min后,灭酶冷却定容测定液化液DE值及还原糖含量。
1.4 响应面实验
使用Design-Expert 8.0软件,采用Box-Behnken Design实验设计原理[8],以酶解时间、pH、酶解温度为自变量,分别以A、B、C表示,并以1、0、-1分别代表自变量的高、中、低水平,以马铃薯淀粉水解液的DE值为响应值,进行响应面实验,实验因素与因素水平见表1。

表1 响应面实验设计因素与水平Table1 Independent variables and levels used in response surface analysis
1.5 数据处理
响应面实验结果利用Design-Expert 8.0软件进行分析,建立回归方程并作等高线和三维曲面图,对任意两种因素的交互效应进行分析和评价[9],得到最优加工工艺组合。其他实验结果均用Excel软件进行处理。
2 结果与分析
2.1 单因素实验
2.1.1 酶解时间对马铃薯淀粉酶解液DE值的影响
酶解时间对马铃薯淀粉酶解液DE值的影响如图1所示。

图1 酶解时间对马铃薯淀粉酶解液DE值的影响Fig.1 Effect of liquid solution enzymolysis time on DE value of potato starch
图1 表明,随着酶解时间的延长,马铃薯淀粉酶解液的DE值先增大后减小。当酶解时间为60 min时,所得的水解液的DE值最高,达到57.94%;当酶解时间大于60 min时,随着酶解时间的延长,马铃薯淀粉酶解液的DE值逐渐降低。其原因可能是:水解时间太短时,水解反应不彻底,水解液的DE值较低;水解时间过长时,水解产生的葡萄糖复合分解反应增加,导致水解液的DE值降低。因此,适宜的酶解时间为60 min。
2.1.2 酶解pH对马铃薯淀粉酶解液DE值的影响 酶解pH对马铃薯淀粉酶解液DE值的影响如图2所示。
图2表明,随着pH的升高,马铃薯淀粉水解液的DE值先增大后减小。当水解pH为8.0,水解液的DE值最高,达到58.49%。可能是因为水解pH较低时,α-淀粉酶的水解活性失活,水解液的DE值较低。当pH过高时,同样使α-淀粉酶的结构发生改变,水解速率下降。因此,适宜的酶解pH为8.0。

图2 酶解pH对马铃薯淀粉酶解液DE值的影响Fig.2 The effect of pH on the enzymatic hydrolysis of potato starch solution DE value
2.1.3 酶解温度对马铃薯淀粉酶解液DE值的影响 酶解温度对马铃薯淀粉酶解液DE值的影响如图3所示。

图3 酶解温度对马铃薯淀粉酶解液DE值的影响Fig.3 Effect of liquid solution enzymolysis temperature on DE value of potato starch
图3表明,随着酶解温度的升高,马铃薯淀粉水解液的DE值先增大后减小。当水解时间为60℃时,所得的水解液的DE值最高,达到54.14%。可能是因为酶解温度较低时,α-淀粉酶的水解活性较低,同时温度较低时化学反应速率较低;当温度过高时,酶活性降低甚至失活,使水解液的DE值降低。因此,适宜酶解温度为60℃左右。
2.2 响应面实验
2.2.1 模型建立与分析 影响马铃薯淀粉酶解的因素有三个:酶解时间、pH、酶解温度,实验采用三因素三水平响应面法优化水解工艺参数,实验设计与结果如表2所示。

表2 响应面实验方案及结果Table2 Scheme and experimental results for response surface design

表3 回归模型方差分析结果Table3 ANVONA results for the fitted regression model
按照Design Expert软件中的Box-Behnken Design模型,对实验设计各组酶解液的DE值进行回归分析,得回归方程为:Y=57.93-0.65A+2.47B-2.177C+2.89AB+0.79AC-2.98BC-9.24A2-7.48B2-6.93C2
式中,Y为水解液的DE值;A、B、C分别为上述3个自变量的编码值。回归方程的R2为0.9137,模型回归系数显著性检验如表3所示:
由表3可知,模型的p<0.0001,表明该实验模型极显著。失拟项p=0.1351>0.05,不显著,说明方程对实验的拟合度较好,该方案可靠。另外,因素B和因素C对马铃薯淀粉酶解DE值影响极显著(p<0.01),因素A的影响不显著;因素A2、B2、C2对DE值的影响均极显著(p<0.01);因素AB、BC交互作用对DE值影响极显著(p<0.01)。根据一次回归系数绝对值大小可知,影响马铃薯淀粉酶解的主次因素为:pH>酶解温度>酶解时间。
2.2.2 响应面分析与优化 通过多元回归方程分析可知3个因素交互作用对DE值的影响情况。用响应面和等高线图可以直观的反映该影响。

图4 酶解时间和pH的交互作用响应面图Fig.4 Response surface of interaction between time and pH value
从图4可以看出,酶解时间和pH对淀粉酶解DE值的影响较大(p<0.01),当酶解时间和pH过高或过低的时候,DE值较低。适中的酶解时间和pH时,响应面出现最高点,此时DE值最高。
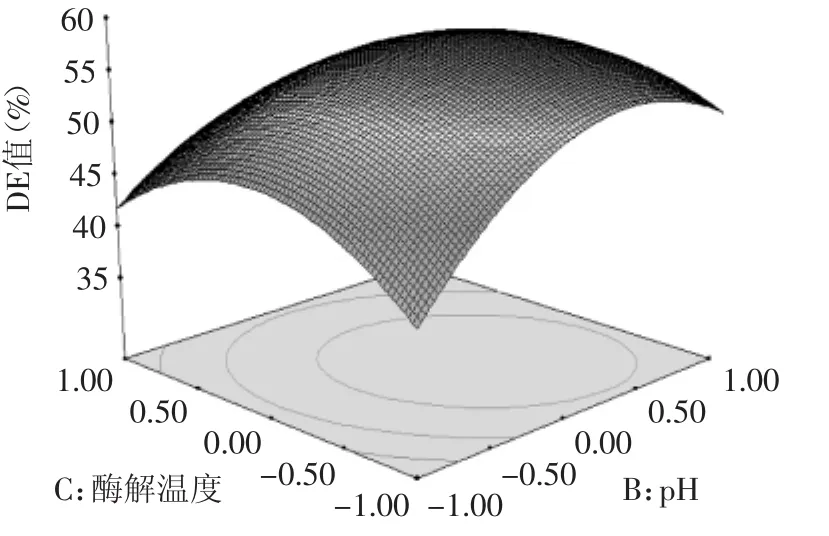
图5 酶解温度和pH的交互作用响应面图Fig.5 Response surface of interaction between temperature and pH value
从图5可以看出,酶解温度和pH对淀粉酶解DE值的影响较大(p<0.01),当酶解温度和pH过高或过低时,DE值较低。适中的酶解温度和pH时,响应面出现最高点,此时DE值最高。
根据回归模型方程以及酶解时间、pH、酶解温度对马铃薯淀粉DE值的影响的等高线、响应面图可知,pH、酶解温度对DE值的影响最为显著,表现的曲线最陡。
2.3 优化及验证实验
用Design Expert 8.0软件进行优化,得到马铃薯淀粉酶解的最佳工艺条件为:pH7.90、酶解温度62.22℃、酶解时间59.21 min,在此条件下,马铃薯淀粉酶解液的预测DE值为58.46%。考虑到实际应用,马铃薯淀粉酶解的最佳工艺条件调整为:pH7.90、酶解温度62℃、酶解时间60 min,在此条件下,马铃薯淀粉酶解液的DE值为57.93%,与预测值接近。由此表明该模型可靠。
3 结论
本研究以马铃薯淀粉为原料,采用中温型α-淀粉酶对马铃薯淀粉进行酶解,以淀粉酶解液DE值作为实验指标,根据单因素实验结果,采用响应面设计实验,运用Box-Behnken的中心组合实验设计原理,选择对水解度有显著影响的3个因素:pH、酶解温度、酶解时间,进行3因素3水平的响应面分析实验,得到α-淀粉酶水解马铃薯淀粉的最佳工艺参数:pH7.90,酶解温度62.22℃,酶解时间59.21 min,在此条件下,马铃薯淀粉酶解液的DE值为58.46%。考虑到实际操作需要,将酶解温度调整为62℃,酶解时间调整60 min,在此条件下,马铃薯淀粉酶解液的DE值为57.93%,与预测值接近。
[1]王拓一,张杰,吴耘红,等.马铃薯渣的综合利用研究[J].农产品加工,2008(7):103-105.
[2]李玉芹,袁正求,冯岳,等.α-淀粉酶和糖化酶协同酶解马铃薯淀粉的工艺条件优化[J].西北农林科技大学学报:自然科学版,2011(7):147-152.
[3]连喜军,王吰,刘旭.α-淀粉酶水解马铃薯淀粉制备抗性淀粉[J].粮食与油脂,2009(2):12-14.
[4]史静,陈本建.马铃薯渣的综合利用与研究进展[J].青海草业,2013,22(1):42-45.
[5]刘达玉,黄丹,李群兰.酶碱法提取薯渣膳食纤维及其改性研究[J].食品研究与开发,2005,26(5):63-65.
[6]郝晓敏,王遂,崔凌飞.α-淀粉酶水解玉米淀粉的研究[J].食品科学,2006,27(2):141-143.毕静.中温型α-淀粉酶水解玉米淀粉生产麦芽糊精工艺研究[J].食品与发酵科技,2010(3):72-74.
[7]于君妍,宋弋,张玉玉,等.响应面法优化板栗淀粉酸水解工艺[J].食品研究与开发,2013(8):32-35.
[8]王长虹,黄纪念,高向阳,等.响应面法优化糖化酶水解麦麸淀粉工艺研究[J].浙江农业科学,2010(6):1317-1322.
[9]张慧君,孙岩,王丽娜,等.响应面优化酶解法提取亚麻粕蛋白的工艺研究[J].食品工业,2013,34(8):67-70.
Optimizing process parameters for enzymolysis of potato starch by response surface methodology
WEI Yu-mei1,LI Qi-bing2,LIU Hua3,*
(1.Center of Experiment,Northwest University for Nationality,Lanzhou 730030,China;2.College of Science and Engineering,Northwest University for Nationality,Lanzhou 730030,China;3.School of Mathematics and Computer Science,Northwest University for Nationality,Lanzhou 730030,China)
Using medium temperature type-amylase on potato starch hydrolysis,the DE value of potato starch hydrolysate was the evaluation index.Based on single-factor experiments of the effect of the pH,enzymolysis temperature and enzymolysis time,the optimum condition of potato starch enzymolysis was determined by response surface methodology.The results showed that the optimum conditions were as follows:pH7.90,enzymolysis temperature 62℃,enzymolysis time 60 min,under the optimum conditions,the enzymolysis of potato starch DE value was 57.93%.
response surface method;potato starch;enzymolysis
TS234+2
A
1002-0306(2016)02-0176-04
10.13386/j.issn1002-0306.2016.02.027
2015-05-06
魏玉梅(1980-),女,硕士研究生,实验师,研究方向:食品开发与安全检测,E-mail:weijy1980@126.com。
*通讯作者:刘华(1977-),男,博士,教授,研究方向:数值计算,E-mail:649118046@qq.com。
中央高校基本科研业务费专项资金项目(31920140095);国家自然科学基金(31260098);西北民族大学2014年开放项目;国家民委中青年英才计划(〔2014〕121号);2013年西北民族大学创新团队项目。
——硫代硫酸钠

