枯草芽胞杆菌HZB02的分离及其室内抑菌效果
周小林, 黄振文, 刘人豪, 葛 磊, 顾卫兵
(1.南通科技职业学院,南通市植物有害生物监测与综合治理重点实验室, 南通 226007;2. 中兴大学植物病害管理实验室,台中 40227; 3. 南通舜德生物制品有限公司, 南通 226000)
枯草芽胞杆菌HZB02的分离及其室内抑菌效果
周小林1*,黄振文2,刘人豪3,葛磊1,顾卫兵1
(1.南通科技职业学院,南通市植物有害生物监测与综合治理重点实验室, 南通226007;2. 中兴大学植物病害管理实验室,台中40227; 3. 南通舜德生物制品有限公司, 南通226000)
从施用SupperGreen的小白菜‘凤山5号’根际土壤中分离筛选到1株对白菜炭疽病菌(Colletotrichum higginsianum)有较强拮抗活性的细菌菌株HZB02。该菌株对白菜炭疽病菌孢子萌发、菌丝生长、盆栽白菜发病等均有明显的抑制能力。根据菌落形态、菌体电镜观察及16SrDNA序列测定结果判断,该菌株属于Bacillus subtilissubsp. subtilis。进一步研究不同培养基条件及添加大豆油对HZB02抗生作用的影响,发现其在SYMA、PDA培养基上抑制炭疽病菌菌丝生长的能力最佳,此外其SYM、PDB发酵液对炭疽病菌孢子萌发的抑制作用亦最强,然而它的TSB发酵液则显示出最优抑制菌丝生长的效果。研究发现在SYM与PDB中添加5%大豆油的发酵液可显著提升HZB02的抑菌功效。
枯草芽胞杆菌;拮抗细菌;白菜炭疽病菌;室内抑菌
近几年来,因为食品与环境生态的安全问题,农药及化肥的使用受到越来越多的限制,不用任何化肥农药的有机栽培法得到了较多的推行。这给作物病害的治理带来了两个方面的变化,一是田间的病害种类发生了巨大的改变,比如有机田易发生由Colletotrichum higginsianum引起的白菜炭疽病、Sclerotium rolfsii(无性世代)导致的白绢病等病害[1];二是非农药植保手段要设法弥补农药限制所留下的空间,其中生物防治是可以大力发展应用的主要方法,高效无污染的生物防治技术已成为研究热点[2]。
大量实践证明, 芽胞杆菌的稳定性、与其他化学试剂的相容性和在不同果蔬不同年份防效的一致性等方面均明显优于非芽胞杆菌和真菌生防菌剂[3]。用蔗糖麸酸培养基培养的Bacillusspp.BR-11 及BS-25皆可促进其对白花芥蓝黑斑病的抑制效果[4]。微生物制剂的组成成分会影响拮抗微生物的生物活性及储架寿命[5],其中不同来源的碳氮是影响拮抗微生物抗生作用的重要因子,因此如何有效地提升微生物制剂的有效性及防治潜力,导入环境因子的调控,以建立一个利于拮抗微生物生长及促其抗生物质产生的发酵环境,是研发微生物制剂不可忽略的方面之一[6]。
本研究以白菜炭疽病菌为测试对象,对从小白菜根际土壤中分离得到的细菌与放线菌菌株进行控病作用测试,以期筛选出有较高生防效果的菌株;同时对影响其生防作用发挥的培养条件进行初步研究,为生防制剂的应用开发提供依据。
1 材料与方法
1.1供试材料
SuperGreen(SG),由安理科技公司(新北市)提供,为一种香蕉萃取物。
白菜炭疽病病菌(Colletotrichum higginsianum)菌株PA01,由中兴大学植物病害管理实验室提供。
SYMA培养基由黄豆粉(20g)煮沸20min后的滤液,添加5g糖蜜(市售),加水至1L,琼脂20g(无琼脂则为SYM),pH7.5,再灭菌而成;几丁质培养基:2g胶状几丁质(中兴大学植物病害管理实验室自制)、琼脂20g、K2HPO40.7g、KH2PO40.5g、MgSO40.5g、FeSO40.01g、ZnSO40.001g,水1L,pH自然。
其他固体培养基包括:TSA、PDA、NA、ISP4,相应液体培养基包括:TSB、PDB、NB、ISP4-A。均为美国DIFCO公司产品。
小白菜品种为‘凤山5号’,种子为台中市售,种植于日光温室中,在3叶1心时挑选长势较为一致的植株进行试验。
1.2菌株的诱导与分离
用SG500倍液浇透盆栽小白菜基质,一周后采集土样。用几丁质、PDA等培养基进行菌株分离,挑选菌落四周有不透明圈的放线菌、分解几丁质能力较强及数量较多的菌落,进一步进行纯化培养,每周用PDA平板画线更新待用。
1.3分离菌株对白菜炭疽病菌的抑菌作用
先采用平板对峙法粗筛出有抑菌作用的菌株,再进行精确测定。
取浓度为105个/mL的白菜炭疽病菌PA01分生孢子悬浮液10μL于PDA平板中央,在PA01两侧对称的两点分别接种两株待测菌,与PA01相距2cm,待测菌浓度为107个/mL孢子(细胞)液,每点接10μL;以只接种菌株PA01为对照。各处理均为4个重复。30℃培养8d后,测量菌株PA01的菌落直径。按如下公式计算抑菌率:
抑菌率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100。
1.4HZB02 PDB发酵产物对白菜炭疽病(菌)的控制效果
选用PDB培养液,将HZB02 于30℃、150r/min下培养5d,发酵液离心后过0.22μm滤膜除菌备用。
1.4.1对白菜炭疽病菌孢子萌发的影响
设置无菌水(CK)、HZB02除菌发酵液的2×、10×、100×稀释液共4个处理,每处理3个重复,每重复随机调查100个孢子的萌发状况。
操作方法:取5μL105个/mL菌株PA01分生孢子悬浮液与5μLHZB02发酵液在无菌玻片上混匀,置于无菌培养皿中,于30℃下保湿培养。12h后检查孢子萌发率、萌发孢子中未形成附着胞的百分比及其他抑制萌发的特征。
孢子萌发率(%)=(对照组孢子萌发率-处理组孢子萌发率)/对照组孢子萌发率×100。
1.4.2对白菜炭疽病的控制效果
取温室中生长有3叶1心的白菜植株,分别喷施清水、HZB02PDB发酵液10×、50×、100×稀释液,待叶面干燥后喷雾接种105个/mL菌株PA01分生孢子悬浮液,每盆接种孢子液10mL,保湿24h。每个处理4个重复,每重复3株(盆)。
5d后调查各处理植株1~3叶发病状况,计算各处理的病情指数和相对防效。各叶片发病程度分级标准为:0级,无发病,1级,发病率[0~0.07%],2级,发病率(0.07%~3%],3级,发病率(3%~10%],4级,发病率(10%~25%],5级,发病率(25%~50%],6级,发病率50%以上;1~5级的发病率上限不计在本级别内[7]。

相对防效(%)=

1.5HZB02的鉴定
观察HZB02在平板上的菌落形态,用电子显微镜观察菌体形态与大小,再进行种的分子鉴定。
分子鉴定通过微波法提取菌株DNA,扩增引物为16S-F(5′-TTGTACACACCGCCCGTCA-3′)和23S-R(5′-GGTACCTTAGATGTTTCAGTTC-3′)[8]。反应体系:两种10μmol/L引物各0.4μL, 5×PCRMasterMix4μL, 模板DNA1μL,ddH2O14.2μL。扩增条件:92℃ 5min;92℃ 60s,55℃ 60s,72℃ 60s,30个循环;72℃ 5min;4℃保存。PCR产物测序由源资国际生物科技股份有限公司完成,再将该序列与美国国家生物信息中心(NationalCenterforBiotechnologyInformation,NCBI)的BLAST(BasicLocalAlignmentSearchTool)数据库进行比对,采用MAGE5.1软件构建系统发育树。
1.6不同培养基对HZB02抑菌作用的影响
1.6.1不同固体培养基培养的HZB02对白菜炭疽病菌菌丝生长的影响
HZB02平板培养选择SYMA、TSA、PDA、NA、ISP4等5种培养基。
取105个/mL菌株PA01分生孢子悬浮液10μL于各平板中央,在与PA01相距2.5cm的对称的两点各接种106个/mLHZB02菌液10μL,每处理4个重复。30℃培养8d后,测量受各待测菌影响的PA01菌落直径,同时观察HZB02在各种培养基上的生长及抑菌表现状况。
1.6.2HZB02不同培养基发酵液对白菜炭疽病菌的影响
菌株HZB02的发酵选用SYM、TSB、PDB、NB、ISP4-A(不含琼脂)共5种培养基,在30℃,150r/min条件下培养5d。取各发酵液过0.22μm滤膜除菌备用。
1.6.2.1对孢子萌发的影响
设置无菌水CK、经不同培养基发酵的HZB02除菌发酵液10×稀释液共6个处理。每处理3个重复,每重复随机调查100个孢子的萌发状况。
操作方法:将5μL105个/mL菌株PA01分生孢子悬浮液与5μLHZB02发酵液在无菌玻片上混匀;每玻片上做3个重复,置于保湿无菌培养皿中30℃下培养;12h后检查孢子萌发抑制率及抑制萌发特征。
1.6.2.2对菌丝生长的影响
将各除菌发酵液与熔化的PDA培养基(V/V为1∶50)混合均匀,以不加发酵液的PDA平板为对照,每处理4个重复。取105个/mL菌株PA01分生孢子悬浮液10μL置于平板中央,30℃培养,待对照组菌落基本长满平板时测定各处理菌落直径。
1.6.3添加植物油的发酵液对抑菌作用的影响
设置SYM、PDB、TSB及分别添加0.5%(V/V)大豆油共6个处理,将各发酵液除菌后与PDA培养基(V/V为1∶50)混合均匀,以不加发酵液的PDA平板为对照,每处理4个重复。取105个/mL菌株PA01分生孢子液10μL置于平板中央,30℃培养,待对照组菌落基本长满平板时测定各处理菌落直径。
1.7数据处理
试验数据采用SAS9.0 软件进行统计分析,采用Duncan’s新复极差法对各处理进行差异显著性检测。
2 结果与分析
2.1分离菌株对白菜炭疽病菌的抑菌效果
从白菜根际土壤中共分离到25株细菌和16株放线菌。经过平板对峙培养初步筛选出2株细菌和5株放线菌对白菜炭疽病菌菌株PA01菌丝生长有一定的抑制效果;有6个菌株在PDA平板上不能良好生长,无法观察其影响;其他菌株则没有抑菌作用。
经进一步精确测定,细菌HZB02、放线菌HZS08具有极为显著的抑制菌株PA01生长的作用,抑菌率分别达到69.90%和63.15%;3个放线菌菌株HZS07、HZS10、HZS06抑制作用表现微弱;细菌HZB03、放线菌HZS16则无明显作用(表1)。

表1 拮抗菌对白菜炭疽病菌的抑制作用筛选1)Table 1 Inhibitory effects of antagonistic HZB and HZSstrains on Colletotrichum higginsianum
1) 表中同列数据后不同小写字母表示经Duncan’s新复极差法检验差异显著(P<0.05)。下同。
DatainthesamecolumnfollowedbydifferentlowercaselettersaresignificantlydifferentbyDuncan’snewmultiplerangetest(P<0.05).Thesamebelow.
2.2HZB02 PDB发酵产物对白菜炭疽病(菌)的控制效果
2.2.1对白菜炭疽病菌PA01孢子萌发的影响
HZB02除菌发酵液2×稀释液对菌株PA01的孢子萌发率虽然没有明显的影响(表2),但萌发产生的菌丝普遍出现肿大,萌发孢子中只有5.67%产生浅色的附着胞(图1a);10×稀释液处理的PA01其孢子萌发率为90.67%,显著高于对照的80.00%,可能是除菌发酵液中的营养物质有促进孢子萌发的作用,但萌发的孢子中仅7.00%有附着胞,且附着胞与萌发孢子基部的长度普遍长于孢子长度3倍以上(图1b);100×稀释液处理的菌株PA01萌发率较CK高,且产生附着胞,与对照没有显著差异。

表2 HZB02 PDB发酵产物对白菜炭疽病菌 孢子萌发的控制作用Table 2 Effects of fermentationproducts of HZB02 on conidial germination ofColletotrichum higginsianum in PDB medium

图1 HZB02 PDB发酵产物对白菜炭疽 病菌孢子萌发的影响Fig.1 Conidial germination of Colletotrichum higginsianum after the treatment with fermentation products of HZB02 in PDB medium
附着胞是炭疽菌产生的能穿透寄主组织的特殊侵染结构[9],对其致病性有着重要影响。10倍稀释液处理后虽然90.67%的白菜炭疽病菌孢子萌发,但绝大多数不能正常形成附着胞。因此,以此为起点,设置10×、50×和100×发酵液进行盆栽防效试验。
2.2.2对白菜炭疽病的控制效果
HZB02PDB发酵液对白菜炭疽病显示出较好的控病作用(表3)。10×稀释液的相对防效达到64.79%,50×和100×也分别达到31.19%和28.00%,显示出较为理想的控病效果。10×稀释液处理后叶片上出现边缘模糊的褐色斑块,其他2个低浓度处理未见此状况,可能是因为高浓度导致的“药害”。

表3 HZB02 PDB发酵产物对白菜炭疽病的控制作用Table 3 Effects of fermentation products of HZB02 inPDB medium on anthracnose disease control
2.3HZB02的鉴定
在不同培养基平板上,HZB02的菌落颜色均为稍灰暗的乳白色,不规则形,边缘锯齿状。在电子显微镜下可见菌体为短杆状,两端钝圆,1.56(1.42~1.67)μm×0.78(0.73~0.87)μm(图2)。

图2 HZB02电镜下形态(5 000×)Fig.2 Observation of HZB02 morphology under electron microscopy
HZB02菌株16SrDNA片段的序列鉴定及分析结果显示,HZB02属于Bacillus subtilissubsp. spizizenii,与菌株NRS231 (CP010434.1)、TU-B-10 (CP002905.1)、W23 (CP002183.1)的相似度达到99%(图3)。
2.4不同培养基对HZB02抑菌作用的影响
2.4.1不同固体培养基培养的HZB02对白菜炭疽病菌菌丝生长的影响
不同平板培养基上的HZB02对白菜炭疽病菌菌丝生长抑制作用表现出显著差异,在SYMA、PDA培养基上其抑制作用表现最为优异,对白菜炭疽病菌菌丝抑菌率分别达到74.64%、69.99%,在NA、ISP4培养基上的抑菌率也达到50%以上,显示出较强的抑菌作用和营养适应能力(表4)。另外,在PDA平板上,白菜炭疽病菌被抑制处菌落表现出黑色、锯齿状特征,其他几种培养基上则较为整齐,亦无颜色变化。

图3 菌株HZB02 16S-23S rDNA 基因区间序列构建的系统发育树Fig.3 Phylogenetic tree based on 16S-23S rDNA interval sequences of the strain HZB02 and its relatives
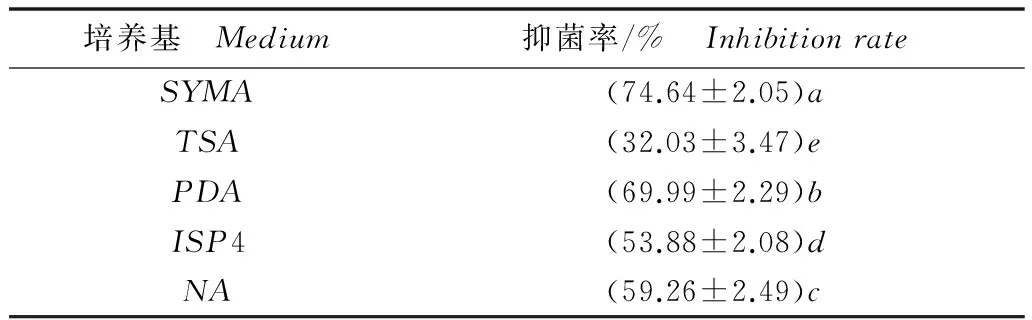
培养基 Medium抑菌率/% InhibitionrateSYMA(74.64±2.05)aTSA(32.03±3.47)ePDA(69.99±2.29)bISP4(53.88±2.08)dNA(59.26±2.49)c
2.4.2不同培养基发酵液对白菜炭疽病菌的影响
2.4.2.1对孢子萌发的影响
HZB02不同液体培养基发酵液10×稀释液对白菜炭疽病菌分生孢子萌发的影响有着较大的差异。从总体萌发率来看,SYM发酵液处理的白菜炭疽病菌只有34.0%的孢子萌发,显示出优异的抑制孢子萌发的作用;其他几种发酵液中白菜炭疽病菌分生孢子萌发率则都明显高于对照的80.0%,均达到90%以上,可能是发酵液中营养的促进作用;发酵液对附着胞形成的影响与对孢子萌发的影响相似,TSB、PDB发酵液处理的白菜炭疽病菌只有12.67%和29.00%具有附着胞(表5)。
2.4.2.2对菌丝生长的影响
利用不同培养液培养HZB02得到的发酵液除菌后与熔化的PDA培养基(V/V为1∶50)混合,对白菜炭疽病菌菌丝生长的抑制作用与对孢子萌发的影响有所不同。结果显示,TSB培养的HZB02抑菌率最高,与其他几种培养液差异显著;SYM、PDB次之,NB、ISP4-A则与对孢子的影响一致,只有6.69%和6.00%(表6)。

表5 HZB02不同发酵液对白菜炭疽病菌 分生孢子萌发的影响Table 5 Effects of different fermentation products of HZB02on conidial germination of Colletotrichum higginsianum

表6 HZB02不同发酵液对白菜炭疽病菌 菌丝生长的影响Table 6 Effects of different fermentation products ofHZB02 on mycelial growth of Colletotrichum higginsianum
2.4.3添加植物油的发酵液对抑菌作用的影响
3种培养基中添加5%大豆油的HZB02发酵液对白菜炭疽病菌菌丝生长抑制作用不同。其中SYM、PDB中添加大豆油后抑菌率显著提高,分别从29.91%提高到35.12%、30.68%提高到36.60%;但TSB添加大豆油后其抑菌能力反而下降了5百分点。

表7 添加大豆油的发酵液对白菜炭疽病菌菌丝生长的影响1)Table 7 Effects of the addition of soybean oil to fermentationproducts on mycelial growth of Colletotrichum higginsianum
1) 同行数据后不同小写字母表示在0.05水平有显著差异。
Differentsmalllettersinthesamerowindicatesignificantdifferenceat0.05level.
3 讨论
炭疽菌的分生孢子先附着于寄主表面,条件适合,产生芽管,继而在其顶端形成附着胞,随后侵入寄主表皮细胞[10]。因此,分生孢子萌发率和附着胞形成率的高低成为病原菌侵染寄主成功与否的关键[11]。Bacillus subtilisHZB02多种发酵产物有明显导致附着胞消失或黑色素减少的现象,这是由于培养基中残存营养的影响,还是特定的代谢产物的作用,以及该现象与对病害控制的关系有待深入研究。
生物农药的加工开发中,通过液态培养进行批量生产是最具经济效益的方法,许多培养条件(如培养基成分、培养时间等)对生物制剂功效的发挥有着重要的影响[12-13]。Bacillus subtilisHZB02总体表现出优良的抑菌和控病能力,显示出较好的生防应用潜力。本研究测定了不同C源、N源的固体与液体培养基以及添加大豆油情况下培养的HZB02对白菜炭疽病菌的影响,结果表明,抑制孢子萌发和菌丝生长的优势培养基有所不同,SYM、PDB的抑制孢子萌发作用最强,而TSB则显示出最优的抑制菌丝生长能力,HZB02制剂的最佳培养条件还需进一步筛选优化。
[1]黄振文,彭玉湘. 有机农场蔬菜真菌性病害的管理策略[C]∥海峡两岸第十届菌物学暨第三届食药菌学术研讨会论文集,2011:270-276.
[2]欧雄常,柳凤,詹儒林,等. 拮抗辣椒疫病菌的红树内生细菌筛选及RS261菌株鉴定[J]. 微生物学通报,2009,36(2):175-180.
[3]郝卫宁,李辉,胡美英,等.柑桔绿霉病拮抗细菌的筛选、鉴定及其抑制效果[J].中国生物防治学报,2011,27(2): 284-288.
[4]钟文全,黄振文.应用微生物防治白花芥蓝黑斑病[J]. 植保会刊,1994,36(2): 117-130.
[5]FravelDR,LewisJA,ChittamsJL.AlginateprillformulationsofTalaromyces flavuswithorganiccarriesforbiocontrolofVerticillium dahlia [J].Phytopathology, 1995, 85(2):165-168.
[6]江嘉容.檬果炭疽病的生物防治菌鉴定与其防病之雏形发酵营养配方设计[D].台中:中兴大学.2011.
[7]孙彩玉. 十字花科炭疽病菌的病原性与存活[D]. 台中:中兴大学植物病理学系,2011.
[8]LiuPY,ShiZY,LauYJ,etal.ComparisonofdifferentPCRapproachesforcharacterizationofBurkholderia (Pseudomonas) cepaciaisolates[J].JournalofClinicalMicrobiology, 1995,33(12):3304-3307.
[9]王洪凯,林福呈,王政逸.植物病原真菌附着胞的机械穿透力[J].菌物学报,2004,23(1):151-157.
[10]张敬泽,胡东维.影响柿树炭疽菌孢子萌发、附着胞形成及致病性的环境因子[J].植物生理学报,2004,34(2):154-l61.
[11]路梅,叶美娟,凌丹燕,等.影响茶花炭疽病孢子萌发与附着胞形成的因子[J].微生物学杂志, 2012,32(6):37-41.
[12]McQuilkenMP,BudgeSP,WhippsJM.Effectsofculturemediaandenvironmentalfactorsonconidialgermination,pycnidialproductionandhyphalextensionofConiothyrium minitans [J].MycologicalResearch, 1997,101(1): 11-17.
[13]ShihHD,ChungWC,HuangHC,etal.IdentificationforStreptomyces padanusstrainPMS-702asabiopesticideagent[J].PlantPathologyBulletin,2013,22(2):145-158.
(责任编辑:杨明丽)
IsolationofBacillus subtilisHZB02anditsantimicrobialeffect
ZhouXiaolin1,HuangJennwen2,LiuRenhao3,GeLei1,GuWeibing1
(1.NantongCollegeofScienceandTechnology,NantongKeyLaboratoryofPlantPestMonitoringandComprehensiveManagement,Nantong226007,China; 2.LaboratoryofPlantDiseasesManagement,ChungHsingUniversity,Taichung40227,China; 3.NantongShundeBiologicalsCo.,Ltd.,Nantong226000,China)
AbacterialstrainHZB02,whichishighlyantagonisticagainstColletotrichum higginsianum,wasisolatedandscreenedfromtherhizospheresoilofChinesecabbage‘Fengshan5’ (Brassica chinensisL.)whichwasdrenchedwithSupperGreen.ThestrainhadsignificantlyinhibitoryeffectonconidialgerminationandmycelialgrowthofC.higginsianum,aswellastheinfectionofBrassica chinensisL.bytheanthracnosefungusinthelaboratoryandgreenhouseexperiments.Accordingtotheresultsofmorphologicalcharacteristics,electronmicroscopicobservationand16SrDNAsequencehomology,thestrainHZB02wasidentifiedasBacillus subtilissubsp. subtilis.DifferentnutrientmediaandtheadditionofsoybeanoilforculturingHZB02werefurtherevaluatedforitsantibioticeffectsonthepathogen.TheresultsshowedthatthestrongestinhibitoryeffectonthemycelialgrowthofC.higginsianumwasobservedwhenHZB02andthefunguswereduallyculturedinSYMAandPDA.ConidialgerminationwasalsohighlyinhibitedbyfermentationproductsofHZB02inSYMandPDB.Moreover,theantimicrobialeffectofthestrainHZB02wasdramaticallyenhancedwhenitsculturalmediaSYMandPDBwereaddedwith5%(V/V)soybeanoil.
Bacillus subtilis;antagonisticbacterium;Colletotrichum higginsianum;antimicrobialeffect
2014-11-24
2015-02-15
江苏省高校优秀中青年教师和校长境外研修项目(2011年度);南通舜德生物制品有限公司和南通市植物有害生物监测与综合治理重点实验室提供部分资金资助
E-mail:zxl700621@sina.com
S476
ADOI:10.3969/j.issn.0529-1542.2016.01.025

