壳聚糖和核黄素诱导裸仁美洲南瓜对白粉病抗性的研究
窦剑兵, 张树武, 王卫雄, 梁巧兰, 徐秉良
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心, 兰州 730070)
壳聚糖和核黄素诱导裸仁美洲南瓜对白粉病抗性的研究
窦剑兵,张树武,王卫雄,梁巧兰,徐秉良*
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心, 兰州730070)
采用喷雾接种法测定了不同浓度壳聚糖(chitosan)和核黄素(riboflavin)诱导裸仁美洲南瓜对白粉病菌(Podosphaeraxanthii)抗性的研究。结果表明,经400 μg/mL壳聚糖和753 μg/mL核黄素处理后,其病情指数显著低于对照,仅为7.10和8.14,且诱导抗病效果较为显著,分别为80.70%和77.86%,诱导抗病持久期可延续15 d。诱导后相关生理生化指标测定结果表明,随着处理时间的增加,叶片中POD、PAL和PPO活性总体呈现出先升高后降低的趋势,且处理显著高于对照。壳聚糖处理后POD、PAL和PPO活性分别于第3、5和7天达到峰值;核黄素处理后POD和PAL活性于第5天达到峰值,而PPO活性则于第7天达到峰值。
壳聚糖;核黄素;白粉病菌;诱导抗病性
南瓜白粉病在南瓜的整个生育期内均可发生,尤其在南瓜的生长后期,可以导致植株提早枯死,产量降低,品质下降,造成严重的经济损失。长期以来,人们对南瓜白粉病的控制主要采用抗病品种和化学药剂,但抗病育种工作存在一定局限性,杀菌剂的使用存在残留、残毒、污染环境等问题[1-2],因此,寻找一种高效、低残留、无污染的新的防治植物病害的途径迫在眉睫。
植物诱导抗病具有非专化性和无公害等特点,是近年来植物病害防治中代替化学防治的新技术和新方法,受到人们的广泛重视[3-5]。目前,壳聚糖和核黄素是人们普遍使用的两种植物诱抗剂,均可以诱导植物细胞发生一系列的抗性反应,最终增强植物的抗病性[6-9]。钟小刚等[10]报道壳聚糖诱导苹果叶片对斑点落叶病菌(AlternariamaliRoberts)产生一定的抗病性,杜文超等[11]报道外施核黄素诱导小麦对白粉病菌(Blumeriagraminisf.sp.tritici)产生抗性,裴冬丽等[12]报道核黄素诱导番茄幼苗对白粉菌产生抗性,但是目前有关壳聚糖和核黄素诱导裸仁美洲南瓜对白粉病抗性方面尚未见报道。本试验以壳聚糖和核黄素为诱抗剂,通过盆栽接种和保护性酶的测定研究了壳聚糖和核黄素对裸仁美洲南瓜抗白粉病诱导的作用,以期为南瓜白粉病的防治提供新的思路。
1 材料与方法
1.1材料
1.1.1供试材料及菌种
供试材料由武威金苹果有限责任公司提供,品种为裸仁美洲南瓜高代自交姊妹系 ‘04LAg-26-28’。
裸仁美洲南瓜白粉病菌(Podosphaeraxanthii)采自武威金苹果公司田间发病植株,并接种于甘肃农业大学植物病理实验室室内裸仁美洲南瓜盆栽苗扩繁培养备用。
1.1.2供试药剂
壳聚糖(chitosan):化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖,淡黄色粉末,脱乙酰度≥91%,西安裕华生物科技有限公司。
核黄素(riboflavin):化学名称为7,8-二甲基-10-(1′-D-核糖基)-异咯嗪。上海笛柏化学品技术有限公司。
1.2方法
1.2.1白粉菌分生孢子悬浮液配制
在超净工作台上用毛笔轻轻将南瓜苗上培养的白粉菌分生孢子刷于盛有0.5‰ SDS水溶液的烧杯中,混匀后镜检,使孢子浓度为10×10倍镜下50~60个分生孢子/视野。
1.2.2壳聚糖和核黄素对裸仁美洲南瓜白粉菌的抑菌活性测定
将南瓜种子放入盛有灭菌水的烧杯中浸泡12 h,使种子充分吸水后放在装有浸水海绵的盘子里,将种子铺平用纱布盖住,置于28℃培养箱中催芽,待种子露白时将其种于底部带孔育苗钵中于室温下培养,以灭菌的园土∶沙=2∶1的混合土为育苗基质,当幼苗长出第2片真叶时,选择长势一致、健壮的幼苗供接种用。待南瓜植株第2片真叶充分展开时,用浓度为100、200、300、400、500 μg/mL的壳聚糖和浓度为188、376、565、753、941 μg/mL的核黄素分别喷雾处理裸仁美洲南瓜,以植株叶片全部湿润为标准,用清水喷雾为对照,并采用喷雾法接种白粉病菌,分别于接种12、24和36 h后采用随机取样法对各盆栽苗上、中、下各部叶片进行取样并打取叶圆片,按照Kuzuya等[13]的方法用乙醇-乳酚油在80℃条件下水浴脱色至透明,用考马斯亮蓝染色后在显微镜(10×40)下观察裸仁美洲南瓜叶片上分生孢子的萌发情况,统计分生孢子萌发数并通过下式计算分生孢子萌发率。试验重复3次,每个重复至少取20个叶圆片,每个叶圆片观察50个分生孢子。

1.2.3不同浓度壳聚糖和核黄素诱导裸仁美洲南瓜抗病性测定
待瓜苗第2片真叶充分展开时,用浓度为100、200、300、400、500 μg/mL的壳聚糖和浓度为188、376、565、753、941 μg/mL的核黄素分别喷雾,以植株叶片全部湿润为标准,用清水喷雾作对照。处理后7 d进行接种,室温保湿24 h后移至温室内培养,接种后7 d调查发病情况,每处理3个重复,南瓜白粉病病情分级标准参照王建设等的方法[14-15]。

诱导效果(%)=

1.2.4壳聚糖和核黄素诱导裸仁美洲南瓜抗白粉病持久期测定
选用壳聚糖与核黄素5种浓度处理诱抗效果最佳的浓度对南瓜2叶期幼苗进行处理,分别于处理后1、5、7、9、11、15 d进行接种,方法同上。接种后7 d调查发病情况,以喷清水作对照,每处理3个重复。
1.2.5壳聚糖和核黄素诱导后对POD、PPO和PAL酶活性的影响
采用浓度为400 μg/mL的壳聚糖和浓度为753 μg/mL核黄素喷雾处理第2片真叶充分展开的裸仁美洲南瓜,以植株叶片全部湿润为标准,用清水喷雾为对照,于诱导处理后1、3、5、7、9 d采用随机取样法对各盆栽苗上、中、下各部叶片进行取样,并参照庄霞等[16]的方法用TU-1810紫外分光光度计进行POD、PPO和PAL酶活性测定。
2 结果与分析
2.1壳聚糖和核黄素诱导裸仁美洲南瓜叶片抑菌活性测定
经5种不同浓度的壳聚糖和核黄素分别处理南瓜叶片并接种白粉菌后,结果表明:不同浓度的壳聚糖和核黄素对南瓜白粉菌分生孢子的萌发均没有明显影响,且经不同浓度的壳聚糖和核黄素处理后白粉菌分生孢子的萌发率与对照相比无显著性差异(表1)。
2.2不同浓度壳聚糖和核黄素诱导裸仁美洲南瓜抗病性测定
用不同浓度的壳聚糖和核黄素分别处理2叶期裸仁美洲南瓜叶片进行诱导抗病性测定,结果表明:经不同浓度的壳聚糖和核黄素处理后植株病情指数明显低于对照植株,其中400 μg/mL的壳聚糖和753 μg/mL的核黄素处理后病情指数最低,分别为7.10和8.14;不同浓度壳聚糖和核黄素对裸仁美洲南瓜叶片的诱抗效果随浓度升高而增强,其中壳聚糖浓度为400 μg/mL和核黄素浓度为753 μg/mL的诱抗效果最好,分别为80.70%和77.86%(表2)。

表1 不同浓度壳聚糖和核黄素对白粉菌分生孢子的影响1)Table 1 Effects of different concentrations of chitosan and riboflavin on spore germination of Podosphaera xanthii
1) 表中数据均为3次重复的平均值。表中大、小写字母分别表示在0.01水平和0.05水平各处理间的差异性,下同。
The data in the table are means of three repetitions. The capital and lower-case letters represent the differences among treatments at the 0.01 and 0.05 levels,respectively. The same below.
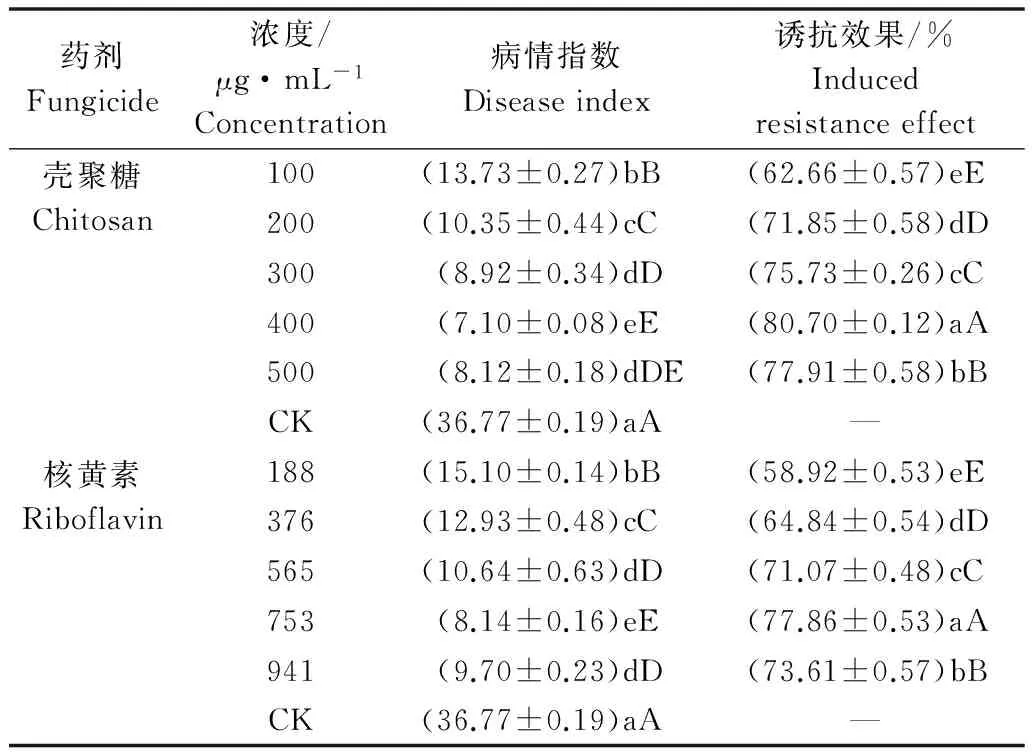
表2 壳聚糖和核黄素对裸仁美洲南瓜叶片的诱抗效果Table 2 Effects of induced-resistance by chitosan and riboflavin to Cucurbita pepo leaves
2.3壳聚糖和核黄素诱导美洲南瓜抗白粉病持久期测定
通过喷雾接种法对壳聚糖(400 μg/mL)和核黄素(753 μg/mL)诱导南瓜幼苗后抗白粉的持久性测定,结果表明:两种诱导剂在不同时间间隔均能诱导南瓜幼苗产生抗病性(图1)。壳聚糖和核黄素的诱导效果随着时间的推移均先增加后减小,其中壳聚糖处理7 d后,诱导效果达到最高,为79.25%,核黄素处理9 d后,诱导效果达到最高,为77.63%。此外,随着时间的推移壳聚糖和核黄素两种诱导剂的诱导效果虽在减小但并没有很快地减弱,而在处理15 d后接种两者诱导效果均在65%以上,其诱导抗病性的持久期可延续15 d。

图1 壳聚糖和核黄素对裸仁美洲南瓜植株诱导抗性持久期比较Fig.1 Comparison of lasting days of induced resistance between chitosan and riboflavin
2.4壳聚糖和核黄素诱导后对POD酶活性的影响
研究结果表明:经两种药剂诱导处理后,叶片POD酶活性明显高于清水对照(图2)。在第3天时壳聚糖处理POD酶活性达到峰值,为107.96 U/(min·g),相比对照升高了56.4 U/(min·g),而核黄素处理在第5天时POD酶活性达到峰值,为101.86 U/(min·g),相比对照升高了47.18 U/(min·g),达到峰值后两者均呈现不同程度的下降趋势。通过两种药剂的诱导效果比较,壳聚糖诱导后POD酶活性始终高于核黄素诱导,因此,壳聚糖对叶片POD酶活性的影响较核黄素显著。

图2 壳聚糖和核黄素对裸仁美洲南瓜叶片POD酶活性的影响Fig.2 Effects of chitosan and riboflavin treatment on POD activity in the leaves of Cucurbita pepo
2.5壳聚糖和核黄素诱导后对PAL酶活性的影响
经壳聚糖和核黄素诱导处理叶片后, PAL酶活性明显高于对照,其变化趋势为先升高后降低,与对照相似。壳聚糖和核黄素诱导处理后第5天时, PAL酶活性均达到峰值,分别为45.78、50.34 U/(min·g),与对照相比分别升高了27.52、32.08 U/(min·g),达到峰值后三者均呈现不同程度的下降趋势(图3)。

图3 壳聚糖和核黄素对裸仁美洲南瓜叶片PAL酶活性的影响Fig.3 Effects of chitosan and riboflavin treatment on PAL activity in the leaves of Cucurbita pepo
2.6壳聚糖和核黄素诱导后对PPO酶活性的影响
经两种药剂诱导处理后,叶片PPO酶活性随时间的增长呈现先升高后降低的趋势。壳聚糖诱导后PPO酶活性明显高于核黄素诱导及对照,而且始终高于核黄素诱导处理,两者诱导7 d后PPO酶活性达到峰值,分别为78.28、48.55 U/(min·g)。相比对照分别升高了37.00和7.27 U/(min·g)。因此,壳聚糖和核黄素对裸仁美洲南瓜抗白粉病菌具有较强的诱导作用,但壳聚糖诱导对叶片PPO酶活性影响较大(图4)。
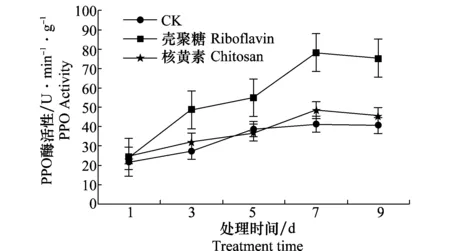
图4 壳聚糖和核黄素对裸仁美洲南瓜叶片PPO酶活性的影响Fig.4 Effects of chitosan and riboflavin treatment on PPO activity in the leaves of Cucurbita pepo
3 结论与讨论
近年来,有关植物诱导抗性的研究报道较多,生物和非生物因子(如微生物、化学物质以及物理因素等)都能够诱导植物产生抗病性[17],本文选用壳聚糖和核黄素为诱导剂对裸仁美洲南瓜进行诱导后测试其对白粉病菌的抗性,结果表明,不同浓度的壳聚糖和核黄素均能诱导裸仁美洲南瓜对白粉病产生抗性,其中浓度为400 μg/mL的壳聚糖和浓度为753 μg/mL的核黄素诱导裸仁美洲南瓜对白粉病具有显著的抗病性,且诱导抗病持久期可持续15 d。
前期研究表明,壳聚糖和核黄素可以诱导植物细胞发生一系列的防御酶系反应,并激发植物对病原菌产生抗性[6, 18]。本研究中,经壳聚糖和核黄素处理后南瓜叶片POD和PAL酶活性明显升高,且随时间的增长,POD和PAL酶活性先升高后降低,这与钟小刚等[10]报道的壳聚糖诱导苹果叶片以及裴冬丽等[12]报道的核黄素诱导番茄幼苗POD和PAL酶活性的变化趋势相一致。核黄素对PPO酶活性变化与对照相比影响较小,而壳聚糖诱导后叶片中PPO活性相比对照变化较大,这与陈年来等[19]报道的BTH诱导甜瓜及岳东霞等[20]报道的水杨酸诱导黄瓜叶片PPO酶活性均高于对照,且PPO酶活性先升高后降低的结果相一致。
植物诱导剂对环境无污染,有利于维持生态系统的平衡,同时也可促进我国农业朝着可持续农业的方向发展,有着许多化学药剂无可比拟的优点,植物诱导抗性已成为植物病理学科的研究热点,未来极具发展潜力。本试验只针对壳聚糖和核黄素对裸仁美洲南瓜叶片生理生化方面进行了研究,而关于这两种诱导剂在实际生产中的应用以及诱导处理后分子生物学机理的研究尚未涉及,有待进一步的研究。
[1]颜惠霞, 徐秉良, 梁巧兰, 等. 南瓜品种对白粉病的抗病性与叶绿素含量和气孔密度的相关性[J]. 植物保护, 2009, 35(1): 79-81.
[2]梁巧兰, 魏列新, 徐秉良. 裸仁美洲南瓜白粉病菌对几种杀菌剂敏感性及抗药性诱导[J]. 农药, 2012, 11(51): 840-843.
[3]田谷, 徐秉良, 梁巧兰, 等. 几种化学物质诱导彩色马蹄莲对软腐病抗性的研究[J]. 植物保护, 2010, 36(6): 53-57.
[4]Walters D, Walsh D, Newton A, et al. Induced resistance for plant disease control: maximizing the efficacy of resistance elicitors [J]. Phytopathology, 2005, 95(12): 1369-1373.
[5]李玉红, 陈鹏, 程智慧, 等. 草酸和BTH对黄瓜幼苗霜霉病抗性和胞间隙病程相关蛋白的诱导[J]. 植物病理学报, 2006, 36(3):238-243.
[6]张怡, 刘严, 康静敏, 等. 壳聚糖诱导植物抗病机理的研究进展[J]. 广东农业科学, 2011, 38(14): 82-85.
[7]Dong H, Beer S V. Riboflavin induces disease resistance in plants by acting a novel signal transduction pathway [J]. Phytopathology, 2000, 90(8): 801-811.
[8]杨飞飞, 董汉松. 核黄素诱导番茄抗病性与Pti蛋白激酶基因表达[J].鲁东大学学报(自然科学版), 2009, 25(1): 59-64.
[9]Wang S, Tzeng D D. Methionine-riboflavin mixtures with surfactants and metal ions reduce powdery mildew infection in straw berry plants [J]. Journal of the American Society for Horticultural Science, 1998, 123(66): 987-991.
[10]钟小刚,薛应钰,梁巧兰,等.水杨酸和壳聚糖诱导苹果叶片对斑点落叶病抗性的研究[J].植物保护,2013,39(4):20-24.
[11]杜文超, 刘昌来, 董汉松. 外施核黄素诱导小麦对白粉病菌的抗性[J]. 华北农学报, 2011, 26(5): 230-233.
[12]裴冬丽, 丁锦平, 张庆深, 等. 核黄素诱导番茄幼苗抗白粉菌机理研究[J]. 河南师范大学学报(自然科学版), 2012, 40(5): 121-124.
[13]Kuzuya M, Hosoya K, Yashiro K, et al. Powdery mildew (Sphaerothecafuliginea) resistance in melon in selectable at the haploid level [J]. Journal of Experimental Botany, 2003, 54: 1069-1074.
[14]王建设, 唐晓薇, 孟淑春, 等. 甜瓜白粉病抗源鉴定与抗性遗传分析[J]. 华北农学报, 2002,17(3): 124-128.
[15]王建设, 陈杭. 甜瓜抗白粉病鉴定[J]. 华北农学报, 2000, 15(1): 125-128.
[16]庄霞, 马强, 刘晓燕. 青霉素处理苹果树腐烂病SOD、POD、PAL、PPO的变化[J]. 内蒙古农业科技, 2008(4): 54-56.
[17]Tian Shiping, Chan Zhulong. Potential of induced resistance in postharvest diseases control of fruits and vegetables [J]. Acta Phytopathologica Sinica, 2004, 34(5): 385-394.
[18]孙溶溶, 彭真, 程琳, 等. BTH诱导花椰菜对菌核病的抗性研究[J]. 植物病理学报, 2012, 42(3): 281-289.
[19]陈年来, 朱振家, 代春艳, 等. BTH诱导不同抗性水平甜瓜抗白粉病的效应[J]. 果树学报, 2010, 27(5): 764-769.
[20]岳东霞, 张要武, 张金林, 等. 水杨酸对黄瓜植株抗病酶系和白粉病抗性的诱导作用[J]. 河北农业大学学报, 2003, 26(4): 14-17.
[21]侯珲, 朱建兰, 周红平, 等. BTH和水杨酸(SA)对甜瓜抗白粉病的诱导作用[J]. 果树学报, 2006, 23(5): 736-739.
[22]Jordan C M, Wakeman R J, Devey J E. Toxicity of free riboflavin and methionine riboflavin solutions toPhytophthorainfestansand the reduction of potato late blight disease [J]. Canadian Journal of Microbiology, 1992, 38(11): 1108-1111.
[23]Taheri P, Hofte M. Riboflavin induces resistance in rice againstRhizoctoniasheath diseases by activating signal transduction pathways leading to upregulation of rice cationic; peroxidase and formation of lignin as a structural barrier [J]. Communications in Agricultural and Applied Biological Sciences, 2006, 71(1):255-258.
(责任编辑:田喆)
Resistance ofCucurbitapepoagainstPodosphaeraxanthiiinduced by chitosan and riboflavin
Dou Jianbing,Zhang Shuwu,Wang Weixiong,Liang Qiaolan,Xu Bingliang
(Pratacultural College of Gansu Agricultural University, Key Laboratory of Grassland Ecosystem Ministry of Education, Pratacultural Engineering Laboratory of Gansu Province, Sino-US Center for Grazingland Ecosystem Sustainability, Lanzhou730070, China)
The inhibitory and resistant effects ofCucurbitapepoagainst powdery mildew (Podosphaeraxanthii) were determined by different concentrations of chitosan and riboflavin through spraying method in this experiment. The results showed that the disease index was significantly lower than the control, and the disease indexes were only 7.10 and 8.14, respectively, after chitosan (400 μg/mL) and riboflavin (753 μg/mL) induction. However, the induced-resistance effects were stronger, which were 80.70% and 77.86%, respectively. The disease-resistance lasting period was 15 d. The induced physiological and biochemical index determination results showed that the POD, PAL and PPO activities were significantly higher than the control, and with the increase of time, the POD, PAL and PPO activities increased at first and then decreased. The maximum activities of POD, PAL and PPO were observed at the 3rd, 5th and 7th day after chitosan induction. The maximum activities of POD and PAL were observed at the 5th day, but maximum activities of PPO was observed at the 7th day after riboflavin induction.
chitosan;riboflavin;Podosphaeraxanthii;induced resistance
2014-12-21
2015-02-07
国家自然科学基金(31460518)
E-mail:xubl@gsau.edu.cn
S 436.42
A
10.3969/j.issn.0529-1542.2016.01.012

