中国成人糖尿病肾脏病临床诊断的专家共识
中华医学会内分泌学分会
中国成人糖尿病肾脏病临床诊断的专家共识
中华医学会内分泌学分会
【编者按】随着糖尿病管理水平的提高,糖尿病患者的预期寿命延长,这将使得很多与糖尿病病程有关的健康问题越来越突出,其中就包括糖尿病肾脏疾病。有资料显示,亚洲人群的肾脏在糖尿病面前似乎更加脆弱。中国医师协会内分泌代谢科医师分会在2013年发布了《2型糖尿病合并慢性肾脏病患者口服降糖药用药原则中国专家共识》,并在不久前进行了更新,中华医学会糖尿病学分会在2014年发布了《糖尿病肾病防治专家共识(2014年版)》,中华医学会内分泌学分会在2015年也发布了《中国成人糖尿病肾脏病临床诊断的专家共识》,足见糖尿病肾脏疾病正在得到更多的关注。
我国成人慢性肾脏疾病(chronic kidney disease,CKD)的总患病率为10.8%,因此同糖尿病一样,CKD已成为严重的公共卫生问题。糖尿病患者筛查白蛋白尿以知晓肾脏和心血管危险研究(DEMAND)显示,亚洲2型糖尿病患者中白蛋白尿的检出率为56%,高于白种人(41%)。若将白蛋白尿作为CKD的诊断标志之一,至少可以看出亚洲人2型糖尿病患者伴CKD并不少见,且超过白种人。我国目前CKD的首位病因是慢性肾小球肾炎,但糖尿病肾脏病(diabetic kidney disease,DKD)仍是CKD的重要病因。
虽然DKD的诊断存在一些问题,且目前我国尚缺乏全国性的DKD流行病学调查资料,但一些数据仍有重要参考价值,如2009年至2013年文献报道的我国社区2型糖尿病患者DKD患病率为10%~40%。糖尿病与心血管疾病行动研究(ADVANCE)已证实即使在相同的降糖、降压条件下,亚洲2型糖尿病患者总肾脏事件的发生风险比经济发达地区高出73%。我国DKD在终末期肾病(ESRD)中占16.4%。随着中国糖尿病患病率的攀升以及糖尿病管理水平的提高,患者寿命的延长,DKD未来可能会成为ESRD的首位病因。
由于相当部分内分泌/糖尿病医师对于CKD认识往往不足,当糖尿病伴CKD时,内分泌/糖尿病医师极易盲目地将其归因为DKD,而忽略了其他一些可能引起CKD的病因。糖尿病合并CKD时,肾脏损害的病因可能是DKD、非DKD(non-DKD)、DKD合并non-DKD。其中,糖尿病患者中non-DKD的患病率为16%~83%、DKD合并non-DKD的患病率为3%~46%。
2007年美国国家肾脏基金会(NKF)所属“肾脏病预后质量提议”(K/DOQI)工作组制定的糖尿病与CKD的临床诊断治疗指南,为了便于患者、医疗服务提供者和卫生政策制定者之间沟通与交流,同时与CKD分型匹配,将糖尿病导致的肾脏疾病命名为DKD,并建议用DKD代替传统专业术语糖尿病肾病(diabetic nephropathy,DN),而糖尿病肾小球病变(diabetic glomerulopathy,DG)这一病理诊断术语应当保留。DN侧重于病理诊断,大致与DG的概念相似。但本共识为了与国际指南一致,且强调糖尿病所导致的肾脏损害并不仅仅局限于肾小球,故采用术语DKD。
为规范我国DKD筛查与诊断,提高广大内分泌糖尿病医师对于DKD的认识,中华医学会内分泌学分会组织内分泌与肾脏病学相关专家制定了本共识。因此,本共识仅局限于内分泌糖尿病医师诊治的DKD患者,不讨论已转入肾病专科诊治的患者。
共识证据分级
参照美国糖尿病学会(ADA)证据分级标准。
DKD的定义
DKD系慢性高血糖所致的肾脏损害,病变可累及全肾,包括:肾小球、肾小管肾间质、肾血管等。临床上以持续性白蛋白尿和(或)肾小球滤过率(glomerular filtration rate,GFR)进行性下降为主要特征,可进展为ESRD。典型的肾脏形态学改变包括:肾小球基底膜增厚、系膜基质增宽、肾小球硬化、足细胞丢失;肾小管基底膜增厚、肾小管萎缩及细胞凋亡增加、肾间质炎性浸润、肾间质纤维化、管周毛细血管稀疏;出入球小动脉壁玻璃样变,尤以出球小动脉的玻璃样变更具特征性。
DKD的临床诊断思路
1.首先应明确糖尿病是否合并CKD
CKD诊断依据2012年改善全球肾脏病预后组织(KDIGO)发布的CKD评估与管理临床实践指南(表1)。

表1 KDIGO慢性肾脏疾病诊断标准
由于目前DKD的临床诊断缺乏特异性的标准和指标,当糖尿病患者合并CKD时,应考虑如下。
2.能否肯定高血糖与CKD的因果关系或者高血糖为CKD的起始病因
需结合患者病程、血糖控制情况、肾脏损害和肾脏功能下降程度、是否合并其他糖尿病微血管病变等情况进行综合评估。1型糖尿病患者病程在10年以上,对于大多数患者而言高血糖与CKD的因果关系可基本确立。因2型糖尿病患者诊断时机通常较晚,无法明确具体发病时间,且合并高血压、血脂紊乱、高尿酸、肥胖、风湿病及老年肾脏退行性变等其他肾脏损害的危险因素,甚至伴发原发性慢性肾小球肾炎,故通过病程确定高血糖与CKD的关系较困难。
3.是否存在糖尿病视网膜病变
无论1型还是2型糖尿病患者,如果合并糖尿病视网膜病变,则有利于DKD诊断。其中,增殖期糖尿病视网膜病变更具特异性。
4.是否存在non-DKD
临床中出现如下任意情况时,需考虑non-DKD:(1)病程较短(1型糖尿病<10年)或未合并糖尿病视网膜病变;(2)GFR较低或下降过快;(3)尿蛋白迅速增加或出现肾病综合征;(4)顽固性高血压;(5)出现活动性尿沉渣;(6)其他系统性疾病的症状或体征;(7)给予血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)治疗后2~3个月内GFR下降大于30%;(8)肾脏超声发现异常。
5.转诊问题
若患者不能满足DKD诊断条件时,建议仅诊断为糖尿病合并CKD,有困难时将患者转诊至肾脏专科,并由肾脏病专家进一步明确CKD病因。
DKD的临床诊断依据
至少具备以下1条:(1)能够肯定高血糖与CKD的因果关系或高血糖为CKD的起始病因或排除了non-DKD。(2)已有病理学诊断的支持:对于已行肾穿刺病理检查的患者,如存在糖尿病特征性的肾脏损害的病理学证据,DKD诊断可确立。
DKD肾脏受损的评估
当DKD的临床诊断确立后应进行全面的肾脏受损情况评估,评估内容为:
1.DKD肾小球受累的分期
分为临床分期与病理分期。(1)临床分期:对于DKD的临床分期推荐使用2012 年KDIGO发布的CKD评估与管理临床实践指南中提出的病因-肾小球滤过率-白蛋白尿(cause-GFR-albuminuria,CGA) 分期(表2)。GFR估算方法和尿白蛋白测定方法分别见附件1和附件2。诊断用G1~5、A1~3表示,G代表估计肾小球滤过率(eGFR)分期,A代表尿白蛋白排泄分期。其中,G1~2A2期且不合并糖尿病视网膜病变时,此时糖尿病患者尿白蛋白排泄的升高常由非肾脏因素所致,如血管内皮、血压、胰岛素抵抗、饮食及血糖等因素。G3a~5A1期DKD患者,即正常白蛋白尿DKD(normoalbuminuria diabetic kidney disease)患者,在1型和2型糖尿病患者中均占有一定比例。目前其发病机制尚不完全清楚,有限的研究资料显示患者肾脏病理改变呈现一定的异质性,典型的糖尿病肾小球病理改变在此类患者中较G3a~5A2~3期患者少见,而肾小管肾间质及血管病变(特别是动脉粥样硬化病变)反而更为常见,提示年龄、血压等其他因素也可能与之相关。(2)DKD肾小球病变病理分级:糖尿病伴DKD一般无需作病理诊断,若已获得肾脏穿刺活检标本,建议进行肾小球病理分级。推荐使用2010年肾脏病理学会(Renal Pathology Society,RPS)国际专家组制定的DKD肾小球病理分级标准,该分级系统适用于1型和2型糖尿病患者。RPS的DKD分级系统根据肾脏组织光镜、免疫荧光染色和电镜的改变,对DKD肾小球病变分为4级(表3)。
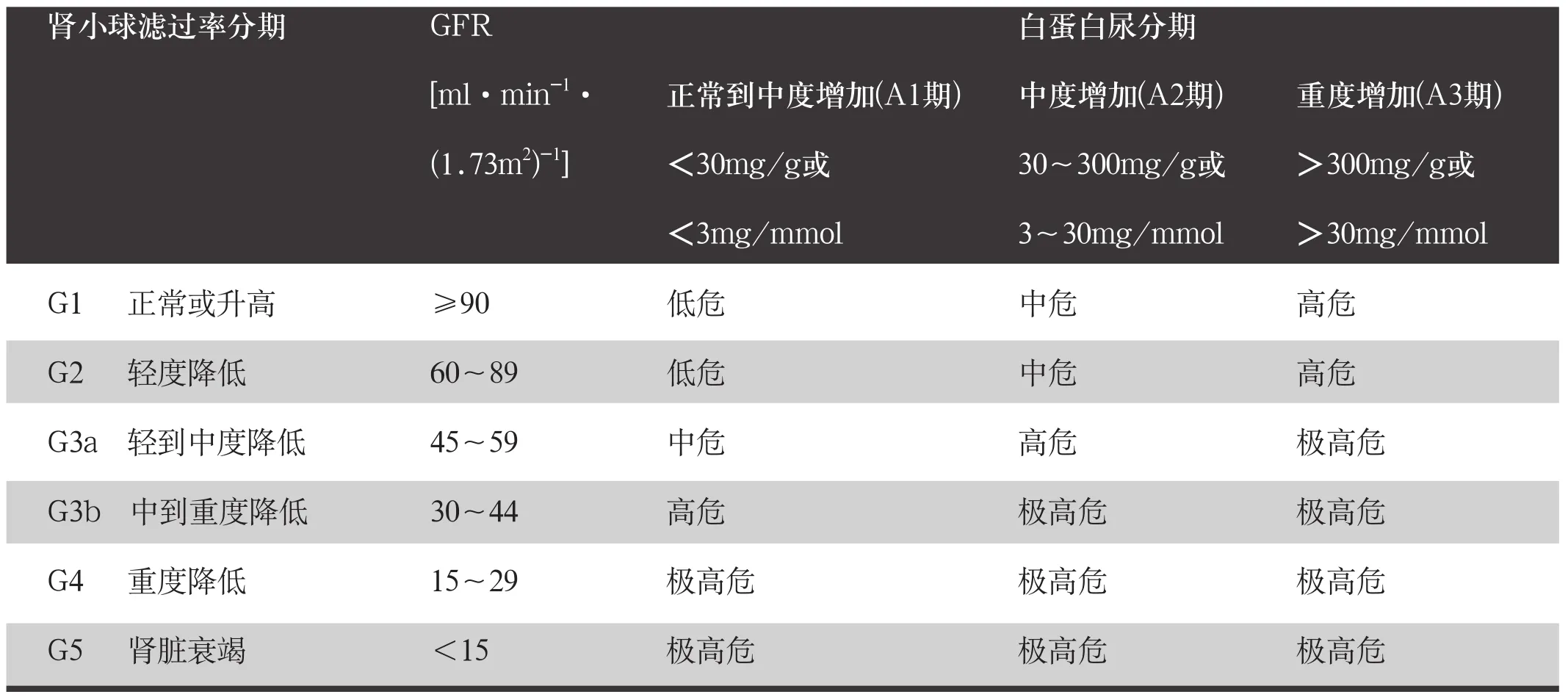
表2 2012年KDIGO CKD分期
2.DKD肾小管受累的临床评估
虽然DKD以肾小球系膜细胞病变为主,但也可累及肾小管肾间质。研究发现,肾小管间质病变与DKD肾脏功能恶化的相关性较肾小球病变更为密切;肾小管损伤在DKD早期即可出现,且可先于肾小球病变。因此推荐对DKD患者的肾小管受累情况也进行临床评估。可依据所在医院条件,选择如尿α1 微球蛋白(α1-MG)等指标检测。
3.肾脏形态评估
为了全面评估DKD同时排除non-DKD,推荐常规行肾脏的影像学检查评估肾脏形态。其中,以肾脏超声作为首选,其简单、无创,可有效评估肾脏大小、排除梗阻、肾盂肾炎、结石等其他临床情况。在DKD早期肾脏可因高灌注、高滤过而体积增大,随着病程的进展出现肾小球硬化时,肾脏会逐步缩小。在行肾脏影像学检查时应尽量避免使用造影剂。因糖尿病是造影剂肾病的危险因素,通常在普通人群造影剂肾病(RCN)的发生率<3%,而糖尿病患者为5%~10%,糖尿病合并CKD患者则高达20%~50%。若在充分权衡利弊的前提下,择期静脉应用含碘造影剂时,可通过如下策略减少RCN的发生:(1)选用等渗型或非离子型造影剂;(2)尽可能使用最低剂量;(3)检查前停用潜在肾毒性药物;(4)检查前、检查中及检查后充分水化。
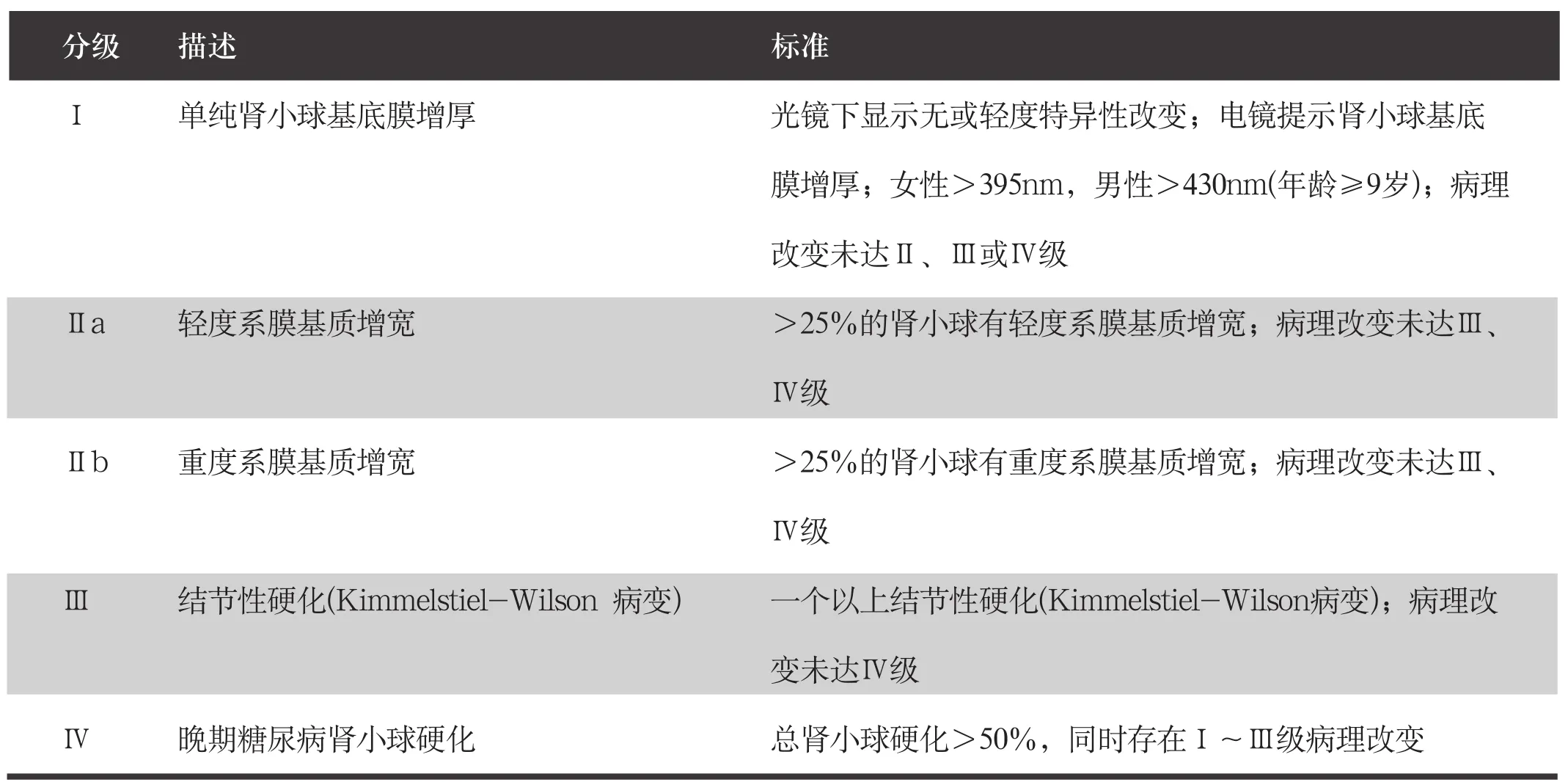
表3 2010年肾脏病理学会DKD肾小球病理分级标准
4.肾动脉评估
当患者出现顽固性高血压、服用ACEI或ARB后出现肾功能进行性下降时,需警惕存在肾动脉狭窄,肾动脉狭窄可造成肾血管性高血压和缺血性肾病。对于糖尿病合并CKD且怀疑肾动脉狭窄的患者应尽可能避免使用造影剂。对于此类患者,推荐选用核磁共振血管成像(MRA)和彩色双功能多普勒超声评估肾动脉狭窄情况。因卡托普利试验肾核素显像在GFR下降或双侧肾动脉狭窄的患者中诊断肾动脉狭窄的敏感度较低,故不推荐采用。有条件时也可尝试采用钆或二氧化碳等相对肾毒性小甚至无肾毒性的新型非碘造影剂进行血管造影。除非无可替代品,不推荐G5期患者使用含钆造影剂;G4~5期患者建议在予以大环螯合物的前提下方可使用。
5.其他损害
糖尿病还可对肾脏造成非特异的损害,如:与代谢相关的小动脉性肾硬化,与感染有关的肾盂肾炎、肾脓肿、肾周脓肿,与缺血有关的肾乳头坏死等。上述疾病并非糖尿病所特有,但在糖尿病患者中发生率较高、病情较重,在临床中也需警惕。
完整DKD临床诊断的建议
鉴于糖尿病的肾脏损害累及全肾,我们建议完整的DKD诊断应该包括:肾小球病变(临床分期参照2012年KDIGO指南,如诊断为G1A1)、肾小管病变、肾脏形态、肾血管四个方面。
DKD肾脏之外其他病变的评估
DKD常可出现其他血管病变,也会出现CKD的各种并发症,为了改善患者不良预后和减少患者病死率,故本共识推荐对DKD的肾外病变进行评估。
1.心脑血管疾病(CCVD)及风险
DKD患者CCVD风险明显高于单纯的糖尿病或non-DKD患者,同时CCVD也是DKD患者死亡的首要原因。对于DKD患者,至少每年评估一次CCVD风险,评估具体内容应包括:CCVD病史、年龄、有无CCVD危险因素(吸烟、脂代谢紊乱、糖代谢紊乱、高血压及家族史、腹型肥胖)、肾脏损害程度(尿白蛋白排泄率及GFR下降水平)、房颤(可致卒中)、颈动脉狭窄(可致卒中)。评估普通糖尿病患者CCVD病变的原则和方法在G1~4期患者中也同样适用,但DKD患者需使用造影剂时应充分权衡利弊。G5期患者存在活动受限,不建议使用平板运动心电图来评估冠心病,可选用影像学的药物负荷试验(多巴酚丁胺、潘生丁)。需注意的是评估CCVD的常用实验室指标(脑钠肽、肌钙蛋白等)和无创性检查(心电图负荷试验、超声心动图、核素显像等)在DKD患者中应用存在一定的局限性。
2.营养状态
由于厌食和消化功能紊乱,蛋白质、能量摄入不足以及内分泌代谢障碍,使DKD患者营养不良的发生率较高,同时营养状况也是影响DKD患者预后的重要因素之一。合理的评估和改善患者营养状况可减少患者不良预后的发生。我们推荐由营养师对患者的营养状态进行评估和监测。当GFR<60ml·min-1·(1.73m2)-1时,发生营养不良的风险明显增高,因此建议将此定为筛查的起始时机,监测频率应根据营养不良风险而定。DKD营养状态综合评定的内容如下:(1)人体测量:体重指数、肱三头肌皮褶厚度和上臂围等;(2)生化指标:血清白蛋白、前白蛋白、转铁蛋白等指标;(3)通过主观综合营养评估(SGA)量表评定,并给出SGA评分等级:A级:营养良好;B级:轻鄄中度营养不良;C级:重度营养不良。
3.当GFR<60ml·min-1·(1.73m2)-1时,还需对CCVD、营养不良以外的其他CKD并发症进行评估
包括代谢性酸中毒、电解质紊乱、贫血、慢性肾脏疾病-矿物质-骨代谢异常(CKD-MBD)、继发性甲状旁腺功能亢进等,具体评估指标、评估时机、监测频率详见表4。

表4 糖尿病患者CKD的管理
糖尿病患者CKD及DKD的早期筛查
所有糖尿病患者首次就诊时都应筛查CKD,如:尿沉渣、GFR、尿白蛋白与肌酐比值(ACR)与肾脏超声检查。
1.肾小球受累的早期筛查
(1)筛查时机:初始筛查的时机为:1型糖尿病患者病程≥5年;2型糖尿病患者确诊时。无CKD者每年1次筛查。(2)筛查指标:DKD筛查指标应包括:①任意时点的尿标本(清晨首次尿最佳)检测ACR评估尿白蛋白排泄;②测量血肌酐值,并计算eGFR。(3)注意事项:①尿白蛋白排泄受多种生理或病理因素的影响,如24h内的剧烈运动、长时间站立、感染(尤其是泌尿系统感染)、发热、慢性心力衰竭、血糖过高、血压过高、血脂过高等。如果在上述临床情况下进行尿白蛋白排泄的检测可造成假阳性结果。因此推荐在排除上述临床情况后,再筛查ACR。②推荐DKD的诊断或A分期应当以3~6个月内的2~3次ACR结果作为基础。
2.肾小管受累的早期筛查
(1)筛查时机:推荐对G3a~5A1期DKD患者,即尿白蛋白阴性的DKD患者,进行肾小管受累的筛查。(2)筛查指标:推荐采用任意时点(清晨首次尿最佳)尿标本测定α1-MG。文献中报道的临床评估指标包括:测定尿液中近端肾小管损害标志物α1-MG、β2微球蛋白(β2-MG)、视黄醇结合蛋白(RBP)、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾损伤分子1(Kim-1)、肝脏型脂肪酸结合蛋白(L-FABP)、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)及远端肾小管损害标志物心脏型脂肪酸结合蛋白(H-FABP)等。24h尿尿酸、钾、钠、氯、钙及磷也有参考价值。(3)注意事项:排除影响因素,依据2~3次结果判定。
3.肾脏血管受累的早期筛查
可使用彩色多普勒超声评估肾内血流动力学变化情况,测量肾微小动脉血流参数,包括:收缩期峰值血流速度(PSV)、舒张末期血流速度(EDV)、阻力指数(RI)、搏动指数(PI)等。
向肾脏专科转诊问题
DKD的首诊医师常为内分泌/糖尿病医师,因此明确DKD转诊至肾脏专科接受管理和治疗的时机显得尤为重要。推荐将患者转诊至肾脏专科的时机为:(1)糖尿病患者诊断DKD证据不足或怀疑糖尿病患者合并non-DKD时;(2)肾病综合征等大量蛋白量时;(3)患者出现明显CKD并发症,如贫血、继发性甲状旁腺功能亢进、CKD-MBD、电解质紊乱、代谢性酸中毒等,内分泌/糖尿病医师无法管理时;(4)疾病进入终末期,eGFR<30ml·min-1·(1.73m2)-1时。
共识内容的循证医学证据
为何DKD的诊断与糖尿病分型无关(E级)
DKD主要是糖尿病微血管病变在肾脏的表现,系慢性高血糖所致的肾脏损害。无论是1型糖尿病还是2型糖尿病导致的DKD,在临床和病理学特征存在极大的相似性,发病机制基本相似。再者,中国人DKD只是CKD的常见病因之一,无论是1型还是2型糖尿病所致DKD在CKD中的管理原则是相同的。因此,本共识中DKD的诊断与糖尿病分型并不相关。这样不仅便于临床应用,提高可操作性;同时统一的标准有利于科学研究、规范文献报道。
为何DKD证据不足时建议诊断CKD且必要时由肾脏病专家寻找CKD病因(E级)
DKD并不是CKD的唯一病因,其他一些常见的病因还包括:原发性肾小球肾炎、高血压肾小动脉硬化、慢性间质性肾炎、多囊肾等。其中,我国主要的CKD病因仍是原发性肾小球肾炎。当糖尿病患者出现CKD时,存在如下三种情况:(1)糖尿病合并non-DKD;(2)DKD;(3)DKD合并non-DKD。DKD的疾病发展、治疗原则及预后与non-DKD不完全相同。通常认为DKD疾病进程难以逆转,然而部分non-DKD经过治疗病情可缓解,因此及时识别并治疗这部分人群相当重要。鉴于内分泌/糖尿病医师对于non-DKD的诊治经验不及肾病专科医师丰富,因此将糖尿病合并肾脏损害原因不明的患者必要时转诊给肾病专科医师,让其接受专科诊断和管理对于患者的预后至关重要。
为什么DKD的肾小球病变需尿白蛋白排泄联合GFR进行评估(A级)
本共识推荐DKD肾小球病变选用尿白蛋白排泄联合GFR进行评估,主要是基于以下原因:(1)近年来随着研究不断深入,发现在DKD病程进展过程中,尿白蛋白的排泄增加程度与eGFR的下降水平并不完全平行。DKD患者在疾病早期,eGFR升高或处于正常范围时,尿白蛋白排泄率的增多可能已经存在。近年来正常白蛋白尿的DKD也受到了越来越多的关注。此类患者在尿白蛋白排泄正常的情况下,eGFR 却降至60ml·min-1·(1.73m2)-1以下,肾穿刺病理检查也发现了典型的糖尿病肾小球病变。有研究提示,若只选用尿白蛋白排泄率作为评估指标,20%~30%病程进展的DKD患者会被漏诊。因此,只有同时评估两项指标才能早期诊断并有效评估疾病进程。(2)白蛋白尿和eGFR两者均是肾脏疾病终点事件和CVD的独立危险因素,在一定程度上可评估DKD患者预后,因此推荐两项指标联合评估。
为什么要对肾小球之外的肾脏病变进行评估(B级)
虽然糖尿病肾脏损害的经典表现是肾小球,但是随着研究的深入,发现慢性高血糖的损害可以累及全肾,除肾小球损害外,还包括肾小管肾间质、肾脏内血管。有研究报道,在2型糖尿病DKD A2期患者中进行肾穿刺病理检查,40%的患者存在典型的糖尿病肾小球病变,30%肾脏结构接近正常,30%存在肾小管肾间质、血管、非典型糖尿病肾小球病变的肾小球硬化。
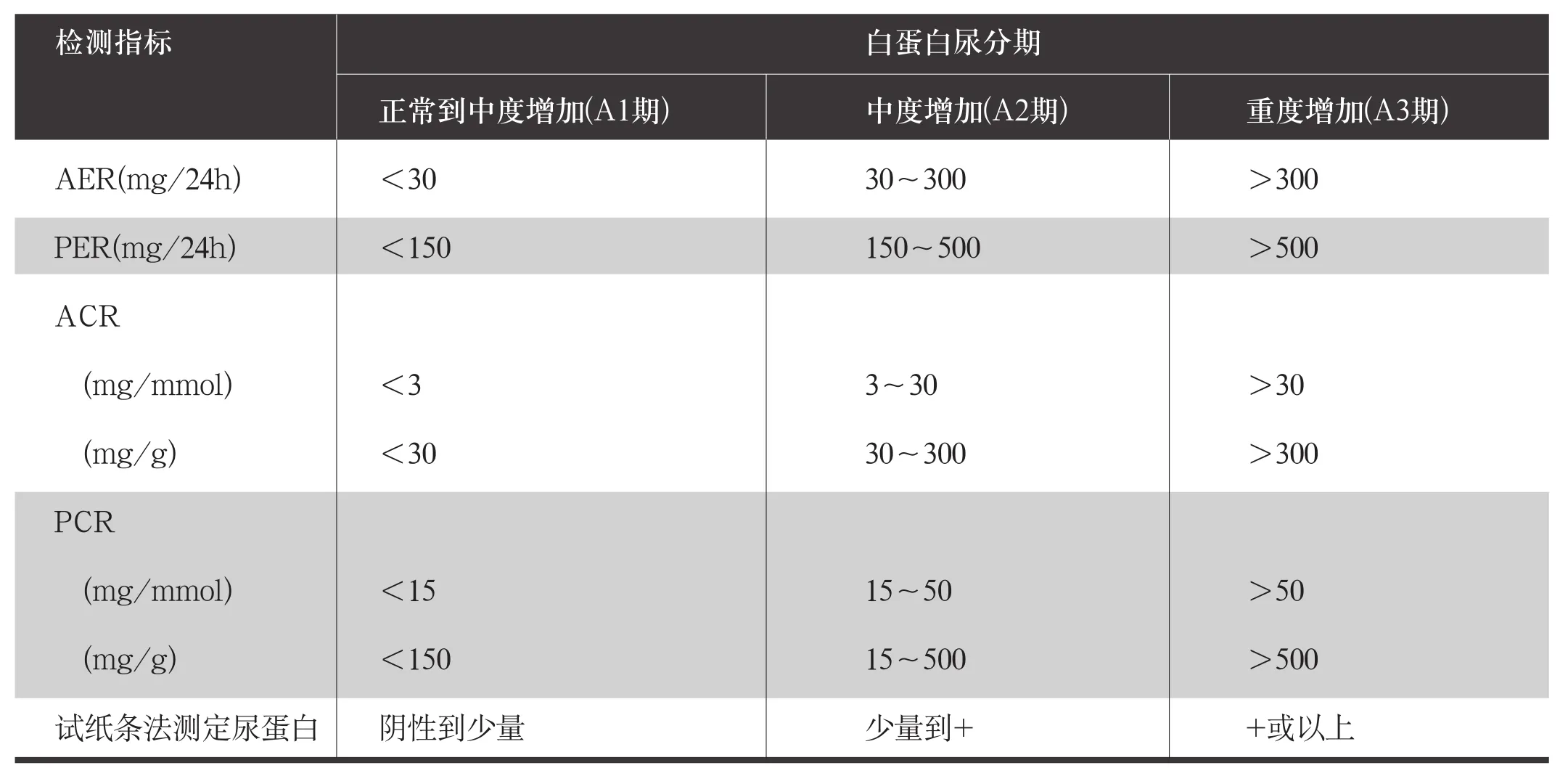
表5 白蛋白尿分期及其近似估算方法
何时采集尿标本测定尿白蛋白(A级)
尿白蛋白筛查方法有三种:(1)采集任意时点尿标本(清晨首次尿标本最佳),测定ACR。ACR是筛查DKD敏感性和特异性均较好的指标(敏感度和特异度均>85%),且标本采集方便,故本共识推荐使用ACR筛查尿白蛋白的排泄。有研究提示清晨首次尿液ACR不仅排除了体位性白蛋白尿或蛋白尿这一可能混杂因素的影响,还能更好地预测DKD的肾脏终点事件,因此本共识推荐在条件允许的情况下可尽量在空腹的情况下采集清晨首次尿标本测定ACR,其他任意时点收集尿标本时应当尽量在一天的同一时段并避免在2h内进食。(2)采集24h尿标本,测定尿白蛋白排泄率(AER)。24h尿标本收集极为不方便,而且并不能显著提高检测的准确度,故不推荐作为首选。不推荐测定尿白蛋白浓度作为DKD筛查指标,因为容易受身体水合状态或其他因素的影响。不推荐使用尿蛋白排泄率(PER)或尿蛋白肌酐比值(PCR)作为DKD筛查指标,因为肾病综合征水平(nephrotic range)的尿蛋白(AER>2200mg/24h、ACR>2200mg/g或220mg/mmol;PER>3000mg/24h、PCR>3000mg/g或300mg/mmol)在某些特殊的临床情况中(如肾小球肾炎)才具有意义,因此并不推荐使用PER或PCR作为DKD的筛查指标。表5显示AER与PER的分期与估算。

表6 尿白蛋白与肌酐比值(ACR)测定值的影响因素
为什么早期筛查时一次ACR测定不可靠(A级)
本共识推荐DKD的诊断或A分期应当以3~6个月内的2~3次ACR检测结果作为基础。早期筛查一次ACR不可靠的原因:(1)尿白蛋白的排泄(urine albumin excretion,UAE)存在生理波动,个体内存在的变异系数(intraindividual coefficient of variation) 约为40%。(2)多种生理或病理因素可引起UAE检测结果呈假阳性,如24h内的剧烈运动、长时间站立、感染(尤其是泌尿系统感染)、发热、慢性心力衰竭、血糖过高、血压过高、血脂过高等。然而,上述临床情况常常被临床医师忽略,在未排除上述情况下即行ACR检查。表6详细列举了影响ACR测定的影响因素。

附件1 GFR估算公式推荐
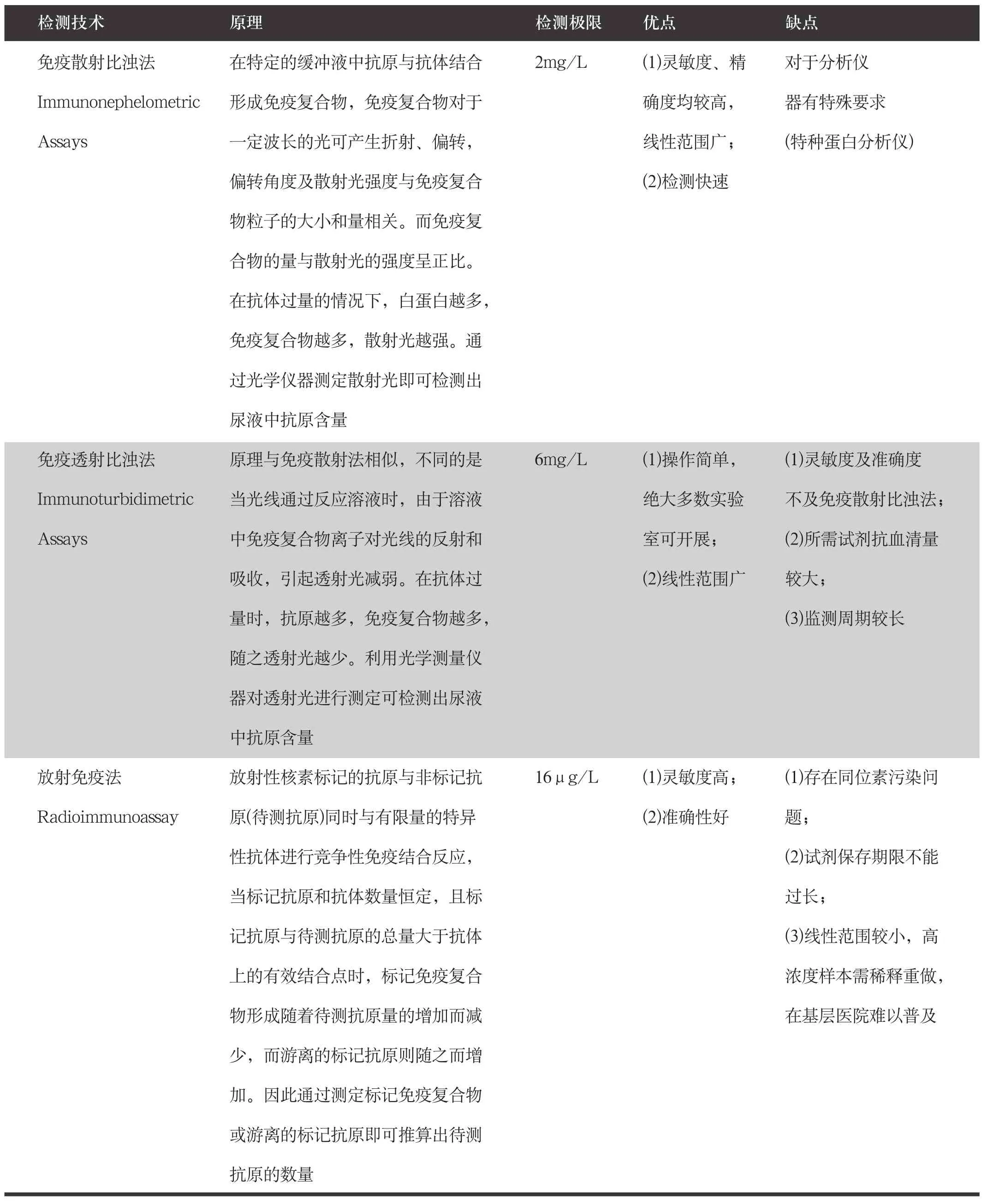
附件2 尿白蛋白测定方法推荐
10.3969/j.issn.1672-7851.2016.06.003

