超高效液相色谱-串联质谱法检测水稻和土壤中氟唑菌酰胺的残留及消解动态
路彩红, 杨 林, 申流柱, 刘 路,姚 赛, 吴 希, 张 盈, 段婷婷*
(1. 贵州省毕节市农产品质量安全监督检验测试中心, 毕节 551700;2. 贵州省农业科学院植物保护研究所, 贵阳 550006)
超高效液相色谱-串联质谱法检测水稻和土壤中氟唑菌酰胺的残留及消解动态
路彩红1,杨林1,申流柱1,刘路1,姚赛1,吴希1,张盈2,段婷婷2*
(1. 贵州省毕节市农产品质量安全监督检验测试中心, 毕节551700;2. 贵州省农业科学院植物保护研究所, 贵阳550006)
本文采用QuEChERS方法,建立了超高效液相色谱-串联质谱(UPLC-MS/MS)快速测定氟唑菌酰胺在水稻糙米、水稻壳、水稻植株、稻田水和土壤样品中的残留分析方法。样品经乙腈提取,十八烷基硅烷键合硅胶(C18)、石墨化炭黑(GCB)和N-丙基乙二胺(PSA)净化后采用外标法进行定量分析。添加浓度为0.1、0.5和1 mg/kg时,氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的平均回收率为82.7%~111.7%,变异系数为1.6%~13.0%,氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的最低检出浓度LOQs 分别是18.89、2.85、10.27、30.21和3.21 μg/kg。该方法的准确度和精密度等均符合农药残留分析的要求。田间试验结果表明,氟唑菌酰胺在水稻植株中的消解动态符合一级动力学方程,安徽、广西和北京三地的水稻植株上的消解半衰期分别为2.5、3.8和9.9 d,表明氟唑菌酰胺属于易降解农药。
氟唑菌酰胺;水稻;土壤;UPLC-MS/MS;残留
氟唑菌酰胺(fluxapyroxad)化学名称3-(二氟甲基)-1-甲基-N-(3′,4′,5′-三氟[1,1′-联苯]-2-基)-1H-吡唑-4-甲酰胺,分子式C18H12F5N3O,分子量381.3,化学结构式见图1。氟唑菌酰胺属于羧酰胺类化合物,其作用方式是对线粒体呼吸链的复合物Ⅱ中的琥珀酸脱氢酶起抑制作用,从而抑制靶标真菌的孢子萌发,芽管和菌丝体生长。田间试验表明其对小粒谷物、蔬菜和大豆等多种作物上的真菌病害表现出高的选择性和极好的预防和治疗作用[1],可广泛用于谷物、水果和蔬菜等多种作物[2-3]。目前,仅欧盟制定氟唑菌酰胺在稻米上的最大残留限量值(MRL)是0.01 mg/kg,我国尚未建立相关MRL值。因此研究氟唑菌酰胺在水稻上的残留分析方法对该农药在我国残留限量标准的制定和保证食品安全具有重要意义。
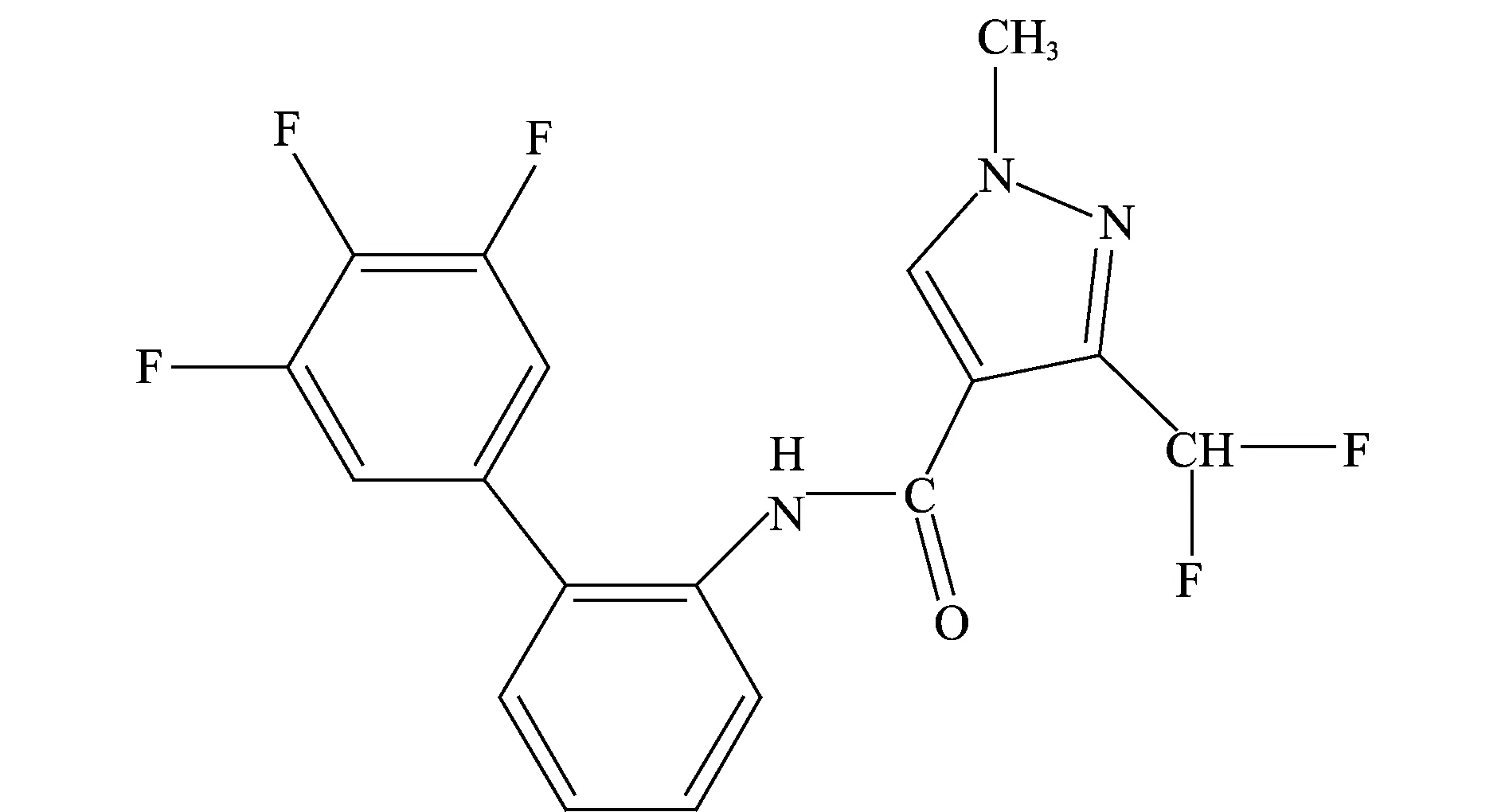
图1 氟唑菌酰胺的化学结构式Fig.1 Chemical structure of fluxapyroxad
刘磊等采用固相萃取净化,高效液相色谱法检测草莓中的氟唑菌酰胺残留量[4];Dong等建立了氟唑菌酰胺在谷物(稻米和小麦)、水果和蔬菜中的残留分析方法,但仅报道了氟唑菌酰胺在稻米中的残留分析方法[5]。除此之外,目前尚未见其他氟唑菌酰胺残留量测定方法研究的报道,且氟唑菌酰胺在水稻上的消解动态研究,亦是空白。
本文建立了QuEChERS-UPLC-MS/MS检测氟唑菌酰胺在水稻植株、稻壳、糙米、土壤和稻田水样品中的残留分析方法。该方法操作快捷简便,能有效地去除干扰,提高灵敏度,且定性定量准确,能完全满足氟唑菌酰胺在水稻植株、稻壳、糙米、土壤和稻田水中残留量的快速检测和确证。同时应用该方法进一步研究了12%氟菌·氟环唑乳油在水稻植株中的消解,为该农药在水稻上的合理使用提供科学依据。
1 材料与方法
1.1仪器和试剂
三重四极杆串联质谱联用仪(Acquity UPLC-TQD,美国Waters 公司);Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm;Milford,MA,USA);XW-80A漩涡混合器(美国Scientific Industries公司);L550离心机(湖南湘仪离心机仪器有限公司)。
氟唑菌酰胺标准品(97.5%)及12% 氟菌·氟环唑乳油来自巴斯夫(中国)有限公司; C18粉末(40 μm)、N-丙基乙二胺(PSA,40 μm)和石墨化炭黑(GCB,40 μm)购自天津博纳艾杰尔科技有限公司;乙腈(色谱纯,美国Honeywell International公司);NaCl和无水MgSO4均为分析纯。
1.2田间试验设计
参照《农药残留试验准则》(NY/T 788-2004)[6],于2013年分别在广西、安徽和北京三地进行12%氟菌·氟环唑乳油在水稻植株上的残留消解动态试验。于水稻采收期,采用兑水喷雾方式喷施药剂1次,剂量为90 mL/667 m2(有效成分162 g/hm2,为推荐最高剂量的1.5倍)。每处理小区面积30 m2,灌水深度4~6 cm,重复3次,小区随机排列,另设清水空白对照区,小区之间设保护带。分别于喷药前、喷药后2 h、1、2、4、7、14、21、28 d取水稻植株样品。稻田水、土壤、糙米和稻壳在空白对照区取样。在每个试验小区内随机选6~12个采样点采集水稻植株和稻穗不少于2.0 kg,水稻植株切碎混匀,稻穗研磨后使稻壳和糙米分离,四分法留样500 g。土壤和水样本的采集:空白区随机取点5~10个,用干净矿泉水瓶灌装水样品1 000~2 000 mL,用土钻采集0~10 cm的土壤1~2 kg,除去水和土壤中的碎石、杂草和植物根茎等杂物,混匀后四分法留样500 g,-20℃低温冷冻保存待测,其余样品抛弃。小区边行和每行距离两端0.5 m内不采样。
1.3分析步骤
1.3.1标准品的配制
称取适量标准品用色谱纯乙腈溶解,得100 mg/L的氟唑菌酰胺储备液,并用乙腈稀释配制成1、0.5、0.1、0.05、0.01 mg/L的系列标准品溶液。于-20℃低温冷冻保存待测。3个月后,经优化后的检测条件测试,标准溶液未降解。
1.3.2样品前处理
(1) 水稻植株、土壤、糙米和稻壳:准确称取植株和稻壳样品各5 g,土壤和糙米样品各10 g于50 mL聚四氟乙烯离心管中,加入5 mL超纯水,再加入10 mL乙腈,然后振荡10 min,随后在植株、稻壳样品中加入3 g无水硫酸镁和2 g氯化钠,土壤、糙米样品中加入4 g无水硫酸镁和1 g氯化钠,迅速剧烈振荡3 min, 4 000 r/min离心5 min,移取1.5 mL上清液加入装有净化剂(土壤和糙米为150 mg无水硫酸镁、30 mg C18和10 mg GCB;稻壳为150 mg无水硫酸镁和50 mg C18;水稻植株为150 mg无水硫酸镁和50 mg PSA)的2 mL微型离心管中,涡旋1 min, 5 000 r/min离心5 min,上清液经0.22 μm有机滤膜过滤到进样小瓶中, 贮存于-20℃待测。
(2) 稻田水:准确吸取10 mL稻田水于50 mL聚四氟乙烯离心管中,加入10 mL乙腈,振荡10 min,加入4 g无水硫酸镁,1 g氯化钠,迅速剧烈振荡3 min, 4 000 r/min离心5 min,取1.5 mL上清液,加入装有150 mg无水硫酸镁和30 mg C18的2 mL微型离心管中,涡旋1 min,在5 000 r/min离心5 min,上清液经0.22 μm有机滤膜过滤到进样小瓶中, 贮存于-20℃待测。
1.4仪器测定条件
采用超高效液相色谱-串联质谱,三重四级杆检测器测定。Acquity UPLC BEH C18色谱柱,柱温45℃,进样体积3 μL。采用二元梯度洗脱分离,以0.2%甲酸水溶液(A)和乙腈(B)为流动相,梯度洗脱条件为:0~0.5 min,10%~60% A;0.5~1.8 min,60%~90% A;1.8~2.0 min,90%~10% A;2.0~4.0 min,10% A;流速0.3 mL/min。
质谱条件为:电喷雾离子源,负离子电离模式(ESI-);毛细管电压3.0 kV, 离子源温度120℃,去溶剂气温度 350℃,去溶剂气流量为600 L/h,锥孔反吹气50 L/h,锥孔电压44 V。采用多反应检测模式(MRM)。以保留时间和两个离子对380 >131(碰撞电压24 eV)及380 > 248(碰撞电压21 eV)进行定性分析,以母离子和响应值最高的子离子组成的离子对380 >131进行定量分析。氟唑菌酰胺的保留时间为2.68 min。
2 结果与分析
2.1检测条件的优化
在电喷雾离子源下,将0.5 mg/L氟唑菌酰胺标准溶液在100~500 m/z内扫描,根据其化学结构式判断,选正离子和负离子电离模式,只获得特征离子峰[M-H]-,进一步选择合适的监测离子和碰撞能量等质谱参数,最终选择的检测条件如“1.4节”。由图2a可以看出,在此条件下标准溶液的峰形及重现性较好,灵敏度较高。按照“1.3节”的前处理方法处理样品,水稻植株中氟唑菌酰胺的色谱图见图2。

图2 氟唑菌酰胺标准溶液及氟唑菌酰胺在水稻植株中的色谱图Fig.2 Chromatograms of standard fluxapyroxad solution and fluxapyroxad in rice plants
2.2提取溶剂及净化剂的选择
提取溶剂的选择:由于糙米、水稻植株和稻壳的基质组分比较复杂,甲醇提取物含有太多杂质,将有可能干扰目标色谱峰,故采用乙腈作为提取溶剂。
样品净化过程净化剂的选择:首先选用了主要用于反相萃取的C18和主要用于正相萃取的PSA两种典型的净化剂。C18主要用于从极性样品中去除非极性和中等极性化合物;而PSA由于具有较弱的阴离子交换功能,主要用于吸附非极性样品中有机酸、糖类和脂肪等化合物[5,7]。用30 mg C18净化糙米、土壤和水中的氟唑菌酰胺(添加水平为0.1 mg/kg)时,除水中氟唑菌酰胺能获得满意的平均回收率外,在糙米和土壤这两种基质中氟唑菌酰胺的平均回收率均小于70%,且糙米提取液颜色非常浑浊,初步判断是因疏水性的化合物如色素等没有被完全吸附,这样的提取液如果批量进样会缩短仪器寿命。GCB是一种弱极性或非极性吸附剂,可以去除基质中疏水性化合物如叶绿素等杂质,因此在选用30 mg C18的基础上,添加10 mg 的GCB来净化糙米和土壤样品。试验结果证明,以30 mg C18和10 mg GCB为净化剂,糙米和土壤中的氟唑菌酰胺可以获得满意的回收率,且糙米提取液的颜色明显清澈。由于粉碎后的稻壳具有较大的体积,初步选用了50 mg C18作为净化剂,试验结果也获得了满意的回收率。由于水稻植株样品中有较多的色素、有机酸、糖类和酚类等,选用对这些阴离子化合物具有很好的保留作用,且本身对于一些极性色素和糖类具有强亲和力和高容量的PSA来去除,可获得满意的分析结果。
2.3方法的线性
按照“1.4节”确定的检测条件, 对浓度为0.01、0.05、0.1、0.5、1.0 mg/L的氟唑菌酰胺标准溶液进行色谱分析,以峰面积为纵坐标(Y),进样浓度为横坐标(X),进行线性回归,结果显示,在 0.01~1.0 mg/L的范围内线性关系良好,线性方程为Y=128 150X+3 399.4,相关系数r=0.997 3。进一步配制系列相同浓度的基质匹配标准溶液来评估方法的线性相关性,通过基质匹配标准溶液与溶剂标准溶液得出的标准曲线的斜率比判定基质效应,结果证明斜率比在90%~110%之间,可判定无基质效应[8-9]。本研究采用溶剂标准曲线法直接进行样品定量。
2.4方法的准确度、精密度和灵敏度
本研究采用添加回收率和相应的变异系数来衡量方法的准确度和精密度。在水稻植株、土壤、糙米、稻壳和稻田水中分别添加0.1、0.5、1.0 mg/kg的氟唑菌酰胺,每个水平重复5次。由表1结果可知,氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的平均回收率范围是82.7%~111.7%,变异系数为1.6%~13.0%,符合残留量测定的要求[6,10]。
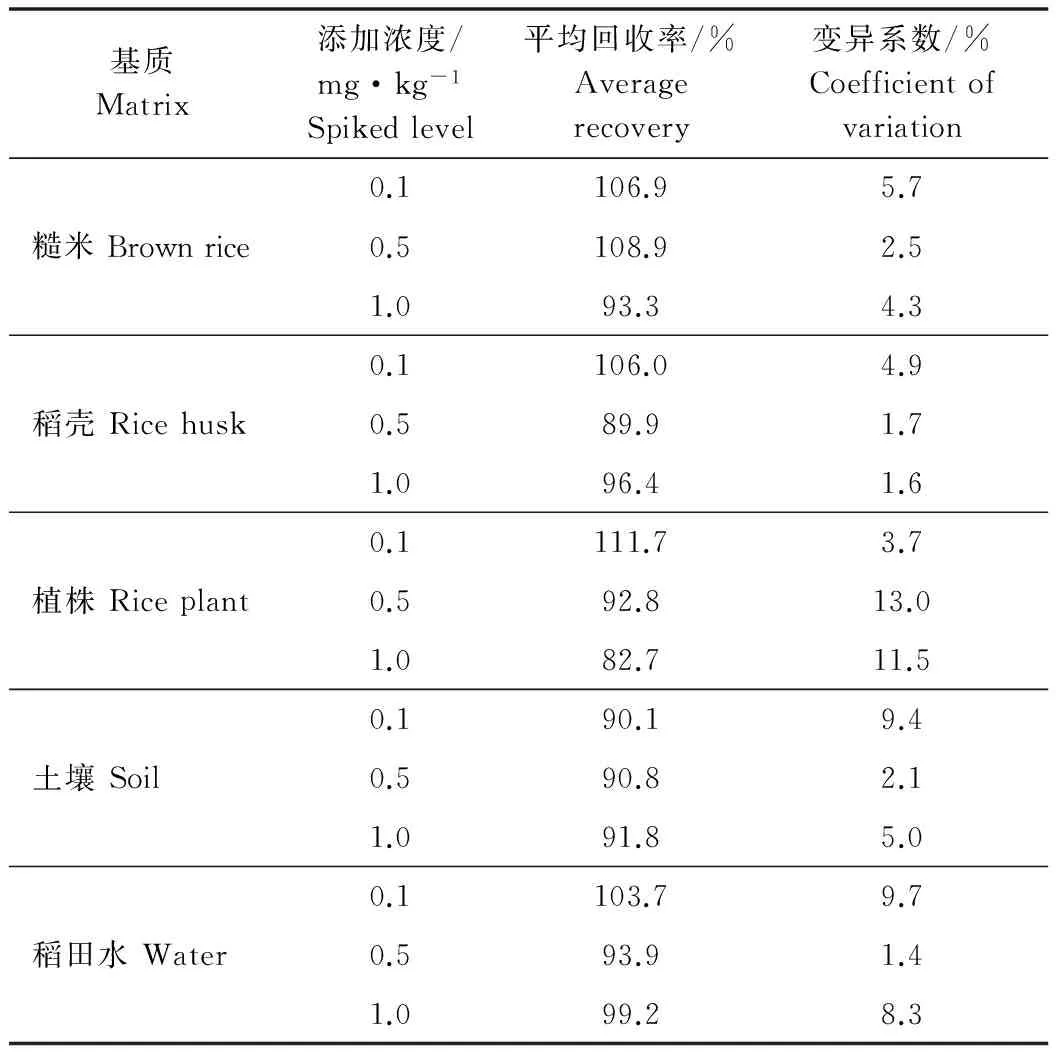
表1 氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的添加回收率及变异系数(n=5)
方法的LOD和LOQ分别以添加回收试验的最低添加水平0.1 mg/kg的色谱图中信噪比(S/N)的3倍和10倍确定,得出氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的LODs分别是5.67、0.86、3.08、9.06和0.96 μg/kg,最低检出浓度LOQs 分别是18.89、2.85、10.27、30.21和3.21 μg/kg。
2.5氟唑菌酰胺在水稻植株中的消解动态
田间试验结果显示,氟唑菌酰胺在北京、安徽和广西三地水稻植株上的原始沉积量分别为1.58、1.67和2.43 mg/kg。随时间的延长氟唑菌酰胺的残留量逐渐下降,水稻植株上的氟唑菌酰胺的残留量与施药后间隔时间呈指数关系,C=AeBt。从氟唑菌酰胺在水稻植株中消解动态方程和相关参数(表2)可知,氟唑菌酰胺在安徽、广西和北京三地水稻植株中的半衰期分别是2.5、3.8和9.9 d,表明氟唑菌酰胺属于易降解农药(t1/2<30 d)。从氟唑菌酰胺在水稻植株上的消解动态曲线(图3)可知,安徽和广西的消解情况较为一致,北京的消解时间较长,这可能与北京的气候有关。
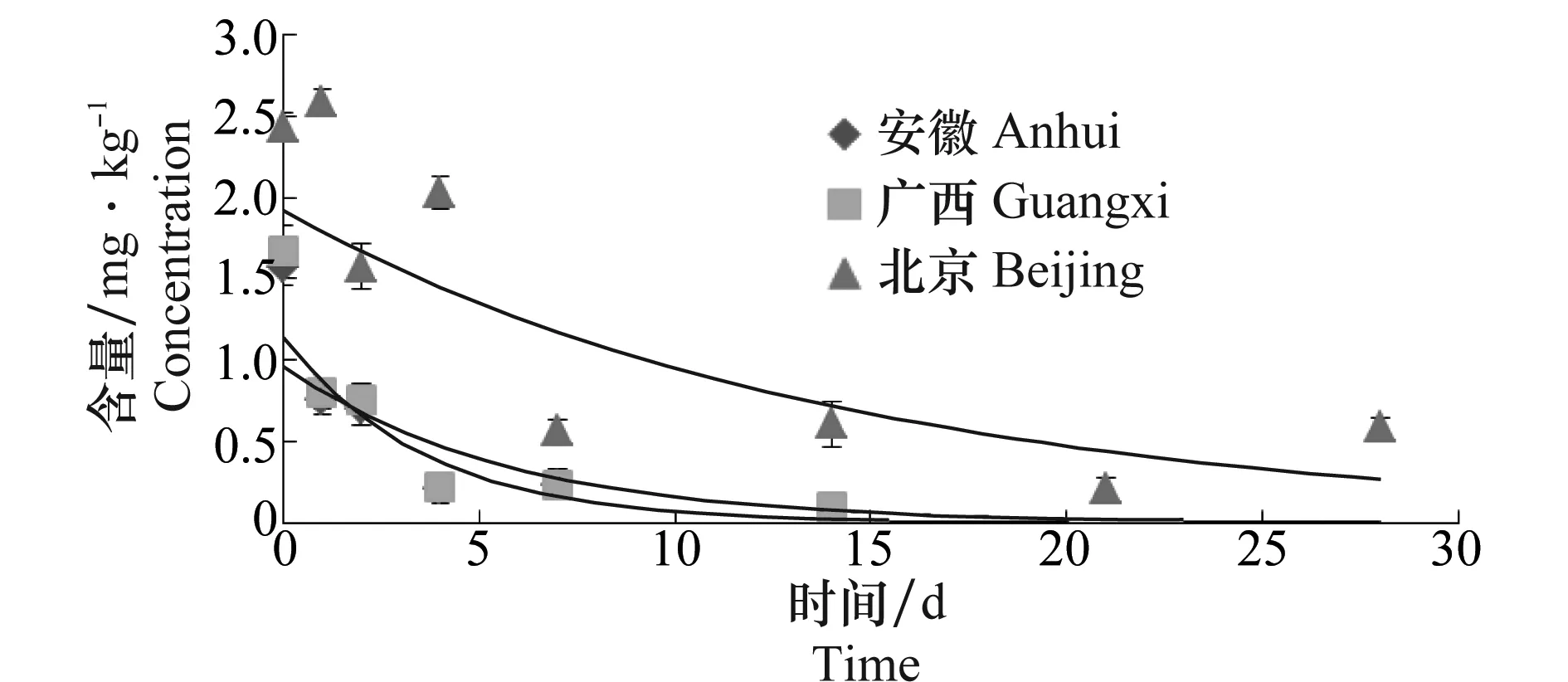
图3 氟唑菌酰胺在水稻植株上的消解动态曲线Fig.3 Dynamic curve of fluxapyroxad in rice plants
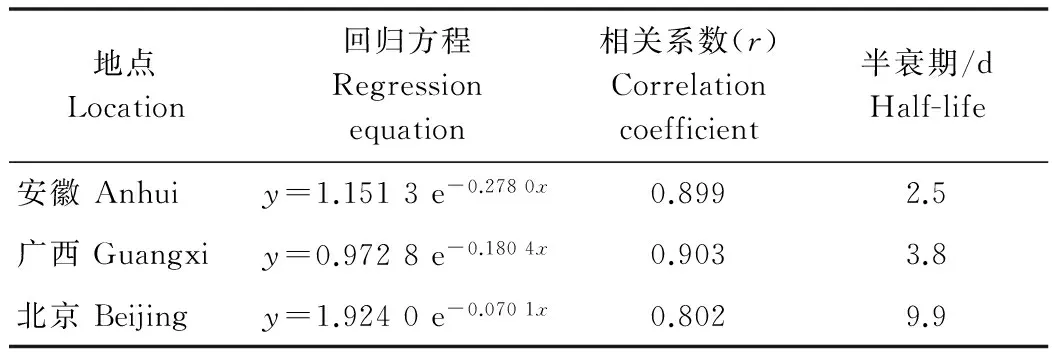
地点Location回归方程Regressionequation相关系数(r)Correlationcoefficient半衰期/dHalf-life安徽Anhuiy=1.1513e-0.2780x0.8992.5广西Guangxiy=0.9728e-0.1804x0.9033.8北京Beijingy=1.9240e-0.0701x0.8029.9
3 结论
本研究在QuEChERS方法基础上,建立了采用UPLC-MS/MS分析水稻植株、土壤、糙米、稻壳和稻田水中的氟唑菌酰胺残留的分析方法。氟唑菌酰胺在水稻植株、土壤、糙米、稻壳和稻田水中的平均回收率范围是82.7%~111.7%,变异系数为1.6%~13.0%,LODs分别是5.67、0.86、3.08、9.06和0.96 μg/kg,最低检出浓度LOQs 分别是18.89、2.85、10.27、30.21和3.21 μg/kg。结果表明该方法杂质干扰小,有良好的线性、准确性、精密度和较低的检测限。12%氟菌·氟环唑乳油在水稻植株上的残留消解动态试验表明,氟唑菌酰胺在安徽、广西和北京三地水稻植株中的半衰期分别是2.5、3.8和9.9 d,表明氟唑菌酰胺降解较快。
[1]邓金保. 巴斯夫的新杀菌剂fluxapyroxad及它的一些复配制剂在欧美获登记[J]. 农药市场信息, 2012(28): 37-38.
[2]Vicentini C B, Romagnoli C, Andreotti E, et al. Synthetic pyrazole derivatives as growth inhibitors of some phytopathogenic fungi [J]. Journal of Agricultural and Food Chemistry, 2007, 55(25): 10331-10338.
[3]Nagahori H, Yoshino H, Tomigahara Y, et al. Metabolism of furametpyr. 1. Identification of metabolites andinvitrobiotransformation in rats and humans [J]. Journal of Agricultural and Food Chemistry,2000, 48(11): 5754-5759.
[4]刘磊, 邵辉, 李辉, 等. 固相萃取-高效液相色谱法测定草莓中氟唑菌酰胺残留量[J]. 农药, 2014, 53(11): 818-820.
[5]Dong Fengshou, Chen Xiu, Liu Xingang, et al. Simultaneous determination of five pyrazole fungicides in cereals, vegetables and fruits using liquid chromatography/tandem mass spectrometry [J].Journal of Chromatography A, 2012, 1262: 98-106.
[6]中华人民共和国农业部. NY/T 788-2004, 农药残留试验准则[S]. 北京: 中国标准出版社,2004.
[7]Liu Xingang, Xu Jun, Dong Fengshou, et al. Residue analysis of four diacylhydrazine insecticides in fruits and vegetables by Quick, Easy, Cheap, Effective, Rugged, and Safe (QuEChERS) method using ultra-performance liquid chromatography coupled to tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2011, 401(3): 1051-1058.
[8]张雯雯,徐军,张盈,等.超高效液相色谱-串联质谱法检测棉花和土壤中呋虫胺残留[J].植物保护,2015,41(2):125-129.
[9]Li Yuanbo, Dong Fengshou, Liu Xingang, et al. Simultaneous enantioselective determination of triazole fungicides in soil and water by chiral liquid chromatography/tandem mass spectrometry [J]. Journal of Chromatography A, 2012, 1224: 51-60.
[10]农业部农药检定所.农药残留实用检测方法手册(第三卷)[M].北京:中国农业出版社, 2005: 385-387.
(责任编辑:杨明丽)
Residues and degradation determination of fluxapyroxad in rice and soil by UPLC-MS/MS
Lu Caihong1,Yang Lin1,Shen Liuzhu1,Liu Lu1,Yao Sai1,Wu Xi1,Zhang Ying2,Duan Tingting2
(1. Bijie Supervision and Testing Center of Agricultural Products Quality & Safety, Guizhou551700, China;2. Institute of Plant Protection, Guizhou Academy of Agricultural Sciences,Guiyang550006,China)
A rapid, highly sensitive and selective method was developed for determination of fluxapyroxad by QuEChERS coupled with ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The target compound was extracted with acetonitrile, and cleaned up with primary secondary amine (PSA), graphitized carbon black (GCB) or octadecylsilane (C18). Average recoveries for rice plant, paddy soil, brown rice, rice hull and water at three spike levels (0.1, 0.5 and 1.0 mg/kg) ranged from 82.7% to 111.7% with coefficients of variation of 1.6% to 13.0%, and the limit of quantifications (LOQs) were 18.89, 2.85, 10.27, 30.21 and 3.21 μg/kg, respectively. Therefore, the established method was suitable for the determination of fluxapyroxad residues in rice. The field experiments demonstrated that the degradation of fluxapyroxad in rice plant was conformed to the first-order dynamic equation. The results showed that the half-lives of fluxapyroxad were 2.5, 3.8 and 9.9 days in rice plants from Anhui, Guangxi and Beijing, indicating that fluxapyroxad was easily degradable in the rice eco-system.
fluxapyroxad;rice;soil;UPLC-MS/MS;residue
2015-07-12
2015-09-06
贵州省自然科学基金([2015]2101号)
E-mail:gzdtt@126.com
S 481.8
A
10.3969/j.issn.0529-1542.2016.04.021

