桔梗糖蛋白的组成分析和对·OH的清除作用的研究
廉亚楠,果婷婷,崔 琳,赵胜男,林雪燕,郑晓凤,高金波
(佳木斯大学药学院,黑龙江佳木斯 154007)
桔梗糖蛋白的组成分析和对·OH的清除作用的研究
廉亚楠,果婷婷,崔琳,赵胜男,林雪燕,郑晓凤,高金波*
(佳木斯大学药学院,黑龙江佳木斯 154007)
分离纯化经超临界CO2辅助提取的桔梗糖蛋白,确定其单糖及氨基酸组成,考察其对·OH自由基的清除作用。以DEAE-52纤维素柱及Sephadex G-75柱分离纯化桔梗糖蛋白,分别利用PMP法柱前衍生和OPA-FMOC联合衍生测定糖蛋白中单糖和氨基酸的种类与组成,分光光度法检测桔梗糖蛋白对·OH自由基的清除作用。结果显示:桔梗糖蛋白主要由7种单糖及15种氨基酸组成,平均糖含量为61.82%,蛋白含量为33.11%,对·OH的清除能力的IC50值为0.99 mg/mL。由此表明:桔梗糖蛋白具有一定的抗氧化能力,为其用于功能食品、药物制造等方面发展提供理论依据。
桔梗,糖蛋白,组成分析
桔梗为桔梗科(Campanulaceae)植物桔梗(Platycodongrandiflorum(Jacq.)A. DC.)的根,别名铃铛花、僧冠帽等,是兼食、观赏、药用的珍稀经济植物[1-2]。桔梗性平、味苦、辛,具有化痰止咳、利咽开音等功效,桔梗药用最早见于《神农本草经》[3-4]。研究表明,桔梗主要含有蛋白质、桔梗总皂苷,还含有多聚糖、甾醇类及其糖苷、脂肪油、脂肪酸等成分[5]。糖蛋白(glycoprotein)是由寡糖和多肽链共价修饰连接而形成的一类重要生理活性物质,它广泛存在于植物、动物体内[6-7]。近年来从植物中分离的糖蛋白日益增多[8],由于糖蛋白的种属专一性,不同植物的糖蛋白具有不同特性,所以本文利用无污染的超临界CO2萃取技术对桔梗进行预处理,再采用超声波辅助水提醇沉法提取其中的桔梗糖蛋白(Platycodongrandiflorumglycoprotein,PGP),再经DEAE-52纤维素柱[9]和Sephadex G-75[10]葡聚糖凝胶柱进行分离纯化,获得了较为纯净的PGP,并对其单糖和氨基酸的组成进行了分析,考察了它对·OH自由基的清除作用,欲为今后的进一步研究提供理论依据。
1 材料与方法
1.1材料与仪器
桔梗购于佳木斯药店,安国市振宇中药材饮片有限公司,批号2013814,50 ℃烘干粉碎,过筛,收集备用;D-甘露糖(Man),D-(+)半乳糖醛酸(GalUA),D-(+)葡萄糖醛酸(GlcUA),D-阿拉伯糖(Ara)上海蓝季科技发展有限公司;D-半乳糖(Gal),L(+)-鼠李糖(Rha)北京化学试剂公司;D-木糖(Xyl),葡萄糖(Glc),D-核糖(Rib),岩藻糖(Fuc)上海华精生物高科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)天津市光复精细化工研究所;邻苯二甲醛(OPA)化学纯,中国五联化工厂;9-芴甲基甲酸酯(FMOC)、DEAE-52纤维素上海源叶生物科技有限公司;Sephadex G-75葡聚糖凝胶上海金穗生物科技有限公司。18种氨基酸,纯度:HPLC≥99%,上海源叶生物科技有限公司。
Agilent 1100型高效液相色谱仪(含G1311A四元泵、G1313A自动进样器、G1316A柱温箱、G1322A在线真空脱气机、G1315BDAD二极管阵列检测器)美国安捷伦责任有限公司;LG10-2.4A高速离心机北京精力离心机有限公司;KQ-500DE数控超声波清洗器昆山市超声仪器有限公司。
1.2实验方法
1.2.1超临界CO2辅助超声提取PGP桔梗饮片粉碎过40目筛,加入1 L萃取釜中,在温度为45 ℃,压力为25 MPa,夹带剂乙醇浓度为70%的条件下超临界萃取1.5 h,将萃取后的桔梗粉末晾干,按料液比桔梗∶蒸馏水=1∶46,在超声功率为400 W,温度75 ℃条件下,超声40 min,纱布过滤,离心,浓缩,80% 以上醇沉,过夜,离心,干燥,得粗PGP粉末。
1.2.2PGP的分离及纯化取粗PGP粉末1 g,溶于40 mL蒸馏水中,湿法上DEAE-52纤维素柱,吸附过夜,用纯水洗脱,每10 mL为1管收集,用苯酚-硫酸法在490 nm处检测多糖,在280 nm处检测蛋白质,以洗脱管数为横坐标,吸光度值为纵坐标,绘制洗脱曲线。将同时具有多糖和蛋白质的组分合并,透析,浓缩,冷冻干燥,得到PGP半纯品。
将PGP半纯品100 mg溶于10 mL三蒸水中,上Sephadex G-75 葡聚糖凝胶柱,用纯水洗脱,以洗脱管数为横坐标,吸光度值为纵坐标,绘制洗脱曲线。同上法收集同时具有多糖和蛋白质的组分,透析,浓缩,冷冻干燥,得到PGP。
1.2.3多糖与蛋白质的含量测定用苯酚-硫酸法测定多糖含量[11],用凯氏定氮法测定蛋白质含量[12-13]。
1.2.4PGP中单糖组成的测定
1.2.4.1色谱条件色谱柱:Agilent Extend-C18(250 mm×4.6 mm,5 μm)柱;流动相A:0.1 mol/L磷酸盐缓冲溶液(pH6.7),B:乙腈;流速:1.00 mL/min;检测波长:245 nm;进样量:10 μL;柱温:室温。梯度洗脱程序为:开始时A为17%,保持到14 min,14.01~22 min,A逐渐降至15%,22.01~34 min,A逐渐降至10%,34.01~65 min,A逐渐升至17%。
1.2.4.2标准单糖混合液的PMP衍生精密称取Glc,Man,Xyl,L-(-)Fuc,D-Gal,D-Rib,L(+)-Rha,D-Ara,GlcUA和GalUA各30~35 mg,用10 mL氨水溶解。取该标准单糖混合液500 μL与500 μL的PMP/甲醇溶液(0.5 mol/L)混合,在70 ℃下反应30 min,取出后冷却至室温,用2 mL的氯仿萃取,充分振荡后除去有机相,重复3次。
1.2.4.310种单糖标准曲线的绘制分别取衍生后的单糖混合标准溶液 1、4、8、12、16、20 μL在其色谱条件下进行HPLC分析。以各种单糖的物质的量(mol/L)为横坐标,以各种单糖峰面积的积分值为纵坐标,绘制得到标准曲线。
1.2.4.4PGP的水解与PMP衍生精确称取PGP 100 mg于西林瓶中,加入2 mol/L TFA溶液2 mL,用压盖器压盖,沸水浴加热40 min,冷却,取水解液500 μL,同上法衍生[14]。
1.2.4.5单糖组成分析选取5批PGP作为样品,精密称量适量,水解,PMP衍生后,取10 μL进样,重复5次,根据出峰的时间和峰面积,确定各单糖的摩尔数。
1.2.5蛋白质的氨基酸组成分析
1.2.5.1色谱条件色谱柱:ODS HYPERSIL(250 mm×4.6 mm,5 μm);流动相:流动相A为0.02 mol/L醋酸钠溶液(含200 μL/L三乙胺和3.5 mL/L四氢呋喃,2%醋酸溶液调pH=7.2±0.05),流动相B为0.02 mol/L醋酸钠溶液-甲醇-乙腈(200∶400∶400,pH=7.2±0.05),柱温40 ℃,流速:1.00 mL/min;梯度洗脱时间,流动相比例(A:B)和检测波长分别为:时间:0-20-25-35-45 min;流动相A比例:100%-80%-50%-0%;检测波长:338-338-254-338 nm。
1.2.5.218种氨基酸标准溶液的配制精密称取18种氨基酸 0.10 ~ 0.11 g,分别溶于0.1 mol/L的盐酸溶液中,定容于10 mL容量瓶中,得各氨基酸标准溶液的贮备液。
1.2.5.3混合氨基酸标准溶液的配制取以上各氨基酸标准品溶液1.00 mL,置于25 mL量瓶中,用0.1 mol/L盐酸溶液定容。
1.2.5.4PGP的水解精确称取PGP纯品20 mg,置于20 mL西林瓶中,加入6 mol/L盐酸15 mL,用压盖器压盖。置于110 ℃恒温干燥箱中水解24 h,冷却后,蒸干,然后加入1%盐酸2.00 mL,超声10 min,备用。
1.2.5.5氨基酸在线衍生自动进样程序吸取OPA溶液15 μL,洗针,再吸取待测液20 μL,洗针,混合,等待2 min后,再吸取FMOC 15 μL,洗针,进样[15-16]。
1.2.5.618种氨基酸的标准曲线的绘制用自动进样器分别取混合氨基酸的标准溶液1、5、10、15、20、25 μL,按照1.2.5.5 氨基酸在线衍生自动进样程序衍生进样,以测得的各种氨基酸的峰面积为纵坐标,以各种氨基酸的进样质量(μg)为横坐标。
1.2.5.7氨基酸的组成分析取PGP的水解液,按在线衍生自动进样程序进样分析,根据出峰时间进行组成分析,根据色谱峰的峰面积计算各氨基酸的含量。
1.2.6羟基自由基的生成和清除率的测定利用Fenton反应体系[17-18],检测PGP对羟基自由基清除作用。取0.15 mol/L的磷酸缓冲溶液(pH7.4)1.00 mL,0.258 mg/mL番红花红T溶液200 μL,6 mmol/L的EDTA-Na+Fe2+1.00 mL,然后分别加入7.00 mL不同质量浓度(0.20、0.40、0.60、0.80、1.00 mg/mL)的PGP,后加入0.8 mL的3%的过氧化氢,放入40 ℃水浴30 min后,在520 nm处测吸光度值。
式中:A1-体系中未加样品溶液时的吸光度;AS-体系中加了样品溶液时的吸光度;A2-番红花红和缓冲溶液混合后的吸光度。
2 结果与讨论
2.1双柱法对PGP分离纯化的影响
DEAE-52柱和Sephadex G-75柱的洗脱曲线分别见图1和图2。图1中9~16洗脱管为多糖与蛋白质的重叠峰。图2中20~30洗脱管为多糖与蛋白质的重叠峰。通过两柱的分离纯化,足以说明多糖与蛋白质为一结合体。
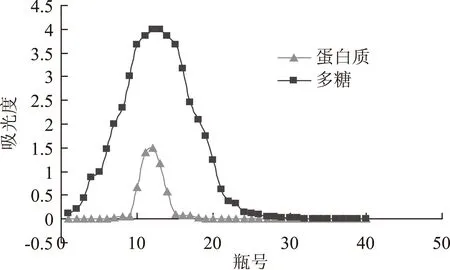
图1 DEAE-52柱洗脱曲线Fig.1 Gradient elution curve of DEAE-52 column
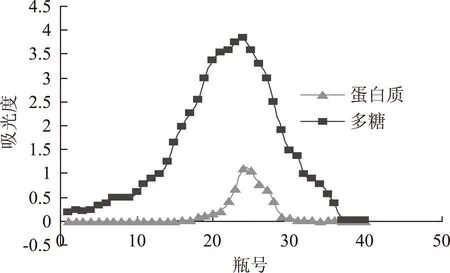
图2 Sephadex G-75洗脱曲线Fig.2 Gradient elution curve of Sephadex G-75 column
2.2PGP中多糖与蛋白质的含量
本实验对PGP中多糖与蛋白质的含量测定结果为:多糖的平均含量为61.82%,蛋白质的平均含量为33.11%。结果表明,PGP中多糖的含量大于蛋白质的含量,约为蛋白质含量的2倍。
2.3PGP中单糖的组成分析
2.3.1单糖标准曲线方程图3为标准单糖PMP衍生物的色谱图。回归所得工作方程,相关系数及线性范围,见表1,用于单糖组成比的计算。
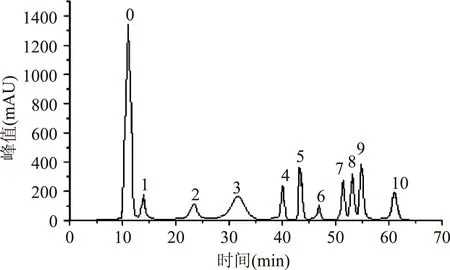
图3 单糖标准品PMP衍生物色谱图Fig.3 Chromatogram of monosaccharide standard by PMP derivatives注:0:PMP(1-苯基-3-甲基-5-吡唑啉酮),1:Man(甘露糖),2:Rib(核糖),3:Rha(鼠李糖),4:GlcUA(葡萄糖醛酸),5:GalUA(半乳糖醛酸),6:Glc(葡萄糖),7:Gal(半乳糖),8:Xyl(木糖),9:Fuc(岩藻糖),10:Ara(阿拉伯糖)。
2.3.2PGP的单糖组成图4为桔梗糖蛋白中多糖水解衍生物色谱图。通过图3与图4的对比可知,桔梗糖蛋白中的多糖主要由葡萄糖醛酸,半乳糖醛酸,葡萄糖,半乳糖,木糖,岩藻糖,阿拉伯糖7种单糖组成,经计算其摩尔比为5.844∶3.373∶15.20∶4.616∶4.089∶5.274∶6.171。
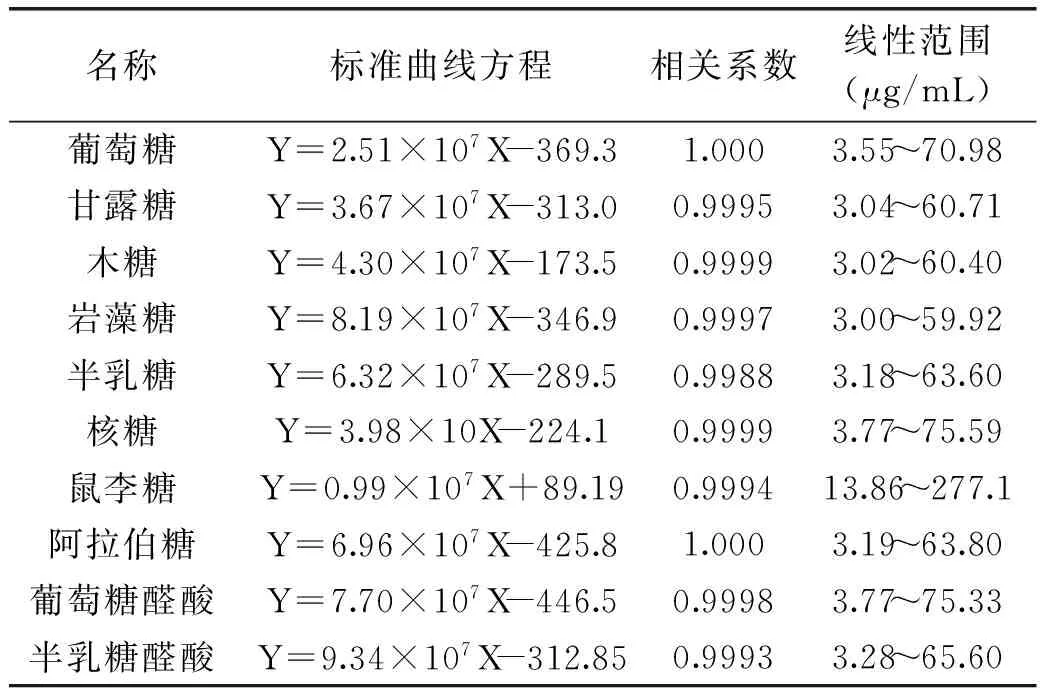
表1 各种单糖及糖醛酸的标准曲线方程Table 1 Standard curve of standard monosaccharide
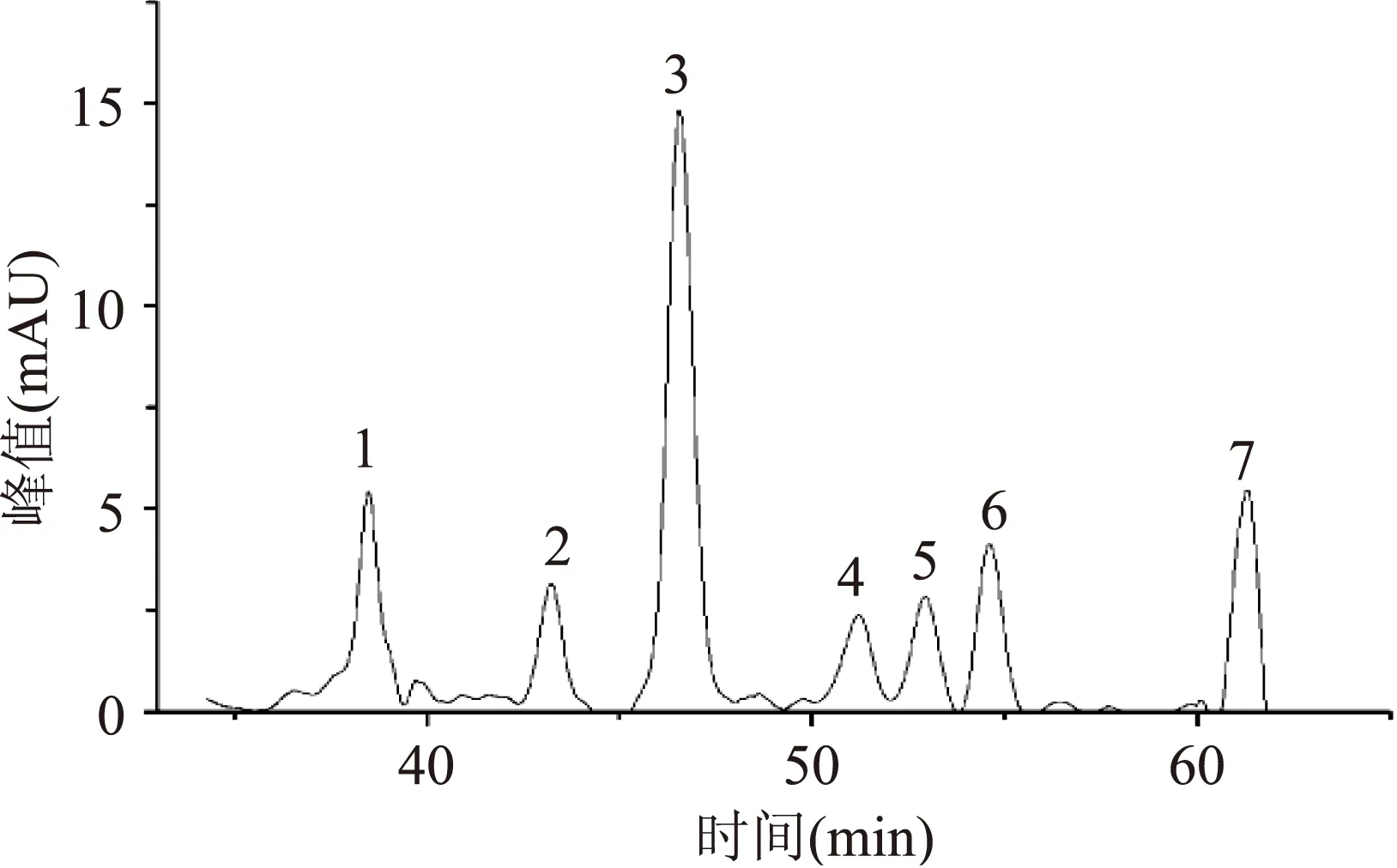
图4 桔梗糖蛋白中多糖水解衍生物色谱图Fig.4 Derivative chromatogram of Platycodon grandiflorum hydrolysis in glycoprotein polysaccharide注:1:GlcUA(葡萄糖醛酸),2:GalUA(半乳糖醛酸), 3:Glc(葡萄糖),4:Gal(半乳糖),5:Xyl(木糖), 6:Fuc(岩藻糖),7:Ara(阿拉伯糖)。
2.4PGP中的氨基酸组成分析
2.4.118种氨基酸的标准曲线方程的建立由实验得到18 种氨基酸的标准曲线方程、相关系数及线性范围(见表2)。标准色谱图见图5。
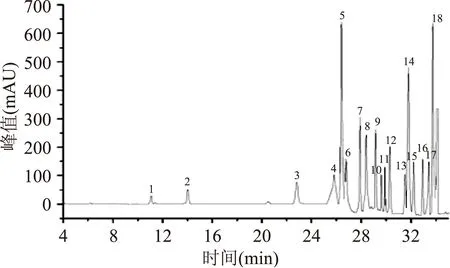
图5 氨基酸混合标准品Fig.5 HPLC chromatograms of amino acid mixed standards注:1:Asp(天门冬氨酸),2:Glu(L-谷氨酸),3:His(组氨酸),4:Thr(苏氨酸),5:Gly(甘氨酸),6:Ala(丙氨酸),7:Tyr(酪氨酸),8:Arg(精氨酸),9:Val(缬氨酸),10:Met(蛋氨酸),11:Phe(苯丙氨酸),12:Ile(异亮氨酸),13:Pro(脯氨酸),14:Cys(胱氨酸),15:Leu(亮氨酸),16:Trp(色氨酸),17:Lys(赖氨酸),18:Ser(丝氨酸)。表2 18种氨基酸的标准曲线Table 2 Regression equations and linear ranges of 18 kinds of amino acids
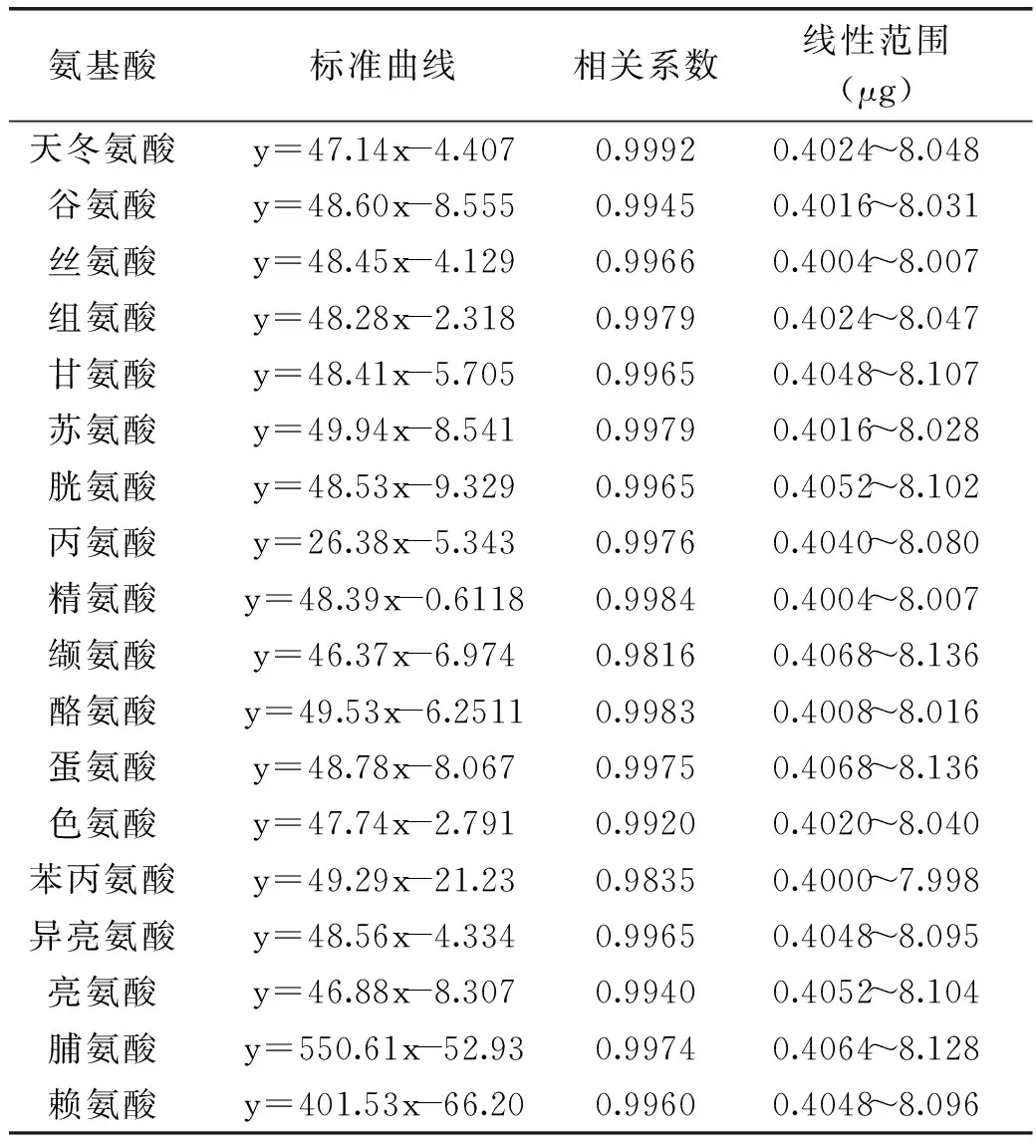
氨基酸标准曲线相关系数线性范围(μg)天冬氨酸y=47.14x-4.4070.99920.4024~8.048谷氨酸y=48.60x-8.5550.99450.4016~8.031丝氨酸y=48.45x-4.1290.99660.4004~8.007组氨酸y=48.28x-2.3180.99790.4024~8.047甘氨酸y=48.41x-5.7050.99650.4048~8.107苏氨酸y=49.94x-8.5410.99790.4016~8.028胱氨酸y=48.53x-9.3290.99650.4052~8.102丙氨酸y=26.38x-5.3430.99760.4040~8.080精氨酸y=48.39x-0.61180.99840.4004~8.007缬氨酸y=46.37x-6.9740.98160.4068~8.136酪氨酸y=49.53x-6.25110.99830.4008~8.016蛋氨酸y=48.78x-8.0670.99750.4068~8.136色氨酸y=47.74x-2.7910.99200.4020~8.040苯丙氨酸y=49.29x-21.230.98350.4000~7.998异亮氨酸y=48.56x-4.3340.99650.4048~8.095亮氨酸y=46.88x-8.3070.99400.4052~8.104脯氨酸y=550.61x-52.930.99740.4064~8.128赖氨酸y=401.53x-66.200.99600.4048~8.096
2.4.2PGP中氨基酸的组成图6为PGP水解液的色谱图。通过图5与图6的对比可知:桔梗糖蛋白的氨基酸主要由谷氨酸、苏氨酸、甘氨酸、丙氨酸、酪氨酸、精氨酸、缬氨酸、蛋氨酸、苯丙氨酸、异亮氨酸、脯氨酸、胱氨酸、亮氨酸、色氨酸、赖氨酸等15种组成,总量为224.8 mg/g,各氨基酸的质量分布见图7。其中,含有全部人体必需氨基酸,占总氨基酸的76.15%。
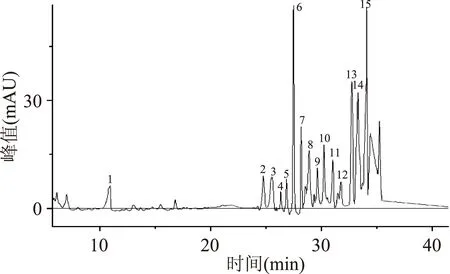
图6 糖蛋白中氨基酸组成色谱图Fig.6 The chromatograms of amino acids in glycoprotein注:1:Glu(L-谷氨酸),2:Thr(苏氨酸),3:Gly(甘氨酸),4:Ala(丙氨酸),5:Tyr(酪氨酸),6:Arg(精氨酸),7:Val(缬氨酸),8:Met(蛋氨酸),9:Phe(苯丙氨酸),10:Ile(异亮氨酸),11:Pro(脯氨酸),12:Cys,13:Leu(胱氨酸),14:Trp(色氨酸),15:Lys(赖氨酸)。
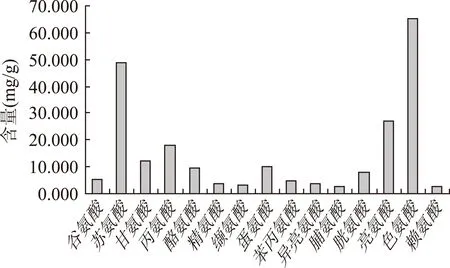
图7 糖蛋白中氨基酸组成质量分布图Fig.7 Mass distribution of amino acid in glycoprotein
2.5PGP对·OH自由基清除能力的影响
桔梗糖蛋白对·OH自由基的清除实验结果见图8。
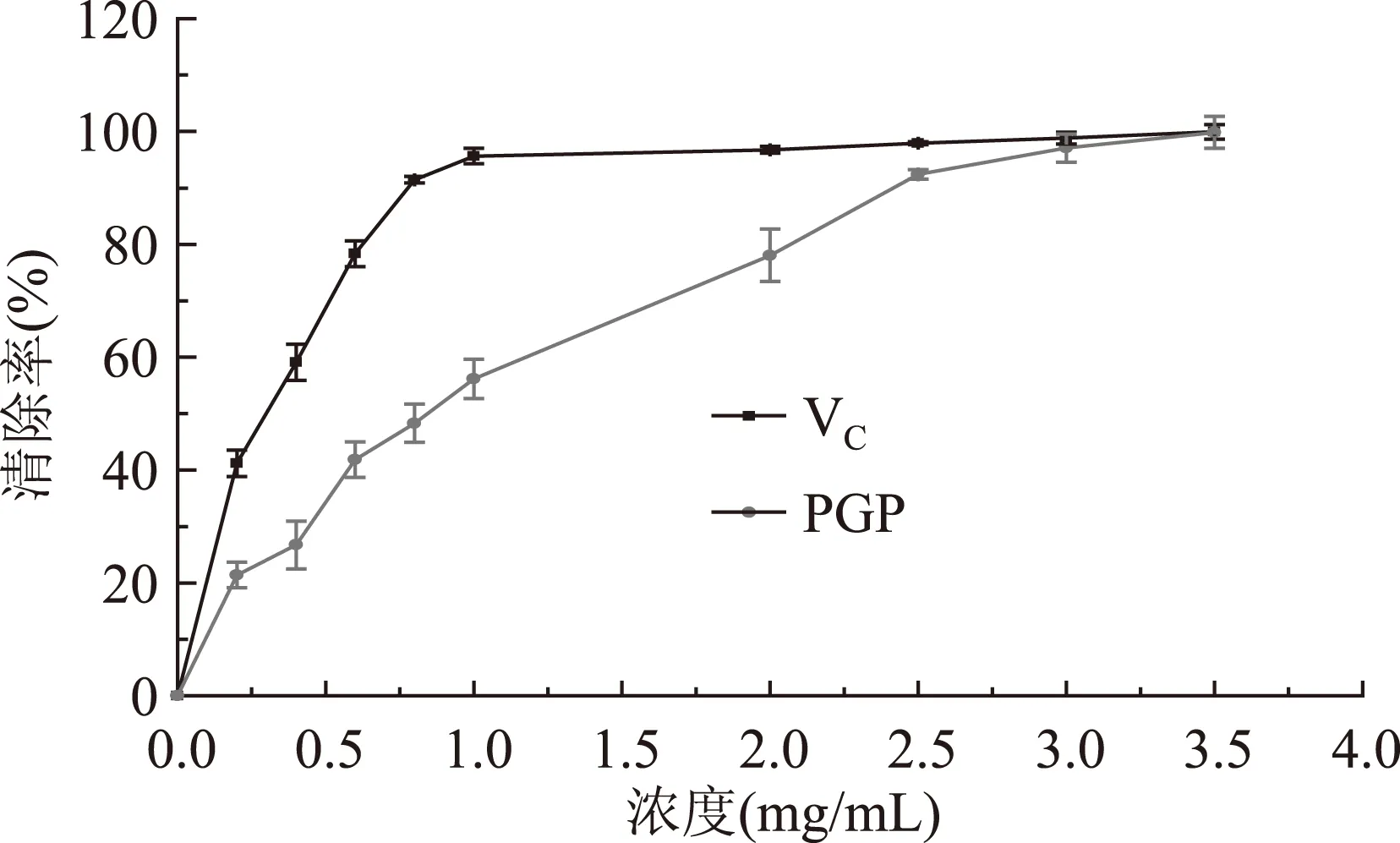
图8 PGP对·OH自由基的清除的能力(n=3)Fig.8 Scavenging capability on ·OH free radicals(n=3)
结果显示,桔梗糖蛋白对·OH自由基的清除能力随浓度的增加而增大,且PGP与VC的IC50值分别为:0.99 mg/mL和0.29 mg/mL,当浓度达到2.5 mg/mL以上时PGP与VC的清除能力基本相当,表现出良好的对·OH的清除能力。
3 结论
本实验采用超临界CO2萃取与超声波振荡辅助提取法得到的桔梗糖蛋白(PGP),经由双柱(DEAE-52纤维素柱和Sephadex G-75葡聚糖凝胶柱)分离纯化,获得了较为纯净的PGP之后,对其多糖和蛋白质的含量和组成进行了测定与分析,同时测定了PGP对·OH自由基清除能力,并与VC进行了比较。结果显示,PGP由7种单糖及15种氨基酸组成,其中多糖的含量占61.82%,蛋白含量占33.11%,蛋白质中含有必需的8 种氨基酸,占总氨基酸的76.15%;对·OH自由基的清除PGP和VC的半数抑制浓度IC50值分别为0.99 mg/mL和0.29 mg/mL,当浓度大于2.5 mg/mL时,对·OH的清除能力较强,且与VC相当。表明PGP具有一定的抗氧化能力,本研究为桔梗的开发与利用提供了理论依据。
[1]国家药典委员会. 中华人民共和国药典(第一部)[S]. 北京:中国医药科技出版社,2010:259-260.
[2]徐丽萍,李笑梅,王鑫. 响应曲面法优化桔梗皂甙提取工艺[J]. 食品科学,2010,31(12):49-53.
[3]张莲姬,南昌希,张丽霞. 桔梗多糖的提取及其抗氧化作用研究[J]. 食品与机械,2008,24(03):60-63.
[4]郭丽,张村,李丽,等. 中药桔梗的研究进展[J]. 中国中药杂志,2007,32(3):181-185.
[5]谭玲玲,彭华胜,胡正海. 桔梗的生物学特性及化学成分研究进展[J]. 南方农业学报,2011,42(12):1523-1527.
[6]Li Lei,Zhang Jinping,Zhou Quancheng. Optimization of microwave-assisted extraction of polysaccharides in the flower of Platycodon grandiflorum by response surface methodology[J]. Int J Agric & Biol Eng,2009,2(2):65-74.
[7]Yeo Dae Yoon,Sang Bae Han,Jong Soon Kang. Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix of Platycodon grandiflorum[J].International Immunopharmacology,2003(3):1873-1882.
[8]杜晓旭,钟洁,段玉峰,等. 蒲公英糖蛋白的分离纯化与结构分析[J]. 食品工业科技,2012,33(8):198-201.
[9]孙宇婧,韩涛,卞科,等. 山药糖蛋白纯化条件及其理化方法鉴定[J]. 中国粮油学报,2011,26(3):81-85.
[10]杨新河,黄建安,刘仲华,等. 树脂对普洱茶多糖的纯化与分离[J]. 食品科学,2015,36(02):19-24.
[11]刘晓涵,陈永刚,林励,等. 蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技,2009,34(9):270-272.
[12]刘玉明,钱甜甜,蒋定文,等. 凯氏定氮法和考马斯亮蓝法测定方格星虫多糖中蛋白质的含量[J]. 中国实验方剂学杂志,2010,19(19):96-98.
[13]鲁健章,孙丽华,周彦钢. 凯氏定氮法测定鱼蛋白质含量的干扰因素分析[J]. 食品科学,2010,31(19):453-456.
[14]田鑫,盛文静,赵园园,等. 刺参多糖中糖醛酸氨基糖和中性单糖的同步测定方法研究[J].食品工业科技,2014,35(15):85-89.
[15]陈华萍,陈黎,魏育明,等. 柱前衍生反相高效液相色谱法测定小麦中氨基酸含量[J]. 分析化学,2005,33(12):1689-1692.
[16]叶英. OPA-FMOC柱前衍生反相液相色谱法测定氨基酸含量[J]. 食品科学,2002,23(9):91-93.
[17]王恒超,严静,陈锦屏,等. 微波辅助法提取柿子黄酮及抗氧化活性研究[J]. 食品工业科技,2012,33(18):232-235.
[18]王呈文,纪明慧,陈光英,等. 热带莫氏兰根提取物的抗氧化活性及稳定性研究[J]. 食品工业科技,2013,34(05):209-211.
Study on the composition analysis and inhibition of·OH of glycoprotein fromPlatycodongrandiflorum
LIAN Ya-nan,GUO Ting-ting,CUI Lin,ZHAO Sheng-nan,LIN Xue-yan,ZHENG Xiao-feng,GAO Jin-bo*
(College of Pharmacy,Jiamusi University,Jiamusi 154007,China)
Separation and purification of glycoprotein which were extracted by super critical CO2fromPlatycodongrandiflorum. Then the monosaccharide and amino acids composition and the inhibition of ·OH of glycoprotein were investigated.The glycoprotein were extracted fromPlatycodongrandiflorumand purified by DEAE-52 cellulose column and Sephadex G-75 gel column. Monosaccharide and amino acids of glycoprotein were analyzed by pre-column derivatization with PMP and OPA-FMOC respectively. The results showed thatPlatycodongrandiflorumglycoprotein was composed of 7 kinds of monosaccharide(average content of 61.82%)and 15 kinds of amino acids(average content of 33.11%). IC50value of inhibition ·OH was 0.99 mg/mL. The study showed that ·OH could be inhibited by thePlatycodongrandiflorumglycoprotein effectively,which provided the theoretical basis for the further study on functional food and the drugs manufacture.
Platycodongrandiflorum;glycoprotein;analysis of composition
2015-07-09
廉亚楠(1993-),女,本科,研究方向:天然产物药物分析,E-mail:1263238105@qq.com。
高金波(1960-),女,本科,教授,研究方向:天然产物药物分析,E-mail:gaojinbo2001@163.com。
佳木斯大学大学生“校长创新创业基金项目”研发项目课题(xzyf2013-07);佳木斯大学大学生科技创新项目(2014-013);佳木斯大学大学研究生科技创新项目(LM2015-095)。
TS201.5
A
1002-0306(2016)03-0083-05
10.13386/j.issn1002-0306.2016.03.008
——辨别味之苦甜

