顺义潮白河再生水受水区反硝化作用初探
何宝南,何江涛*,王 健,李 杰(.中国地质大学(北京)水资源与环境工程北京市重点实验室,北京 00083;.东华理工大学,南昌 33003)
顺义潮白河再生水受水区反硝化作用初探
何宝南1,何江涛1*,王健2,李杰1
(1.中国地质大学(北京)水资源与环境工程北京市重点实验室,北京 100083;2.东华理工大学,南昌 330013)
以顺义潮白河段再生水受水区为研究对象,沿受水区再生水补给路径布设监测点,利用N2∶Ar法和膜进样质谱仪(MIMS)直接测定反硝化产物溶解性N2浓度,计算水-气界面N2通量,探究N2通量变化特征和硝酸盐氮沿流向变化的受控因素,概算硝氮转化过程中主要作用的贡献。结果显示:减河段N2通量为8.92~15.20 mmol N·2m-·2d-1,潮白河段N2通量为17.07~33.01 mmol N·2m-·2d-1。-N含量在不同河段的变化主要受控于反硝化作用和浮游植物的同化吸收,其中减河段反硝化作用除氮量和浮游植物同化吸收固氮量分别为0.041 mmol·L-1和0.017 mmol·L-1,分别占-N变化量的68.33%和28.33%;潮白河段为0.254 mmol·L-1和0.125 mmol·L-1,分别占-N变化量的63.50%和31.25%。
再生水;反硝化;N2∶Ar法;N2通量
何宝南,何江涛,王健,等.顺义潮白河再生水受水区反硝化作用初探[J].农业环境科学学报,2016,35(8):1565-1572.
HE Bao-nan,HE Jiang-tao,WANG Jian,et al.Preliminary investigation on the denitrification of reclaimed water intake area of the Chaobai River[J].Journal of Agro-Environment Science,2016,35(8):1565-1572.
再生水是经深度处理的污水,即污水通过物理、化学和生物组合工艺中的一系列连续处理,去除悬浮物、可溶解物、有机物质、营养盐、金属等后被再次利用的水[1]。目前,再生水较大范围用于补充天然水体和景观用水,少部分用于工业生产和农业灌溉等。由于再生水特殊的物理化学性质以及现行的再生水处理水质标准,使得回用于景观的再生水中氮、磷含量仍然相对较高,易造成水体富营养化[1-2],对地下水氮污染构成潜在威胁。
反硝化过程是氮素由活性氮向惰性氮转化的唯一途径,是实现完整氮循环和氮平衡的关键环节,反硝化作用能够去除氮素,是减缓水体富营养化的重要途径[3]。Howarth等[4]指出全球范围内河口区约50%的氮素是通过反硝化去除。杨丽标等[3]指出夏季大辽河河口区约26%总氮、43%的硝氮通过反硝化过程去除。陈小峰等[5]指出在2009—2010水文年中,约3.22× 104t氮素从太湖水体中去除,其中约3.02×104t氮素是由反硝化途径去除的。目前,反硝化作用常用的测试方法主要有N2∶Ar法、乙炔抑制法和15N同位素法[6]等。在国内外,N2∶Ar法在测定海水、河流、水渠、河口以及淹水环境的反硝化作用方面已得到了广泛的应用[7-12]。徐继荣等[13]、钟继承等[14]利用乙炔抑制法分别探究了珠江口入海河段的反硝化作用及湖泊底泥疏浚对沉积物反硝化作用的影响。Sebilo等[15]、Kellman等[16]、Wexler等[17]利用15N同位素法分别探究了塞纳河、加拿大魁北克省某河流以及Wensum河的反硝化作用。通过对比显示,N2∶Ar法具有直接测定水体N2和Ar比值的优点,测定精度<0.03%,每个样品测定时间<2 min,相比于其他测试方法具有明显的优越性,该方法被认为是目前最具潜力的反硝化测定方
法[10,18]。
潮白河再生水受水区长期水质监测结果显示总氮和硝氮含量沿流向呈显著降低趋势[19],初步分析认为水体反硝化作用可能是导致总氮和硝氮显著降低的主要原因,这种降低趋势如果是必然的、规律性的,那么将有可能缓解水体富营养化程度,减轻对地下水造成的氮污染。为探明硝酸盐氮沿流程降低的趋势是否主要由反硝化作用导致,本研究尝试通过N2∶Ar膜进样质谱法测定受水区水-气界面溶解性N2浓度,计算N2通量,探究受水区水体反硝化作用在不同河段的变化特征及其影响因素,阐明再生水水体硝氮转化主要途径及贡献。
1 材料与方法
1.1研究区概况及采样点布置
研究区为顺义区城北减河全程和潮白河一段,是“引温济潮”工程的主要受水区。北京市政府在2007年将温榆河污水再生处理后,经顺义城北减河输送至潮白河形成300万m2的再生水水面景观,以达到补充潮白河生态环境用水及涵养地下水源的目的[20]。在此之前,城北减河、潮白河则为完全干涸的两条河道,目前,除大气降水外,其水源均主要来自再生水的补给。受水区城北减河段长度为2.35 km,平均深度1.11 m,属人工型河道,两侧砌边坡,自然河底,平均流速为0.015 m·s-1[21],在向阳闸下游与潮白河交汇。潮白河段的长度约为1.6 km,平均深度2.45 m,平均流速为1.49×10-3m·s-1,在河南村橡胶坝处拦水形成人工湖,宽度为200~400 m,蓄水量约为6×106m3。
根据受水区地理条件及环境特征,共布置5个采样点,见图1。自出水口而下分别为卧龙公园北桥和铁路桥中间(#1)、减河桥(通顺路)下游约30 m(#2)、减河桥(右堤路)下游约30 m(#3)、潮白河与减河交汇处(#4)、滨河小区对面(#5)。
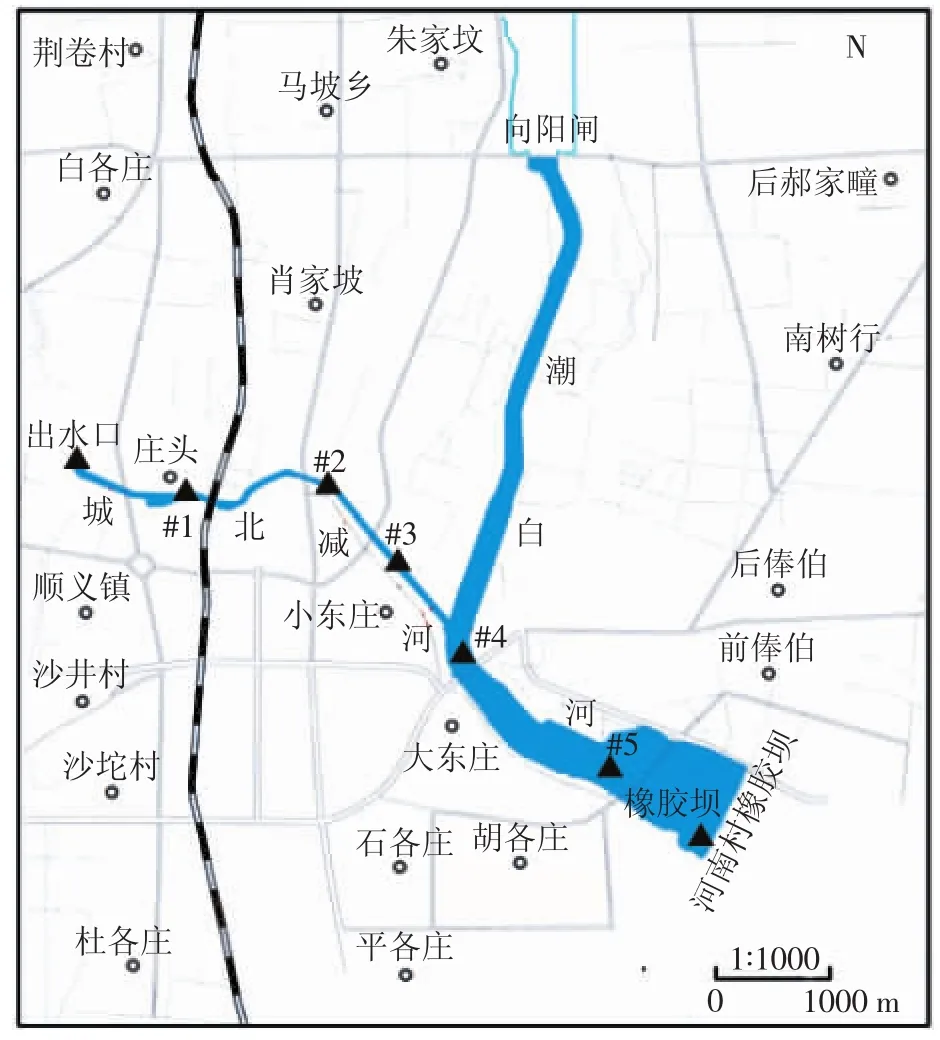
图1 研究区及采样点布置示意图Figure 1 Map of the study area and sampling sites
1.2采样方法
1.2.1实验器材与药品
2500 mL卡盖式采水器1个(Qccc-5型,国家海洋技术中心);带橡胶垫片的细长型螺口瓶110个(7 mL,Labco Limited,UK);虹吸管2根;石蜡1盒;0.5%饱和氯化汞溶液1瓶;2.25 mol·L-1硫酸锰溶液、碱性碘化钾-叠氮化钠溶液各1瓶;便携式气象仪Kestrel-3500,USA(测定气温、风速和气压);美国Eureka公司生产的Manta多参数水质监测仪(测定水温等水质物理指标);恒温箱(现场保存水样)。黑白瓶挂瓶所需器材为:250 mL可旋紧密封的优质溶解氧瓶50个,其中锡箔纸包裹的溶解氧瓶作为黑瓶;固定溶解氧瓶的支架1套、细绳1卷;锡箔纸2盒;透明度盘1个;250 mL锥形瓶15个;1 mL和2 mL移液管各一根;标签纸、透明胶、签字笔若干。
1.2.2样品采集及处理方法
首先将采水器放至所需深度,待装满水后缓慢提出,然后用硅胶管将水样引流至样品瓶内,当水样装满整个样品瓶后继续引流,让其溢出样品瓶1/2体积以上,每次取4个平行样,其中3个滴加0.2 mL 0.5%氯化汞溶液灭活用于溶解性N2浓度的测定[12],另一个保存原样用于等指标的测定。同时利用水质监测仪和气象仪现场测定水温、pH值、TDS、Eh、电导率、气温、风速、气压等参数,用于水-气界面N2通量计算和分析。本次采样具体时间为2014年6月23—24日、7月18—19日、8月16—17日、9月4—5日、9月18—19日,共5次,每次24 h,为排除天气情况对采样的影响,采样期间均选取晴天。
利用透明度盘测定水体透明度,然后分别在表层及0.5、1、2、3、4倍透明度水层取样;将各水层的水样分别装入9个250 mL可旋紧密封溶解氧瓶中(3组平行样,初始瓶、白瓶、黑瓶各3瓶),水样灌满溶解氧瓶后,仍需溢出2~3倍容积的水,以保证溶解氧瓶与采水器中的溶解氧浓度完全一致。灌瓶完毕,立即对每层水样的3个初始瓶进行溶解氧现场固定,用移液管在取好样品的溶解氧瓶液面下加入1 mL硫酸锰溶液和2 mL碱性碘化钾-叠氮化钠溶液,盖好瓶盖,颠倒混合数次,静置至棕色沉淀物下降到瓶底,即完成溶解氧现场固定[23],为初始溶解氧;将黑瓶和白瓶按照采样水层悬挂于支架上,放回水中,在自然光照下培养24 h。待光照培养完成后,取下白瓶和黑瓶进行溶解氧现场固定,随后把完成固定的所有溶解氧瓶放入避光箱中保存,运回实验室进行溶解氧含量的测定[23]。N2O的采集参照李建鸿等[22]对水气界面温室气体采集的方法。
1.3测定方法
基于已建立的N2∶Ar方法,利用膜进样质谱仪(Membrane Inlet Mass Spectrometer,MIMS)测定水样N2∶Ar(物质的量比,测试单位为中国科学院南京土壤研究所),计算溶解性N2净增量,通过N2净增量来量化反硝化速率[10]。N2O含量的测定采用静态箱-气象色谱法[24]。所用仪器的装置为配有微电子捕获检测器μEDC的GC-7980A气象色谱仪(美国Aglient公司),以纯度为99.999%的N2作为载气(25 mL·min-1),采用80~100目Porpak.Q填充柱,在70℃柱箱温度和330℃检测器温度下利用GC-7980A气象色谱仪进行N2O浓度分析(测试单位为中国农业科学院)。
初级生产力的确定通过黑白瓶测氧法实现[23,25],将含有浮游植物的黑白瓶悬挂于水中进行24 h曝光培养,黑瓶中的浮游植物由于得不到光照,溶解氧会减少,白瓶中的浮游植物在光照条件下,光合作用和呼吸作用同时进行,溶解氧会增加,假定光照和黑暗条件下呼吸强度相同,就可根据挂瓶曝光期间的溶解氧变化计算出光合作用和呼吸作用的强度,根据瓶中溶解氧量即可求得浮游植物净初级生产量。初级生产量与浮游植物同化固氮之间又存在相应的转化比例,从而可以确定浮游植物同化固氮含量。
1.4数据分析
1.4.1溶解性N2净增量
为表征反硝化作用,用实测溶解性气体浓度与理论平衡浓度差值计算溶解性N2净增量Δ[N2],计算公式如下:
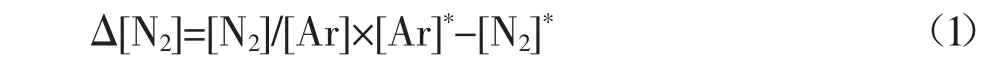
式中:Δ[N2]为溶解性N2净增量,μmol·L-1;[N2]为水样实际溶解N2浓度,μmol·L-1;[Ar]为水样实际溶解Ar浓度,μmol·L-1;[N2]*为水样理论溶解N2浓度,μmol· L-1;[Ar]*为水样理论溶解Ar浓度,μmol·L-1。具体步骤详见陈能汪等[11]建立的基于N2/Ar原理直接测定水体反硝化产物溶解性N2的方法。
1.4.2水-气界面N2通量计算
根据受水区溶解性N2净增量,结合现场测定的温度、风速等参数,依据水-气界面分子扩散模型和亨利定律,计算水-气界面N2通量,Li等[26]指出正N2通量可以估量净反硝化速率,负N2通量可以估量净固氮速率,N2通量具体计算公式如下[11,31]:

式中:F为水-气界面N2交换通量,mmol N2·m-2·d-1;Δ[N2]为N2净增量,μmol·L-1;k为气体交换速度,cm· h-1,是风速和气体Sc数(Schmidt Number)的函数。本文采用Wanninkhof[27]提出的适用于短期风速或瞬时风速估算k值的计算公式:

式中:u10为水面上方10 m高度的风速,m·s-1;Sc为水的动力粘度与待测气体分子扩散速率之比,式中600适用于淡水。Wanninkhof[27]指出淡水中N2的Sc和水温(t,℃)的关系为:
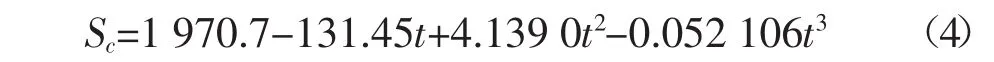
1.4.3N2O通量计算
N2O通量利用温室气体扩散方式进行计算,计算公式如下[28]:

式中:F为交换通量,mg·m-2·h-1;V为采样箱内空气体积,m3;ρ为标准状态下气体的密度,kg·m-3;A为采样箱覆盖面积,m2;P为采样箱内气压,MPa;T为采样箱内绝对气温,K;P0和T0为标准状态下的空气气压和气温,MPa、K;dc/dt为气体浓度和时间线性回归斜率,h-1。
2 结果与讨论
2.1水体基本指标
2.2N2、N2O通量的变化特征
测试和计算结果表明,沿流向方向,减河段N2通量为8.92~15.20 mmol N2·m-2·d-1,均值为12.59 mmol N2·m-2·d-1;潮白河段N2通量为17.07~33.01 mmol N2· m-2·d-1,均值为25.04 mmol N2·m-2·d-1。受水区N2O通量为0.002~0.03 mmol N2·m-2·d-1,均值为0.021 mmol N2·m-2·d-1,N2O通量约占总通量的0.2%。水-气界面N2、N2O通量沿流向变化情况见图3(A),在采样期间,受水区N2、N2O通量均大于0,且潮白河段N2通量变异较大,这一现象说明采样期间受水区水体不断向大气释放N2与N2O,所释放的N2O通量波动性较大。与N2通量相对应,减河段水体中-N含量为12.02~12.86 mg·L-1,潮白河段水体中-N含量为4.64~10.23 mg·L-1,占无机氮含量的90%以上-N含量沿流向逐渐递减,潮白河段递减效果比减河更加明显,见图3(B);-N、-N含量为0.085~0.201、0.248~0.446 mg·L-1,分别占无机氮含量的1.32%和3.30%,含量较少且无明显变化,故其对水体产生的影响忽略不计。通过Origin8.5软件对N2通量和-N含量进行相关性分析(图4),初步认为采样期间受水区水体主要发生了反硝化作用,N2主要由水体中-N反硝化作用产生,N2O通量极少。Melillo等[29]指出在酸性水体条件下N2O是反硝化的主要产物,本受水区水体呈弱碱性,限制了N2O的产生,对N2通量则无影响,故N2O通量极少,忽略不计;此外,骆坚平等[30]指出以朝阳公园为首的6个北京市典型景观水体中好氧反硝化菌约占总菌株的90%,李平等[31]研究表明好氧反硝化菌存在时,高氧条件下反硝化作用仍然可以发生,有效解释了N2通量较高的现象。
受水区昼夜N2通量大都位于零刻度线之上,仅9月份昼夜交替时间所对应的N2通量位于零刻度线以下(图5),这一现象说明采样期间内受水区水体总体表现为向大气释放N2,仅个别时间表现为吸收N2。受水区N2通量昼夜变化特征与温度联系密切,主要表现为温度较高的白天N2通量高于温度较低的晚上。2.3水体释放氮气的来源
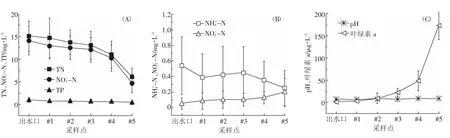
图2 部分指标沿流向监测断面变化情况Figure 2 Changing characteristic of part indexes along the flow monitoring section

图3 N2、N2O通量沿流向变化特征和三氮含量沿流向变化特征Figure 3 Characteristic of N2,N2O fluxes along the river and characteristic of-N content along the river

图4 -N含量和N2通量相关性分析Figure 4 Correlation analysis of-N content and N2flux
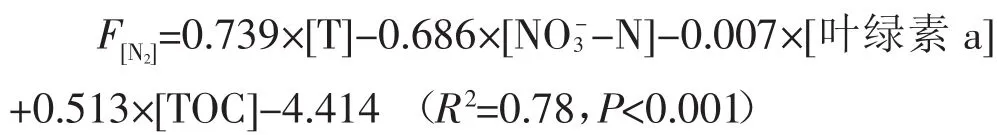
受水区多元回归结果显示,N2通量与NO-3-N、温度、叶绿素a、TOC呈显著相关关系,对于本受水区相对封闭的水体而言,水体从减河流动至潮白河过程中在不断向大气释放N2。Wu等[32]指出在淡水、河口系统中水体产生的N2主要来源于厌氧氨氧化和反硝化作用,本受水区水体中氨氮含量极少,厌氧氨氧化较弱,-N含量较多且沿流向逐渐减少,故认为水体释放的N2主要来自-N的反硝化作用。同时,叶绿素a、TOC含量随水体从减河流动至潮白河过程中也逐渐增加,叶绿素a和TOC能够反映出有机质的含量,有机质是微生物活动的主要营养来源,有机质含量越多,其所能供给微生物的能量越充足,越有利于微生物的生长和繁殖,故认为从减河流至潮白河的水体中有机质含量逐渐增加,微生物活性逐渐增强,反硝化条件逐渐成熟。综上,根据水流过程中-N氮源,有机质、微生物环境等变化情况,认为水体从减河流动至潮白河过程中发生了反硝化作用,水体中的-N作为反硝化作用的电子受体被大量消耗,产生N2。
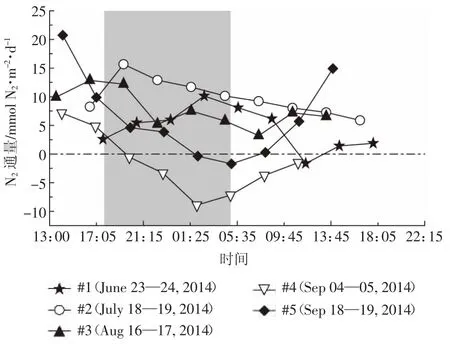
图5 水-气界面N2通量昼夜变化特征Figure 5 Diurnal variation characteristic of N2flux in water-air interface
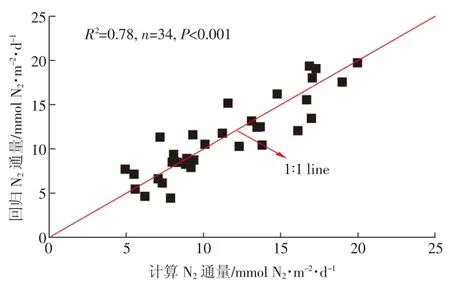
图6 受水区水体计算、回归N2通量Figure 6 Calculation and regression of N2flux in intake area
温度与受水区N2通量呈显著正相关(P<0.05),表明温度对N2通量的昼夜变化确实有一定影响。陈能汪等[11]指出水温是影响反硝化作用众多因子中至关重要的一个,因为不同温度条件下水体具有不同的矿化程度、硝化速率及O2的浓度,进而影响反硝化作用。Bouletreau等[33]和Wertz等[34]指出高温可以激活水中反硝化细菌,从而促进反硝化作用。综上,温度对N2通量的影响是多种因素共同作用的结果,该结果与Dalsgaard等[35]、Nowicki[36]、Chen等[37]研究结果一致。从多元回归分析结果看,受水区N2通量与藻类含量有明显的相关关系,认为除反硝化作用外,河道内水生植物可能也会同化吸收水中的溶解性无机氮[38],从而导致部分-N通过同化作用去除。
Chen等[37]将水-气界面N2通量作为九龙江水体反硝化速率,Li等[26]将N2通量作为相应河流、池塘、水库的反硝化速率。参考该方式,以N2通量表征受水区水体反硝化速率,则减河、潮白河段反硝化速率分别为25.17、50.08 mmol N·m-·2d-1,潮白河段反硝化速率约为减河段的2倍。据受水区反硝化影响因素显示,潮白河段水体中叶绿素a、TOC含量明显高于减河,叶绿素a是反映浮游植物数量的重要指标,其含量越大,能够为微生物生长和繁殖提供的有机质越多,越有利于微生物的生长,故认为潮白河段水体中微生物活性更强;此外,水体从减河流至潮白河过程中流速逐渐降低,至潮白河已接近于0,极易发生富营养化。综合以上微生物活性及流速状态,认为潮白河水体为反硝化创造了更加有利的条件,从而反硝化速率更高。李晨辰等[21]也对本受水区浮游植物及水质进行分析,结果显示潮白河浮游植物数量及富营养化程度明显高于减河,与本研究一致,有效解释了潮白河反硝化速率较高的现象。
水体中氮转化过程较为复杂。水体与大气、水体内部、水体与浮游植物之间都存在氮的相互转化。-N是受水区最主要的无机氮存在形式(占无机氮比例90%以上),因此主要对-N的转化进行分析。减河、潮白河段-N沿流向的变化量分别为0.06 mmol·L-1和0.4 mmol·L-1。根据减河、潮白河段水体反硝化速率,结合河段长度、水流流速以及水深,得到减河、潮白河段反硝化作用除氮量为0.041、0.254 mmol·L-1,分别占-N变化量的68.53%、63.38%。根据反硝化作用对-N的去除贡献判断,水体反硝化除氮量并不能完全解释-N的变化量,因此认为除反硝化作用外,必然还存在其他去除硝态氮的方式。依据N2通量和叶绿素a呈显著相关的回归分析结果,推断浮游植物同化吸收可能会消耗水中-N。对此采用黑白瓶法进行验证,按公式6、公式7进行计算,结果显示:减河、潮白河水柱浮游植物日净生产力分别为82.06 mmol O2·m-2·d-1和197.03 mmol O2· m-·2d-1。

式中:NP为水层浮游植物净初级生产力,mmol O2·m-3· d-1;LB为挂瓶后白瓶溶解氧量,mmol·L-1;IB为初始溶解氧量,mmol·L-1;Δt为挂瓶时间,d。采用算术平均值累计法计算水柱日净初级生产力值(GNP)。计算公式为[39]:
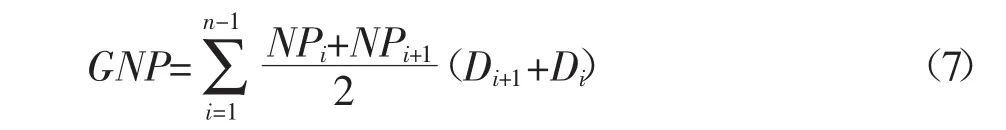
式中:GNP为水柱日净初级生产力,mmol O2·m-2·d-1;NPi为第i水层的浮游植物净初级生产力,mmol O2· m-3·d-1;Di为第i水层的深度,m;n为取样层数(1≤i≤n-1)。
Ploug等[40]指出,浮游植物净碳、氮的固定比率为(8.0±0.8),按碳、氮比8.0计算,则减河、潮白河段浮游植物同化吸收的固氮速率分别为10.26 mmol N· m-2·d-1和24.63 mmol N·m-·2d-1,根据浮游植物固氮速率,结合河段长度、水流流速以及水深,得到减河、潮白河段浮游植物同化吸收的固氮量为0.017、0.125 mmol·L-1,分别占-N变化量的27.94%、31.17%。有效验证了浮游植物同化吸收对水体中-N的去除(表1)。综合分析可知,受水区水体-N降低途径主要为水体反硝化作用和浮游植物的同化吸收,除此之外,还可能存在异化还原、沉降等多种作用对-N产生少量的消耗。
3 结论
表1 水体中-N转化途径及相应的贡献Table 1-N transformation approach and the corresponding contribution in the water
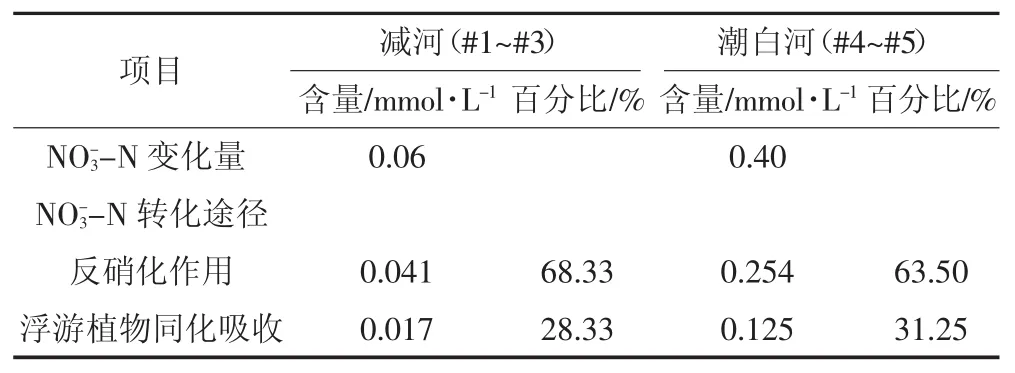
表1 水体中-N转化途径及相应的贡献Table 1-N transformation approach and the corresponding contribution in the water
3-N转化途径反硝化作用 0.041 68.33 0.254 63.50浮游植物同化吸收 0.017 28.33 0.125 31.25项目 减河(#1~#3) 潮白河(#4~#5)含量/mmol·L-1百分比/%含量/mmol·L-1百分比/% NO-3-N变化量 0.06 0.40 NO-
致谢:感谢北京市水利科学研究院在研究工作中提供的技术指导与帮助,感谢潮白河管理处对本研究工作给予的支持。参考文献:
[1]任丽艳,甘庆午.再生水回用于景观水体的富营养化问题分析[C]//中国环境科学学会,2012中国环境科学学会学术年会论文集(第二卷).北京:中国农业大学出版社,2012:1244-1246. REN Li-yan,GAN Qing-wu.Eutrophication problems of recycled water for landscape water and ecological[C]//Chinese Society for Environmental Sciences,2012 the academic conference proceedings of Chinese society for environmental sciences(second volume).Beijing:China A-gricultural University Press,2012:1244-1246.
[2]赵乐军,刘琳,唐福生,等.关于现行再生水水质标准和规范执行情况的讨论[J].给水排水,2007,33(12):120-125. ZHAO Le-jun,LIU Lin,TANG Fu-sheng,et al.Discussion on implementation of reclaimed water quality standards and design codes[J]. Water&Wastewater Engineering,2007,33(12):120-125.
[3]杨丽标,雷坤,孟伟.夏季大辽河河口区水体反硝化及其影响因素[J].环境科学,2015,36(3):905-913. YANG Li-biao,LEI Kun,MENG Wei.Denitrification in water of Daliao River estuary in summer and the effect of environmental factors[J]. Environment Science,2015,36(3):905-913.
[4]Howarth R W,Billen G,Swaney D,et al.Regional nitrogen budgets and riverine N and P fluxes for the drainages to the North Atlantic Ocean:Natural and human influences[J].Biogeochemistry,1996,35(1):75-139.
[5]陈小锋,揣小明,曾巾,等.太湖氮素出入湖通量与自净能力研究[J].环境科学,2012,33(7):2309-2314. CHEN Xiao-feng,CHUAI Xiao-ming,ZENG Jin,et al.Nitrogenous fluxes and its self-purification capacity in lake Taihu[J].Environment Science,2012,33(7):2309-2314.
[6]Groffman P M,Altabet M A,Böhlke J,et al.Methods for measuring denitrification:Diverse approaches to a difficult problem[J].Ecological Applications,2006,16(6):2091-2122.
[7]Tortell P D.Dissolved gas measurements in oceanic waters made by membrane inlet mass spectrometry[J].Limnology and Oceanography:Methods,2005,3:24-37.
[8]Laursen A E,Seitzinger S P.Diurnal patterns of denitrification,oxygen consumption and nitrous oxide production in rivers measured at the whole reach scale[J].Freshwater Biology,2004,49(11):1448-1458.
[9]Baulch H,Venkiteswaran J,Dillon P,et al.Revisiting the application of open-channel estimates of denitrification[J].Limnology and Oceanography:Methods,2010,8:202-215.
[10]陈能汪,吴杰忠,段恒轶,等.N2∶Ar法直接测定水体反硝化产物溶解N2[J].环境科学学报,2010,30(12):2479-2483. CHEN Neng-wang,WU Jie-zhong,DUAN Heng-yi,et al.N2∶Ar method for direct measurement of denitrification product(dissolved N2)using membrane inlet mass spectrometry(MIMS)[J].Acta Scientiae Circumstantiae,2010,30(12):2479-2483.
[11]陈能汪,吴杰忠,洪华生.九龙江河口区夏季反硝化作用初探[J].环境科学,2011,32(11):3229-3234. CHEN Neng-wang,WU Jie-zhong,HONG Hua-sheng.Preliminary results concerning summer-time denitrification in the Jiulong River estuary[J].Environment Science,2011,32(11):3229-3234.
[12]李晓波,夏永秋,郎漫,等.N2∶Ar法直接测定淹水环境反硝化产物N2的产生速率[J].农业环境科学学报,2013,32(6):1284-1288. LI Xiao-bo,XIA Yong-qiu,LANG Man,et al.N2∶Ar technique for direct determination of denitrification rate of aquatic ecosystems using membrane inlet mass spectrometry[J].Journal of Agro-Environment Science,2013,32(6):1284-1288.
[13]徐继荣,王友绍,殷建平,等.珠江口入海河段DIN形态转化与硝化和反硝化作用[J].环境科学学报,2005,25(5):686-692. XU Ji-rong,WANG You-shao,YIN Jian-ping,et al.Transformation of dissolved inorganic nitrogen species and nitrigication and denitrification processes in the near sea section of Zhujiang River[J].Acta Scientiae Circumstantiae,2005,25(5):686-692.
[14]钟继承,刘国锋,范成新.湖泊底泥疏浚环境效应:Ⅲ.对沉积物反硝化作用的影响[J].湖泊科学,2009,21(4):465-473. ZHONG Ji-cheng,LIU Guo-feng,FAN Cheng-xin.Environmental effect of sediment dredging in lake:Ⅲ.influence of dredging on denitrification in sediments[J].Journal of Lake Sciences,2009,21(4):465-473.
[15]Sebilo M,Billen G,Grably M,et al.Isotopic composition of nitrate-nitrogen as a marker of riparian and benthic denitrification at the scale of the whole Seine River system[J].Biogeochemistry,2003,63(1):35-51.
[16]Kellman L,Hillaire-Marcel C.Nitrate cycling in streams:Using natural abundances of-δ15N to measure in-situ denitrification[J]. Biogeochemistry,1998,43(3):273-292.
[17]Wexler S K,Hiscock K M,Dennis P F.Catchment-scale quantification of hyporheic denitrification using an isotopic and solute flux approach [J].Environmental Science&Technology,2011,45(9):3967-3973.
[18]Laursen A E,Seitzinger S P.Measurement of denitrification in rivers:An integrated,whole reach approach[J].Hydrobiologia,2002,485(1-3):67-81.
[19]王健,何江涛,刘玉梅,等.潮白河再生水受水区水质变化特征多元统计分析[J].环境科学与技术,2014,37(6):171-176. WANG Jian,HE Jiang-tao,LIU Yu-mei,et al.Multibariate statistical analysis for the charateristics of reclaimed water quality in reception basin of Chaobai River[J].Environment Science&Technology,2014,37(6):171-176.
[20]王佳军,赵立新,吴晓辉,等.潮白河水质监测与水质改善措施的初步研究[J].北京水务,2009,13(2):13-14. WANG Jia-jun,ZHAO Li-xin,WU Xiao-hui,et al.The preliminary research of water quality monitering and improvement measures inChaobai River[J].Beijing Water,2009,13(2):13-14.
[21]李晨辰,杜桂森,赵立新,等.北京减河-潮白河水系的浮游植物与水质分析[J].中国环境监测,2011,27(3):74-78. LI Chen-chen,DU Gui-sen,ZHAO Li-xin,et al.Analysis on the phytoplankton and water quality in the aquatic system of Jian River-Chaobai River of Beijing[J].Environment Monitoring in China,2011,27 (3):74-78.
[22]李建鸿,蒲俊兵,孙平安,等.不同地质背景水库区夏季水-气界面温室气体交换通量研究[J].环境科学,2015,36(11):4032-4042. LI Jian-hong,PU Jun-bing,SUN Ping-an,et al.Summer greenhouse gases exchange flux across water-air interface in three water reservoirs located in different geologic setting in Guangxi,China[J].Environment Science,2015,36(11):4032-4042.
[23]中华人民共和国国家环境保护局.GB/T 7489—1987水质溶解氧的测定碘量法[S].北京:中国标准出版社,1987. National Environmental Protection Agency of PRC.GB/T 7489—1987,Water quality determination of dissolved oxygen:Iodometric method[S]. Beijing:China Standard Press,1987.
[24]王跃思,郑循华,王明星,等.静态箱法气相色谱法自动检测农田N2O排放[J].分析测试技术与仪器,1997,3(1):10-15. WANG Yue-si,ZHENG Xun-hua,WANG Ming-xing,et al.Automatic system composed of static chamber and gas chromatograph for in-situ measurement of N2O emission from cropland[J].Analysis and Testing Technology and Intruments,1997,3(1):10-15.
[25]中华人民共和国水利部.SL 354—2006水质初级生产力测定.“黑白瓶”测定法[S].北京:中国标准出版社,2007. Ministry of Water Resources of PRC.SL 354—2006 water quality determination of primary productivity:“black and white bottle”disolved oxygen method[S].Beijing:China Standard Press,2007.
[26]Li X B,Xia Y Q,Li Y F,et al.Sediment denitrification in waterways in a rice-paddy-dominated watershed in Eastern China[J].Journal of Soils and Sediments,2013,13(4):783-792.
[27]Wanninkhof R.Relationship between wind speed and gas exchange over the ocean[J].Journal of Geophysical Research-Oceans,1992,97 (C5):7373-7382.
[28]International Hydropower Association.GHG measurement guidelines for freshwater reservoirs[R].London:International Hydropower Association,2010:70-71.
[29]Melillo J M,Aber J D,Steudler P A,et al.Denitrification potentials in a successional sequence of Northern Hardwood forest stands[J].Ecological Bulletins,1983,35:217-228.
[30]骆坚平,刘玉娟,潘涛,等.北京典型景观水体好氧反硝化菌组成特征[J].微生物学杂志,2015,35(6):21-26. LUO Jian-ping,LIU Yu-juan,PAN Tao,et al.Composition characteristics of aerobic denitrification bacteria in typical landscape waters in Beijing[J].Journal of Microbiology,2015,35(6):21-26.
[31]李平,张山,刘德立.细菌好氧反硝化研究进展[J].微生物学杂志,2005,25(1):60-64. LI Ping,ZHANG Shan,LIU De-li.Study progress of bacterial aerobic denitrification[J].Journal of Microbiology,2005,25(1):60-64.
[32]Wu J Z,Chen N W,Hong H S,et al.Direct measurement of dissolved N2and denitrification along subtropical river-estuary gradient,China [J].Marine Pollution Bulletin,2013,66(1/2):125-134.
[33]Bouletreau S,Salvo E,Lyautey E.Temperature dependence of denitrification in phototrophic river biofilms[J].Science of the Total Environment,2012,416:323-328.
[34]Wertz S,Goyer C,Zebarth B J.Effects of temperatures near the freezing point on N2O emissions,denitrification and on the abundance and structure of nitrifying and denitrifying soil communities[J].Fems Microbiology Ecology,2013,83(1):242-254.
[35]Dalsgaard T,Thamdrup B.Factors controlling anaerobic ammonium oxidation with nitrite in marine sediments[J].Applied and Environmental Microbiology,2002,68(8):3802-3808.
[36]Nowicki B L.The effect of temperature,oxygen,salinity,and nutrient enrichment on estuarine denitrification rates measured with a modified nitrogen gas flux technique[J].Estuarine,Coastal and Shelf Science,1994,38(2):137-156.
[37]Chen N W,Wu J Z,Chen Z H,et al.Spatial-temporal variation of dissolved N2and denitrification in an agricultural river network,southeast China[J].Agriculture,Ecosystems&Environment,2014,189:1-10.
[38]冯露露,李正魁,周涛.太湖浮游植物和各形态无机氮的时空分布特征[J].湖泊科学,2012,24(5):739-745. FENG Lu-lu,LI Zheng-kui,ZHOU Tao.Temporal and spatial distributions of phytoplankton and various forms of inorganic nitrogen in Lake Taihu[J].Journal of Lake Sciences,2012,24(5):739-745.
[39]汪益嫔,张维砚,徐春燕,等.淀山湖浮游植物初级生产力及其影响因子[J].环境科学,2011,32(5):1249-1256. WANG Yi-pin,ZHANG Wei-yan,XU Chun-yan,et al.Phytoplankton productivity and its influencing factors in Dianshan Lake[J].Environment Science,2011,32(5):1249-1256.
[40]Ploug H,Adam B,Musat N,et al.Carbon,nitrogen and O2fluxes associated with the cyanobacterium nodularia spumigena in the Baltic Sea [J].The ISME Journal,2011,5(9):1549-1558.
Preliminary investigation on the denitrification of reclaimed water intake area of the Chaobai River
HE Bao-nan1,HE Jiang-tao1*,WANG Jian2,LI Jie1
(1.Key Laboratory of Water Resources and Environmental Engineering,School of Water Resources and Environment,China University of Geosciences,Beijing 100083,China;2.East China University of Technology,Nanchang 330013,China)
Monitoring points were set along reclaimed water supply path in intake area of the Chaobai River in Shunyi.N2∶Ar ratio method and membrane introduction mass spectrometry(MIMS)were used to determine dissolved nitrogen directly,and then N2fluxes on water-air interface were calculated.Based on these,N2fluxes changing characteristics and controlling factors of-N changes along the river were investigated,and then contributions of main factors in-N transformation were estimated.The results showed that N2fluxes in the Jian River and the Chaobai River were 8.92~15.20 mmol N2·m-·2d-1and 17.07~33.01 mmol N2·m-2·d-1,respectively.Denitrification combined with assimilation of phytoplankton led to variation of-N concentration at different parts of intake area.In the Jian River,nitrogen removal amounts caused by denitrification and phytoplankton were 0.041 mmol·L-1and 0.017 mmol·L-1,accounting for 68.33%and 28.33%of total-N changes,respectively.In the Chaobai River,the values were 0.254 mmol·L-1and 0.125 mmol·L-1,accounting for 63.50%and 31.25%,respectively.
reclaimed water;denitrification;N2∶Ar ratio method;N2flux
X522
A
1672-2043(2016)08-1565-08
10.11654/jaes.2016-0268
2016-03-03
中央高校基本科研业务项目(2012065);2012环保部公益项目(20120953-2)
何宝南(1992—),男,硕士研究生,主要研究方向为地下水环境。E-mail:754744529@qq.com
何江涛E-mail:jthe@cugb.edu.cn

