全反式视黄酸通过RARα对铁调节蛋白2的基因表达的影响
蓝 岚,梁克纪,张羽飞,李厚忠
(1 黑龙江省牡丹江市卫生局卫生监督所传染病监督科,黑龙江牡丹江 157000 1;2 牡丹江第一人民医院血液科,黑龙江牡丹江 157011;3 牡丹江医学院医药研究中心,黑龙江牡丹江 157011;4 牡丹江医学院药学院药理研究室,黑龙江牡丹江 157011)
全反式视黄酸通过RARα对铁调节蛋白2的基因表达的影响
蓝岚1,梁克纪2,张羽飞3,李厚忠4
(1黑龙江省牡丹江市卫生局卫生监督所传染病监督科,黑龙江牡丹江157000 1;2牡丹江第一人民医院血液科,黑龙江牡丹江157011;3牡丹江医学院医药研究中心,黑龙江牡丹江157011;4牡丹江医学院药学院药理研究室,黑龙江牡丹江157011)
目的:通过体外肝细胞培养来研究全反式视黄酸(atRA)对铁调节蛋白2(IRP2)的影响。方法:体外实验将大鼠原代肝细胞按Seglent法分离后,随机分为严重缺乏组A、边缘性缺乏组B、正常生理组C、治疗剂量组D、RARα阻抑组E,分别给予0、0.5、1.0、50μmol/L全反式视黄酸和50μmol/L全反式视黄酸+10μmol/LRO培养96h。用逆转录—聚合酶链反应(RT-PCR法)检测肝脏的IRP2mRNA的表达。结果:大鼠全反式视黄酸缺乏时,肝脏IPR2mRNA表达增强(P<0.05),补充全反式视黄酸后,IPR2mRNA表达减弱,但阻抑RARα后,VA这种作用减弱。结论:全反式视黄酸可通过RARα改变IRP2mRNA的转录来影响铁代谢。
全反式视黄酸;视黄酸核受体α;铁调节蛋白2
维生素A缺乏(vitaminAdeficiency,VAD)和铁缺乏(irondeficiency,ID)两者作为最常见的微量营养素缺乏性疾病,其关系已越来越受到关注。维生素A的水平对细胞铁状态的调节有明显影响,维生素A缺乏干扰铁代谢最终导致贫血,但作为贫血的主要发生原因之一,其具体的影响机制还不是十分清楚。近年来,研究证明,细胞铁稳态重要的调节机制是诱导物诱导铁调节蛋白转录水平和蛋白水平,进而影响Fn和TFR水平来调节铁的代谢[1,2]。为证明维生素A,特别是全反式视黄酸(all-transretinoicacid,atRA),能够通过激活视黄酸细胞核受体(retinoicacidreceptor,RARα),从而诱导铁调节蛋白2(ironregulatoryprotein2,IRP2)基因的表达最终影响铁代谢,本研究通过阻抑实验进一步确认atRA对铁代谢的基因影响是通过RARα途径调节,为进一步证实维生素A缺乏导致贫血的机制提供科学依据。
1 材料与方法
1.1试剂
Ⅳ型胶原酶、Ⅰ型胶原和DMEM培养液等(Dulbecco’smodifiedEaglemedium)培养基,购于GibcoBRL;PCR试剂TaKaRaTaqDNAPolymeraseKit,购于大连宝生物工程有限公司;Ro41-5253(RARα选择性拮抗剂,Ro),购于Enzolifescience.Co,引物为上海英骏生物技术有限公司提供合成等。
1.2肝细胞培养及处理
SD大鼠24只,禁食12h采用Seglent法分离原代肝细胞[3],将活力在90%以上的大鼠肝细胞(台盼兰)5×105/mL的密度接种于I型胶原凝胶的包被的培养板内。等待原代大鼠肝细胞培养12h后,将原代肝细胞随机分为5组:A组为VA完全缺乏组:培养液中只含有0.5%DMSO,没有atRA;B组为VA边缘缺乏组:0.5μmol/LatRA;C组为VA正常对照组:1μmol/LatRA;D组为VA治疗组:培养液中含有0.5%DMSO、50μmol/LatRA;E组为培养液中含有50μmol/LatRA、10μmol/LRo。5组培养液共有的成分:10%胎牛血清;表皮生长因子、肝细胞生长因子各10μg/L;青霉素、链霉素、胰岛素、地塞米松分别为40万U/L、100mg/L、500U/L、0.4mg/L。培养96h的肝细胞备用。
1.3肝脏mRNA检测
内参照(β-actin),铁调节蛋白2(IRP2)表达检测:β-actin(512bp):上游:5′-GTGATGGTGGGAATGGGTCAG-3′;下游5′-TTTGATGTCACGCACGATTTCC-3′IRP2(459bp)上游:5′-GTTTGTCTCCAGGCAGTG-3′;下游:5′-ACCGTTTATTTCCCATCT-3′。PCR条件为预变性94℃4min,变性94℃30s,退火55℃30s,72℃延伸50s,β-actin,IRP2循环35个循环。72℃10min后,4℃储存。PCR产物经凝胶电泳计算IRP2产物的密度值(与β-actin的密度值作为参考)[4]。
1.4统计分析
采用SPSS16.0软件进行统计,多组整体比较采用完全随机设计的方差分析,两两比较采用Q检验,以α=0.05作为检验标准。
2 结果与分析
各组大鼠肝脏IRP2mRNA表达情况:A、B、C、D组随着atRA剂量的增加,IRP2mRNA是表达下降的趋势(差异具有显著性),但VA缺乏组和边缘缺乏组之间IRP2mRNA含量差异没有统计学意义(P>0.05)。D组IRP2mRNA的表达最低,A组最强,E组介于A、D之间(P<0.05)(图1、图2)。可见,atRA缺乏可以使大鼠原代肝细胞IRP2mRNA的表达增强,补充atRA可使其表达降低,但在加入RO后,这种减弱作用缓解。

图1 atRA作用后各组IRP2 mRNA的表达(459bp)
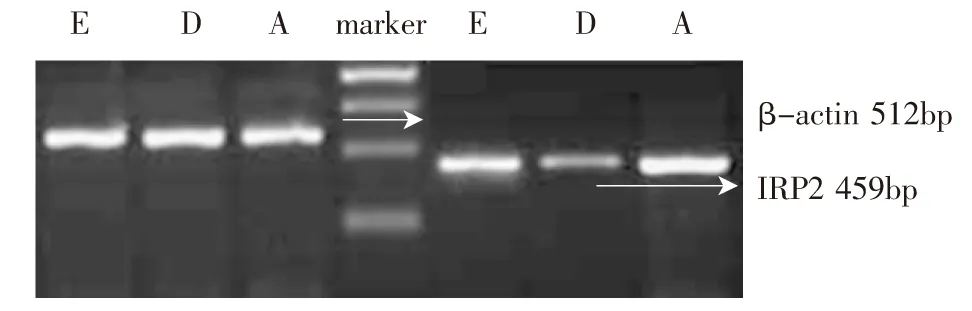
图2 加入RO后IRP2 mRNA表达情况比较
3 讨论
VA对细胞铁稳态的调节机制的深入研究,为研究维生素A缺乏对贫血的影响提供了分子生物学基础。VA,特别是全反式视黄酸(后者为前者的天然代谢产物),通过视黄酸胞内结合蛋白(cellularretinoicacidbindingprotein,CRABP)、视黄酸核受体(RARs、RXRs)及视黄酸反应元件(retinoicacidresponsiveelement,RARE)参与作用激活很多种基因,来调节组织细胞的特定功能,如生长因子和受体、激素、细胞酵素及其效应器的基因[5]。另一方面,铁代谢相关基因的发现使人们对铁在体内代谢的分子机理认识有了初步的了解。
细胞铁的稳态主要被几种蛋白所调控,这些蛋白的数量直接关系到细胞铁代谢的平衡,它们协作完成铁在细胞内的利用,确保在细胞需要时有足够的铁供给,但却避免铁毒性。调控这些蛋白的水平从而调节细胞铁浓度的中心蛋白-铁调节蛋白(IRP)位于铁代谢的中心位置。铁调节蛋白是一种调节胞浆RNA结合蛋白,与存在于转铁蛋白受体、铁蛋白mRNA3′端或5′端非翻译区(UTR)的铁效应元件IREs结合,在转录后水平控制转铁蛋白受体、铁蛋白的表达来调控哺乳动物细胞的铁代谢,并且IRP1、IRP2在细胞质中表达。IRP靶向切除的小鼠表明IRP2(而不是IRP1)是哺乳动物的铁稳态起反应的主要的转录后调节物,故本研究基因表达的分析选择了IRP2[6,7]。
本试验证明,维生素A,特别是全反式视黄酸,能够通过激活视黄酸细胞核受体,激活视黄酸反应元件,从而诱导IRP2基因的表达最终影响铁代谢。当机体维生素A缺乏时,肝脏IRP2mRNA表达增多,使肝细胞从血中摄取、吸收、储存铁增多,促进机体肝、脾等实质脏器的网状内皮细胞系统铁储存增加,动员减少、转运受阻,进而导致红细胞内铁含量降低,骨髓的铁摄取受损,最终导致贫血的发生,与陈科[8]的研究一致。VA通过影响铁储备和利用产生作用,VA营养状况越好,机体铁动员效率越高,肝脏储铁越少;而VA营养状况越差,机体铁动员效率越低,铁在肝脏中储存,向组织和血液中转运受阻,组织和血液、骨髓中缺铁,造成贫血的发生。但本研究不排除atRA通过调节其他途径来干扰IRP2的调节功能,因为除了细胞内铁稳态,还有很多因素可以影响的IRP的活性,例如缺氧和氧化应激反应等。◇
[1]K.W.Sijtsma,etal.IronstatusinratsfedondietscontainingmarginalamountsofvitaminA[J].BritishJournalofNutrition,1993,70:111-185、777.
[2]EisensteinRS.Ironregulatoryproteinsandthemolecularcontrolofmammalianironmetabolism[J].AnnuRevNutr,2000,20:622-627.
[3]王莹,等.三明治构型大鼠原代肝细胞长期培养及生物学特性的研究[J].首都医科大学学报,2007,28(1):2017-2031.
[4]徐小磊,王朝旭,苏畅,等.维生素A缺乏对大鼠铁代谢影响[J].中国公共卫生,2008,24(10):1225-1226.
[5]DongWei,etal.TheExpressionofRetinoicAcidReceptorsinLymphNodesofYoungChildrenandtheEffectofAll-trans-RetinoicAcidontheBCellsfromLymphNodes[J].JournalofClinicalImmunology,2007,27(1):88-94.
[6]姜珊,王朝旭,姜丽英,等.维生素A缺乏对大鼠铁代谢影响[J].中国公共卫生,2011,27(10):1271-1272.
[7]蓝岚,王朝旭,史锐,等.全反式视黄酸对大鼠原代肝细胞铁代谢的影响[J].卫生研究,2009,38(5):603-606.
[8]陈科,等.儿童维生素A水平与机体TFR-F指数及总铁含量关系的研究[A].中国营养学会妇幼营养第七次全国学术会议论文汇编[C].2010:211-216.
(责任编辑李婷婷)
Effects of atRA on IRP2 mRNA Expression by RARα Pathway
LAN Lan1,LIANG Ke-ji2,ZHANG Yu-fei3,LI Hou-zhong4
(1Health Supervision Institute of Mudanjiang Municipal Health Bureau,Mudangjiang 157000,China;2The First Hospitl of Mudanjiang,Mudanjiang 157011,China;3Medical Research Center,Mudanjiang Medical University,Mudanjiang 157011,China;4Department of Pamacy,Mudanjiang Medical University,Mudanjiang 157011,China)

all-transretinoicacid(atRA);retinoicacidreceptor(RARα);ironregulatoryprotein2(IRP2)
FoodandNutritioninChina
国家自然科学基金(项目编号:30872107);黑龙江省自然科学基金(项目编号:D200641)。
蓝岚(1981—),女,硕士,主治医师,研究方向:传染病防控。

