蛋白磷酸酶5(PP5)对小鼠脂肪代谢的影响
王 君,邱 彬,刘 明,王 超,雍伟东,谢忠稳
(1. 安徽农业大学,茶与食品科技学院, 茶树生物学与资源利用国家重点实验室,安徽,合肥 230036;2. 中国医学科学院医学实验动物研究所, 基因与发育室,北京 100021 )
蛋白磷酸酶5(PP5)对小鼠脂肪代谢的影响
王君1,邱彬2,刘明2,王超2,雍伟东2,谢忠稳1
(1. 安徽农业大学,茶与食品科技学院, 茶树生物学与资源利用国家重点实验室,安徽,合肥230036;2. 中国医学科学院医学实验动物研究所, 基因与发育室,北京100021 )
目的利用蛋白磷酸酶5(PP5)基因敲除小鼠,探究PP5在小鼠脂肪代谢中的作用。方法随机选取6周龄雄性PP5基因敲除(PP5 KO)和野生型(WT)小鼠,高脂饲养6周后,应用HE染色和油红O染色技术对小鼠肝脏结构和脂滴积累进行检测,应用Western blotting和real-time PCR技术检测肝脏组织中脂代谢相关基因的表达情况。同时应用PP5 KO和WT小鼠成纤维细胞,在体外观察PP5对脂肪分化的影响。结果与WT小鼠相比,高脂饲养后PP5 KO小鼠体重与WT小鼠相比显著减轻,肝脏中脂滴数量显著较少且脂滴较小。体外实验发现与WT小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)相比PP5 KO MEF细胞脂肪分化显著较弱,脂滴较小。此外,在PP5 KO肝脏组织中脂肪分化标记基因CD36、AP2、PPARγ2和Glut4的相对表达量显著降低,而能量代谢相关蛋白糖皮质激素受体(GR)的磷酸化水平显著增加,解偶联蛋白1(UCP1)表达量也显著升高。结论 PP5通过调节GR的去磷酸化影响机体脂肪分化和能量代谢调控小鼠脂肪代谢。
蛋白磷酸酶5;糖皮质激素受体;解偶联蛋白1;脂肪分化;能量代谢
甾体激素受体是一类参与细胞调控的核受体超家族,对生物体具有极其重要的作用,主要包括糖皮质激素受体(GR)、雌激素受体(ER)、雄激素受体(AR)、孕激素受体(PR)以及盐皮质激素受体(MR)。其中糖皮质激素受体在个体中具有广泛表达,介导糖皮质激素(GCs)对机体糖、脂肪和蛋白质的生物合成和代谢等功能的调节作用。由于糖皮质激素(GCs)是全身能量平衡的重要调节因子[1],因而GR的活性变化将严重影响机体的物质能量代谢功能。蛋白磷酸酶5(PP5),是一种在机体内广泛表达的共伴侣蛋白,具有丝氨酸/苏氨酸磷酸酶活性,在细胞生长、增殖、分化、迁移以及胁迫条件下的细胞生存等方面都发挥重要作用[2, 3]。研究表明PP5能够直接与HSP90/GR复合体结合,通过催化GR的去磷酸化过程[4],调节GR活性。另有研究利用体外小鼠成纤维细胞脂肪诱导分化模型发现,敲除PP5可明显抑制脂肪分化[5]。这些结果提示PP5可能通过调节GR去磷酸化影响脂肪分化,但目前仍缺乏有力的体内实验证据。本研究利用PP5基因敲除小鼠和PP5敲除小鼠成纤维细胞,从体内和体外两方面探讨敲除PP5基因对脂肪代谢的影响及其分子机制。
1 材料和方法
1.1实验动物及实验环境
清洁级雄性PP5敲除(PP5 KO)小鼠为本实验室保存,PP5敲除小鼠及其野生型(WT)对照小鼠饲养繁殖于中国医学科学院医学实验动物研究所,动物使用合格号为【SYXK(京)2011-0022】。动物实验方案经中国医学科学院医学实验动物研究所实验动物使用与管理委员会批准,批准号为ILAS-PG-2014-012。
1.2实验仪器
电子天平(精度0.01 g,上海民桥电子天平厂)。MRI(7.0T micro MRIV,美国Varian公司)。石蜡切片机(IVS-401,日本Sakura Finetek公司)。冰冻切片机(CM1900,德国Lecia)。光学显微镜(BX50,日本Olympus公司)。PCR循环仪(Applied Biosystem 7500,美国ABI公司)。化学发光成像系统(Tanon 5500,中国天能公司)。
1.3材料
高脂饲料(60 kcal% fat,D12492)购自美国Research Diets公司。异氟宁(上海雅培制药有限公司)。高糖DMEM、胎牛血清(FBS)、青霉素-链霉素购自美国Invitrogen公司,用于培养小鼠胚胎成纤维细胞,使用前按每100 mL培养液中89%高糖DMEM、10% FBS和1%青/链霉素混合均匀后使用。磷酸酶抑制剂和蛋白酶抑制剂购自美国Sigma公司,RIPA裂解液购自中国碧云天生物科技有限公司,使用RIPA 裂解液1 mL/0.1 g组织、蛋白酶抑制剂10 μL/0.1 g组织(1片溶于100 mL三蒸水)、磷酸酶抑制剂1 μL/0.1 g组织的混合液裂解小鼠肝脏组织。地塞米松(DEX)、IBMX和胰岛素购自美国Sigma公司,使用终浓度为地塞米松1 μmol /L、IBMX 500 μmol /L、胰岛素10 μmol/mL 与DMEM的混合液诱导小鼠胚胎成纤维细胞脂肪分化。Trizol购自美国Invitrogen公司,按1 mL/0.1g组织提取mRNA。mRNA反转使用cDNA反转录试剂盒和荧光定量PCR试剂盒(SYBR green法)购自中国TaKaRa公司,组织蛋白定量使用BCA蛋白定量试剂盒购自中国碧云天生物科技有限公司,Western blotting 检测使用p-GR抗体购自美国Cell Signaling Technology公司,UCP1抗体购自美国Abcam公司,使用比例均为抗体:稀释液=1:1 000。
1.4实验方法
1.4.1小鼠高脂饲养和体重测量:随机选取6周龄雄性PP5 KO和WT小鼠各6只,高脂喂养6周,每周称量并记录小鼠体重1次。
1.4.2MRI扫描小鼠体内脂肪:取上述高脂喂养6周后的PP5 KO和WT雄鼠各3只, 2%异氟宁/O2(L/min) 对其进行麻醉后使用MRI进行扫描,应用IRW软件(Inveon Research Workplace,Siemens,美国)计算小鼠脂肪体积。
1.4.3肝脏组织HE染色和油红O染色:随机选取上述高脂诱导后PP5 KO和WT雄鼠各3只,脱颈处死,肝脏以10%中性福尔马林固定,石蜡包埋后以4 μm厚度切片,随后进行HE染色。另取1 cm × 1 cm × 0.5 cm大小肝脏经冰冻切片后,进行油红O染色。组织切片染色封片后光学显微镜下观察并采集图片。
1.4.4MEF细胞诱导脂肪分化:参考文献方法[6],永生化PP5 KO和WT型MEF细胞按2×105个/孔接种于60 mm细胞培养皿中,使用DMEM培养基(含10% FBS、1%青霉素-链霉素)在37℃、5% CO2条件的细胞培养箱中培养。待细胞密度达80%密度时(记为d-2),继续培养2天(记为d0)。在d0时,将培养基更换为含有脂肪分化诱导剂的DMEM培养基(含10% FBS、1%青霉素-链霉素、500 μmol /L IBMX、1 μmol /L DEX、10 μmol/mL insulin)。2 天后(d2)将培养基更换为只含有10% FBS和10 μmol /mL insulin的DMEM培养基,以后每2 d更换1次DMEM 培养基(10% FBS、1%青霉素-链霉素至d8。当细胞诱导分化至第8天时将细胞取出经油红O染色后,在光学显微镜(BX50,Olympus,日本)下观察并照像。
1.4.5肝脏mRNA提取及Real-time-PCR检测:取高脂诱导后PP5 KO和WT雄鼠各3只,脱颈处死,取其肝脏。以TRIzol法提取小鼠肝脏mRNA后,各样本以500 ng mRNA反转录合成cDNA,以Gapdh作为内参,使用SYBR green相对定量法进行PCR扩增反应。实验中用到的引物序列如下表1:
1.4.6Western blotting检测肝脏蛋白表达:取高脂诱导后PP5 KO和WT雄鼠各3只,脱颈处死,取其肝脏在冰上以RIPA蛋白裂解液(含10%蛋白酶抑制剂、1%磷酸酶抑制剂)提取组织蛋白。蛋白经BCA法定量后以60 μg上样量进行SDS-PAGE电泳,转膜封闭后孵育一抗(UCP1,1:1000;p-GR,1:1000)过夜。次日孵育二抗(1:5000)后以ECL法使用化学发光成像系统采集荧光信号。

表1 Realtime-PCR检测引物
2 结果
2.1PP5 基因敲除小鼠对高脂诱导的体重增加明显抑制
PP5 KO小鼠在高脂喂养3周后,体重明显轻于野生型小鼠;高脂诱导5周后,野生型小鼠体重达到(28.61±1.00)g,而PP5基因敲除小鼠体重仅为(23.70±0.72)g,二者相比具有显著性差异(P=0.0074,图1)。摄食量测定结果显示,PP5 KO小鼠和WT小鼠的摄食量没有差别,说明敲除PP5并不影响小鼠的摄食量。以上结果表明PP5基因敲除小鼠能够抵制高脂诱导的体重增加。
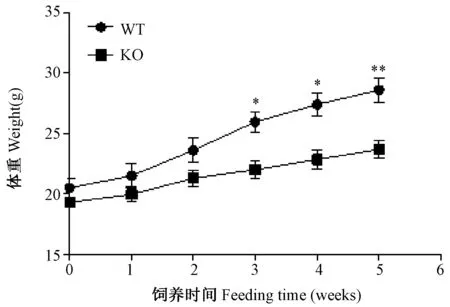
注:高脂饲养后小鼠周体重记录,n=6。*,P<0.05;**,P<0.01。图1 敲除PP5基因对小鼠体重的影响Note. The body weight of mice fed with high fat diet was recorded every week. n =6. *, P<0.05, **, P<0.01.Fig.1 The effect of knocking out PP5 on body weight of the mice.
2.2敲除PP5基因抑制高脂诱导的小鼠体内脂肪积累
通过核磁共振成像仪对高脂喂养6周后的WT和KO小鼠体内脂肪含量进行测定。图2A显示的白色区域表示脂肪组织,从图中可以看出WT小鼠的脂肪含量多于KO小鼠。运用Inveon Research Workplace软件计算白色区域的绝对脂肪面积,除以体重即是单位体重的绝对脂肪体积,结果如图2 B所示,WT小鼠的单位体重的绝对脂肪体积显著高于KO小鼠(P=0.0476)。这一结果表明,PP5 KO小鼠体脂含量显著少于对照组,未出现肥胖表型,提示敲除PP5基因能够抑制小鼠体内脂肪积累。
2.3敲除PP5基因小鼠肝脏脂肪沉积明显较少
高脂饲养6周后,WT小鼠肝脏切片HE染色显示有显著的脂肪堆积(空泡为脂肪组织),而PP5 KO小鼠肝脏切片中脂肪堆积明显少于WT,并且其脂肪颗粒较小(图3 A-D)。脂肪特异性油红O染色法对高脂诱导后的WT和PP5 KO小鼠肝脏进行分析,结果与HE染色一致(图3 E-H),高脂诱导后WT小鼠肝脏切片出现大量的红色脂滴,脂肪沉积严重,而PP5 KO小鼠肝脏切片与WT相比红色脂滴明显减少,并且脂滴较小。这些结果揭示PP5可能通过调节小鼠脂肪细胞的形成或者脂肪分解影响脂代谢。
2.4敲除PP5基因对小鼠胚胎成纤维细胞脂肪分化的影响
小鼠MEF细胞体外诱导脂肪分化实验结果显示,对体外诱导脂肪分化至第8天的小鼠MEF细胞进行油红O染色,结果如图4所示,与WT MEF细胞相比,PP5 KO MEF细胞在体外诱导脂肪分化后产生的脂滴数量明显较少,且脂滴大小也小于WT MEF细胞。这一结果进一步证实敲除PP5基因脂肪细胞的分化受到抑制。
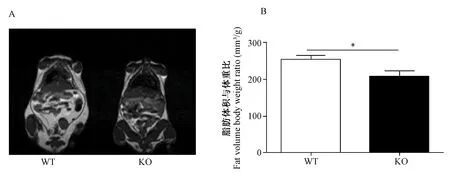
注:A.小鼠磁共振图;B.脂肪体积与小鼠体重比统计图,n =3。*,P<0.05;**,P<0.01。图2 敲除PP5对小鼠脂肪含量的影响Note. A: MRI photograph of mice. B: Statistic result of fat volume/body weight/ratios. n =3. *, P<0.05; **, P<0.01.Fig.2 The effect of knocking out PP5 on the mouse whole body fat
2.5敲除PP5对小鼠肝脏中脂代谢相关基因的影响
利用real-time PCR技术检测了高脂诱导后脂肪形成标记基因包括CD36、AP2、PPARγ2、Glut4及能量代谢相关基因GR和UCP1的表达。结果(图5 A-D)显示,与WT小鼠相比KO小鼠肝脏中CD36、AP2、PPARγ2和Glut4表达显著减少,GR表达没有差异性变化(图5E),但解偶联蛋白1(UCP1)表达量却显著性升高(图5 F)。用western blotting技术检测了p-GR和UCP1在蛋白水平上的变化。结果显示(图6),高脂诱导后PP5 KO小鼠肝脏中p-GR和UCP1蛋白表达量显著升高。这些结果表明PP5敲除后小鼠能量代谢增强,脂肪分化减弱。
3 讨论
我们前期研究发现在细胞水平敲除PP5可使脂肪分化作用减弱[5]。本研究利用PP5基因敲除小鼠和PP5敲除小鼠MEF细胞,从体内和体外两方面探讨敲除PP5基因对脂代谢的影响以及参与这一过程的分子机制。实验结果发现,高脂诱导后PP5 KO小鼠体重较WT小鼠显著减轻,单位体重脂肪体积显著低于WT小鼠。进一步通过对高脂饲养小鼠肝脏HE和油红O染色证实,引起上述表型的原因可能是PP5 KO小鼠脂肪分化减少或者脂肪代谢增强导致。体外诱导MEF细胞脂分化实验证实,敲除PP5基因具有明显降低脂分化的能力。通过real-time PCR和western blotting技术分析脂肪代谢相关基因表达,发现PP5 KO脂肪形成标记基因CD36、AP2、PPARγ2、Glut4相对表达量显著降低,能量代谢相关基因GR相对表达量无显著性变化,但磷酸化GR(p-GR)和UCP1的蛋白表达量显著升高。这些结果表明PP5基因敲除后小鼠能量代谢增强,脂肪分化减弱。
高脂饮食和运动缺乏的情况下机体会将未能消耗的营养成分转化为脂肪储存在脂肪组织、肝脏、肌肉中。一旦体内能量供应不足时,GCs就会促进脂肪和蛋白质分解,为机体提供能量。而GR通过介导GCs实现对机体糖、脂肪和蛋白质的生物合成和分解代谢等功能的调节作用,GCs是全身能量平衡的重要调节因子[1],因而GR作为转录因子通过调控脂肪分解基因、脂肪形成基因,如CD36和Glut4的表达对机体的物质能量代谢起到重要调控作用。GR与热休克蛋白90相互结合,而PP5通过它的TPR结构域与热休克蛋白90结合,从而与GR构成复合物行使转录因子功能[7]。PP5作为蛋白磷酸酶能够使GR去磷酸,这将增强GR的活性[1, 4, 8]。我们的实验结果表明当PP5敲除后GR磷酸化水平升高,抑制脂肪形成相关基因CD36、AP2、PPARγ2、Glut4的表达,在PP5 KO小鼠体内揭示了PP5对脂肪形成的抑制作用这与已报道的体外实验结果一致,并且当PP5 KO MEF细胞重新获取PP5之后这种抑制作用减弱[5]。
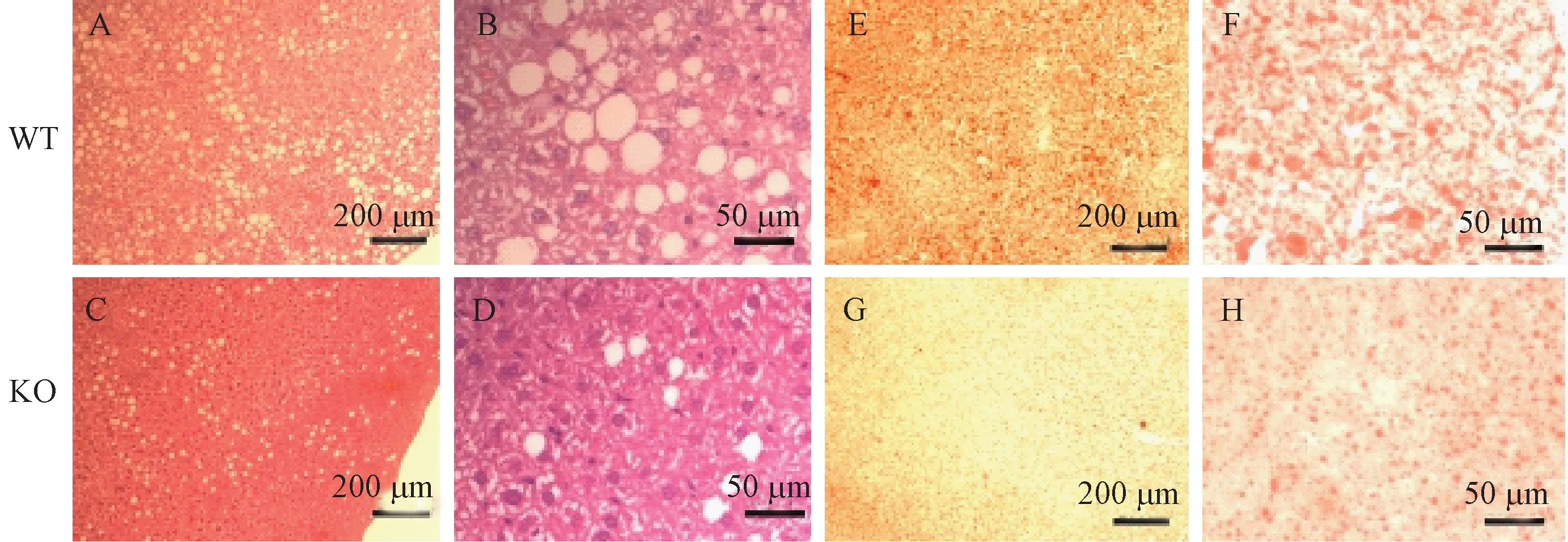
注:A-D.肝脏石蜡切片HE染色;E-H.肝脏冰冻切片油红O染色.图3 PP5对小鼠肝脏脂肪的影响(10倍,标尺=200 μm;40倍,标尺=50 μm)Note. A-D: HE staining; E-H: Oil red O staining. Fig.3 Effect of PP5 on the mouse liver fat. 10 times, bar=200 μm; 40 times, bar=50 μm.
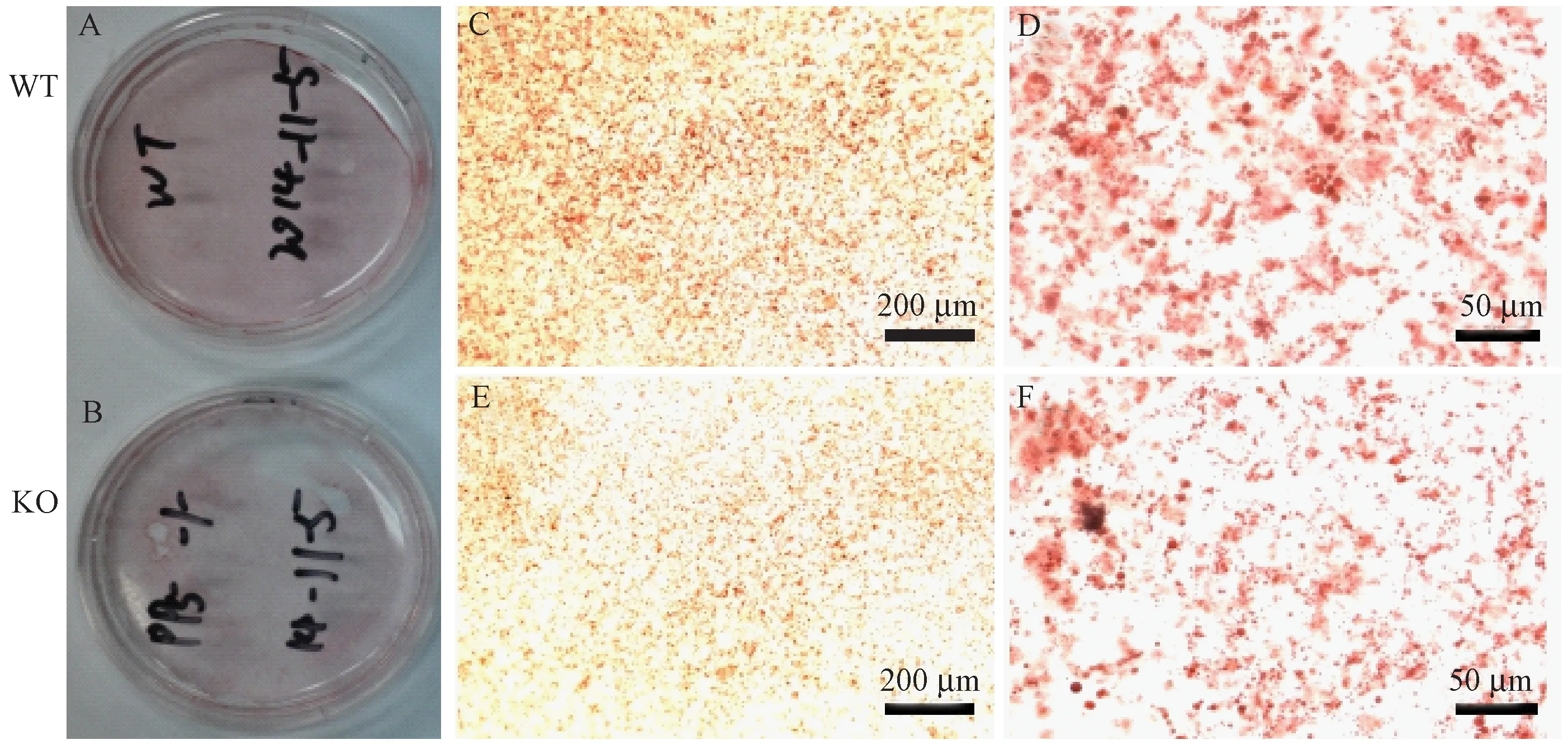
注:A-F.诱导分化后WT和KO MEF细胞油红O染色。图4 敲除PP5基因抑制MEF细胞脂肪分化(10倍,标尺=200 μm;40倍,标尺=50 μm)Note: A-F. Adipocyte deffereniation of WT and KO mouse embryonic fibroblasts.Oil red O staining. Fig.4 Knocking out PP5 prevents the adipogenesis of MEF cells (10 times, bar=200 μm; 40 times, bar=50 μm)
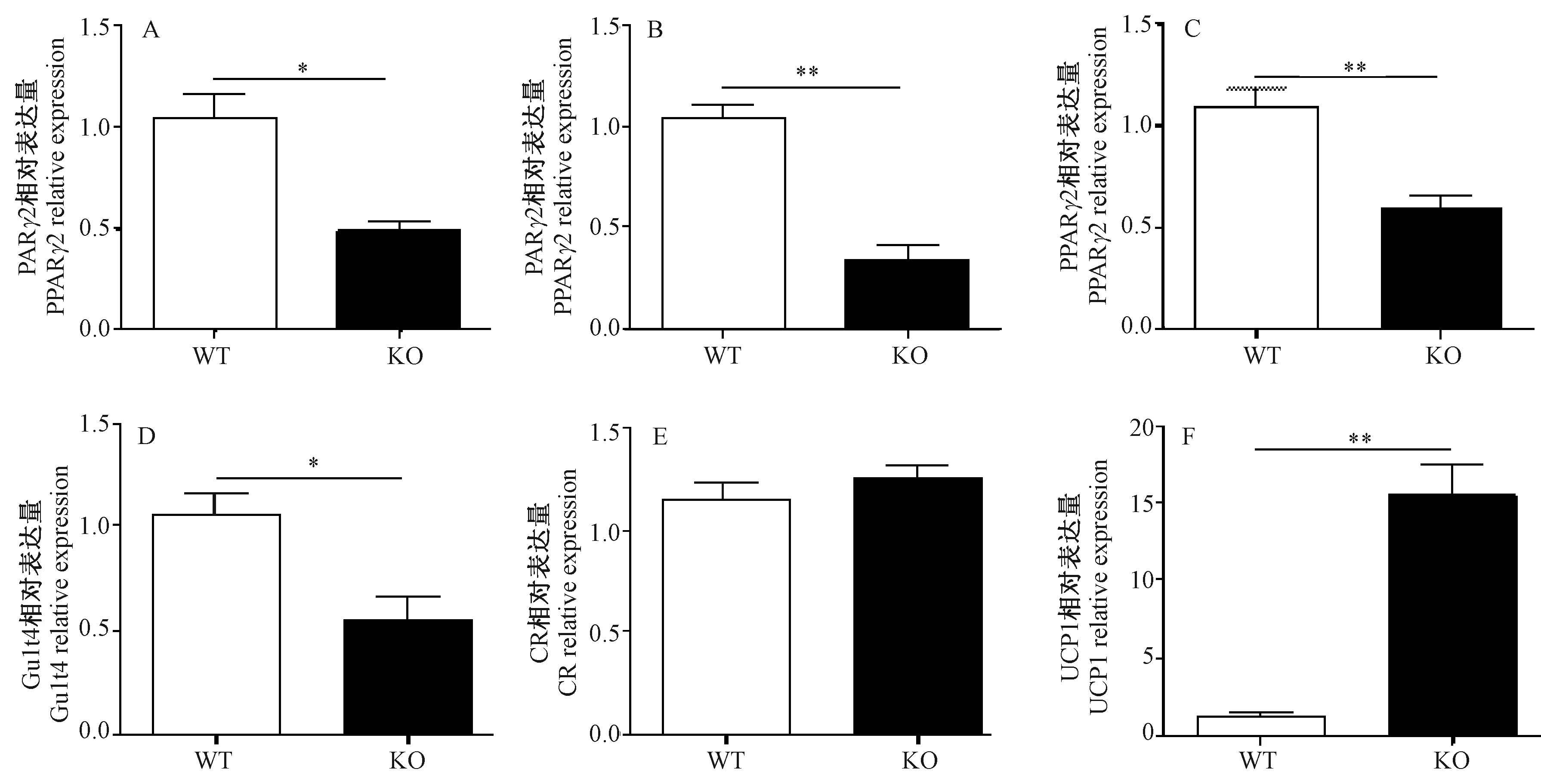
注:n=3。*,P<0.05;**,P<0.01。图5 肝脏中脂代谢相关基因表达Note: n=3. *, P<0.05; **, P<0.01.Fig.5 Expression of lipid metabolism-related genes in the mouse livers.
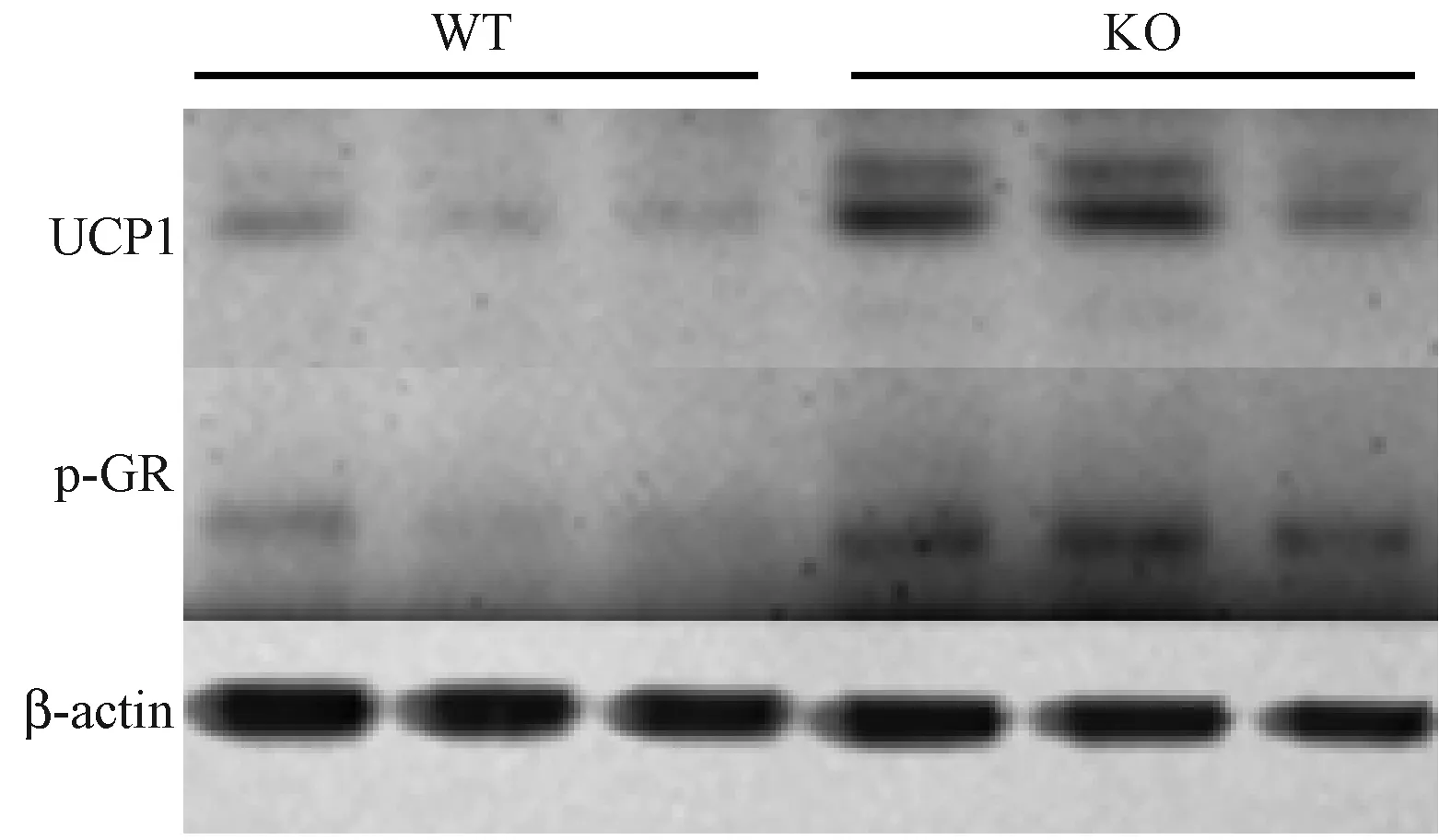
图6 肝脏中UCP1和p-GR的表达Fig.6 The expression of UCP1 and p-GR in the livers
哺乳动物体内的脂肪组织分为白色脂肪和棕色脂肪,白色脂肪主要以甘油三脂的形式储存能量,而棕色脂肪则通过氧化分解脂肪为机体提供热量[9],这种作用主要通过线粒体膜上的解偶联蛋白1(UCP1)完成[10]。已有研究证实与野生型小鼠相比UCP1缺乏的小鼠对高脂诱导型肥胖更加敏感[11],与此相反,过表达UCP1的小鼠抵抗高脂诱导型肥胖[12]。我们实验中发现,当PP5敲除后小鼠UCP1表达量升高且小鼠表现出对高脂诱导型肥胖的抵抗,这一现象此前未见报道,但PP5通过UCP1调控小鼠能量代谢的具体机制尚不清楚,有待进一步的研究。由于PP5是一种蛋白磷酶,目前尚未有关于PP5是否能够影响UCP1磷酸化的报道,而糖皮质激素(GCs)能够抑制UCP1的表达[13],因此我们推断PP5 KO中UPC1的增加是一个间接调控过程, 可能的机理也许是PP5敲除后GR活性增强,大量的GCs与GR结合从而对UCP1的抑制减弱,UCP1的表达量升高进而增强由UCP1介导的脂分解能量代谢。PP5,GR和UCP1三者之间的关系还有待进一步的深入研究。
[1]Vegiopoulos A, Herzig S. Glucocorticoids, metabolism and metabolic diseases[J]. Mol Cell Endocrinol, 2007, 275(1-2): 43-61.[2]Dean DA, Urban G, Aragon IV, et al. Serine/threonine protein phosphatase 5 (PP5) participates in the regulation of glucocorticoid receptor nucleocytoplasmic shuttling[J]. BMC Cell Biol, 2001, 2: 6.
[3]Golden T, Swingle M, Honkanen R E. The role of serine/threonine protein phosphatase type 5 (PP5) in the regulation of stress-induced signaling networks and cancer[J]. Cancer Metastasis Rev, 2008, 27(2): 169-178.
[4]Jacob W, Rosenzweig D, Vazquez-Martin C, et al. Decreased adipogenesis and adipose tissue in mice with inactivated protein phosphatase 5[J]. Biochem J, 2015, 466(1): 163-176.
[5]Hinds TJ, Stechschulte LA, Cash HA, et al. Protein phosphatase 5 mediates lipid metabolism through reciprocal control of glucocorticoid receptor and peroxisome proliferator-activated receptor-gamma (PPARgamma)[J]. J Biol Chem, 2011, 286(50): 42911-42922.
[6]张曼,邱彬,曹勇,等. 共伴侣蛋白FKBP51在高脂诱导肥胖中的作用[J]. 中国比较医学杂志, 2015(07): 53-58.
[7]Silverstein AM, Galigniana MD, Chen MS, et al. Protein phosphatase 5 is a major component of glucocorticoid receptor.hsp90 complexes with properties of an FK506-binding immunophilin[J]. J Biol Chem, 1997, 272(26): 16224-16230.
[8]Smas CM, Chen L, Zhao L, et al. Transcriptional repression of pref-1 by glucocorticoids promotes 3T3-L1 adipocyte differentiation[J]. J Biol Chem, 1999, 274(18): 12632-12641.
[9]Tseng YH, Cypess AM, Kahn CR. Cellular bioenergetics as a target for obesity therapy[J]. Nat Rev Drug Discov, 2010, 9(6): 465-482.
[10]Schneider K, Valdez J, Nguyen J, et al. Increased energy expenditure, UCP1 expression and resistance to diet-induced obesity in mice lacking nuclear factor-erythroid-2 related transcription factor-2 (Nrf2)[J]. J Biol Chem, 2016. doi: 10.1074/jbc.M115.673756
[11]Feldmann HM, Golozoubova V, Cannon B, et al. UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality[J]. Cell Metab, 2009, 9(2): 203-209.
[12]Kopecky J, Clarke G, Enerback S, et al. Expression of the mitochondrial uncoupling protein gene from the aP2 gene promoter prevents genetic obesity[J]. J Clin Invest, 1995, 96(6): 2914-2923.
[13]Soumano K, Desbiens S, Rabelo R, et al. Glucocorticoids inhibit the transcriptional response of the uncoupling protein-1 gene to adrenergic stimulation in a brown adipose cell line[J]. Mol Cell Endocrinol, 2000, 165(1-2): 7-15.
Influence of protein phosphatase 5 on the lipid metabolism in mice
WANG Jun1, QIU Bin2, LIU Ming2, WANG Chao2,YONG Wei-dong2, XIE Zhong-wen1
(1. College of Tea and Food Sciences, State Key Laboratory of Tea Plant Biology and Utilization, Anhui Agricultural University,Hefei 230036, China; 2. Laboratory of Gene and Development, Chinese Academy of Medical Sciences , Beijing 100021)
ObjectiveTo investigate the effect of protein phosphatase 5 (PP5) on lipid metabolism in the PP5 knockout (KO) mice. Methods Male PP5 KO and wild type (WT) mice at the age of 6 weeks were used in this study. In order to study the effect of high fat diet (HFD) feeding, the body weight was measured. The liver histology was examined by HE and oil red O staining. To further verify PP5 functions in the adipogenesis,invitroexperiment was carried out using mouse embryonic fibroblasts (MEF). Western blotting and real-time PCR were performed to quantified the expression of lipid metabolism-related genes in the liver tissues.ResultsCompared with the WT mice, the body weight gain was slower in the KO mice. The size of the lipid droplets was smaller and the quantity was less in the KO mouse liver tissue.Invitrostudy revealed that the KO mouse MEF cells showed less differentiated adipocytes with smaller lipid droplets than the WT MEF cells. This observation was further confirmed by detecting the expression of adipogenesis-related genes in the HFD liver. The markers of adipocyte differentiation, such asCD36,AP2,PPARγ2, andGlut4, were significantly decreased, while energy expenditure-related markers, such as phosphorylation of GR and expression of UCP1, were significantly increased. ConclusionsProtein phosphatase 5 may play a regulatory role in the mouse lipid metabolism through regulating the de-phosphorylation of p-GR and enhancing the expression of UCP1.
Protein phosphatase 5; GR; UCP1; Adipocyte differentiation; Energy metabolism; Mice
国家自然科学基金(81272273)、国家科技重大专项(2014ZX10004002-003-001)资助。
王君(1991-),女,硕士研究生,研究方向:营养与发育生物学。E-mail: junwang138@sina.com。
谢忠稳,男,教授,研究方向:营养与代谢生物学,Email: zhongwenxie@ahau.edu.cn;雍伟东,男,研究员,研究方向:生殖与发育生物学,Email: wyong@cnilas.org。
研究报告
R-33
A
1671-7856(2016) 08-0079-06
10.3969.j.issn.1671-7856.2016.08.013
2016-04-19

