尿通卡克乃其片大鼠长期毒性实验的血液指标变化
热比姑丽·伊斯拉木,阿布都吉力力·阿布都艾尼,冷英莉,王 静
(1. 新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐,新疆 830049;2. 新疆银朵兰维药股份有限公司,乌鲁木齐,新疆 830013)
尿通卡克乃其片大鼠长期毒性实验的血液指标变化
热比姑丽·伊斯拉木1,阿布都吉力力·阿布都艾尼1,冷英莉2,王静2
(1. 新疆维吾尔自治区维吾尔医药研究所,乌鲁木齐,新疆830049;2. 新疆银朵兰维药股份有限公司,乌鲁木齐,新疆830013)
目的探讨尿通卡克乃其片大鼠长期毒性试验血液学指标变化。方法SD大鼠120只,雌雄各半,随机分为对照组,尿通卡克乃其片低、中、高剂量组。对照组为灌胃给予0.5%羧甲基纤维素钠混悬液,低、中、高剂量组分别灌胃给予尿通卡克乃其片0.32g、1.6g、3.2g(生药)/kg·d,每周6 d,连续180 d,分别观察大鼠在给药90 d、180 d及停药后30 d一般状况、血液细胞变化、血生化变化,电解质及血凝指标变化。结果在实验期间大鼠未见死亡或无明显毒性反应。与对照组比较,在实验期间大鼠红细胞计数(RBC)、血红蛋白(HGB)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、血小板计数(PLT)、白细胞计数(WBC)、淋巴细胞百分含量(LYMP%);丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、葡萄糖(GLU)、尿素氮(BUN)、白蛋白(ALB)、总胆红素(TBIL)、肌酐(Crea)、总胆固醇(TCHO)、甘油三酯(TG)、肌酸磷酸激酶(CK);钾离子浓度(K+)、钠离子浓度(Na+)、氯离子浓度(Cl-)、凝血酶原时间(PT),具有统计学差异(P<0.05~P<0.01),但未见时间、剂量规律性,无病理意义。结论0.32 g、1.6 g、3.2 g(生药)/kg·d 剂量下灌胃尿通卡克乃其片原料粉180 d对大鼠血液指标无明显异常,该药在临床剂量下长期使用是安全的。
尿通卡克乃其片;大鼠;长期毒性;血液指标
尿通卡克乃其片是在古代维医秘方的基础上采用现代科学技术研制而成的片剂,由酸浆、黄瓜子、血竭、西黄耆胶、阿拉伯胶、巴旦仁等10味维吾尔药材组成,具有镇痛、利尿的功效。临床上用于治疗尿痛、尿不尽、尿血、尿道流脓等[1]。本文初步探讨尿通卡克乃其片(100%处方原药粉)的大鼠灌胃长期毒性试验血液学指标变化,对其临床应用安全性进行再评价。
1 材料和方法
1.1实验动物及实验环境
SD大鼠140只,SPF级,雌雄各半,体重60~90 g,由新疆医科大学医学实验动物中心提供,生产许可证号:SCXK (新) 2003-0001。实验动物使用许可证号:SYXK(新)2003-0002。动物实验经新疆维吾尔自治区维吾尔医药研究所药物安全性评价中心(GLP)审核,符合动物伦理委员会的管理准则。实验开始前检疫,经一般行为观察,选用符合要求的120只大鼠(♀、♂各半)进行长期毒性试验。
1.2仪器与试剂
PM4000/3全自动生化分析仪,意大利·罗马;BC300全血细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;HK2003电解质分析仪,郑州市汇科电子有限公司;SZZ血凝分析仪,深圳市鹏瑞佳电子有限公司;高速冷冻离心机,TGL-16G,金坛市华峰仪器有限公司。
尿通卡克乃其片(100%处方原药粉)由新疆华康药业有限责任公司(现新疆银朵兰维药股份有限公司)提供,批号:080601。红细胞计数(RBC)、血红蛋白(HGB)、红细胞容积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、血小板计数(PLT)、白细胞计数(WBC)、淋巴细胞百分含量(LYM%)、中间细胞百分含量(MID%)、粒细胞百分含量(GRA%)、网织红细胞数(Ret);丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、葡萄糖(GLU)、尿素氮(BUN)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、肌酐(Crea)、总胆固醇(TCHO)、甘油三酯(TG)、肌酸磷酸激酶(CK);钾离子浓度(K+)、钠离子浓度(Na+)、氯离子浓度(Cl-)、凝血酶原时间(PT),上述试剂盒均购自中生北控生物科技股份有限公司。
1.3动物实验[2-4]
1.3.1动物分组及给药方法:取120只大鼠,雌雄分别按体质量随机分为4组,分别为对照组、尿通卡克乃其片(原药粉)低、中、高3个剂量组。每组30只,雌雄各半。对照组0.5% CMC-Na混悬液;尿通卡克乃其片低剂量组为0.32 g(生药)/kg,中剂量组为1.6 g(生药)/kg,高剂量组为3.2 g(生药)/kg(即分别相当于临床成人每日每公斤用的5、25、50倍)。本实验采用与临床一致的给药途径,灌胃给药(1 mL/100 g·bw)。每天给药1次,每周给药6 d,连续给药180 d。分别在给药90 d结束时、给药180d结束时和停药30 d结束时,每组各处死10只(雌雄各半)。
1.3.2观察指标:
1.3.2.1一般状况观察:每日观察大鼠一般形态外观、行为活动、饮食情况、分泌物、排泄物等,同时观察动物中毒反应的症状,起始时间,严重程度,持续时间,是否可逆,填写笼旁观察记录表肉眼观察动物。
1.3.2.2血细胞指标检测:分别在给药90 d结束时(处死40只,雌雄各半)、给药180 d结束时(处死40只,雌雄各半)和停药30 d结束时(处死40只,雌雄各半),检查各组大鼠血细胞指标(RBC、HGB、HCT、MCV、MCH、MCHC、PLT、WBC、LYM%、MID%、GRA%、Ret)1次,总共3次。
1.3.2.3血生化指标检测:分别在给药90 d结束时(处死40只,雌雄各半)、给药180 d结束时(处死40只,雌雄各半)和停药30 d结束时(处死40只,雌雄各半),检查各组大鼠血生化指标(ALT、AST、ALP、GLU、BUN、TP、ALB、TBIL、Crea、TCHO、TG、CK)1次,总共3次。
1.3.2.4电解质及血凝检测:分别在给药90 d结束时(处死40只,雌雄各半)、给药180 d结束时(处死40只,雌雄各半)和停药30 d结束时(处死40只,雌雄各半),检查各组大鼠电解质指标(K+、Na+、Cl-)及血凝指标(PT)1次,总共3次。
2 结果
2.1一般观察
与对照组比较,尿通卡克乃其片组(低、中、高剂量)分别在给药90 d结束时、给药180 d结束时和停药30 d结束时,大鼠未见动物死亡或无明显毒性反应。
2.2血细胞指标检测
与对照组比较,给药180 d RBC(♀:M)、HGB(♀:M、H)降低(P<0.05),分别在给药90 d和停药后30 d均差异无统计学意义(P>0.05);给药90 d MCH(♂:L、H)升高(P<0.05),分别在给药180 d和停药后30 d均差异无统计学意义(P>0.05);MCHC在给药90 d(♂♀:L、M、H),给药180 d(♂:L、M,♀:H),停药30 d(♀:L、M)差异有统计学意义(P<0.05);给药90 d WBC(♀:M、H)、LYMP%(♀:L)、PLT(♂:M)升高(P<0.05),给药180 d均差异无统计学(P>0.05),但停药30 d PLT(♂:M)升高(P<0.05)。结果见表1。
2.3血生化指标检测
与对照组比较,AST(♂)在给药90 d(L)、给药180 d(H)、停药30 d(H)降低(P<0.05);给药180 d ALT(♂:M、H)降低、BUN(♀:H)升高(P<0.01),停药30 d ALT(♂:M)、BUN(♂:M)均升高(P<0.05);分别在给药180 d和停药30 d ALP(♂,H)降低,GLU(♀,H)升高(P<0.05~P<0.01);给药90 d CK(♂:L)、ALB(♀:H)、TCHO(♀:L)降低(P<0.05),分别在给药180 d和停药30 d除TCHO,♂M外均差异无统计学意义(P>0.05);停药30 d TBIL(♂:H)降低(P<0.01),分别在给药90 d、180 d均差异无统计学意义(P>0.05);给药180 d Crea(♂:M)、TG(♂:L,M,H)降低,分别在给药90 d、停药30 d均差异无统计学意义(P>0.05)。结果见表2。
2.4电解质及血凝检查
与对照组比较,给药90 d,K+(♂♀:L、M、H)、Na+(♂:L,♀:L、M、H)差异有统计学意义(P<0.05~P<0.01),分别在给药180 d、停药30 d差异没有统计学意义(P>0.05)。给药90 d Cl-(♂:L,♀:L、M、H),停药30 d(♂:L,H)差异有统计学意义(P<0.05~P<0.01)。给药180 d PT(♂:L)升高,给药90 d、停药30 d差异没有统计学意义(P>0.05)。结果见表3。
3 讨论
尿通卡克乃其片是维吾尔医经典方剂。药性干寒,具有生干生寒,清热消炎,除腐排脓,利尿通阻等功效[5]。同时可作为异常粘液质清除剂,具有清除异常黏液质,恢复黏液质的正常状态,平衡体液,调整气质,用于治疗疾病[6-8]。本文初步探讨尿通卡克乃其片(100%处方原药粉)的大鼠灌胃长期毒性试验血液学指标变化,对其临床应用安全性进行再评价。
血细胞结果表明,给药180 d RBC(♀:M)、HGB(♀:M、H)降低(P<0.05),分别在给药90 d和停药后30 d均差异无统计学意义(P>0.05);说明RBC、HGB变动在正常范围内(一般雌性大鼠正常范围比雄性低)。给药90 d MCH(♂:L、H)升高(P<0.05),分别在给药180 d和停药后30 d均差异无统计学意义(P>0.05);说明MCH变化无时间和剂量规律性。MCHC在给药90 d(♂♀:L、M、H),给药180 d(♂:L、M,♀:H),停药30d(♀:L、M)差异有统计学意义(P<0.05);此变化无规律性。给药90 d WBC(♀:M、H)、LYMP%(♀:L)、PLT(♂:M)升高(P<0.05),给药180 d均差异无统计学意义(P>0.05),但停药30 d PLT(♂:M)升高(P<0.05);说明此变化无时间、剂量规律性,且变动量在正常范围内。
血生化结果表明,AST(♂)在给药90 d(L)、给药180 d(H)、停药30 d(H)降低(P<0.05);给药90 d CK(♂:L)、TCHO(♀:L)降低;给药180 d Crea(♂:M)、TG(♂:L,M,H)降低;停药30 d TBIL(♂:H)降低(P<0.01);给药180 d和停药30 d ALP(♂:H)降低;均无病理意义。给药180 d ALT(♂:M、H)降低,BUN(♀:H)、GLU(♀:H)升高(P<0.05~P<0.01);停药30 d ALT(♂:M)、BUN(♂:M)、GLU(♀,H)均升高(P<0.05~P<0.01);说明升高作用无明显剂量规律性,且变动量在正常范围内。给药90 d ALB(♀:H)降低(P<0.05),给药180 d和停药30 d均差异无统计学意义(P>0.05),说明降低作用无时间规律性,且变动在正常范围内。


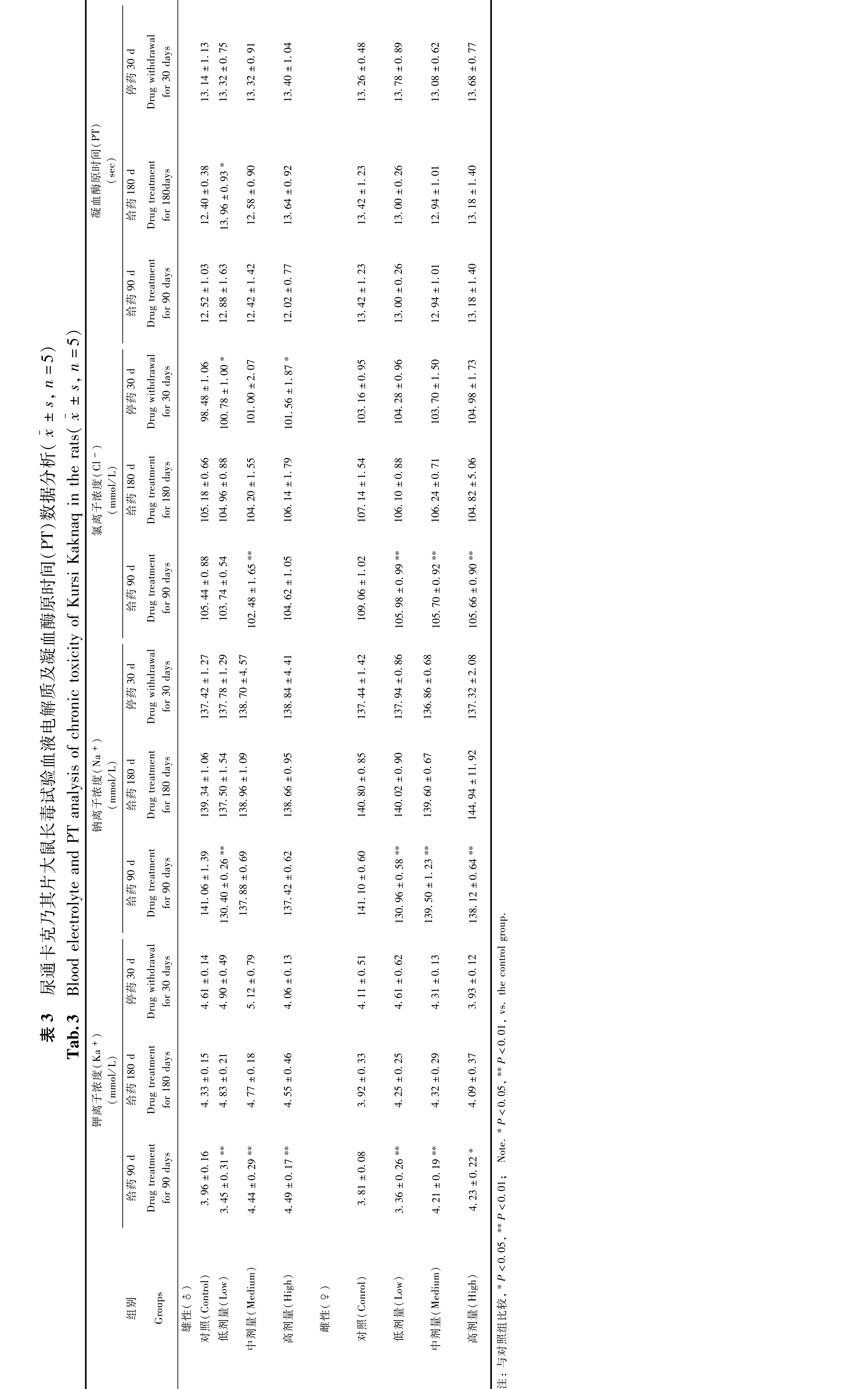
电解质与血凝结果表明,给药90 d,K+(♂♀:L、M、H)、Na+(♂:L,♀:L、M、H),给药90 d Cl-(♂:L,♀:L、M、H)、停药30 d Cl-(♂:L,H),给药180 d PT(♂:L)均有差异统计学意义(P<0.05~P<0.01),说明变动在正常范围之内,无病理意义。
总而言之,0.32 g、1.6 g、3.2 g(生药)/kg·d(相当于拟推荐成人临床剂量的5、25、50倍) 剂量下的尿通卡克乃其片原料粉灌胃大鼠180 d,虽大鼠个别剂量组、血液个别指标差异有统计学意义(P<0.05~P<0.01),但无剂量、时间规律性,均无病理意义。因此,尿通卡克乃其片原料粉灌胃大鼠180 d对大鼠血液指标无明显异常,在临床用剂量下长期使用是安全的。
[1]中华人民共和国卫生部药品标准—维吾尔药分册(维文)[M]. 乌鲁木齐:新疆科技卫生出版社, 1999: 169.
[2]袁伯俊, 廖明阳. 药物毒理学实验方法与技术 [M]. 北京:化学工业出版社, 2007: 141-146, 200-231.
[3]魏伟, 吴希美, 李元建.药理实验方法学(第4版)[M]. 北京: 人民卫生出版社,2010: 393-406.
[4]热比姑丽·伊斯拉木, 尤力都孜·买买提,阿布都吉力力·阿布都艾尼, 等.疆曼陀罗子及其代表制剂镇痛艾比西帕丸的大鼠长期毒性试验 [J]. 中国药理学通报,2011, 27(10): 1479-1480.
[5]艾力阿吉·库尔班尼亚孜艾米琪。维吾尔医成药宝库(维文)[M]. 乌鲁木齐:新疆人民卫生出版社. 2007: 169-170.
[6]热比姑丽·伊斯拉木, 阿娜古丽·买合木提, 冷英莉,等. 异常黏液质清除剂尿通卡克乃其片的药效学实验研究 [J]. 中国医药导报, 2010, 7(15): 52-54.
[7]阿不都热依木·卡德尔·阿塔哥. 中国新疆维吾尔医药学 [M]. 乌鲁木齐:新疆人民卫生出版社. 2013: 100-104.
[8]哈木拉提·吾甫尔, 阿不都热依木·玉素甫. 维吾尔医气质、体液论及其现代研究 [M]. 乌鲁木齐:新疆科学技术出版社, 2003: 46-49.
A long-term study of the toxicity of an Uyghur medicine,Kursi Kaknaq, on hematological parameters in rats
Rabigul·Islam1, Abdujilil·abdugheny1, LENG Ying-li2, WANG Jing2
(1. Institute of Xinjiang Traditional Uyghur Medicine, Urumqi 830049, China;2. Xinjiang Yinduolan Uyghur Medicine Co. Ltd., Urumqi 830013)
【Abstract】ObjectiveTo investigate the long-term toxicity of an Uyhgur medicine, Kursi Kaknaq, on hematological parameters in the rats. Methods A total of 120 healthy Sprague-Dawley rats were randomly divided into the control, low dose (0.32 g/kg·d ), moderate dose (1.6 g/kg·d) and high dose (3.2g/kg·d) Kursi Kaknaq groups.The drug was given orally, 6 days per week for 180 days. The control group was given 0.5% sodium carboxymethyl cellulose suspension. ResultsNo death was recorded in the rats and no obvious toxic events were observed during the experiment. Hematological parameters including RBC,HGB, MCH, MCHC, LYMP%, WBC, and PLT; biochemical parameters including ALT,AST, ALP, GLU, BUN, ALB ,TBIL, Crea, TCHO, TG, and CK; electrolyte time parameters such as K+, Na+, Cl- and prothrombin time(PT) showed statistically significant differences (P<0.05 andP<0.01), but did not show time and dose effect regularity, and no pathological significance. ConclusionsNo obvious toxic effects on hematological parameters are observed in the SD rats treated with Kursi Kaknaq at doses of 0.32 g, 1.6 g, or 3.2 g (crude drug)/ kg·d orally administered for 180 days, indicating that this drug is safe for long-term clinical use.
Kursi Kaknaq, Uyghur medicine; Rats; Chronic Toxicity, Blood parameters
新疆维吾尔自治区专利实施计划项目基金(编号2009002);新疆维吾尔自治区乌鲁木齐市科学技术计划项目基金(编号C111110002)。
热比姑丽·伊斯拉木(1970-),女,研究方向:维药药理毒理学研究。E-mail:rabiya272@126.com。
冷英莉(1976-),女,研究方向:新药开发。E-mail:719803232@qq.com。
研究报告
R-33
A
1671-7856(2016) 08-0059-07
10.3969.j.issn.1671-7856.2016.08.009
2016-03-30

