不产氧光合细菌分离鉴定及其产氢菌株的快速筛选
邓春浩,苟维超,孙良昱,陈坤明
(西北农林科技大学 生命科学学院,陕西杨凌 712100)
不产氧光合细菌分离鉴定及其产氢菌株的快速筛选
邓春浩,苟维超,孙良昱,陈坤明
(西北农林科技大学 生命科学学院,陕西杨凌712100)
为建立产氢不产氧光合菌株的快速筛选方法,从采自陕西、河南、安徽3个省8份不同水样中分离出的不产氧光合细菌,通过菌落形态、革兰氏染色、细菌特征峰及16S rDNA鉴定等方法进行初步鉴定获得不产氧光合细菌,同时利用自制的产氢菌株快速筛选系统对其产氢能力进行检测,并分析菌液终点氧化还原电位与细胞产氢的关系。结果表明:共分离得到31株光合细菌,其中18株沼泽红假单胞菌(Rhodopseudomonaspalustris)、5株荚膜红细菌(Rhodobactercapsulatus)、4株球形红细菌(Rhodobactersphaeroides)和2株固氮红细菌(Rhodobacterazotoformans),此外还有2株菌与Rhodobactersp.TCRI 14相似。这些光合细菌的产氢能力存在显著差异,其中3株产氢性能较高,2株为沼泽红假单胞菌,1株为球形红细菌。通过菌液终点氧化还原电位与细胞产氢能力对比,发现产氢较高的菌株其菌液的终点氧化还原电位也明显较低。
不产氧光合细菌;分离鉴定;产氢;筛选
由于能源紧缺、环境污染等问题已成为制约社会发展的重要因素,越来越多的人开始关注可再生清洁能源,氢气作为一种重要的清洁可再生能源已逐渐受到广泛研究。随着生物制氢技术的发展,微生物代谢制氢已显示其重要的生态和社会价值,微生物代谢在产氢同时可降解水中各种有机物、亚硝酸盐及硫化物等,在废水的无害化处理、污染物的消除等方面具有广阔的应用前景[1- 2]。目前,生物制氢技术中一种重要的制氢方法是利用不产氧光合细菌制氢[3-5],不产氧光合细菌是一类可利用光照为其生长代谢供能的光合微生物,在光合作用中不生成氧气,可在固氮酶及氢酶催化下产生氢气,因此不产氧光合细菌产氢方面研究被许多研究者所重视,其中不产氧光合细菌的高效产氢菌株筛选显得尤为重要[6-8]。然而,由于传统光合细菌产氢试验装置需要通过排水法收集气体,并利用气相色谱仪分析气体组分,因此,此类氢气检测装置结构及操作显得异常复杂,不利于高效产氢菌株的大规模筛选。为此本研究从陕西、河南、安徽3个省份8份常年能受到光照的河流或污水水样中分离的光合细菌,通过形态学、分子生物学等方法对其进行快速鉴定,同时设计一套简易的产氢光合细菌分析装置,对所分离光合细菌的产氢能力快速筛选,并结合细菌培养液氧化还原电位分析,对光合细菌产氢机制有更深入了解,为新能源的开发和光合细菌资源的利用提供重要的支持。
1 材料与方法
1.1试验材料
1.1.1样品来源将采自陕西、河南、安徽3个省份常年能受到光照的河流或污水中8份不同水样用于不产氧光合细菌的分离,采样地点分别为河南省洛阳市洛河、河南省南阳市白河、陕西省杨凌区渭河及其支流、陕西省杨凌区莲藕田、安徽省芜湖市长江及青弋江(表1)。
1.1.2培养基富集培养基[9]:NaCl 2 g、MgSO4·7H2O 0.2 g、NH4Cl 1 g、NaHCO32 g、KH2PO41.75 g、CH3COONa 3 g、酵母粉1 g,蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min。
分离培养基:富集培养基中加入15g/L琼脂粉,pH 6.8~7.2,121 ℃灭菌20 min。
产氢培养基[6]:CH3COONa 0.3 g, NaHCO30.2 g,谷氨酸钠0.1 g,K2HPO40.02 g,MgSO4·7H2O 0.02 g,NaCl 0.2 g,酵母膏0.1 g,微量元素溶液1 mL,生长因子溶液1 mL,pH 7.0,加蒸馏水至100 mL。微量元素溶液为FeCl3·6 H2O 5 mg、CuSO4· 6H2O 0.05 mg、MnCl2·4H2O 0.05 mg、ZnSO4·7H2O 1 mg、H3BO41 mg、CO( NO3)·6H2O 0.5 mg,加蒸馏水至1 L;生长因子溶液为维生素B1 0.01 mg、尼克酸1 mg、生物素0.01 mg、对氨基苯甲酸0.1 mg,加蒸馏水至100 mL,121 ℃灭菌20 min。
1.2不产氧光合细菌的分离纯化
1.2.1不产氧光合细菌的富集将采集得到的水样及其底泥摇匀,取30~50 mL水样倒入50 mL无菌锥形瓶中,沉淀4 h以上,去除上清,加入30 mL无菌富集培养基,之后倒入少许无菌液体石蜡封闭液面,并放入光照培养箱(光照度3 000 lx,温度30 ℃)中培养5~7 d,可见培养基由清变红。取1 mL富集培养液,转接入新的含有富集培养基及液体石蜡的锥形瓶中,继续培养5~7 d,并重复此富集2~3次。
1.2.2不产氧光合细菌的分离取1 mL富集产物做10倍梯度稀释,取10-5、10-6、10-7中3个稀释液各100 μL分别涂布于3个分离培养基平板中。将平板倒扣于含有0.5 g焦性没食子酸及0.5 g无水碳酸钠混合物的玻璃板上,之后用加热融化的固体石蜡将平板与玻璃板封合,利用焦性没食子酸碱性条件下吸氧创造厌氧环境,将其置于光照培养箱(光照度3 000 lx,温度30 ℃)中培养7~10 d,可见红色菌落产生。
1.2.3不产氧光合细菌纯化及编号挑取单克隆光合细菌,划线接种于分离培养基平板上,而后将其放入玻璃干燥器中。事先在玻璃干燥器中放入一支点燃的蜡烛及适量焦性没食子酸与无水碳酸钠的混合物,盖紧盖子并用凡士林封口,创造无氧或低氧环境。最后将玻璃干燥器置于光照培养箱中,3 000 lx光照度下30 ℃培养5~7 d。对所纯化的菌株按照省份及分离顺序编号,从陕西样品所分离得到的菌株命名为SX1~SXn,从河南样品所分离得到的菌株命名为HN1~HNn,从安徽样品中所分离得到的菌株命名为AH1~AHn。
1.3不产氧光合细菌鉴定
1.3.1菌落及细菌形态观察在分离培养基上划线培养菌株,3 000 lx光照度下30 ℃培养5~7 d,观察菌落颜色、大小及形态等指标。挑取分离培养基上的单克隆于载玻片上,通过革兰氏染色检验细菌特性并用显微镜镜检。
1.3.2特征吸收峰检测不产氧光合细菌由于具有光捕获复合体,因此在800~875 nm处有吸收峰[10-14],在厌氧光照下,将菌株接种于富集培养基中进行液体纯培养,而后取纯培养物在Epoch分光光度计里扫描600~900 nm处特征峰。
1.3.3细菌16S rDNA鉴定以菌液为模板,扩增细菌16S rDNA。引物采用细菌16S rDNA鉴定通用引物,正向引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492r:5′-TACGGTTACCTTGTTACGACTT-3′[9]。PCR扩增体系(50 μL):菌液模板1 μL,引物各2 μL,去离子水20 μL,2×PCR masterTaqMix 25 μL。PCR扩增条件:95 ℃ 5 min,95 ℃ 30 s;58 ℃ 30 s;72 ℃ 2 min;35个循环;72 ℃ 10 min。产物电泳检测得到目的条带后直接送至金斯瑞公司进行测序。测序结果用NCBI-Blast在GenBank数据库中进行比对(网址:http://ncbi.nlm.nih.gov/blast)。
1.4不产氧光合细菌产氢能力筛选
1.4.1氢气检测系统的设计氢气检测系统包括3部分:氩气控制装置(A)、细菌培养及氢气收集装置(B)、氢气检测器(Ennix GS10-H2)(C)。其中氩气装置中包含1个氩气钢瓶及气体流量计,所有连接靠硅胶管相连,细菌培养及氢气收集系统由1个100 mL血清瓶、插有2个长注射器针头的橡胶塞及1支1 mL注射器组成。
在培养菌株及收集氢气时,装置B靠顶部注射器及无菌注射器软管保证培养时无杂菌污染,同时将部分氢气收集在血清瓶中。检测氢气时,装置A与B连接,首先拔去装置B的注射器,装置A中由气体流量计伸出的硅胶管通过一支内部装有无菌棉花的无菌1 mL枪头与B连接,每测1个样品,换一支无菌枪头;装置B与C靠注射器软管相连。
1.4.2氢气检测流程将待测菌株接种于富集培养基中,待菌株生长至对数期时,按φ=1%的量接种于含有50 mL产氢培养基的血清瓶中,而后组装好细菌培养及氢气收集装置,将装置充满氩气后放置于光照培养箱中,在30 ℃条件下3 000 lx 光照度培养,每12 h检测1次氢气浓度,每个待测菌株做3个重复。检测氢气时,首先拔去细菌培养及氢气收集装置顶部注射器,而后连接氩气装置及氢气检测仪,将气体流量计快速调至60 mL/min,随后读取并记录氢气检测仪中显示的最大值,最后分离3部分装置,将细菌培养及氢气收集装置重新放置于光照培养箱中培养,并进行下一瓶菌株氢气检测。
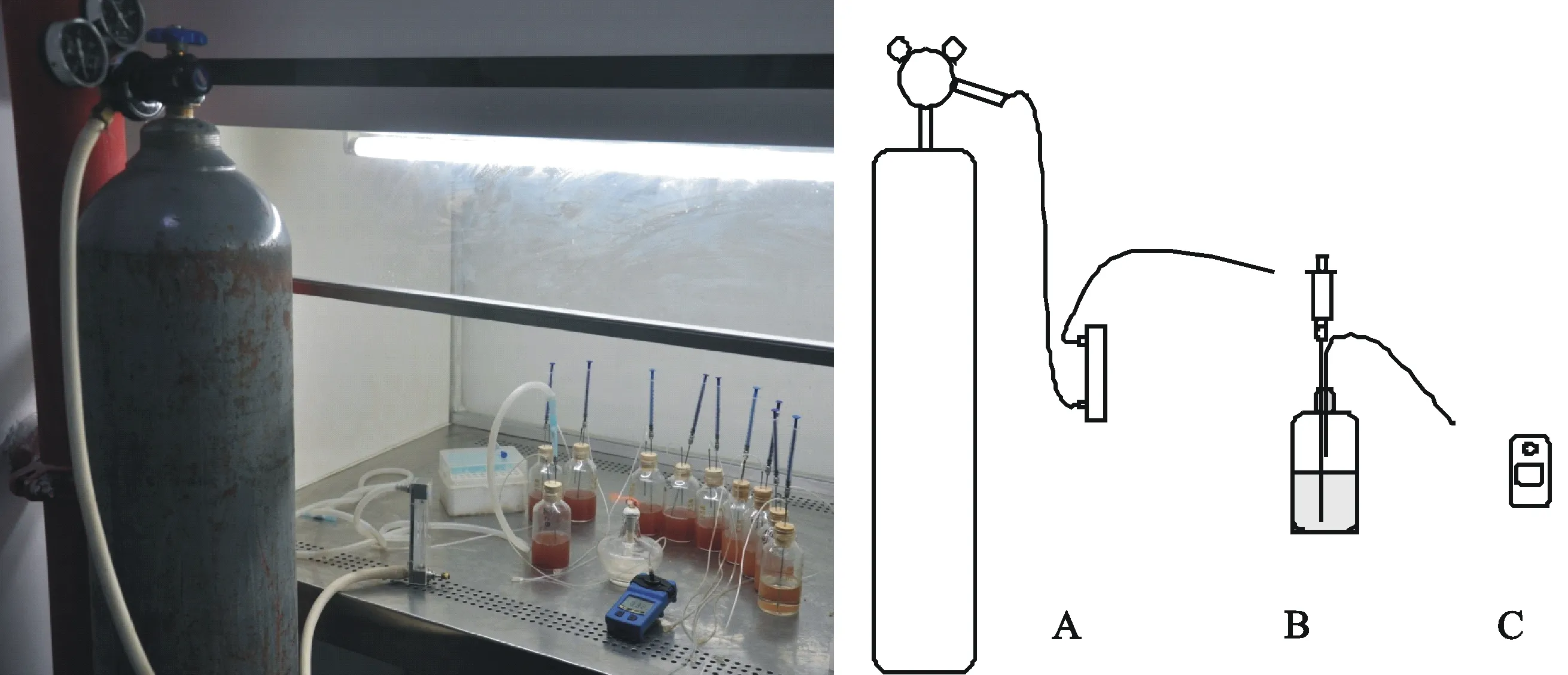
图1 氢气检测系统及其示意图
1.4.3培养液终点氧化还原电位测定对产氢测定结束的菌株,利用氧化还原(ORP)电极(Sartorius pb-10)测定每瓶培养液终点氧化还原电位,记录数值。
1.5数据处理
分别记录不同菌株培养瓶中氢气浓度及培养液终点氧化还原电位,采用Excel 2013对数据进行处理并绘图。
2 结果与分析
2.1不产氧光合细菌分离纯化
通过富集培养基富集,分离培养基分离纯化后,从陕西、河南、安徽8份不同水样中共分离并纯化出31株不产氧光合细菌,菌株分离地点及环境见表1。根据其菌落形状、大小及颜色,主要分为6类。由图2可以看出,所分离菌株菌落都为圆形,颜色有粉色、红褐色和黄褐色,菌落大小为1~2 mm和3~5 mm。对所分离菌株进行革兰氏染色及显微镜镜检,部分菌株形态如图3所示,发现所有菌株均为革兰氏阴性菌株(G-),形态为球形或长短不等的杆状。
2.2不产氧光合细菌鉴定
分离出红色或褐色菌落后,通过革兰氏染色及显微镜检查所分离菌株均为G-菌株。将菌株接入液体培养基纯培养,利用Epoch分光光度计检测菌液600~900 nm处特征峰,发现所分离菌株均在800~875 nm处存在不产氧光合细菌光捕获复合体的特征峰,确定所分离菌株为不产氧光合细菌。最后扩增所分离菌株的16S rDNA并测序,在NCBI数据库中比对,发现所分离的不产氧光合细菌主要分布在红细菌属(Rhodobacter)和假单胞菌属(Rhodopseudomonas)2个属,所有不产氧光合细菌鉴定结果见表2。由表2可知,所分离的不产氧光合细菌大部分为红假单胞菌属的沼泽红假单胞菌(Rhodopseudomonaspalustris),共有18株,有5株荚膜红细菌(Rhodobactercapsulatus),4株球形红细菌(Rhodobactersphaeroides),2株固氮红细菌(Rhodobacterazotoformans),此外还有2株菌与Rhodobactersp.TCRI 14相似。

表1 不产氧光合细菌分离地点
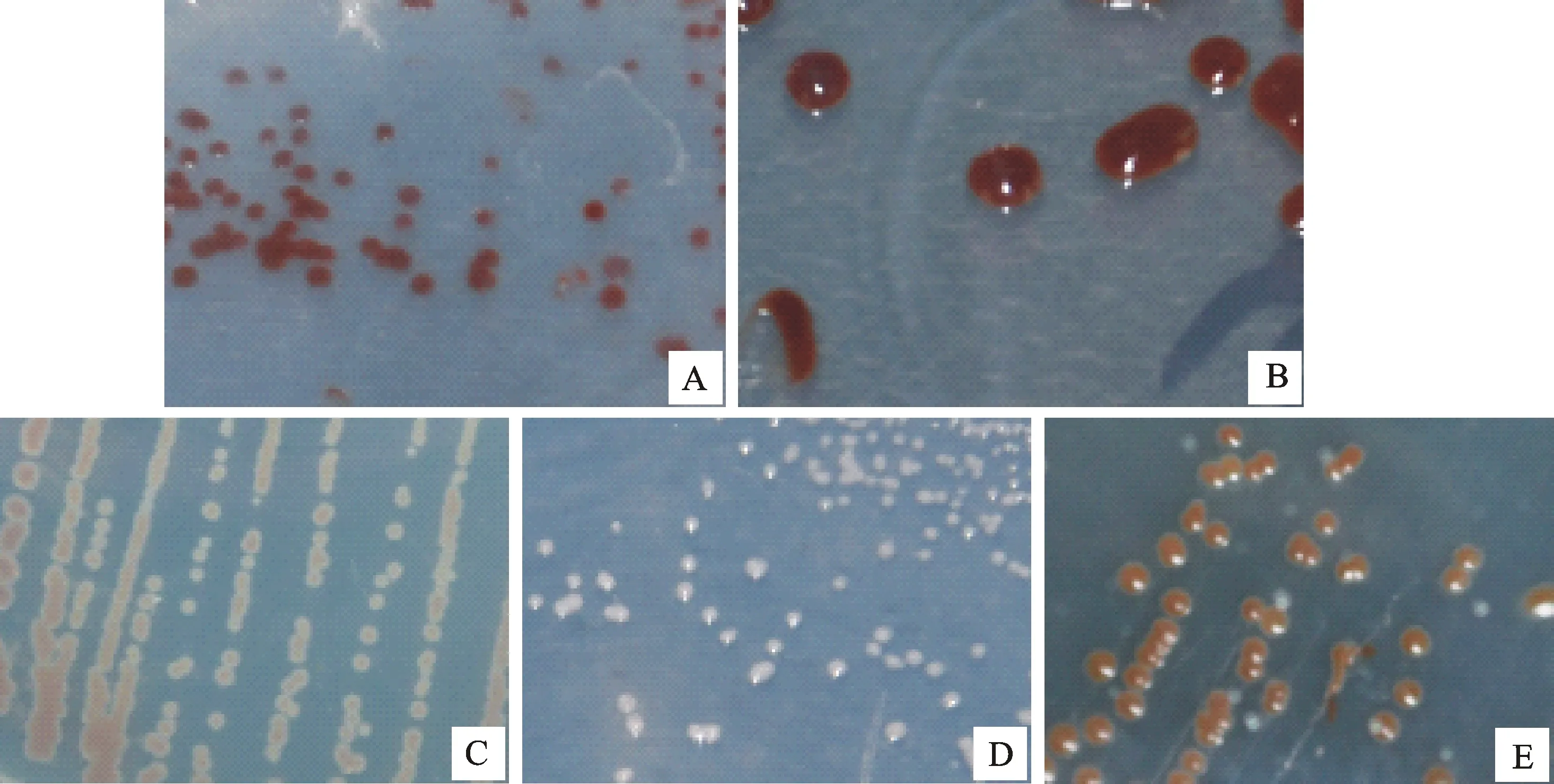
A.菌落呈圆形,直径约1~2 mm,菌落为红褐色Round colony ,1-2 mm in diameter,reddish-brown;B.菌落呈圆形,直径约3~5 mm,菌落为红褐色Round colony,3-5 mm in diameter,reddish-brown;C.菌落呈圆形,直径约1~2 mm,菌落为黄褐色Round colony,1-2 mm in diameter ,tan;D.菌落呈圆形,直径约1~2 mm,菌落为不透明粉色The colony were round,3-5 mm diameter,pink;E.菌落呈圆形,直径约2~3 mm,菌落为黄褐色Round colonym,2-3 mm in diameter,tan
图2不产氧光合细菌菌落形态
Fig.2 Colonial morphology of anoxygenic photosynthetic bacteria

图3 不产氧光合细菌革兰氏染色显微形态(1 000×)
2.3不产氧光合细菌产氢性能筛选
利用自制光合细菌产氢系统,检测所分离的各个菌株产氢能力,每株菌分别做3个重复,每12 h检测1次细菌培养及收集装置中氢气浓度,由于所有菌株均在96 h时测得氢气浓度最高,以96 h检测浓度对比不同菌株的产氢能力,结果见图4。
由图4可以看出,相同菌株3个重复之间有良好的重复性,应用此系统可快速方便地分析出不同菌株的产氢能力。共分离出3株产氢较高的菌株,最高氢气检测量超过3.0×10-4;6株菌氢气浓度介于2.0×10-4~3.0×10-4;其余菌株产氢能力较低。产氢较高的3个菌株分别是HN1、HN2、AH3,其中HN1和HN2为沼泽红假单胞菌,AH3为球形红细菌。所有分离的菌株中,产氢超过2.0×10-4的菌株有11株,其中9株为沼泽红假单胞菌,1株球形红细菌AH7,1株固氮红细菌(Rhodobacterazotoformans) HN3;所分离的5株荚膜红细菌产氢均未超过2.0×10-4。

表2 不产氧光合细菌鉴定
注:“+”表示在800~875 nm存在特征峰。
Note:“+” represent that the culture of this bacteria have characteristic peaks at 800-875 nm.
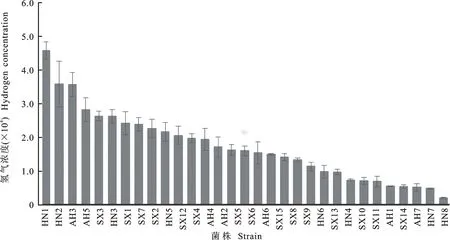
图4 不产氧光合细菌产氢能力筛选结果
2.4产氢培养基终点氧化还原电位分析
产氢试验后,利用ORP来检测菌液终点氧化还原电位。如图5所示,不同菌株培养液的氧化还原电位都为负值,但存在较大差异。对比图4中菌株产氢能力发现,产氢量高的菌株的培养液明显具有相对更低的氧化还原电位,而产氢能力低的菌株培养液氧化还原电位相对较高。

图5 产氢菌株菌液氧化还原电位
3 讨 论
本研究利用不产氧光合细菌富集培养基及分离培养基,结合平板厌氧及干燥器厌氧2种方法,快速地从河南省洛阳市洛河、河南省南阳市白河、陕西省杨凌区渭河及其支流、陕西省杨凌区莲藕田、安徽省芜湖市长江及青弋江的8份水样中分离得到31株光合细菌。通过菌落形态、革兰氏染色、细菌特征峰分析,快速确定所分离菌株为不产氧光合细菌,结合16S rDNA鉴定技术,确定所分离菌株的种属。通过本研究发现,不同地域分离出的部分不产氧光合细菌16S rDNA序列完全一致,如HN1及SX9与RhodopseudomonaspalustrisDX-1相似度为100%,HN3及SX11均与Rhodobacterazotoformans strain JCM 9340菌株相似度同样为100%,但其产氢特性却差异很大,说明不同环境下的不产氧光合细菌具有明显的代谢多样性,因此从不同环境中获得并大规模筛选产氢菌株是非常必要的。同时本研究对比菌株产氢能力与其环境(正常水质或污水),发现二者并无明显关系,可能与采集水体样本不够丰富有关。由于不产氧光合细菌代谢多样性,从不同环境中筛选得到的不产氧光合细菌产氢特征可能存在较大差异,例如碳源、氮源、金属离子、pH等因素对不同菌株的影响也不同[15-19],因此,未来对产氢菌株进行大规模选育时,可通过调整培养基成分,以期获得不同环境及底物下最适产氢菌株。对具有特定研究意义及价值的菌株,可对其进一步通过生理生化特征、脂肪酸图谱分析、DNA-DNA杂交特征及特异分子标记信息等方式鉴定[20],以进一步深入研究其环境适应及产氢机制。
本研究产氢试验中,菌株培养时快速氢气检测系统氩气装置与细菌培养及氢气收集装置分离,同时将细菌培养及氢气收集简化为单个血清瓶,可同时检测多个菌株产氢能力,并通过试验重复减少系统误差,适合产氢菌株的大规模筛选。由于此系统细菌培养及氢气收集装置在细菌培养时与外界连通,同时需要在检测氢气时向其中通入氩气,因此无法准确测得菌株氢气产生量。所以在实际应用中,可首先通过该氢气检测系统对产氢菌株大规模筛选,比较其产氢能力差异后,最后利用传统氢气检测装置对候选菌株的产氢能力及特点进行分析,可明显提高产氢光合菌株的筛选效率。
本研究在检测菌株产氢能力的同时,检测菌液的终点氧化还原电位,通过对比菌株之间产氢趋势与氧化还原电位趋势之间的关系(图4和图5),发现产氢高的菌株培养液终点氧化还原电位更低。由于光合细菌在产氢过程中要消耗大量的电子及还原力[21-22],试验结果也证实菌株产氢能力与菌液氧化还原状态有密切联系[23],因此氧化还原状态对光合细菌自身氢代谢具有重要的作用。值得注意的是,部分菌株培养液的氧化还原电位明显低于其他产氢能力相似菌株,如SX7菌株氧化还原电位明显低于SX1,除了系统误差外,还可能是该研究所对比的是菌株在84~96 h的产氢能力,而终点氧化还原电位可能与菌液的总产氢量直接相关。
Reference:
[1]CHANDRASEKHAR K,LEE Y J,LEE D W.Biohydrogen production:strategies to improve process efficiency through microbial routes [J].InternationalJournalofMolecularSciences,2015,16(4):8266-8293.
[3]EROGLU E,MELIS A.Photobiological hydrogen production:recent advances and state of the art[J].BioresourceTechnology,2011,102(18):8403-8413.
[4]CARLOZZI P.Hydrogen photoproduction byRhodopseudomonaspalustris42OL cultured at high irradiance under a semicontinuous regime[J].JournalofBiomedicineandBiotechnology,2012:1-8.
[5]ZHANG C,WANG A J,ZHANG Q G.A two-dimensional mass transfer model for an annular bioreactor using immobilized photosynthetic bacteria for hydrogen production [J].BiotechnologyLetters,2013,35(10):1579-1587.
[6]杨素萍,赵春贵,李建波,等.高效选育产氢光合细菌的研究[J].山东大学学报(理学版),2002,37(4):353-358.
YANG S P,ZHAO CH G,LI J B,etal.Higheffective screening of hydrogen-producing photosynthetic bacteria[J].JournalofShandongUniversity(NaturalScience),2002,37(4):353-358(in Chinese with English abstract).
[7]王永忠,廖强,朱恂,等.产氢光合细菌的分离鉴定及高产氢菌株的筛选[J].应用与环境生物学报,2008,14(5):673-677.
WANG Y ZH,LIAO Q,ZHU X,etal.Isolation and identification of photosynthetic bacteria and their hydrogen-producing abilities[J].ChineseJournalofApplied&EnvironmentalBiology,2008,14(5):673-677 (in Chinese with English abstract).
[8]LEE C M,HUNG G J,YANG C F.Hydrogen production byRhodopseudomonaspalustrisWP 3-5 in a serial photobioreactor fed with hydrogen fermentation effluent[J].BioresourceTechnology,2011,102(18):8350-8356.
[9]马姝萍,赵述淼,郭俊平,等.高效净化污水光合细菌的分离鉴定[J].饲料工业,2012,33(15):46-50.
MA SH P,ZHAO SH M,GUO J P,etal.Isolation and identification of a photosynthetic bacteria for highly efficient purification on sewage[J].FeedIndustry,2012,33(15):46-50(in Chinese with English abstract).
[10]KOEPKE J,HU X,MUENKE C,etal.The crystal structure of the light-harvesting complex II (B800-850) fromRhodospirillummolischianum[J].Structure,1996,4(5):581-597.
[11]WALZ T,JAMIESON S J,BOWERS C M,etal.Projection structures of three photosynthetic complexes fromRhodobactersphaeroides:LH2 at 6 A,LH1 and RC-LH1 at 25 A[J].JournalMolecularBiology,1998,282(4):833-845.
[12]HARTIGAN N,THARIA H A,SWEENEY F,etal.The 7.5-A electron density and spectroscopic properties of a novel low-light B800 LH2 fromRhodopseudomonaspalustris[J].BiophysicalJournal,2002,82(2):963-977.
[13]EVANS K,FORDHAM-SKELTON A P,MISTRY H,etal.A bacteriophytochrome regulates the synthesis of LH4 complexes inRhodopseudomonaspalustris[J].PhotosynthesisResearch,2005,85(2):169-180.
[14]WACKER T,GAD'ON N,BECKER A,etal.Crystallization and spectroscopic investigation with polarized light of the reaction center-B875 light-harvesting complex ofRhodopseudomonaspalustris[J].FEBSLetters,1986,197(1/2):267-273.
[15]谢学旺,朱恂,王永忠,等.不同酸碱条件下光合细菌的生长产氢特性[J].应用与环境生物学报,2011,17(2):251-255.
XIE X W,ZHU X,WANG Y ZH,etal.Effect of substrate pH value on hydrogen production by photosynthetic bacteria[J].ChineseJournalofApplied&EnvironmentalBiology,2011,17(2):251-255(in Chinese with English abstract).
[16]韩滨旭,王毅,曾凡,等.光合产氢细菌优势菌群富集及其产氢实验研究[J].太阳能学报,2013,34(1):111-115.
HAN B X,WANG Y,ZENG F,etal.Enrichment predominant group of hydrogen-producing photosynthetic bacteria and their hydrogen production experiment[J].ActaEnergiaeSolarisSinica,2013,34(1):111-115(in Chinese with English abstract).
[17]LEE J Y,CHEN X J,LEE E J,etal.Effects of pH and carbon sources on biohydrogen production by co-culture ofClostridiumbutyricumandRhodobactersphaeroides[J].JournalofMicrobiolandBiotechnology,2012,22(3):400-406.
[18]POTT R W,HOWE C J,DENNIS J S.The purification of crude glycerol derived from biodiesel manufacture and its use as a substrate byRhodopseudomonaspalustristo produce hydrogen[J].BioresourceTechnology,2014,152:464-470.
[19]HEINIGER E K,ODA Y,SAMANTA S K,etal.How posttranslational modification of nitrogenase is circumvented inRhodopseudomonaspalustrisstrains that produce hydrogen gas constitutively[J].AppliedandEnvironmentalMicrobiology,2012,78(4):1023-1032.
[20]杨素萍,林志华,崔小华,等.不产氧光合细菌的分类学进展[J].微生物学报,2008,48(11):1562-1566.
YANG S P,LIN ZH H,CUI X H,etal.Current taxonomy of anoxygenic phototrophic bacteria—a review [J].ActaMicrobiologicaSinica,2008,48(11):1562-1566(in Chinese with English abstract).
[21]VIGNAIS P M,COLBEAU A,WILLISON J C,etal.Hydrogenase,nitrogenase,and hydrogen metabolism in the photosynthetic bacteria[J].AdvancesinMicrobialPhysiology,1985,26:155-234.
[22]刘飞,方柏山.微生物产氢机理的研究进展[J].工业微生物,2007,37(3):58-62.
LIU F,FANG B SH.Research advance in biohydrogen mechanism[J].IndustrialMicrobiology,2007,37(3):58-62(in Chinese with English abstract).
Corresponding authorCHEN Kunming,male,Ph.D,professor,doctoral supervisor.Research area:cellular and molecular physiology and regulation of plant stress,photosynthesis and bioenergy.E-mail:kunmingchen@nwsuaf.edu.cn
(责任编辑:史亚歌Responsible editor:SHI Yage)
Isolation and Identification of Anoxygenic Photosynthetic Bacteria and Quick Screening of Hydrogen Productive Strains
DENG Chunhao,GOU Weichao,SUN Liangyu and CHEN Kunming
(College of Life Sciences,Northwest A&F University,Yangling Shaanxi712100,China)
To establish a quick method for screening hydrogen productive anoxygenic photosynthetic bacteria strains at a large scale,8 water samples from 3 provinces were used for bacteria isolation.According to the clonal morphology,gram staining,absorption peak as well as 16s rDNA detection,the anoxygenic photosynthetic bacteria strains were preliminary identified and its hydrogen productive ability detected by a self-made hydrogen detection system were examined and also compared with the redox state of the bacterium solution.The results showed that 31 anoxygenic photosynthetic bacteria strains were isolated and identified and it was classified mainly into 4 categories,of which 18 belonged toRhodopseudomonaspalustris,5Rhodobactercapsulatus,4Rhodobactersphaeroidesand 2Rhodobacterazotoformanstrains,however,there were 2 strains similar withRhodobactersp.TCRI 14.The hydrogen production ability greatly differed among the those strains ,which of them only 3 strains had highly hydrogen productive ability.Two of them wereRhodopseudomonaspalustrisand one belonged toRhodobactersphaeroides.By comparing the redox states with hydrogen production ability,we found that the strains had higher hydrogen production ability were in lower redox state in the bacterium solution.
Anoxygenic photosynthetic bacteria; Isolation and identification; Hydrogen production;Screening
2015-05-28Returned2015-08-28
Program for Surporting New Century Excellent Talents of Ministry of Education of P.R.China (No.NCET-11-0440); the Scientific Research Start-up Fund for the Returned Overseas Chinese Scholars, Ministry of Education of P.R.China.
DENG Chunhao,male,master student.Research area:anoxygenic photosynthetic bacteria and it’s hydrogen production mechanism.E-mail:dchdr@163.com
2015-05-28
2015-08-28
教育部新世纪优秀人才支持计划(NCET-11-0440);教育部留学回国人员科研启动费。
邓春浩,男,硕士研究生,从事光合细菌及其产氢机制研究。E-mail:dchdr@163.com
陈坤明,男,博士,教授,博士生导师,主要从事植物细胞逆境分子生理与调控及光合作用与生物能源的研究。E-mail:kunmingchen@nwsuaf.edu.cn
Q939.9
A
1004-1389(2016)08-1187-08
网络出版日期:2016-07-14
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160714.1104.022.html

