双水相法提取葡萄皮渣中花色苷
黄 瑜,段继华,黄 伟,白羽嘉,张培岭,郑 峰,冯作山,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.乌鲁木齐创新源生物科技有限公司,新疆乌鲁木齐 830013)
双水相法提取葡萄皮渣中花色苷
黄瑜1,段继华2,黄伟1,白羽嘉1,张培岭1,郑峰1,冯作山1,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.乌鲁木齐创新源生物科技有限公司,新疆乌鲁木齐 830013)
以酿酒葡萄皮渣为原料,研究并优化双水相法对花色苷得率的影响。在单因素的基础上,通过Plackett-Burman实验筛选出pH、乙醇质量分数、硫酸铵质量分数、料液比为主要自变量,以花色苷得率为响应值,利用Box-Benhnken中心组合设计原理和响应面分析法,研究各自变量的交互作用对花色苷得率的影响,模拟得到二次多项式回归方程的模型。响应面优化后的最佳工艺参数是乙醇质量分数为28%,硫酸铵质量分数为18.14%,pH为3.00,料液比为1∶35 g/mL,花色苷得率为4.43mg/g。此研究将为花色苷实际生产应用提供理论依据。
葡萄皮渣,花色苷,双水相,提取
葡萄皮渣(Grape Pomace,GP)是葡萄酒在酿造过程中产生的废弃物,以葡萄果皮、籽和梗为主[1]。世界葡萄与葡萄酒组织(OIV)相关统计数据显示,中国2013年的葡萄酒产量世界排名第七,年产1170万升,而酿酒所产生的废葡萄皮渣大约占葡萄总质量的25%~30%,按此比例我国每年将产生35万t左右的废葡萄皮渣[2]。目前大部分废葡萄皮渣附加值很低,仅能应用于肥料、饲料以及垃圾处理,作为废弃物而丢弃的葡萄皮渣对环境造成了污染,而提取葡萄皮渣中的有效成分不仅能够增加其经济价值,并且丰富了葡萄皮渣的综合利用。从葡萄皮渣中提取有效成分已成为研究热点之一,花色苷作为葡萄皮中重要的功能性成分之一,具有抗氧化、清除自由基、抗癌、改善视力等优点[3]。花色苷的来源有紫甘薯[4]、树莓[5]、蓝莓[6]、黑加仑[7]等,提取方法主要包括溶剂法[8]、超声波法[9],酶解法[10]以及微波法[11],但是这些方法需要严格的操作条件和昂贵的设备投入,无形中增加了企业的成本。近年来,双水相提取法作为一种新型技术,因其操作简单,过程易于放大,生物亲和性好,成本低、溶剂易回收和目标物纯度高等优点而受到广大研究者的关注[12],目前已广泛应用于制药、食品、化工等领域[13],然而在提取花色苷方面研究较少,刘兴丽等[14]使用该法提取紫甘薯中花色苷,效果较好。目前尚未见双水相法在葡萄皮渣中花色苷提取的应用,本研究以葡萄皮渣为原材料,采用乙醇-硫酸铵双水相法提取花色苷,不仅能提高葡萄皮渣的利用率,更为开发以花色苷为主要成分的功能性产品奠定基础。
1 材料与方法
1.1材料与仪器
葡萄皮渣 2014年10月15日收集于新疆农业大学食品学院实习基地旺坪九巷,在地下室用风扇风干的葡萄皮渣;无水乙醇、硫酸铵、氯化钾、无水乙酸钠、盐酸均为分析纯。
TU1810-新世纪紫外-可见分光光度计北京普析通用仪器有限责任公司;FA2004型电子分析天平上海天平仪器厂;DZKW-D-2型电热恒温水浴锅北京市永光明医疗仪器厂。
1.2实验方法
1.2.1葡萄皮渣前处理将葡萄皮渣,经挑选、除杂后粉碎,过40目筛。
1.2.2花色苷的提取工艺流程参照Ying等[15]研究的乙醇硫酸铵相图,称取一定量的硫酸铵溶于适量的去离子水中,调至所需pH,加入一定比例的乙醇,混匀后,静置形成双水相;称取1.00 g葡萄皮渣放入锥形瓶中,在一定温度条件下,提取一段时间后,在8000 r/min离心10 min,收集上相溶液定容至50 mL,测定得率。
1.2.3色价的测定参照赵慧芳等[16]测定色价的方法,取2 mL样品液,用pH3.0磷酸-柠檬酸缓冲稀释10倍,混匀,以提取液加缓冲液作空白,测定样品的吸光值,按下式计算色价:
E=(A×10×a)/W
式(1)
其中:E-色价;A-吸光度;W-取样量,g;a-样品液的稀释倍数。
1.2.4花色苷得率的测定参照冯建光等[17]的测定方法,取稀释后样品1 mL,加入pH4.50醋酸钠缓冲溶液和pH1.00氯化钾缓冲溶液9 mL,摇匀,用紫外-可见分光光度计分别在520 nm和700 nm下测定吸光度。提取液的花青素得率(C,mg/g),计算公式如下:
式(2)
其中:A为最终吸光度,A=(A520 nm,pH1.0-A700 nm,pH1.0)-(A520 nm,pH4.5-A700 nm,pH4.5);F为稀释倍数,V为稀释体积(mL),m为样品质量(g);矢车菊色素-3-葡萄糖苷为标准品,其摩尔吸光系数ε为26900(L/(cm·mg)),相对分子质量(MW)为443.2 u。
1.2.5单因素实验设计
1.2.5.1硫酸铵质量分数的确定控制双水相体系温度25℃,提取时间20 min、pH为2.00,料液比1∶20 g/mL,乙醇质量分数24%,设置硫酸铵质量分数为18%、19%、20%、21%、22%,其它步骤同1.2.2。
1.2.5.2乙醇质量分数的确定依据1.2.5.1实验基础,确定硫酸铵质量分数20%,控制乙醇质量分数为20%、22%、24%、26%、28%,温度25℃,提取时间20 min、pH为2.00,料液比1∶20 g/mL,其它步骤同1.2.2。
1.2.5.3pH确定根据以上实验确定乙醇质量分数为22%,设置pH为1.00、2.00、3.00、4.00、5.00,硫酸铵质量分数20%,温度25℃,提取时间20 min,料液比1∶20 g/mL,其它步骤同1.2.2。
1.2.5.4提取时间的确定根据以上实验确定pH为2.00,设置提取时间为20、40、60、80、100 min,提取温度25℃,硫酸铵质量分数20%,乙醇质量分数为22%,温度25℃,料液比1∶20 g/mL,其它步骤同1.2.2。
1.2.5.5提取温度的确定根据以上实验,确定提取时间为60 min,控制提取温度为15、25、35、45、55℃,pH为2.00,硫酸铵质量分数20%,乙醇质量分数为22%,料液比1∶20 g/mL,其它步骤同1.2.2。
1.2.5.6料液比的确定根据以上实验,确定提取温度为35℃,控制料液比为1∶10、1∶20、1∶30、1∶40、1∶50 g/mL,pH为2.00,硫酸铵质量分数20%,乙醇质量分数26%,提取时间为60 min,其它步骤同1.2.2。
1.2.6响应面分析实验设计在单因素的基础上,选用Box-Benhnken实验设计,以pH、料液比、硫酸铵质量分数和乙醇质量分数为自变量,以花色苷的得率(Y)为响应指标,设计四因素三水平的响应面分析实验。根据单因素实验结果,确定4个自变量的实验水平(见表1)。

表1 响应面实验因素水平编码表
1.3数据统计分析
数据用Microsoft Office Excel 2007处理,利用Spss19.0进行显著性分析。
2 结果与分析
2.1花色苷不同提取方法比较
色价是衡量色素质量的重要指标之一,在一定程度上反映出色素提取方法的优劣。对不同方法提取的花色苷色价进行比较,结果如图1所示。由图可知,双水相法与酸性乙醇法、超声法、水提法相比均有显著差异(p<0.05);双水相法提取物色价明显高于其它方法,约为水提法的4倍,约为酸性乙醇法和超声法的2倍,均有极显著差异(p<0.01),可能是双水相体系萃取过程中能够将部分杂多糖与杂蛋白去除,在一定程度上增加了色素的纯度,从而使色价大大提高,由此可以得出双水相法在花色苷的提取上更有优势。
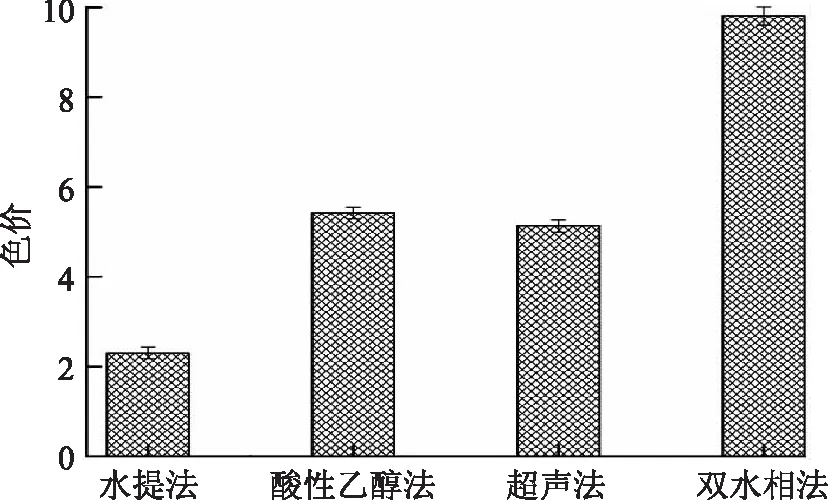
图1 不同提取方法花色苷色价比较Fig.1 Comparison of anthocyanin color density of different extraction methods
花色苷提取方法的优劣直接关系到花色苷得率的高低。实验对以上四种方法进行比较,结果见图2所示。由图可知,双水相法与水提法、酸性乙醇法、超声法相比均有显著性差异(p<0.05),双水相法提取的花色苷得率最高,可能是双水相法中盐与有机相之间的作用力使花色苷更易浸出,花色苷得率较高。因此后期实验采用双水相法提取花色苷。

图2 不同提取方法花色苷得率的比较Fig.2 Comparison of anthocyanin yield of different extraction methods
2.2单因素结果分析
2.2.1硫酸铵质量分数对花色苷得率的影响由图3可知,随着硫酸铵质量分数增加,花色苷得率呈现上升趋势,当硫酸铵质量分数达到20%时,花色苷得率达到最高,为3.693±0.011mg/g;而超过20%时,花色苷得率则下降。分析原因可能是随着硫酸铵浓度增大,其争夺水分子的能力越强,导致上相中水分子减少,乙醇质量分数增加,上相极性增大,使花色苷逐渐溶出;当超出该体系萃取能力时,上相萃取饱和,多余的花色苷转移到下相,导致得率下降[15]。

图3 硫酸铵质量分数对花色苷得率的影响Fig.3 Effects of ammonium sulfate concentration on the anthocyanin yield
2.2.2乙醇质量分数对花色苷得率的影响由图4可知,随着乙醇质量分数的增大,花色苷得率总体呈现先上升后下降趋势,当体系中乙醇浓度由20%增加到22%时,花色苷得率显著升高(p<0.05),可能是有机相浓度增加使得上相萃取能力增加,导致花色苷得率上升;当乙醇浓度为22%时,花色苷得率最高,达到3.677±0.013mg/g,随后呈现下降趋势,分析原因可能是乙醇浓度较低时,花色苷在上相中溶解度较小,溶解出的总量较少,导致花色苷得率降低;而过高浓度的乙醇破坏花色苷的结构性质,不利于花色苷的溶出[18]。

图4 乙醇质量分数对花色苷得率的影响Fig.4 Effects of ethanol content on the anthocyanin yield
2.2.3pH对花色苷得率的影响由图5可知,随着提取液pH上升,提取液酸性降低,花色苷得率逐渐下降,在pH=2时,花色苷得率最高,达到4.121±0.023mg/g,与pH=5.00时相比,花色苷得率高出1.123mg/g,可能是由于花色苷在不同pH下,四种结构相互转化,在较强酸性条件下,花色苷以红色的黄烊正离子存在,显红色,随着pH增大,显无色,因而随着pH增大,花色苷得率呈下降趋势。

图5 pH对花色苷得率的影响Fig.5 Effects of pH on the anthocyanin yield
2.2.4温度对花色苷得率的影响由图6可知,随着温度的升高,花色苷得率总体呈现先上升后下降的趋势,当初始温度为15℃时,花色苷提取得率低,可能是较低的温度不足以使活性物质分子全部浸出[19];而当温度升高到55℃时,花色苷得率显著下降,可能是由于花色苷对热敏感,此时温度已经超过花色苷的耐受范围,导致花色苷结构特性被破坏,从而导致得率的降低;当温度为35℃时,大部分花色苷浸出,并且没有受到高温损伤,花色苷得率最高,达到2.935±0.011mg/g。
2.2.5提取时间对花色苷得率的影响由图7可知,当提取时间为20 min时,花色苷得率最低,可能是较短的时间不足以使目标物质提取完全,而当提取时间上升到60 min时,花色苷得率显著升高,达到2.981±0.002mg/g,随后呈现下降的趋势,分析其原因可能是,过长的时间导致提取液中花色烊阳离子在酸性条件下转变为无色查尔酮结构,结构被损伤[20],花色苷得率下降。
2.2.6料液比对花色苷得率的影响由图8可知,当料液比由1∶10 g/mL上升到1∶40 g/mL,花色苷得率显著升高,当料液比达到1∶40 g/mL时,花色苷得率最高,达到3.837±0.023mg/g,可能是在高料液比条件下,溶剂渗透并扩散到植物细胞内、溶剂在植物细胞内破坏疏水键,花色苷向溶剂中扩散的速度增大,从而一定程度上提高了花色苷得率[14],当料液比由1∶40 g/mL增加到1∶50 g/mL,花色苷得率有所下降,因而过高的料液比反而不能提高花色苷得率,还会使得后期浓缩有一定难度,因此选择1∶40 g/mL为最佳料液比。
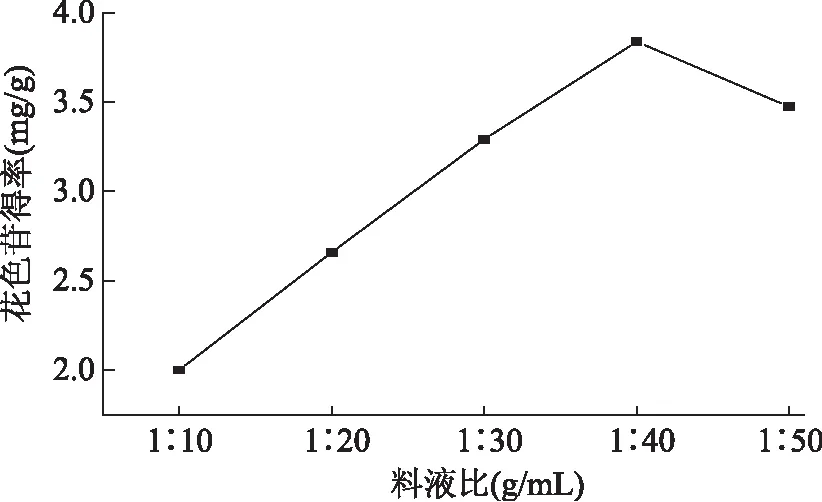
图8 料液比对花色苷得率的影响Fig.8 Effects of solid liquid ratio on anthocyanin yield
2.2.7Plackett-Burman和响应面结果分析采用Plackett-Burman实验筛选,通过表2可以得出提取温度和提取时间对双水相提取花色苷影响不显著(p>0.05),考虑到生产成本和经济效益,提取温度选择常温(25℃),提取时间为30 min。料液比、乙醇质量分数、硫酸铵质量分数、pH对得率(Y)的影响著(p<0.05),因此通过响应面对其进行优化。

表2 Plackett-Burman实验结果表
注:“**”表示极显著(p<0.01),“*”表示显著(p<0.05)。
响应面设计方案和实验结果见表3。采用Design-Expert 8.05软件对表3数据进行多元回归拟合,得到响应值Y对影响因子乙醇质量分数(A)、硫酸铵质量分数(B)及pH(C)、料液比(D)的二次多项式回归模型,如公式(2)所示:
Y=-142.55323+6.91340A+4.19158B-3.08810C+0.71968D-0.11073AB+0.11050AC-0.023932AD-0.012769BC+0.011165BD-3.17600E-003CD-0.073350A2-0.040787B2+0.16844C2-3.84683E-003D2
式(2)
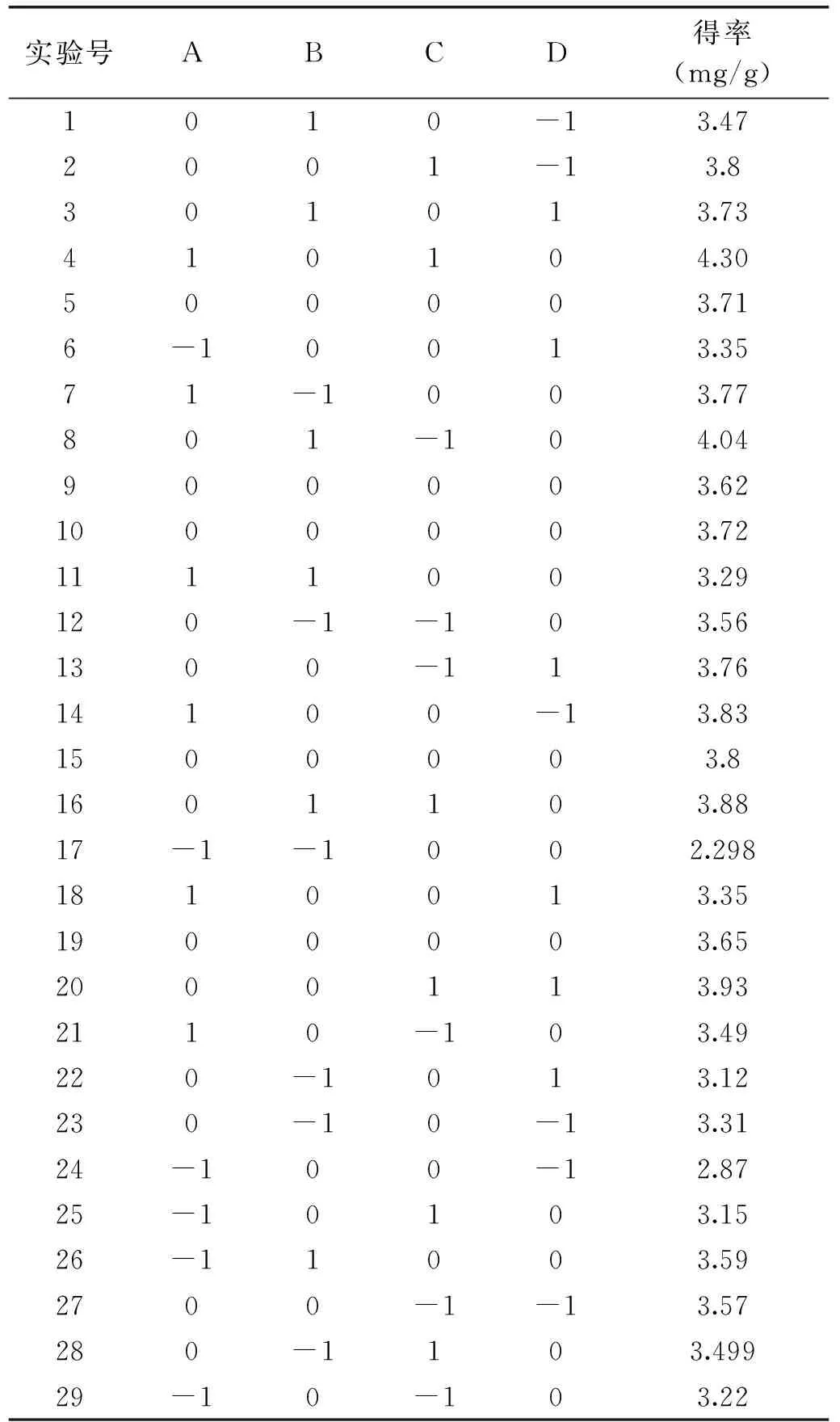
表3 响应面实验设计表
对公式2的模型进行方差分析,结果见表4。
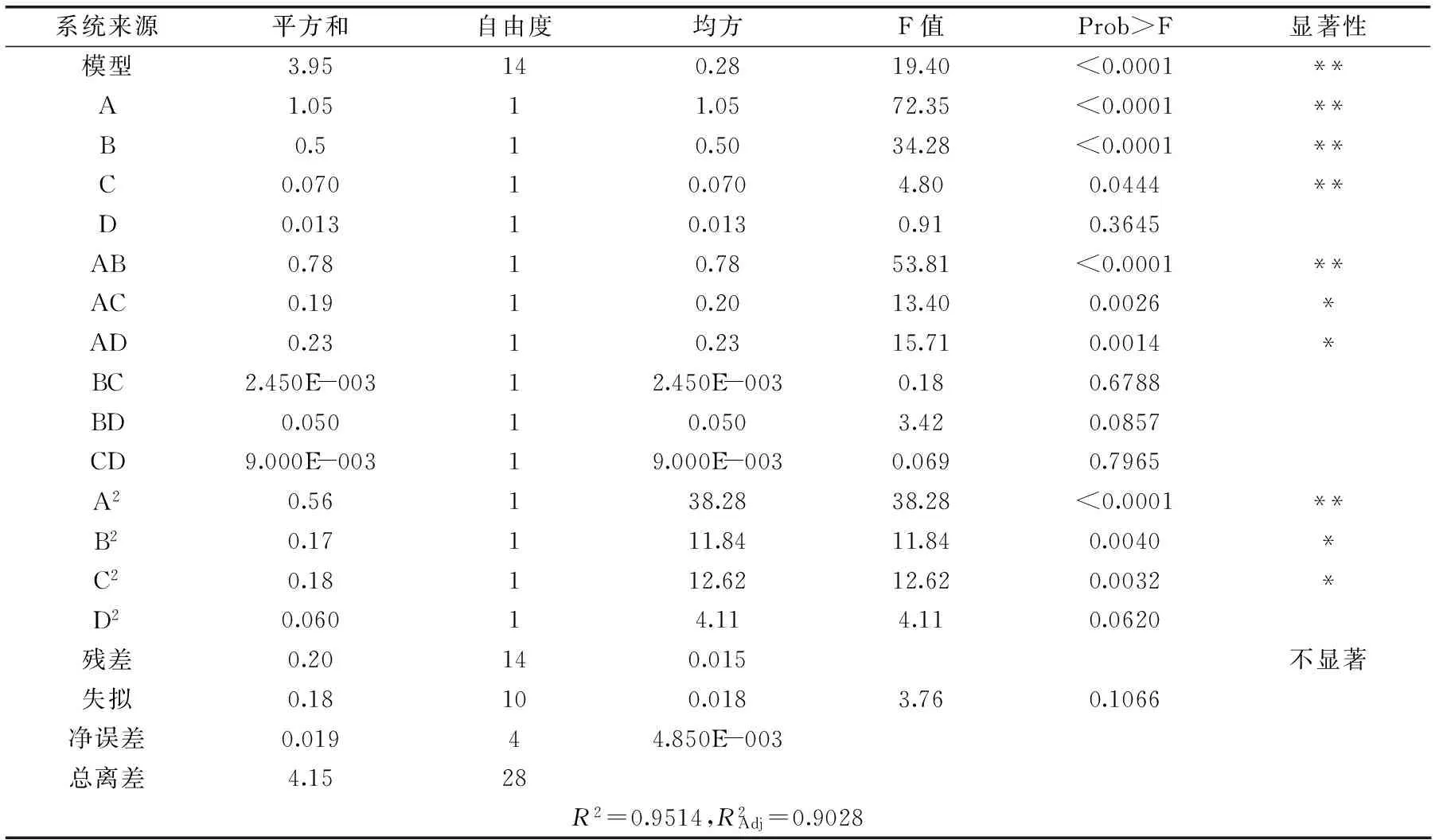
表4 花青素得率实验结果的方差分析
注:“**”表示差异极显著(p<0.0001),“*”表示差异显著(p<0.01或p<0.05)。

利用Design-expert 8.05对数据进行处理,得到乙醇质量分数、硫酸铵质量分数及料液比等各因素之间交互作用的响应面图。图9~图14表示任意两个变量为定值时,其余两个变量的交互作用。由图9~图11可知,在一定范围内,花色苷得率随着乙醇质量分数的增加先增后减,在乙醇质量分数为26%取得最大值。由图12可知,在一定范围内,随着pH的增大,花色苷得率减小,在pH为2时得率最大。图13、图14曲线较陡,表明随着料液比的变化,花色苷得率变化明显。
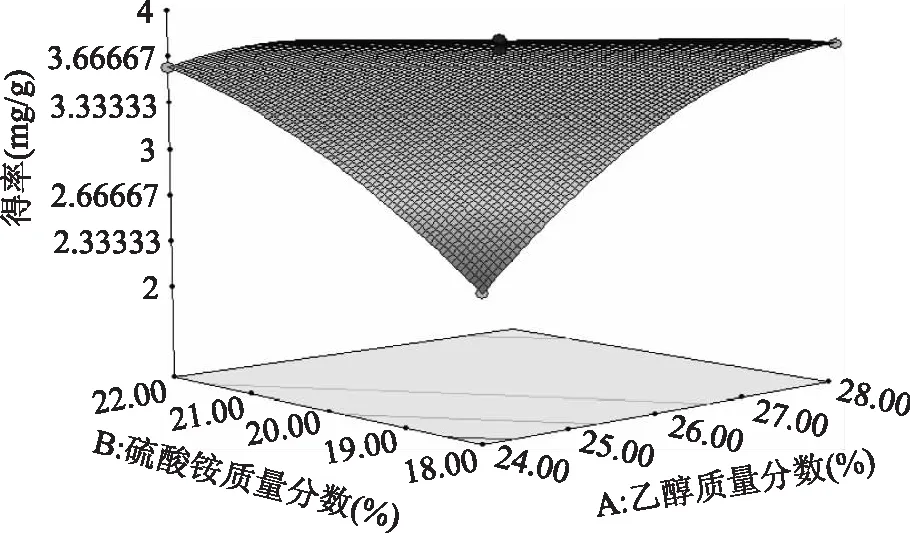
图9 乙醇质量分数和硫酸铵质量分数对花色苷得率影响的响应面图Fig.9 Response surface of ethanol concentration and ammonium sulphate concentration on the anthocyanin yield
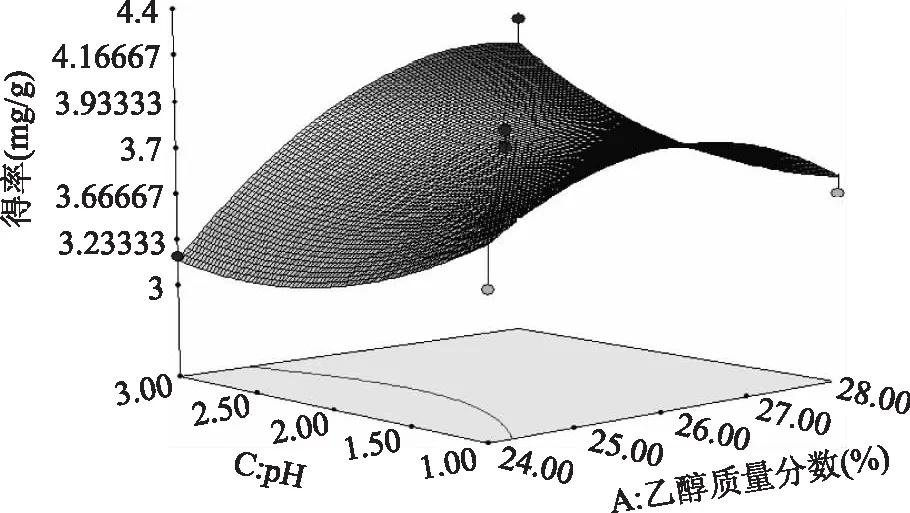
图10 乙醇质量分数和pH对花色苷得率影响的响应面图Fig.10 Response surface of ethanol concentration and pH on the anthocyanin yield

图11 乙醇质量分数和料液比对花色苷得率影响的响应面图Fig.11 Response surface of ethanol concentration and solid-liquid ratio on the anthocyanin yield

图12 硫酸铵质量分数和pH对花色苷得率影响的响应面图Fig.12 Response surface of ammonium sulphate concentration and pH on the anthocyanin yield

图13 pH和料液比对花色苷得率影响的响应面图Fig.13 Response surface of pH and solid-liquid ratio on the yield of anthocyanin
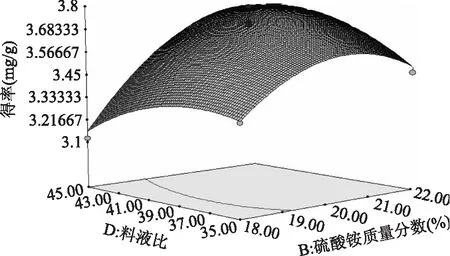
图14 硫酸铵质量分数和料液比对花色苷得率影响的响应面图Fig.14 Response surface of ammonium sulphate concentration and solid-liquid ratio on the yield of anthocyanin
2.2.8提取工艺条件验证实验根据回归模型得到最优的工艺条件为乙醇质量分数为28%,硫酸铵质量分数为18.14%,pH为3.00,料液比为 35.00 g/mL,花青素得率最大预测值为4.50mg/g。即为检验响应曲面法所得结果的可靠性采用上述优化提取条件提取花色苷,考虑到实际生产,将提取工艺参数调整为乙醇质量分数为28%,硫酸铵质量分数为 18.14%,pH为3.00,料液比为 1∶35 g/mL,采用上述工艺参数进行验证,重复3次实际测得的花色苷质量得率分别为4.46、4.42、4.43mg/g,平均花色苷得率为4.44mg/g,与理论值相比,其相对误差约为1.36%。
3 结论
通过单因素实验以及Plackett-Burman实验,拟合了pH、乙醇质量分数、硫酸铵质量分数、料液比,这四个因素对花色苷得率的二次多项式数学模型回归模型,经检验证明该模型合理可靠,能较好预测双水相法提取葡萄皮花色苷的得率。由该模型确定的最优工艺条件是乙醇质量分数为28%,硫酸铵质量分数为18.14%,pH为3.00,料液比为 1∶35 g/mL,花色苷得率为4.43mg/g。采用双水相法提取可以显著提高花色苷的得率,在花色苷提取领域展现出良好的应用前景。
[1]Torres J L,Varela B,Garcia M T,et al.Valorization of grape by products Antioxidant and biological properties of polyphenolic fractions differing in procyanidin composition and flavonol content[J].Journal of Agricultural and Food Chemistry,2002,50(26):7548-7555.
[2]张秀玲,祝义伟,孙佳平,等.酿酒后的葡萄渣的综合利用[J].食品工业科技,2008,29(7):284-288.
[3]薄艳秋.蓝莓花青素的提取和抗氧化活性研究[D].哈尔滨:东北农业大学,2012.
[4]韩永斌.紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D].南京:南京农业大学,2007.
[5]肖军霞,黄国清,仇宏伟,等.红树莓花色苷的提取及抗氧化活性研究[J].食品科学,2011,08:15-18.
[6]李颖畅.蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学,2008.
[7]贾娜,孔保华,张洪涛.黑加仑花色苷的提取及抗氧化活性研究[J].食品科学,2011,16:162-166.
[8]宋岩.黑豆花色苷提取、纯化及体内外抗氧化研究[D].哈尔滨:东北农业大学,2013.
[9]肖功年,李言郡,陈波,等.RSD法优化紫葡萄皮花色苷超声辅助萃取工艺研究[J].浙江科技学院学报,2013,25(1):21-26.
[10]卢锋波,刘桂玲,王烁,等.响应面法优化果胶酶酶解提取黑莓花色苷的工艺参数[J].食品科学,2010,31(16):11-15.
[11]吕春茂,王新现,董文轩,等.响应面法优化越橘花色苷微波辅助提取工艺参数[J].食品科学,2011,32(6):71-75.
[12]王志辉.双水相体系对葛根中葛根素的提取技术的研究[D].江西:南昌大学,2007.
[13]闫永胜,逯洋,韩娟,等.聚合物-盐双水相技术及研究进展[J].吉林师范大学学报:自然科学版,2014,03:6-16.
[14]刘兴丽.紫甘薯花青素双水相提取工艺及酒精性肝损伤预防效果研究[D].北京:中国农业科学院,2013.19-21.
[15]Yingchun Wua,Yun Wang.Extraction and preliminary purification of anthocyanins from grape juice in aqueous two-phase system[J].Separation and Purification Technology,2014,124 170-178.
[16]赵慧芳,王小敏,闾连飞,等.黑莓果实中花色苷的提取和测定方法研究[J].食品工业科技,2008,29(5):176-179.
[17]冯建光,谷文英.葡萄皮红色素的示差法测定[J].食品工业科技,2002,23(9):85-86.
[18]张华.双水相/三液相萃取分离天然产物有效成分[D].大连:大连理工大学,2009.
[19]郭菲,刘继,黄彭,等.响应面分析法优化紫茄皮花色苷的提取工艺[J].食品工业科技,2014,35(6):268-276.
[20]孙文娟.紫薯花色苷提取、脱味、稳定性及其结构初步鉴定[D].无锡:江南大学,2015.
Extraction of anthocyanin from grape skin with aqueous two-phase system
HUANG Yu1,DUAN Ji-hua2,HUANG Wei1,BAI Yu-jia1,ZHANG Pei-ling1,ZHENG Feng1,FENG Zuo-shan1,*
(1.College of Food Science and Pharmacy,Xinjiang Agricultural University,Urumqi 830052,China; 2.Urumqi Innovation Source Biotechnology Limited Company,Urumqi 830013,China)
Grape skin was used as the raw material to explore the effect of Aqueous two-phase system on yield of anthocyanin.Four extraction parameters including pH,ethanol concentration,ammonium concentration,solid-liquid ratio were optimized by using Plackett-Burman design based on single factor investigations for achieving yield of anthocyanin.The interaction of the respective variables and their influence on the yield were studied by using Box-Benhnken central composite design and response surface analysis theory,the simulated quadratic polynomial regression equation of prediction model was set up.The optimal parameters were optimized by response surface analysis.The ethanol concentration,ammonium sulphate concentration,pH and solid-liquid ratio were 28%,18.14%,3.00 and 1∶35 g/mL,respectively.The optimal yield of anthocyanin was 4.43mg/g.The research will provide theoretical support for the anthocyanin of practical application.
grape skin;anthocyanin;aqueous two-phase;extracting
2015-08-07
黄瑜(1991-),女,硕士研究生,研究方向:食品工程,E-mail:hyu1018@126.com。
冯作山(1963-),男,博士,教授,研究方向:食品工程,E-mail:fengzuoshan@126.com。
TS254.1
B
1002-0306(2016)07-0220-07
10.13386/j.issn1002-0306.2016.07.034

