香樟内生细菌的分离与发酵产物抗氧化活性评价
詹 伟,曾令亭,方 正,施 思,张传博,翁庆北
(贵州师范大学生命科学学院,贵州贵阳 550001)
香樟内生细菌的分离与发酵产物抗氧化活性评价
詹伟,曾令亭,方正,施思,张传博,翁庆北*
(贵州师范大学生命科学学院,贵州贵阳 550001)
目的:分离香樟内生细菌,评价内生细菌发酵产物抗氧化活性,为香樟开发及其内生细菌作为天然抗氧化活性物奠定基础。方法:采用组织块分离和组织匀浆法分离香樟内生细菌,通过测定发酵上清液的总还原力,以及其对DPPH自由基、超氧自由基和羟自由基等的清除能力,评价内生细菌发酵产物抗氧化活性,并通过16S rRNA基因序列分析对内生细菌进行初步鉴定。结果:从香樟枝条、叶及果实等组织中共获得64株内生细菌,总还原力测定表明67.19%内生菌的发酵产物具抗氧化活性。香樟内生细菌发酵产物对DPPH自由基的清除能力强于对超氧自由基和羟自由基的清除能力。其中,对DPPH自由基具清除能力的内生菌占62.50%,平均清除率为73.96%;对超氧自由基具清除能力的占12.50%,平均清除率为16.49%;对羟自由基具清除能力的仅占6.25%,平均清除率为6.07%。初步鉴定表明,具抗氧化活性的内生细菌均为芽孢杆菌属(Bacillus)。结论:香樟内生细菌发酵产物具较强的抗氧化活性,可作为筛选开发天然抗氧化剂的潜在资源。
香樟,内生细菌,抗氧化活性,芽孢杆菌
机体在新陈代谢过程中会产生许多活性氧,当体内自由基含量过高时,其与生物大分子结合可造成机体损伤,引发癌症、关节炎、心血管等疾病[1]。通过补充抗氧化物质可以增强机体的抗氧化能力。因此,开发绿色、安全的天然抗氧化物对延缓人体衰老,预防某些疾病具有重要意义。
植物内生细菌指全部或部分阶段生活在植物组织或器官内,对宿主植物不会引起明显病害的细菌[2-4]。内生菌存在于绝大多数植物中,可产生与植物宿主相同或相似的次生代谢产物,具有抗菌、抗氧化、抗癌和抗炎等多种生物活性[4-5]。目前,已从杜仲[6]、虎皮檀[7]、德国鸢尾[8]、交让[9]等许多植物中分离到了具抗氧化活性的内生菌,因此,植物内生菌可作为寻找新的天然产物和开发新药的重要资源。
香樟(Cinnamomumcamphora)是我国长江流域及以南地区的优良木材、油料和药材树种,具驱虫、防腐耐蛀的功能。香樟果实和叶等组织中含有槲皮素、山奈素和异鼠李素黄酮类化合物及多糖等活性成分[10-11],具有清除人体自由基、抗肿瘤、抗炎症等多种生理活性功能[12-14],这为从香樟中分离具生理活性的内生菌资源提供了理论基础。已有研究报道了香樟内生菌具有较好的抑菌活性[15-16],但鲜见香樟内生菌抗氧化活性的研究。本研究从香樟叶、枝条及果实等组织中分离内生细菌,并测定了内生细菌发酵产物的总还原力和自由基清除能力,为进一步开发利用香樟及其内生菌作为天然抗氧化活性物质奠定了基础。
1 材料与方法
1.1材料与仪器
香樟枝条、叶及果实等组织于2012年5月采自贵州师范大学校园内。
1,1-二苯基-2-三硝基苯肼(DPPH)、十二烷基硫酸钠(SDS)、蛋白酶K等购自Sigma公司、pMD18-T/A克隆试剂盒、HhaI和HaeIII等购自Takara公司;溴代十六烷基三甲胺(CTAB)购自北京索莱宝科技有限公司;其它试剂均为国产分析纯。
UV759CRT紫外可见分光光度计上海佑科仪器仪表有限公司;TS-200B恒温摇床上海天星实验仪器制造厂;SW-CJ-2F双人双面净化工作台苏州净化设备有限公司;HVE-50高压蒸汽灭菌锅HIRAYAMA公司;TG16-W微量高速离心机长沙湘仪离心机仪器有限公司;JR2003N电子天平上海精密科学仪器有限公司;DK-98-Ⅱ电热恒温水浴锅天津泰特仪器有限公司;BS97MyCycler PCR仪Bio-Rad公司;DYY-2C电泳仪电源、DYCP-31DN电泳仪北京六一生物科技有限公司。
1.2实验方法
1.2.1牛肉膏蛋白胨培养基牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1000 mL。固体培养基中加入琼脂粉15 g。
1.2.2内生细菌的分离新鲜香樟组织冲洗、晾干后,内生细菌通过常规植物组织块分离法和组织匀浆分离。将枝条、叶及果实等各5 g,75%乙醇浸泡60 s,无菌水冲洗3次,滤纸吸干,0.1%升汞浸泡30 s,无菌水冲洗5次。将表面消毒处理后的各组织剪切成0.5~1 cm的小块置平板上,或置于研钵中,并加入少量的无菌水和石英砂研磨,研磨匀浆梯度稀释后再涂布于牛肉膏蛋白胨平板,37 ℃培养2~3 d,挑取单菌落纯化后转接于试管斜面4 ℃保存。最后一次清洗组织的无菌水涂布平板,对表面消毒进行验证。
1.2.3内生细菌发酵上清液的制备挑取少量菌苔接种至5 mL牛肉膏蛋白胨培养基中,37 ℃ 160 r/min振荡培养12~16 h(OD600=1.50~1.70),取0.5 mL活化后的菌液加至5 mL牛肉膏蛋白胨培养基中,37 ℃ 160 r/min振荡培养24 h后,3000 r/min离心10 min,上清液用于抗氧化活性测定。
1.2.4抗氧化活性的测定
1.2.4.1总还原力的测定参照文献[17],略作改动。在0.5 mL待测上清液中加入0.5 mL 0.2 mol/L的磷酸缓冲液(pH6.6)和0.5 mL 1%铁氰化钾,50 ℃水浴20 min后,急速冷却。再加入0.5 mL 10%三氯乙酸,3000 r/min离心5 min,取上清液1.0 mL,加入1.0 mL蒸馏水和1.0 mL 0.1%三氯化铁,混合均匀,10 min后,测定700 nm处的吸光度值(As)。以培养基代替待测液作为空白对照。不同浓度的VC为对照,绘制标准曲线。同一样品3次平行。
1.2.4.21,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定参照文献[18],略作改动。取0.5 mL待测上清液与2 mL 65 μmol/L DPPH乙醇溶液混合,静置25 min后,测定517 nm处的吸光度值(As)。用0.5 mL样品液与2.5 mL乙醇混合液调零,以培养基代替待测液作为空白对照(A0),不同浓度的VC为对照,绘制标准曲线。同一样品3次平行。
清除率(%)=(A0-As)/A0×100
1.2.4.3羟自由基清除能力的测定参照文献[19],略作改动,将0.2 mL待测上清液与1.0 mL 7.5 mmol/L硫酸亚铁铵溶液、1.0 mL 7.5 mmol/L水杨酸溶液和1.0 mL 7.5 mmol/L过氧化氢溶液混合,静置1 h后,测定510 nm处的吸光度值(As)。以培养基代替待测液作为空白对照(A0),不同浓度的VC为对照,绘制标准曲线。同一样品3次平行。
清除率(%)=(A0-As)/A0×100
1.2.4.4超氧自由基清除能力的测定参照文献[20],略作改动。取4.5 mL 0.1 mol/L Tris-HCl缓冲液(pH8.2)于试管中,加入1.0 mL 1.0 mmol/L乙二胺四乙酸、1.0 mL待测上清液和2.4 mL蒸馏水,25 ℃保温10 min后,加入2.0 mL 9.0 mmol/L邻苯三酚,反应60 min后,加入100 μL 12.0 mol/L HCl终止反应。测定325 nm处的吸光度(As)。以培养基代替待测液作为空白对照(A0),不同浓度的VC为对照,绘制标准曲线。同一样品3次平行。
清除率(%)=(A0-As)/A0×100
1.2.5内生细菌分子鉴定参照文献[21],将菌株过夜培养后,3000 r/min离心10 min收集菌体沉淀,CTAB法提取菌株DNA。采用细菌通用引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′),PCR扩增内生细菌16S rRNA基因片段。扩增产物分别用HhaⅠ和HaeⅢ进行酶切,2.0%琼脂糖凝胶电泳检测,根据酶切图谱的带型划分为不同的分类单元。挑取代表菌株,将PCR产物与pMD18-T连接后,转化DH5α,利用引物对M13-F(5′-TGTAAAACG ACGGCCAGT-3′)和M13-R(5′-CAGGAAACAGC TATGACC-3′),菌液PCR鉴定重组子,阳性克隆送北京博迈德公司测序。测序后的序列在GenBank数据库中进行Blast比对。
2 结果与分析
2.1香樟内生细菌的分离
从香樟组织中共分离出64株内生细菌,其中从枝条中分离出22株,叶中分离出22株,果实中分离出20株。植物组织表面消毒最后一次清洗液涂布平板,37 ℃培养2~3 d后未见菌落生长,表明表面消毒彻底。
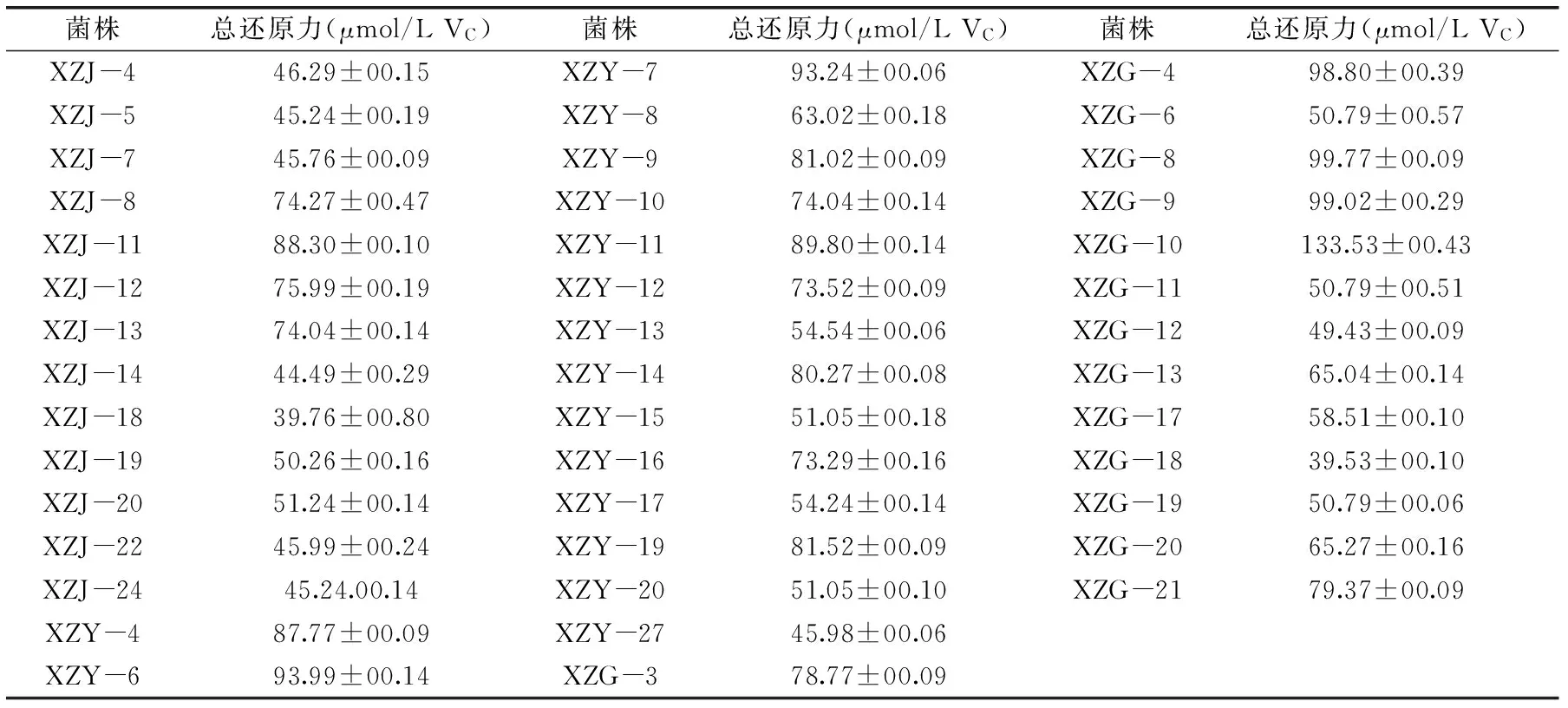
表1 香樟内生菌总还原力的测定Table 1 Total reducing power of endophytic bacteria from Cinnamomum camphor
注:XZJ、XZY和XZG分别表示从香樟枝条、叶和果实中分离的内生菌,表2、表3同。
2.2内生细菌发酵产物抗氧化活性
2.2.1总还原力的测定将分离的64株香樟内生细菌发酵培养后,上清液用于抗氧化活性的测定。总还原力测定结果表明,共43株香樟内生细菌(占67.19%)具有抗氧化能力,其中13株分离自枝条,16株分离自叶,14株分离自果实,分别占各组织分离总菌数的59.09%、72.73%和70.00%(表1)。不同部位分离的内生菌和不同菌株抗氧化活性不同,果实(72.82 μmol/L VC)和叶(71.77 μmol/L VC)内生菌的平均总还原力高于枝条内生菌的(55.91 μmol/L VC),其中还原力最强的为XZG-4、XZG-8、XZG-9、XZG-10及XZY-6,总还原力高于90.00 μmol/L VC,从枝条中分离的XZJ-18最低。
2.2.2清除DPPH自由基的能力通过DPPH分光测定法表明,共有40株内生细菌的发酵产物具有较明显的清除DPPH自由基能力,占总分离菌株的62.50%,其中从枝条、叶、果实等不同组织中分离的菌株数为13株、15株和12株,分别占各组织分离总菌数的59.09%、68.18%和60.00%(表2)。不同部位分离的内生菌和不同菌株对DPPH自由基清除能力略有差异。对DPPH自由基清除能力平均值最高的为果实(76.30%),其次为叶(72.94%)和枝条(72.63%),平均为73.96%。大部分菌株的DPPH自由基清除能力高于70.00%,枝条中分离的XZJ-14、XZJ-19、XZJ-22、XZJ-24以及叶中分离的XZY-27清除率低于70.00%,分别为68.44%、65.55%、66.16%、69.00%和66.21%;分离自叶中的XZY-20、果实中的XZG-6和XZG-8的清除率则高于80.00%,分别为82.19%、80.56%和81.13%。
2.2.3清除羟自由基的能力测定香樟内生细菌发酵产物对羟自由基的清除能力。如表2所示,具有羟自由基清除能力的香樟内生细菌较少且清除率较低,仅4株内生细菌具有清除羟自由基的能力,包括1株从叶中分离的和3株从果实中分离的内生菌,占分离菌株总数的6.25%,清除率在5.11%~6.78%之间,平均清除率为6.07%,这可能与菌株需在氧化应激条件下诱导分泌表达对羟自由基有清除活性物质有关,当环境中缺乏刺激条件时,其表达量较低或不表达[22]。
2.2.4清除超氧自由基能力香樟内生细菌发酵产物对超氧自由基的清除率如表2所示。共有8株内生细菌具有清除超氧自由基的能力,占分离菌株总数的12.50%,平均清除率为16.49%,其中5株分离自果实,另3株分别分离自枝条和叶。其中,除了从果实中分离的XZG-3和XZG-9的清除率分别为32.92%、4.39%,差异较显著外,其余6株内生菌的清除率在12.13%~17.54%之间。
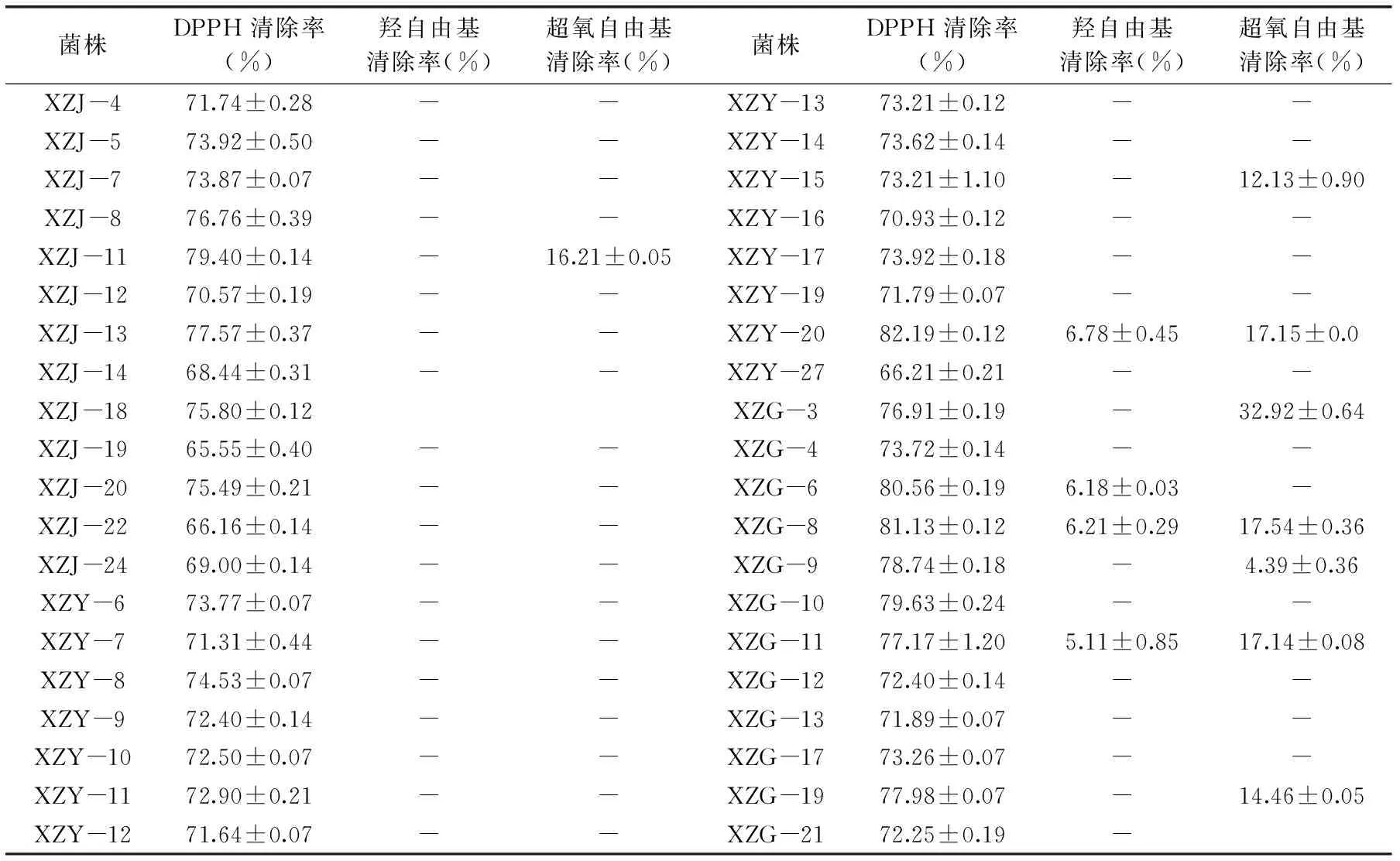
表2 香樟内生细菌对DPPH自由基、羟自由基、超氧自由基的清除作用Table 2 DPPH,hydroxyl and superoxide free radical scavenging activity of endophytic bacteria from Cinnamomum camphor

表3 抗氧化活性内生菌16S rRNA基因序列比对结果Table 3 BLAST results of the antioxidant endophytic bacteria based on 16S rRNA gene sequence
2.3抗氧化活性内生菌的初步鉴定
将具抗氧化活性内生菌培养,提取总DNA,16S rRNA基因扩增产物酶切分析后,将这些菌株分为4个分类单元(表3)。测序和BLAST比对结果表明,这些菌株均属于芽孢杆菌属(Bacillus)。其中,XZJ-5等15株菌株初步鉴定为B.cereus,XZY-7等15株菌株初步鉴定为B.subtilis,XZJ-19等7株菌株初步鉴定为B.stratosphericus,XZJ-4等6株菌株初步鉴定为B.thuringiensis。芽孢杆菌属细菌是植物内生细菌的优势菌群[23],其还可作为肠道益生菌添加到饲料中,降低体内氧自由基含量,提高机体免疫能力,改善生产性能[24-25]。
3 结论与讨论
植物内生菌可以产生宿主植物本身具有或类似的结构更为新颖的生物活性物质,是发掘结构新颖和活性特殊化合物的宝贵资源[4-5]。本实验从香樟组织中初步分离了64株内生细菌,对内生细菌发酵产物抗氧化活性检测和筛选表明,67.19%分离菌株显示出不同能力的抗氧化作用。经16S rRNA基因扩增,分子鉴定初步表明具抗氧化活性的香樟内生细菌均为芽孢杆菌属。结果表明,香樟内生细菌抗氧化活性较为普遍,可作为筛选开发天然抗氧化剂的潜在生物资源。
人体衰老和部分疾病的发生与体内自由基密切相关。通过对DPPH自由基、羟自由基和超氧自由基等的清除能力评价了香樟内生菌发酵产物的抗氧化活性,结果表明,不同内生菌发酵产物对不同自由基的清除能力不同。总体上,香樟内生菌发酵产物对DPPH自由基的清除能力最好,62.50%的分离菌株具有清除能力,平均清除率为73.96%;12.50%的分离菌株对超氧自由基具有清除能力,平均清除率为16.49%;对羟自由基的清除能力最弱,只有6.25%的内生菌具有清除能力,平均清除率为6.07%。香樟不同部位提取物也表现出对不同自由基的清除能力,例如,香樟叶水溶性粗多糖则对过氧化氢具有较好的清除能力,而对羟自由基、DPPH自由基的还原能力较弱[10];香樟果黄酮类花色苷化合物清除DPPH自由基能力较强,对羟自由基、超氧自由基清除能力相对较弱[14]。本实验从香樟分离的43株内生细菌发酵产物中检测到了抗氧化活性,表明这些内生芽孢杆菌可将抗氧化酶或还原性物质分泌到胞外,并与不同自由基发生反应,从而发挥抗氧化作用。但不同菌株发酵产物对不同自由基的清除能力存在差异,除XZY-4、XZG-18、XZG-20等3株菌外,共40株内生菌具有清除DPPH自由基能力,其中,XZJ-11、XZY-15、XZG-3、XZG-6、XZG-9和XZG-19等6株菌还对羟自由基或超氧自由基具有清除作用;XZY-20、XZG-8和XZG-11则表现出对3种自由基都具有较好的清除能力。结果暗示了这些内生菌的抗氧化机制不同。目前报道从杜仲[6]、虎皮檀[7]、德国鸢尾[8]等植物内生菌中分离的抗氧化活性物质多为黄酮类化合物,Teles HL等[26]从Ocoteacorymbosa植物类弯孢属内生真菌中分离到的苯并吡喃以及从九里香正青霉属内生真菌分离的生物碱类物质Spiroquinazoline alkaloid等也具有抗氧化作用。香樟内生菌代谢产物中的抗氧化活性物质是否含为黄酮类或其类似物,以及内生菌的抗氧化物机理是否与其宿主香樟相一致,对它们的体内体外抗氧化活性进一步比较,也将为今后天然抗氧化剂应用和机制研究提供基础。
[1]张江巍,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-37.
[2]Kloepper J B,eauchamp C J.A review of issues related to measuring colonization of plant roots by bacteria[J].Canadian Journal of Microbiology,1992,38:1219-1232.
[3]Hallmann J,Quadt-Hallmann A,Mahaffee W F,et al. Bacterial endophytes in agricultural crop[J].Canadian Journal of Microbiology,1997,43(10):895-914.
[4]王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义[J].微生物学通报,2015,42(2):349-363.
[5]Strobel G,Daisy B.Bioprospecting for microbial endophytes and their natural products[J].Microbiology and Molecular Biology Reviews,2003,67(4):491-502.
[6]沈书庆,殷红,刘芸,等.产杜仲黄酮内生真菌的初步研究[J].菌物研究,2008,6(1):46-48.
[7]Zhao J T,Ma D H,Luo M,et al.Invitroantioxidant activities and antioxidant enzyme activities in HepG2 cells and main active compounds of endophytic fungus from pigeon pea(Cajanuscajan(L.))[J].Food Research International,2014,56:43.
[8]Strobel G A,Ford E J,Worapong JK,et al.Ispoestacin,an isobenzofuranone from Pestalotiopsis microapora,possessing antifungal and antioxidant activities[J].Phytochemistry,2002,69:179-183.
[9]陈良立,苏香萍,邓张双,等.交让木内生真菌JR0203代谢产物抗氧化及抑菌活性研究[J].食品工业科技,2014,35(3):101-104.
[10]王先.芳樟叶黄酮和多糖的提取分离、结构鉴定及抗氧化活性研究[D].厦门:厦门大学,2008.
[11]曾娟,李会娜.香樟叶多酚对油脂的抗氧化活性研究[J].现代食品科技,2012,28(8):949-952.
[12]Hye J L,Eun A H,Weon J Y,et al.Invitroanti-inflammatory and anti-oxidative effect of Cinnammomum camphora extracts[J].Journal of Ethnopharmacology,2006,103:208-216.
[13]苏远波,李清彪,姚传义,等.芳樟树叶乙醇提取物的抗癌作用[J].化工进展,2006,25(2):200-204.
[14]褚衍亮,王娜.香樟果红色素的稳定性及抗氧化活性研究[J].北方园艺,2010,12:44-47.
[15]文才艺,尹志刚,陈建光.香樟内生细菌EBS05的鉴定及其抗菌活性物质性质的研究[J].微生物学通报,2009,6(7):88-93.
[16]李欣龙,王涛,游玲.香樟内生细菌抑制植物病原真菌及对纤维素利用初步研究[J].西南大学学报,2009,31(2):127-130.
[17]Oyaizu M.Antioxidative activities of products of browning reaction prepared from Glucosamine[J].Japanese Journal of Nutrition and Dietetics,1986,44:307-315.
[18]Concepcion S M,Jose A L,Fulgencio S C.A procedure to measure the antiradical efficiency of polyphenols[J].Science of Food and Agriculture,1998,76:270-276.
[19]Smironff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytoehemistry,1989,28(4):1051-1560.
[20]桂兴芬,阎家麒,朱建梅.几种改进的邻苯三酚自氧化法测定超氧化物歧化酶活性的比较[J].中国兽医科技,1993,23(1):23-24.
[21]王玉倩,潘舟强,翁庆北,等.云台山白云岩表层土可培养细菌多样性[J].云南大学学报:自然科学版,2015,37(4):616-622.
[22]文静,黄琴,吴红照,等.12株芽孢杆菌体外抗氧化特性比较研究[J].中国畜牧杂志,2012,48(17):70-73.
[23]Ryan R P,Germaine K,Franks A,et al.Bacterial endophytes:recent developments and applications[J].FEMS Microbiology Letters,2009,278(1):1-9.
[24]Wang Y B,Gu Q.Effect of probiotics on white shrimp(Penaeus vannamei)growth performance and immune response[J].Marine Biology Research,2010,6(3):327-332.
[25]余东游,毛翔飞,秦艳,等.枯草芽孢杆菌对肉鸡生长性能及其抗氧化和免疫功能的影响[J].营养饲料,2010,46(3):22-25.
[26]Teles H L,Si1va G H,Castro G I.Benzopyrans from Curvularia sp.,an endophytic fungus associated with Ocotea corymbosa(Lauraceae)[J].Phytochemistry,2005,66(19):2363-2367.
Isolation of the endophytic bacteria fromCinnamomumcamphoraand evaluation of antioxidant activity of the fermentation product
ZHAN Wei,ZENG Ling-ting,FANG Zheng,SHI Si,ZHANG Chuan-bo,WENG Qing-bei*
(School of Life Sciences,Guizhou Normal University,Guiyang 550001,China)
Objective:To isolate the endophytic bacteria from camphor and evaluate the antioxidant activity of the fermentation product of endophytes in order to lay a basis on developing camphor and its endophytes for natural antioxidants. Methods:Tissue separation and tissue homogenate methods were used to isolate the endopytes from camphor. Through determining of the total reducing power of the fermentation broth and their scavenge activity on DPPH,hydorxyl and superoxide radical,the antioxidant activity of endophytes were evaluated. Based on 16S rRNA gene sequence analysis,the endophytic bacteria were primarily identified. Results:Total of 64 strains of endophytic bacteria were isolated from the stem,leave and fruit of camphor. The total reducing power measurement of the fermentation product showed that 67.19% of the endophytes had antioxidant activity. Moreover,the fermentation product of the camphor endophytes exhibited a higher scavenge activity on DPPH radical compared with the activity on hydroxyl and superoxide radical. Among of them,totally 62.50% of endophytes exhibited scavenging ability on DPPH radical and the average clearance rate was 73.96%,12.50% of endophytes exhibited scavenging ablity on superoxide free radical and the average clearance rate was 16.49%,only 6.25% of endophytes exhibited scavenging ablity on hydroxyl radical and the average clearance rate was 6.07%. The endophytic bacteria with antioxidant activity were primarily identified and all belonged toBacilllus. Conclusion:The endophytic bacteria isolated from camphor have strong antioxidant activity and may be the potential resource for screening natural antioxidants.
Cinnamomumcamphora;endophytic bacteria;antioxidant activity;Bacillus
2016-01-29
詹伟(1987-),男,硕士研究生,研究方向:微生物次生代谢,E-mail:260138560@qq.com。
翁庆北(1975-),女,博士,教授,研究方向:资源微生物学,E-mail:wengqb@126.com。
贵州省优秀科技教育人才省长专项资金([2011]47);国家自然科学基金(31000881)。
TS201.1
A
1002-0306(2016)15-0071-05
10.13386/j.issn1002-0306.2016.15.005

