鲎素肽微胶囊的制备工艺及性能研究
谢海伟,方远见,吴礼珠,王 芬
(蚌埠学院 生物与食品工程系,安徽蚌埠 233030)
鲎素肽微胶囊的制备工艺及性能研究
谢海伟,方远见,吴礼珠,王芬
(蚌埠学院 生物与食品工程系,安徽蚌埠 233030)
本文以合成鲎素肽为芯材,以海藻酸钠和壳聚糖为复合壁材,采用复凝聚法对鲎素肽进行微胶囊化,探讨壁材浓度、壁芯材比例、成囊温度、成囊pH等因素对鲎素肽微胶囊制备工艺的影响,通过单因素实验和正交实验对包埋率和粒径分布进行考察,得到最佳制备工艺参数。并研究微胶囊的形貌特征和粒径大小分布特征;同时研究鲎素肽微胶囊在模拟胃液、模拟肠液中的缓释性能,以及微囊化鲎素肽的抗菌活性、蛋白酶环境下的稳定性。结果表明,最佳的工艺条件为:壁材浓度1.5%,壁芯比8∶1,成囊温度45 ℃,成囊pH5.0;在最佳工艺条件下,鲎素肽微胶囊的包埋率可达84.56%,鲎素肽微胶囊呈规整圆球形,粒径主要分布在40~100 μm区域,平均粒径大小为76.58 μm;鲎素肽微胶囊在模拟胃液中释放率为38.54%,在模拟肠液中的释放率为80.68%,微囊化鲎素肽的抗菌活力是未包埋鲎素肽的80.6%,微囊化鲎素肽比未包埋鲎素肽具有强的蛋白酶耐受性。
鲎素肽,微胶囊,制备工艺,缓释性能
鲎素肽具有抗细菌、抗真菌、抗病毒、抑制肿瘤细胞增殖和诱导癌细胞分化等生物活性,具有巨大应用价值[1]。鲎素肽和其他抗菌肽相比,分子量更小、抗菌谱更广、选择性更高、副作用更低、抗菌效率更强,被看作是一种可替代抗生素类的新型药物。
然而鲎素肽作为小分子活性肽在体内存在半衰期短、稳定性较差、易被体内酶系降解等问题,这使得鲎素肽在口服给药体系中受到极大的限制,大大降低其临床应用价值[2]。采用小分子活性肽微胶囊技术,提高多肽类药物在体内的稳定性,实现鲎素肽药物的缓释效果,可以提高鲎素的临床应用价值。以壳聚糖-海藻酸钠为复合壁材是制备蛋白质类药物微胶囊常采用的一种方法,壳聚糖和海藻酸钠均为天然的高分子材料,具有无毒、可降解、相容性好和成膜性好等特点,适于包埋敏感的蛋白、多肽类药物[3]。海藻酸钠溶液和壳聚糖稀酸溶液混合后,通过静电作用力形成聚电解质膜,静电作用力不需要高温的热交联过程和化学交联中共价键的形成,对蛋白质和肽类等半衰期短、稳定性差的药物是一种良好的载体[4]。目前制备微胶囊的方法很多,但在保持蛋白类药物生物活性的基础上,能够有效地减小微胶囊的粒径、提高对药物的负载能力、并对药物进行控释或缓释,仍是蛋白质给药系统应用的瓶颈问题。
本文以合成的鲎素肽为实验原料,选择海藻酸钠和壳聚糖为复合壁材对鲎素肽进行微胶囊处理,优化微胶囊制备工艺,并对微胶囊的表征性能进行分析,为其开发成临床药物奠定坚实的基础。
1 材料与方法
1.1材料与仪器
鲎素肽氨基酸序列NH2-K-W-C-F-R-V-C-Y-R-G-I-C-Y-R-R-C-R-CONH2由上海黙悉生物科技有限公司合成,纯度95%,采用Fmoc多肽固相合成法合成,合成的鲎素肽样品用反相高效液相色谱纯化,利用质谱确定分子量,通过与理论分子量的比较判断合成效果。壳聚糖,海藻酸钠,无水氯化钙,醋酸均购自于上海生工,均为分析纯。
S-3700扫描电子显微镜日本日立公司;MS2000激光粒度分析仪英国马尔文公司;Waters 600E高效液相色谱、Waters ZQ2000质谱仪美国Waters公司。
1.2实验方法
1.2.1复凝聚法制备鲎素肽微胶囊的工艺优化将壳聚糖溶于1%醋酸溶液,使壳聚糖浓度为1%,加入无水氯化钙搅拌均匀。另配制3%的海藻酸钠水溶液,使复合壁材壳聚糖与海藻酸钠比例为3∶1,在海藻酸钠水溶液中加入鲎素肽,使其终浓度为40 mg/L,将含鲎素肽的海藻酸钠溶液缓慢滴加到等体积的壳聚糖氯化钙溶液中,45 ℃水浴,并用醋酸调到pH5.0,不断搅拌,20 min后移开水浴,3000 r/min离心15 min,洗涤数次,将沉淀物于45 ℃烘箱中干燥即得微囊粉末[5]。
1.2.1.1单因素实验选取复合壁材浓度、壁材芯材质量比、成囊温度、成囊pH四个因素。采用复合壁材浓度为(0.5%、1%、1.5%、2%、2.5%);壁材芯材质量比(2∶1、4∶1、6∶1、8∶1、10∶1、12∶1);成囊温度(30、35、40、45、50、55 ℃);成囊pH(2.0、3.0、4.0、5.0、6.0、7.0)进行单因素实验,分析各因素对鲎素肽微胶囊包埋率的影响。
鲎素肽微胶囊包埋率(%)=最初加入鲎素肽的量-上清液中鲎素肽的量/最初加入鲎素肽的量×100
1.2.1.2正交实验设计为了优化制备工艺,根据以上单因素实验统计分析结果,确定以复合壁材浓度%(A)、壁材∶芯材质量比(B)、成囊温度(C)、成囊pH(D)为影响因素,每个因素选取3个水平,以微囊的包埋率为优化指标,用正交实验设计L9(34)(见表1)。

表1 L9(34)正交实验设计表Table 1 Factors and levels of orthogonal experiment
1.2.2鲎素肽微胶囊的表征
1.2.2.1扫描电子显微镜对微胶囊形貌观察将正交优化实验制备的鲎素肽微胶囊样品放在95%乙醇中,在功率100 W超声分散器中分散30 min,吸取样品到盖玻片上,待乙醇挥发后,在40 ℃进行真空干燥12 h,制作分散好的微胶囊的样品[6]。再对样品进行喷金,随后将样品放到S-3700的扫描电镜下观察,并在放大倍数为1000倍进行拍摄得到电镜图片。
1.2.2.2微胶囊微粒粒径分析将正交优化实验制备的微胶囊样品,100 W的超声分散器中分散60 min,再以水为分散剂,25 ℃条件下,具体参照文献[7]方法,通过MS2000激光粒度分析仪测得微胶囊的粒径平均值以及粒径分布状况。
1.2.3鲎素肽微胶囊体外释放实验人工模拟胃液、肠液参照中国药典(2010版)的方法配制;然后进行鲎素微胶囊在人工模拟消化环境中的释放实验。称取干燥的微胶囊500 mg装入锥形瓶,加入新配制的人工胃液100 mL,37 ℃下混合均匀,每隔1 h取样处理,在280 nm波长处测定吸光度,检测鲎素肽含量的变化。计算释放率,绘制释放曲线[8]。采用上述同样的方法测定鲎素肽在模拟肠液中的释放率。释放率和载药率的计算如下:
释放率(%)=模拟胃(肠)液中释放的总肽量(g)/加入微胶囊的重量(g)×载药率×100
载药率(%)=最初加入鲎素肽的量-上清液中鲎素肽的量/微胶囊的量×100
1.2.4鲎素微胶囊生物活性研究
1.2.4.1鲎素肽微胶囊抗菌特性实验分别配制浓度80 mg/L的未包埋鲎素和微胶囊化鲎素溶液为母液,经2倍稀释后,分别对大肠杆菌K88进行抑菌实验,采用琼脂糖孔穴扩散法[9]测定抗菌活力,以未包埋鲎素肽的抗菌活力定为100,微胶囊化鲎素肽的抗菌活力与其作对照,测得微胶囊鲎素肽的相对抗菌活力,分析未包埋鲎素肽和微胶囊鲎素肽的抗菌活力的变化。
1.2.4.2鲎素肽微胶囊对蛋白酶环境稳定性实验采用1.2.4.1的方法配制未包埋鲎素肽和微胶囊鲎素肽溶液样品,待测样品在不同蛋白酶溶液中的耐受性实验参照文献[10]的方法,以未包埋鲎素肽在水溶液的抗菌活力规定为100,未包埋鲎素肽和微胶囊化鲎素肽在蛋白酶溶液下的抗菌活力与其作对照。分析未包埋鲎素肽和微胶囊鲎素肽对蛋白酶耐受性的变化。
1.2.5数据处理实验均做3次重复,数据用SPSS17.0统计软件处理,数据以均数±标准差(X±s)表示,用Origin8.5作图。
2 结果与讨论
2.1复合壁材浓度对微胶囊性能的影响
从图1可知,微胶囊的包埋率随复合壁材浓度增加呈变化趋势,当复合壁材浓度小于1.5%时,包埋率逐渐增加;当浓度达到1.5%时,包埋率达到最高值83.8%;当浓度大于1.5%时,包埋率反而下降。另外,随着复合壁材浓度的增大,微囊平均粒径也随之逐渐增大,壁材浓度在0.5%~1.5%范围粒径增大明显,当浓度1.5%~2.5%范围粒径增大缓慢,浓度到2.5%时,平均粒径最大。低浓度壳聚糖和海藻酸钠分子易充分、均匀接触,从而在芯材周围形成微胶囊壁,随着浓度的增高,复合壁材中壳聚糖基质可阻止芯材从未固化的微滴扩散进入分散介质,从而使包埋率提高;但壳聚糖浓度过高,会使溶液黏度太大,海藻酸钠和壳聚糖发生急剧的聚合反应,产生胶块,使得壁材不能均匀分散在芯材周围,导致包埋率下降[11]。造成这一结果的原因是壳聚糖和海藻酸钠之间静电相互作用的速度非常快,壳聚糖溶液滴加到海藻酸钠溶液中,正负静电作用迅速形成囊膜。
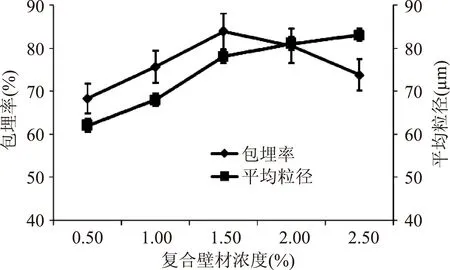
图1 复合壁材浓度对微胶囊性能的影响Fig.1 The effect of microcapsules by capsule concentration
2.2壁芯材比例对微胶囊性能的影响
从图2可以看出,壁芯材的比例直接影响到包埋率,壁材比例越大,包埋率越高,壁芯材比为12.0∶1时,包埋率达到最高80.5%。原则上是包埋率越高越好,但考虑到壁材比重太大,会使载药量降低,因此选择壁芯材比例为8.0∶1,此时包埋率已达75.2%,可以通过优化其它包埋条件进一步提高包埋率。这可能是因为壁材的增加,被包埋的鲎素肽的量将会增加,从而导致微胶囊的包埋率逐渐增加。对于微囊粒径,当壁芯材比例增大,微囊壁厚度增加,微囊的芯材鲎素肽的量将减少,微胶囊的平均粒径先减小,后增大;刚开始时随着海藻酸钠和壳聚糖加入量的增加,使得海藻酸钠和壳聚糖可以和芯材鲎素肽在静电作用力下迅速形成较大的微囊,随后微囊粒径减小,当海藻酸钠和壳聚糖量逐渐增加,微胶囊成囊的壁膜将越来越厚,使得微胶囊的整体粒径增大。
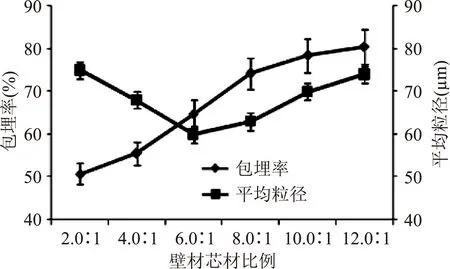
图2 壁芯材比例对微胶囊性能的影响Fig.2 The effect of microcapsules by wall core ratio
2.3成囊pH对微囊性能的影响
从图3可以看出,成囊pH对微胶囊的性能也存在重要的影响。pH从2.0升至5.0时,包埋率呈增加趋势。当pH5.0时达到最大值85.5%;当pH超过5.0后,包埋率开始下降,此时壳聚糖的成膜性能下降,与海藻酸钠发生聚合反应后不能将鲎素肽很好的包裹,当pH提高到6.0时,壳聚糖呈片状从溶液中析出,不能对芯材进行包埋。实验得出pH5.0左右成囊效果最好。微胶囊平均粒径也随pH变化而改变,变化趋势和pH对微胶囊包埋率影响类似。成囊体系pH对微囊的包埋率和粒径大小方面的影响,一方面是因为不同pH下,壁材中壳聚糖的质子化程度不同,导致壳聚糖和海藻酸钠的静电相互作用程度不同而引起机械强度和包埋率等方面的差异。另一方面,壳聚糖-海藻酸钠溶液的pH对所形成膜致密程度产生一定的影响。不同pH下形成的微囊表面可能会呈现致密光滑的结果,也可能形成蜂窝状的多孔结构,从而对微囊的渗透性及芯材释放性能产生影响[12]。
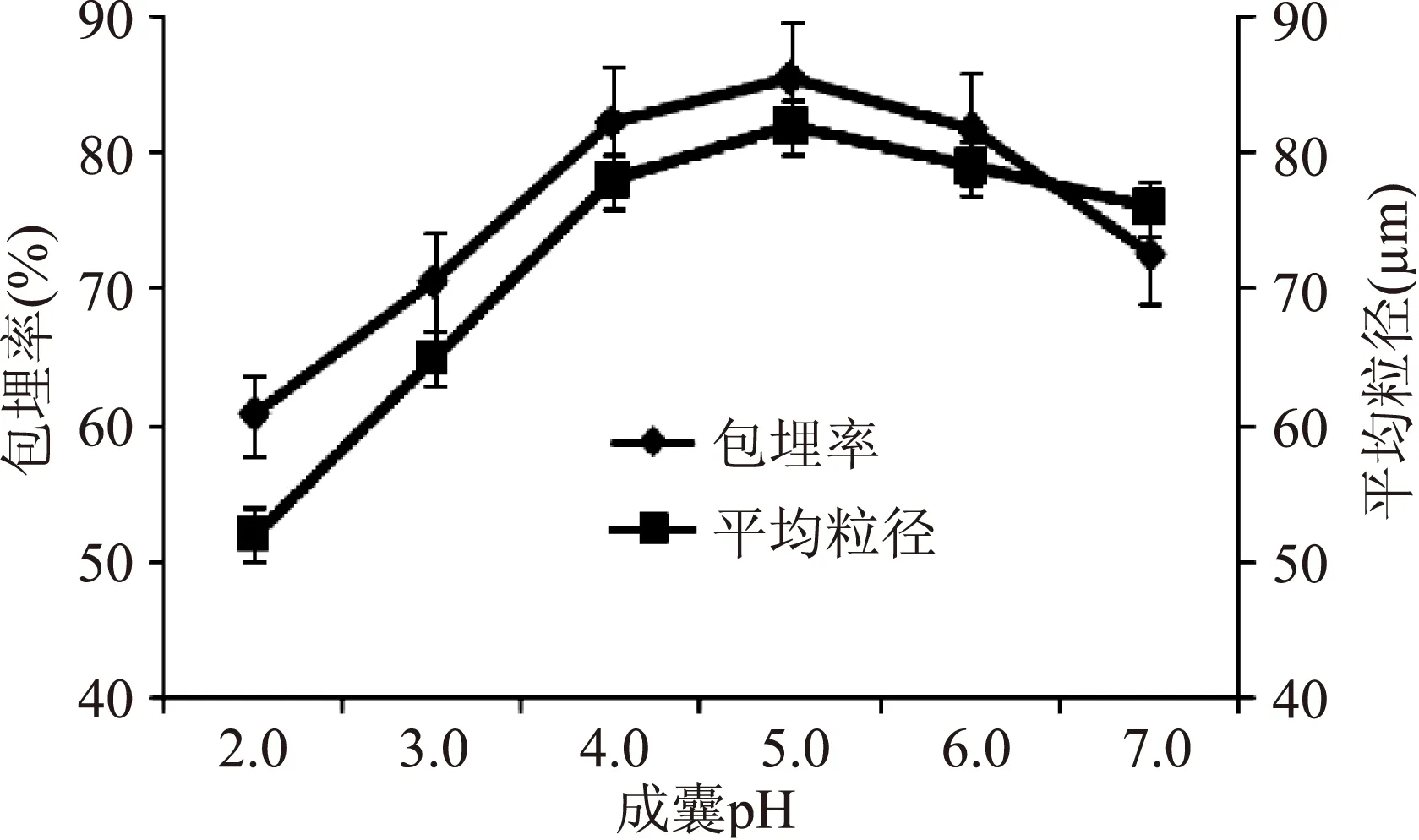
图3 pH对微胶囊性能的影响Fig.3 The effect of microcapsules by pH
2.4成囊温度对微囊包埋率的影响
从图4可以看出,成囊温度对包埋率也存在重要影响,在一定温度范围内,随着温度的升高,包埋率呈现先升高后降低的变化趋势,成囊温度45 ℃时,微胶囊的包埋率达到最大79.5%。适当提高温度可以提高囊材的溶解性能,使其黏度降低,利于成囊;温度升高,体系黏度降低,不利于成囊反应的发生。成囊温度对微胶囊的平均粒径也有一定的影响。低温时,海藻酸钠和壳聚糖容易形成凝胶,使得平均粒径较大,随着温度的升高,海藻酸钠和壳聚糖的凝胶不易形成,微胶囊的平均粒径大大降低。当温度继续上升,可能使得形成的微胶囊囊壁受到破环,使得包埋率有所下降。
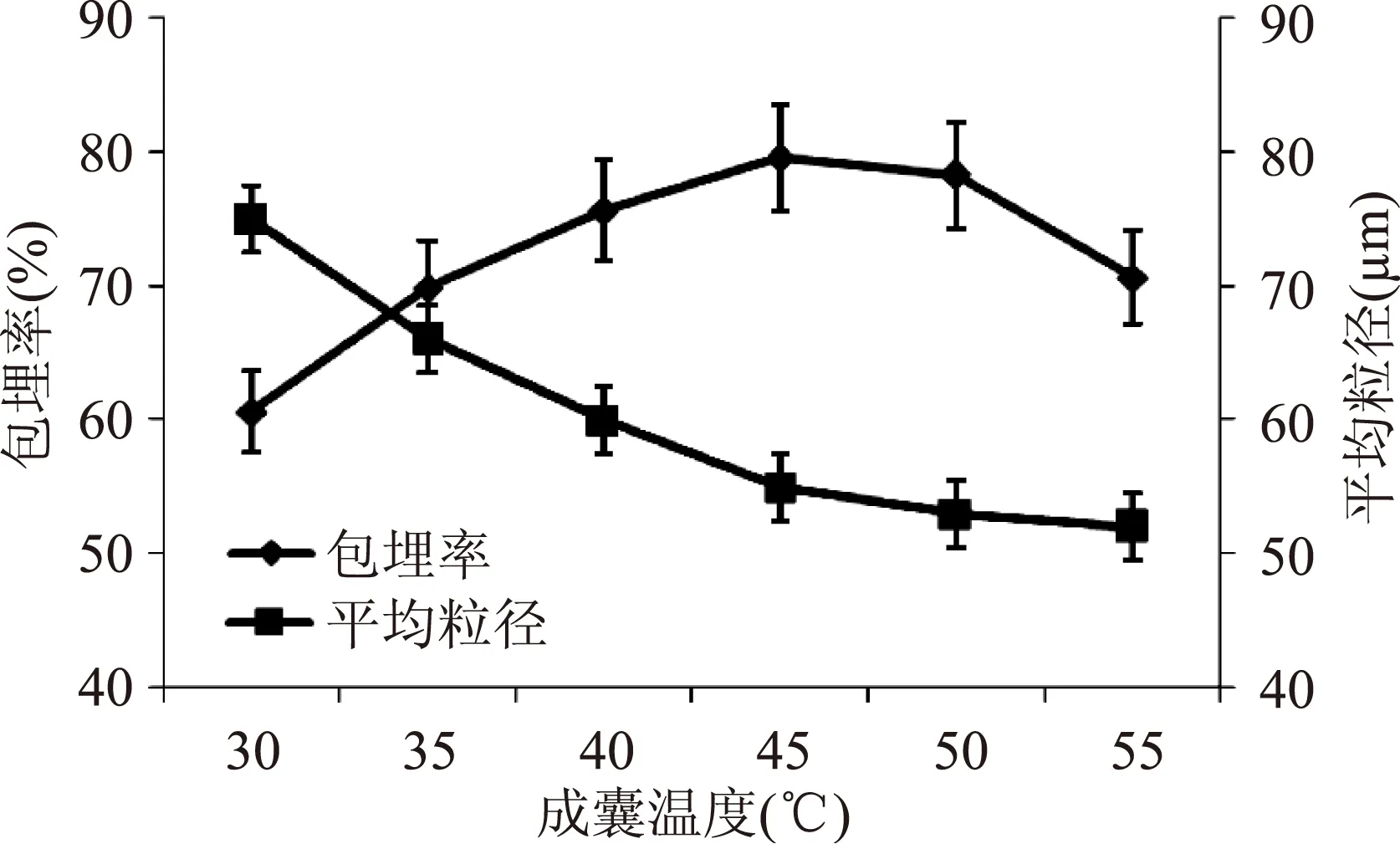
图4 成囊温度对微囊性能的影响Fig.4 The effect of microcapsules by temperature
2.5正交实验分析
通过表2的极差分析,影响鲎素肽微胶囊包埋率的四个因素顺序为:A(复合壁材浓度)>D(成囊pH)>B(壁材∶芯材)>C(成囊温度)。由表3方差分析表明,在α=0.05下方差分析得出4个因素对鲎素肽微囊包埋率均无显著性影响。正交实验设计得出的最佳制备工艺条件组合为:A2B2C2D2,即壳聚糖浓度1.5%,壁材与芯材的比为8.0∶1,成囊pH为5.0,成囊温度45 ℃。在该优化条件下平行实验3次,鲎素肽微胶囊平均包埋率为84.56%。

表2 正交实验设计与结果Table 2 The design and results of orthogonal experiment

表3 方差分析表Table 3 Analysis of variance for orthogonal experiment
2.6鲎素微胶囊形貌观察
通过扫描电镜对鲎素微囊进行表征,如图5所示,优化后制备的鲎素肽微胶囊,大多数微胶囊颗粒呈规则的圆球形,外观形态均匀,表面较光滑,没有空隙,也没有裂痕,颗粒分散均匀,有少量聚集现象,粒径的大小也比较均匀,形态完整、具有良好的球形度、个体间无聚集;少数微胶囊略有凹陷,表面出现褶皱,有裂纹,形状不规则,个别出现团聚粘连现象。可能的原因是复合凝聚法在制备过程中,操作时间长,沉降凝聚形成微胶囊,粘度低,容易成形且不易破坏其均质结构。

图5 最佳工艺制得鲎素肽微胶囊的SEM形貌图(1000倍)Fig.5 Scanning electron micrograph of tachyplesin microcapsules at optimization process(×1000)
2.7微胶囊颗粒粒径分布分析
采用最佳工艺制备的鲎素微胶囊,通过粒度分析仪测试其粒度的分布情况,结果从图6可以看出:微胶囊的粒度主要分布集中在3~10 μm和60~100 μm两个主要分布区域,其中颗粒粒径3~10 μm区域累积分布较少,40~100 μm区域是主要的微胶囊粒径分布区,累积分布度较高,鲎素肽胶囊的粒度呈正态分布,其粒径主要分布在70~80 μm左右,平均粒径大小为76.58 μm。这表明鲎素微囊粒径大小不均一,粒径分布范围较宽。
微胶囊微粒粒径大小分布和微胶囊的制备工艺条件密切相关,可以通过优化工艺条件,改善微囊粒径大小分布。成囊温度、成囊pH、壁材浓度、CaCl2浓度等因素都能影响成囊微粒的外貌特征和粒径大小[13]。微胶囊粒径的分布度是衡量粒度分布范围的重要参数,从粒度分布度可以看出微胶囊的粒径分布的集中程度。因此可以根据微胶囊的应用领域对微胶囊的大小进行改造,以适合鲎素微胶囊的生产应用。
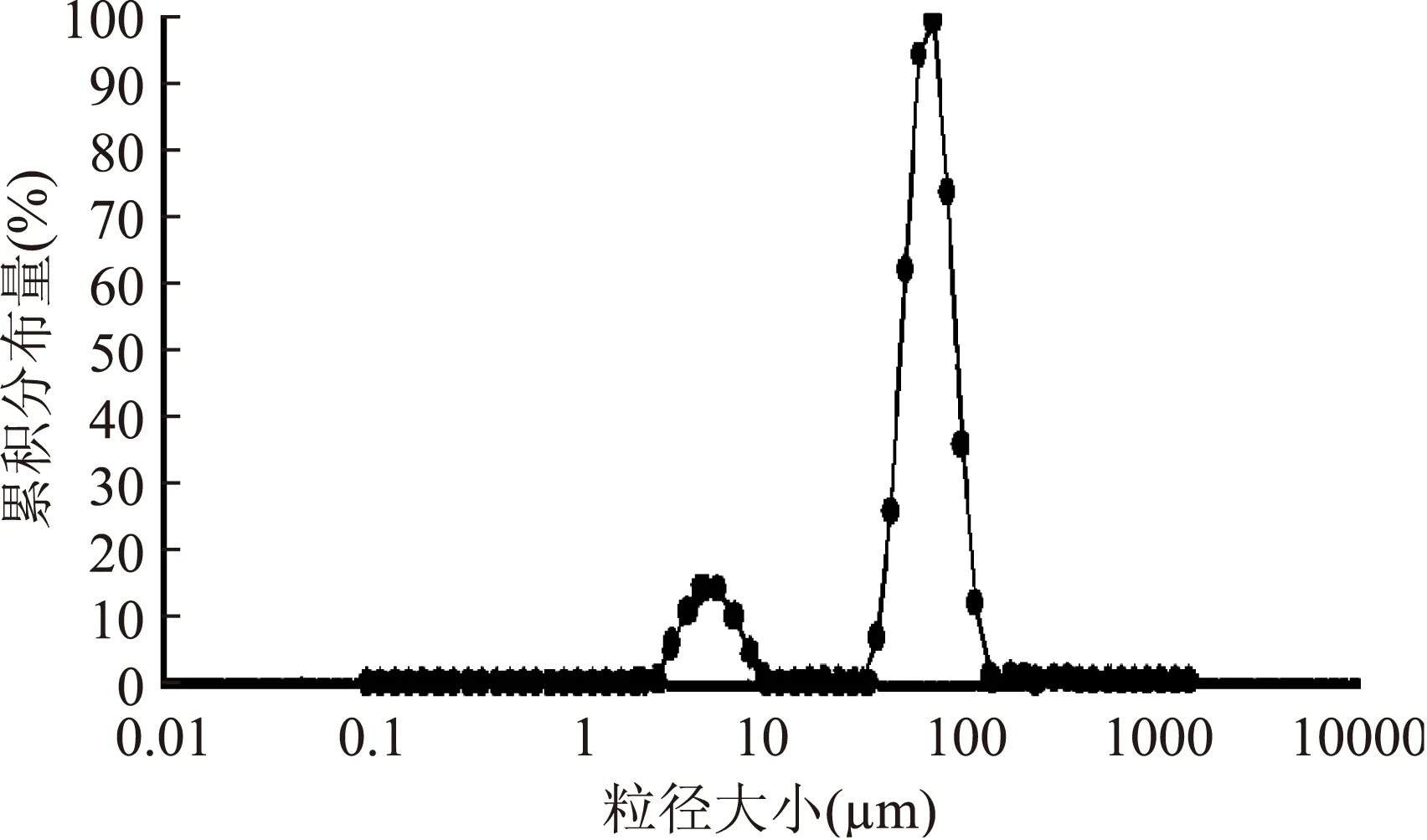
图6 正交实验所得微胶囊的粒径分布Fig.6 Particle diameter distributinon of tachyplesin microcapsules at optimization process
2.8鲎素微胶囊体外缓释和抗菌活性研究
2.8.1体外模拟消化环境的缓释实验鲎素肽微囊在模拟胃液、肠液中的体外释药实验结果见图7。复凝聚法制备的鲎素肽微囊,开始时有稍微的突释现象,随后的各时间段的释放量都较稳定。12 h内,在胃液中的释放率在25%~39%之间;在模拟肠液中的释放率在42%~81%之间。
鲎素微囊在模拟胃液和模拟肠液中的释放存在差异,在模拟胃液中的释放率比在模拟肠液中慢得多,这是由于溶液pH直接影响微囊溶胀的结果,微囊具有在低pH环境收缩、高pH溶胀的响应行为[14]。在酸性条件下,微胶囊的复合壁材遭到破坏,导致鲎素肽的释放,在酸性溶液中停留时间越长,微胶囊表面破坏越严重,对被包埋的扩散限制作用越差,进而导致微胶囊在模拟胃液中的控释能力降低,鲎素肽微胶囊在模拟胃液中释放率为38.54%,在模拟肠液中12 h后鲎素肽微胶囊释放率为80.68%,说明鲎素肽微胶囊在人工肠液中具有较好的缓释效果。
微胶囊的制备工艺、粒径大小、壁材的性质和壁材的厚度等因素都会影响鲎素微囊缓释性能。微囊从内到外依次为海藻酸钙胶核、海藻酸钠与壳聚糖复合层、壳聚糖沉淀层三层结构,在稀酸中,壳聚糖沉淀层可完全溶解,海藻酸钠与壳聚糖复合层可部分溶解[15]。由于微囊具有较大的表面积,鲎素肽以游离或者结合方式分布在海藻酸钠与壳聚糖复合层和壳聚糖沉淀层中,可以在短时间内迅速释放出来。但在酸性条件下,海藻酸钠不溶于酸,表现出收缩的性质,导致水分难以进入海藻酸钙胶核内部而停留在壳聚糖-海藻酸钠复合层,海藻酸钙胶核内部的鲎素肽难以被释放出来。通过复凝聚法制备的微囊可以使鲎素肽在模拟胃液中得到适当保护,在肠液中进行继续释放,避免了频繁给药的麻烦。

图7 鲎素微胶囊在体外模拟消化液释放曲线Fig.7 Release curve of tachyplesin microcapsules in different media
2.8.2鲎素肽微胶囊生物活性变化从图8可以看出,复凝聚法制备的微囊对鲎素肽活性具有较好的保护,微囊化的鲎素肽抑制大肠杆菌的抗菌能力比未包埋的鲎素肽抑制效果低,微囊化鲎素肽相对抗菌活力降低为80.6%,抗菌活性有一定损失,但不是很大。而未包埋鲎素肽与微胶囊鲎素肽对蛋白酶环境耐受性对照实验表明:未包埋鲎素肽经蛋白酶处理后抗菌活力大大降低至原来活性的38%,微囊化鲎素肽抗菌活力仍然达到原抗菌活力的75%,表明胶囊化鲎素肽在蛋白酶消化液环境中具有较好的稳定性。

图8 未包埋鲎素和微胶囊鲎素生物活性对照Fig.8 Bioactivity comparison of microcapsules or not
抗菌活性降低可以从以下几个原因进行解释:其一就是对包埋后的肽进行活性测定时,是按理论载药量溶解成和未包埋的肽同一浓度的待测液,而肽含量实际值可能比理论值稍低。另一方面可能是溶解液以及包埋材料会对其抗菌活性及稳定性产生略微的影响[16]。但总的看来,微胶囊化鲎素对其的抗菌活性起到了一定抑制作用,但影响较小,而对鲎素肽耐受蛋白酶降解起到保护的作用,增强了鲎素肽的操作条件稳定性。微囊化鲎素肽在模拟胃液和肠液中都有较好的缓释作用,有效的提高多肽类药物的生物活性及其利用率。
3 结论
本实验采用复凝聚法对小分子活性肽鲎素微胶囊的制备进行了研究。通过正交实验确定最优的工艺条件为复合壁材浓度为1.5%,壁材芯材比例为8∶1,成囊温度为45 ℃,成囊pH为5.0,在此条件下,鲎素肽微胶囊的平均包埋率可达84.56%。在最优工艺条件下所制得的微胶囊大多数呈规整球形,粒径大小合适。微胶囊的平均粒径76.58 μm,绝大部分的颗粒分布在40~100 μm之间区域。在模拟胃液中释放缓慢,而在模拟肠液中得以充分释放,鲎素肽微胶囊在模拟胃液中释放率为38.54%,在模拟肠液中的释放率为80.68%。微胶囊化对鲎素肽的抗菌活性起到了一定抑制作用,微囊化鲎素肽的抗菌活力是未包埋的80.6%,微囊化鲎素肽比未包埋鲎素肽具有强的蛋白酶耐受性,增强了鲎素肽的操作条件稳定性。
[1]Miyata T,Tokunaga F,Yoneya T,et al.Antimicrobial peptides,isolated from horseshoe crab hemocytes,tachyplesinII,and polyphemusins I and II. Chemical structures and biological activity[J]. J Biochem,1989,106(4):663-668.
[2]谢海伟,代建国,郭勇,等.鲎素抗菌肽的分子结构稳定性及生物活性[J]. 华南理工大学学报(自然科学版),2008,36(4):144-150.
[3]Lucinda-Silva R M,Salgado H R N.,Evangelista R C. Alginate-chitosan systems:invitrocontrolled release of triamcinolone andinvivogastrointestinal transit[J]. Carbohydrate
Polymers,2010,81(2):260-268.
[4]Li Z L,Chen P,Xu X Z,et al. Preparation of chitosan-sodium alginate microcapsules containing ZnS nanoparticles and its effect on the drug release[J]. Materials Science and Engineering C,2009,29(7):250-253.
[5]郑振荣,马晓光,张晓丹.海藻酸钠-壳聚糖相变储热微胶囊的制备[J].纺织学报,2014,35(2):18-22.
[6]谢良,许时婴,王璋.用扫描电镜(SEM)研究微胶囊化茴香油的超微结构[J].中国调味品,1999,250(12):11-14.
[7]赵萌,蔡沙,屈方宁,等.海藻酸钠-魔芋葡甘聚糖微胶囊对嗜酸乳杆菌CGMCC1.2686保护研究[J]. 现代食品科技,2015,31(2):70-75,105.
[8]杨芙莲,刘文彦.锐孔法制备黄酮类化合物微胶囊及其释放性的研究[J].现代食品科技,2013,29(2):297-300.
[9]Hultark D,Steiner H,Rasumson T,et al. Insect immunity purification and properties of the inducible bactericidal peptides from hemolymph of immunized pupae of hyalophora cecrpia[J]. Eur J Biochem,1980,106(1):7-16.
[10]谢海伟,王娣,杨贤松,等.合成抗菌肽TachyplesinⅠ的体外生物活性及其降解规律[J].中国生物制品学杂志,2011,24(3):270-275.
[11]王秀娟,张坤生,任云霞,等. 海藻酸钠凝胶特性的研究[J].食品工业科技,2008,29(2):259-263.
[12]于炜婷,刘袖洞,李晓霞,等. 壳聚糖溶液pH对载细胞海藻酸钠-壳聚糖微胶囊性能的影响[J].高等学校化学学报,2006,27(1):81-86.
[13]Baracat M M,Nakagawa A M,Casagrande R,et al. Preparation and characterization of microcapsules based on biodegradable polymers:pectin/casein complex for controlled drug release systems[J]. AAPS PharmSciTech,2012,13(2):364-372.
[14]Shu X Z,Zhu K J. The release behavior of brilliant blue from calcium-alginate gel beads coated by chitosan:the preparation method effect[J]. Eur J Pharm Biopharm,2002,53(2):193-201.
[15]Lee K W,Yoon J J,Lee J H,et al. Sustained release of vascular endothelial growth factor from calcium-induced alginate hydrogels reinforced by heparin and chitosan[J].Transplant Proc,2004,36(8):2464-2465.
[16]孙月梅. 大豆抗氧化肽酶法制备及其活性保护技术研究[D].哈尔滨:东北农业大学,2008.
Preparation and characterization of microencapsulation of tachyplesin
XIE Hai-wei,FANG Yuan-jian,WU Li-zhu,WANG Fen
(Department of Food and Bioengineering,Bengbu College,Bengbu 233030,China)
In this study,the synthetic tachyplesin peptides were used as core material.Microcapsules containing tachyplesin were prepared by a complex coacervation method with chitosan and sodium alginate as wall material. The wall material concentration,the ratio of wall to core material,the capsule temperature,pH and other factors were investigated to optimize the preparation process of tachyplesin microcapsules.Embedding ratio and particle size distribution were studied using single factor and orthogonal experiments to determine optimal conditions. Morphology and particle size distribution of microcapsules were studied in the optimization process.At the same time,the sustained release effect of tachyplesin microcapsules was studied in simulated gastric and simulated intestinal fluid,and the comparison of antimicrobial activity and stability of the microcapsules with the non encapsulated peptide were also studied in protease environment. The best technological conditions were chitosan and sodium alginate concentration of 1.5%,wall/core material ratio of 8∶1,the capsule temperature of 45 ℃ and the encysted pH of 5.0. Under these optimized conditions,encapsulation efficiency was 84.56%. Tachyplesin microcapsules were regularly spherical,and the particle size was mainly distributed in the 40~100 μm region,the average particle diameter was 76.58 μm. The release rate of tachyplesin peptide microcapsules reached 38.54% in simulated gastric fluid,and 80.68% in simulated intestinal fluid.The antimicrobial activity of the tachyplesin microcapsules was 80.6% of the non-embedded peptide.Microencapsulated tachyplesin with protease tolerance were more stable than non encapsulated tachyplesin.
tachyplesin peptide;microencapsulation;preparation process;sustained release performance
2015-12-18
谢海伟(1978-),男,博士,副教授,从事酶工程、活性多肽方面研究,E-mail:xiehaiwei324@163.com。
安徽省高等学校自然科学研究重点项目(KJ2015A154);安徽省大学生创新训练项目(AH201311305079);安徽省高校优秀青年人才支持计划重点项目(gxyqZD2016362);蚌埠学院学术技术带头人后备人选项目。
TS253.1
B
1002-0306(2016)09-0112-06
10.13386/j.issn1002-0306.2016.09.014

