响应面法优化甲烷氧化菌3011高产甲烷氧化菌素的研究
范洪臣,辛嘉英,,*,王 艳,夏春谷
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
响应面法优化甲烷氧化菌3011高产甲烷氧化菌素的研究
范洪臣1,辛嘉英1,2,*,王艳1,夏春谷2
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
利用响应面方法对甲烷氧化菌3011发酵产甲烷氧化菌素(Mb)条件进行了优化。以Mb产量为考察指标,利用Plackett-Burman设计对影响产量的7个因素进行评价,筛选出具有显著效应的3个因素,这三个因素分别为甲醇流加量、铜离子浓度和pH。利用Box-Behnken实验设计对显著因素进行优化,得到产Mb的最优发酵培养条件为甲醇流加量54.1 μmol/min,pH6.39,铜17.03 μmol/L,温度30 ℃,接种量5×106CFU/mL,通氧量30 L/h,搅拌转速400 r/min,此条件下Mb产量为3300.2 μg/mL。由此可得响应面优化得到的生产工艺是提高Mb产量的可行方法。
响应面法,甲烷氧化菌,甲烷氧化菌素,Plackett-Burman,Box-Behnken
甲烷氧化菌(Methanotrophicbacteria,methanotrophs),是能够以甲烷作为唯一碳源和能源进行同化和异化代谢的微生物,可以在氧气的作用下催化甲烷等低碳烷烃或烯烃羟基化或环氧化[1],其用甲烷生长的代谢途径如图1。甲烷氧化菌生长代谢过程中需要大量的铜,为了获得大量的铜,甲烷氧化菌分泌一种胞外的铜结合化合物称为甲烷氧化菌素(Mb)[2-3],甲烷氧化菌素不仅是颗粒性甲烷单加氧酶活性所必须,而且是甲烷代谢途径中不可或缺的一部分[4-5]。Mb结构如图2,结构中由类似氧唑环杂环、氨基酸、硫键组成,赋予了其特殊的性质,可广泛应用在抗菌、医疗和食品抗氧化上。根据Mb的还原性,近些年还发现Mb可以制备纳米金、银、钯、金钯合金等[6-8],为绿色制备纳米贵金属催化剂提供了良好的材料。

图1 甲烷氧化甲烷与甲醇、甲醛同化途径Fig.1 Pathways for the oxidation of methane and assimilation of for maldehyde注:CytC为细胞色素C,FADH甲醛脱氢酶,FDH甲酸脱氢酶。
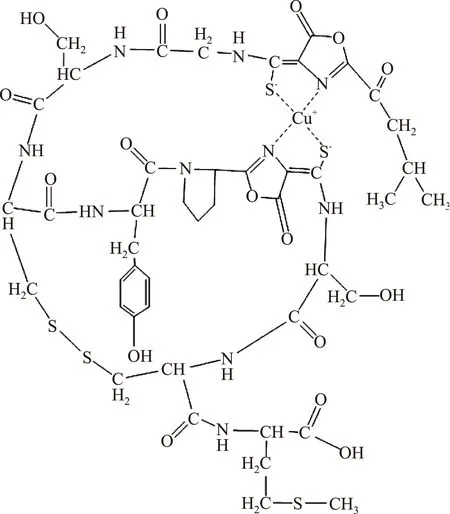
图2 甲烷氧化菌素结构图Fig.2 The structure of Mb
目前国内外的文献报导中主要集中在Mb相关合成基因[9-11]、结构[12]、性质[13]和应用上[6-8,13-17],单纯提高Mb产量的文章还没见报导,且大多数培养都以甲烷气体为碳源。在以甲烷为碳源的条件下,由于甲烷在水中溶解度差,菌体生长相对缓慢,生成的Mb产量很低,且培养过程中甲烷气体属于危险气体而不适合工业化生产,有些甲烷氧化菌也能够以甲醇、甲基胺,甲基化含硫化合物和卤代甲烷等一碳化合物作为碳源生长[18],因此寻找合适的一碳营养物质是提高Mb产量可行的方法。本研究利用甲醇替代甲烷为碳源用于甲烷氧化菌3011发酵生产Mb,并利用响应面法对提高Mb产量进行了探讨,克服了甲烷生产Mb的弊端,为发酵提高Mb产量和实现工业化生产提供了借鉴。
1 材料与方法
1.1材料与仪器
甲烷氧化菌MethylosinustrichosporiumIMV3011由俄罗斯科学院催化研究所提供;NMS培养基按文献配制[8];实验室所有试剂均为分析纯。
UV-2550紫外-可见分光光度计日本岛津公司;2-16K高速冷冻离心机美国Sigma公司;RV8V旋转蒸发仪德国IKA公司;5BG-生化发酵罐上海保兴生物设备工程公司。
1.2实验方法
1.2.1发酵方法将MethylosinustrichosporiumIMV3011按3×106CFU/mL接入到NMS培养基中,甲醇流加量42 μmol/min,培养温度30 ℃,pH6.6,通氧量40 L/h,搅拌速度300 r/min,铜离子浓度12 μmol/L,培养时间96 h。
1.2.2Mb制备方法Mb分离纯化采用将菌体离心,发酵液用大孔树脂HP-20吸附,70%乙醇洗脱,洗脱液旋转蒸发后冷冻干燥,其实验操作见文献[5]。
1.2.3Mb测定方法在25 mL容量瓶中加入2 mL浓度为0.02 mmol/L的铬天青(CAS)溶液,1 mL浓度为0.02 mmol/L的CuSO4溶液,4 mL浓度为0.02 mmol/L的HTDMA溶液,3 mL的Mb溶液,15 min后比色,测定605 nm波长处的吸光值(As),以同样方法测定未加Mb溶液的吸光值(Ar)作为参比值。按Ar-As值表示Mb含量。
1.3数据统计分析
1.3.1Plackett-Burman设计根据培养条件中对响应值的影响因素,选取甲醇流加量、通氧量、铜含量、pH、温度、接种量、搅拌转速7个因素另添加4个虚拟因素,每个因素取高(+1)低(-1)2个水平,选用N=11的Plackett-Burman设计各因素,因素水平及编码见表1。
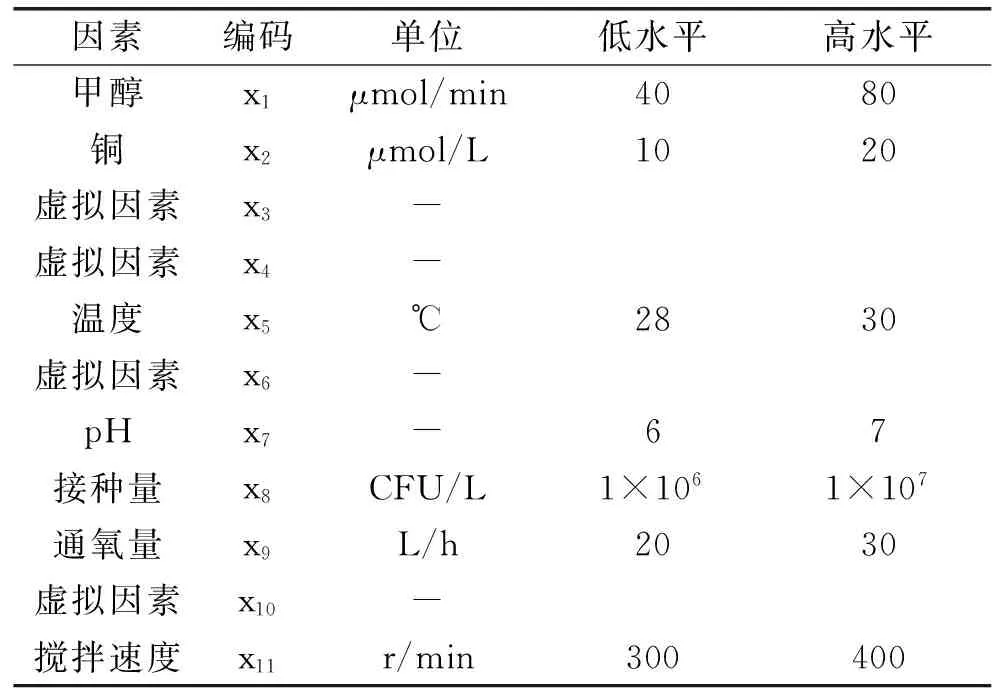
表1 Plackett-Burman实验设计因素水平及编码Table 1 Plackett-Burman test design factors and encoding
1.3.2Box-Behnken实验设计在Plackett-Burman设计研究基础上,采用Box-Behnken设计法,对Mb影响的关键因素作进一步研究和探讨,以获得其最佳发酵水平。将Plackett-Burman设计确定的3个重要因素甲醇、铜离子含量和pH,分别记为A、B、C,以Mb产量作为响应值,记为变量Y,进行因素、水平编码,其具体数据见表2。
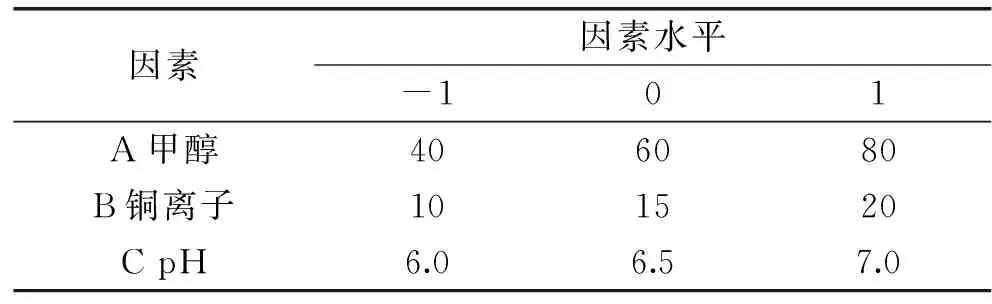
表2 Box-Behnken响应面设计实验因素水平和编码Table 2 Response surface design test factor level and encoding in the design of Box-Behnken
2 结果与分析
2.1发酵因素对Mb产量的影响
甲烷氧化菌3011产Mb受甲醇流加量、温度、pH、通氧量、搅拌速率、接种量、铜离子密度的影响,其影响情况如下。
2.1.1甲醇浓度对菌体密度及甲醇流加量对Mb产量的影响从图3可以看出,菌体密度随着甲醇浓度的升高呈先升高后降低的趋势,当发酵液中甲醇浓度达到9 mmol/L时菌体密度达到最大,再增大甲醇浓度菌体密度下降。从甲醇浓度对菌体密度影响看,发酵液中甲醇浓度超过9 mmol/L时,甲醇浓度对细胞产生了毒性,菌体生长受到抑制从而降低了Mb产量,因此考虑流加甲醇的方式。从图4可以看出,随着甲醇流加量的增大,Mb产量呈现上升趋势,当甲醇流加量达到120 μmol/min时Mb产量最大,甲醇流加量再增大时Mb产量下降。从甲醇流加量对Mb影响看,在合适的甲醇流加量范围内,增大甲醇流加量,Mb产量是增大的,但流加量超过120 μmol/min时Mb产量降低,有可能流加量过大造成甲醇浓度过高对菌体细胞产生了毒性从而对Mb产量有了较大影响。
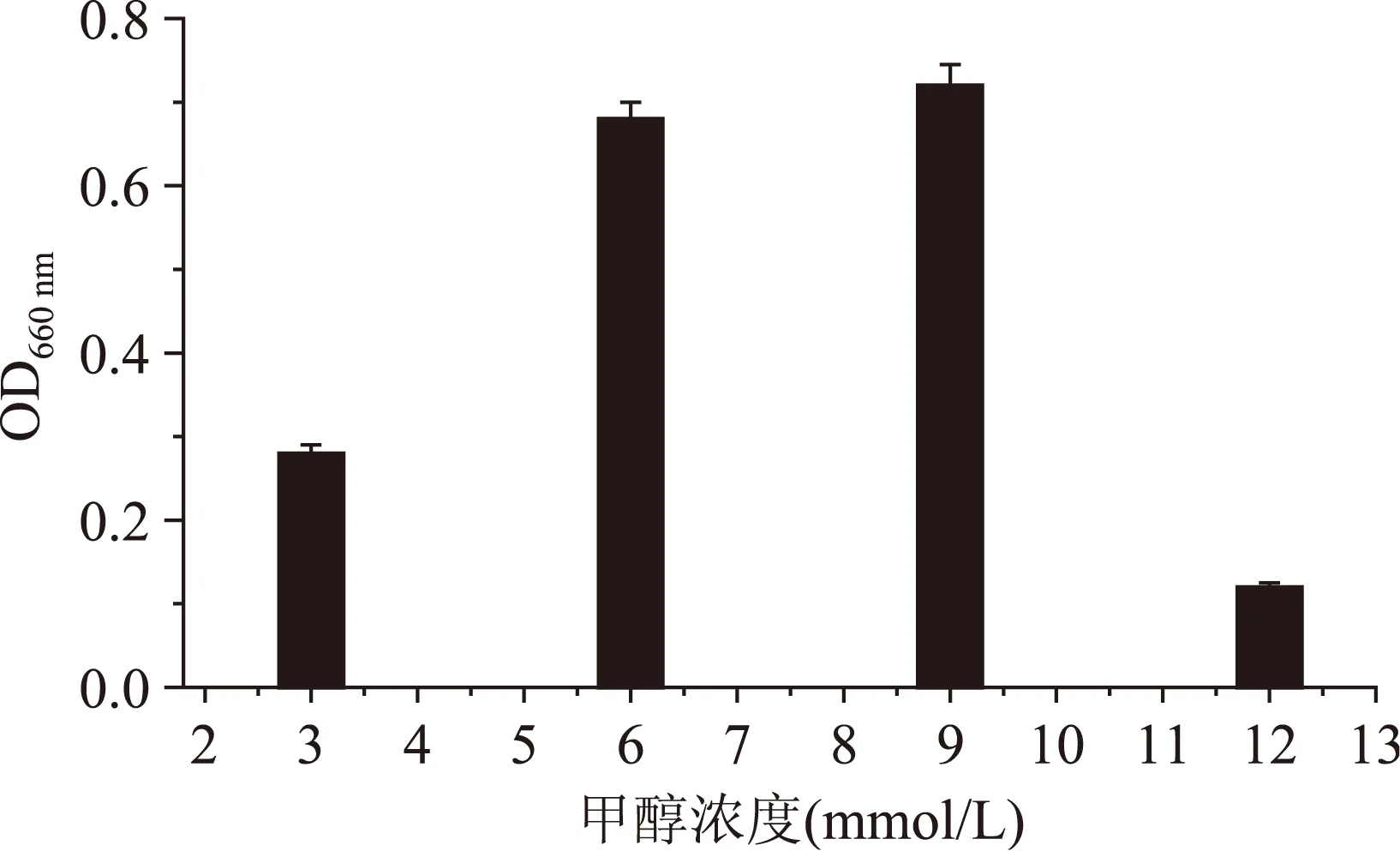
图3 甲醇浓度对菌体密度的影响Fig.3 Effect of methanol on cell density
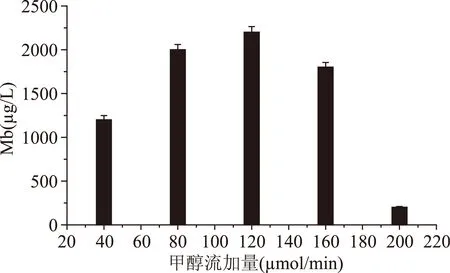
图4 甲醇流加量对Mb产量的影响Fig.4 Effect of methanol flow on the yield of Mb
2.1.2温度对Mb产量的影响由图5可以看出,Mb产量随着温度升高而升高,当温度达到32 ℃时,Mb产量达到最高,温度再升高时,产量基本恒定。从温度对Mb产量影响看,温度可能影响了合成Mb相关酶的活性及合成这些酶相关基因的开启[18]。
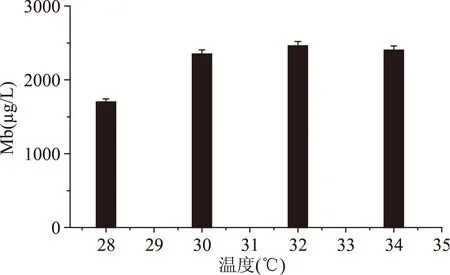
图5 温度对Mb产量影响Fig.5 Effect of temperature on the yield of Mb
2.1.3pH对Mb产量的影响从图6可以看出pH6~7范围内,Mb产量随着pH的升高先升高后降低,pH6.5时Mb产量最大。从pH对Mb产量影响看,pH可能影响了合成Mb相关酶的活性[18],在低于和高于pH6.5条件下都不利于酶合成Mb。

图6 pH对Mb产量的影响Fig.6 Effect of pH on the yield of Mb
2.1.4通氧量对Mb产量的影响甲烷氧化菌3011在以甲烷为碳源的代谢途径中氧气是必不可少的[18],从图1代谢途径中可以看出,甲烷和氧气在菌体相关酶的作用下合成甲醇,从而为菌体提供了更易于生长代谢的碳源。甲烷氧化菌3011直接添加甲醇生产Mb时氧气对产Mb影响也是比较大的,从图7可以看出,Mb产量随着通氧量增大而升高,通氧量达到30 L/h时Mb达到最大,再增大通氧量Mb产量变化并不大,有可能在30 L/h供氧量的条件下培养基中溶解的氧满足了菌体代谢需要。
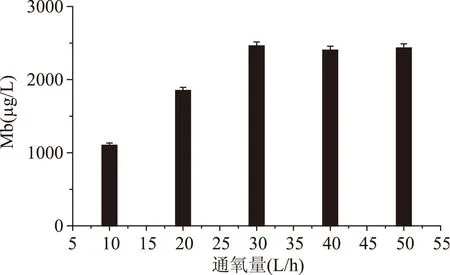
图7 通氧量对Mb产量的影响Fig.7 Effect of Oxygen content on the yield of Mb
2.1.5搅拌速率对Mb产量的影响从前面所得结果看甲烷氧化菌3011以甲醇为碳源产Mb,氧气的供给是必不可少的,发酵罐的搅拌速度能促进气液间传质,提高溶氧浓度有利于发酵[19],提高Mb产量。从图8可以看出,Mb产量随着搅拌速度的增加而升高,搅拌速度达到400 r/min时,Mb产量达到最大,再增加搅拌速度,Mb产量保持恒定。从搅拌速度对Mb产量的影响看,在一定的通氧量下,增加搅拌转速提高了发酵液中溶解氧含量,并且使流加的甲醇快速分散到整个发酵液中,从而有利于菌体产Mb。

图8 搅拌速度对Mb产量的影响Fig.8 Effect of Stirring speed on the yield of Mb
2.1.6接种密度对Mb产量的影响从图9可以看出,随着接种量的增大,Mb产量也在增大,接种量达到5×106CFU/mL时Mb产量达到最大,再增加接种量对Mb产量无较大影响。从接种量对Mb产量的影响看,在甲醇流加量恒定条件下,当接种量少时,由于菌体开始阶段数量较少所以消耗甲醇也少,随着时间的增加,甲醇的累积量过早的达到了菌体耐受甲醇的范围,对菌体产生了毒性,从而影响了Mb产量。

表3 Plackett-Burman设计因素编码水平实验安排表及响应值Table 3 Design factors level test schedule and response values of Plackett-Burman
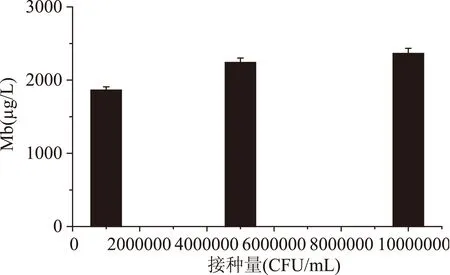
图9 接种量对Mb产量的影响Fig.9 Effect of inoculum density on the yield of Mb
2.1.7铜离子浓度对Mb产量的影响由图10可以看出,随着铜离子含量增加,Mb产量先升高后降低,在铜含量30 μmol/L时Mb产量达到最大。从铜含量对Mb产量的影响看,铜离子的加入在低浓度范围内起调控作用,尤其是在亚适量铜存在下可以诱导Mb的产生[20],随着铜离子浓度加大,过多的铜离子对细胞产生一定毒性,Mb产量有所降低。
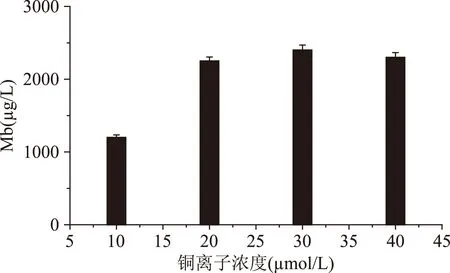
图10 铜含量对Mb产量的影响Fig.10 Effect of Cu2+ content on the yield of Mb
2.2Plackett-Burman设计筛选影响液体发酵的显著因素
2.2.1Plackett-Burman分析根据Plackett-Burman设计进行实验所得响应值见表3。
由实验数据拟合通过Design-Expert得到线性回归方程:
R1=2664.58-28.25X1+32.75X2+6.42X3-8.92X4+0.75X5-13.92X6+24.75X7+16.92X8+10.25X9-13.92X10+10.75X11
其显著性分析见表4。由表4看出,实验因素甲醇、铜离子含量和pH对响应值Y有显著影响。因此,选取这三个显著影响Mb的关键因素,并进一步作响应面分析,以确定它们所对应的最优水平。
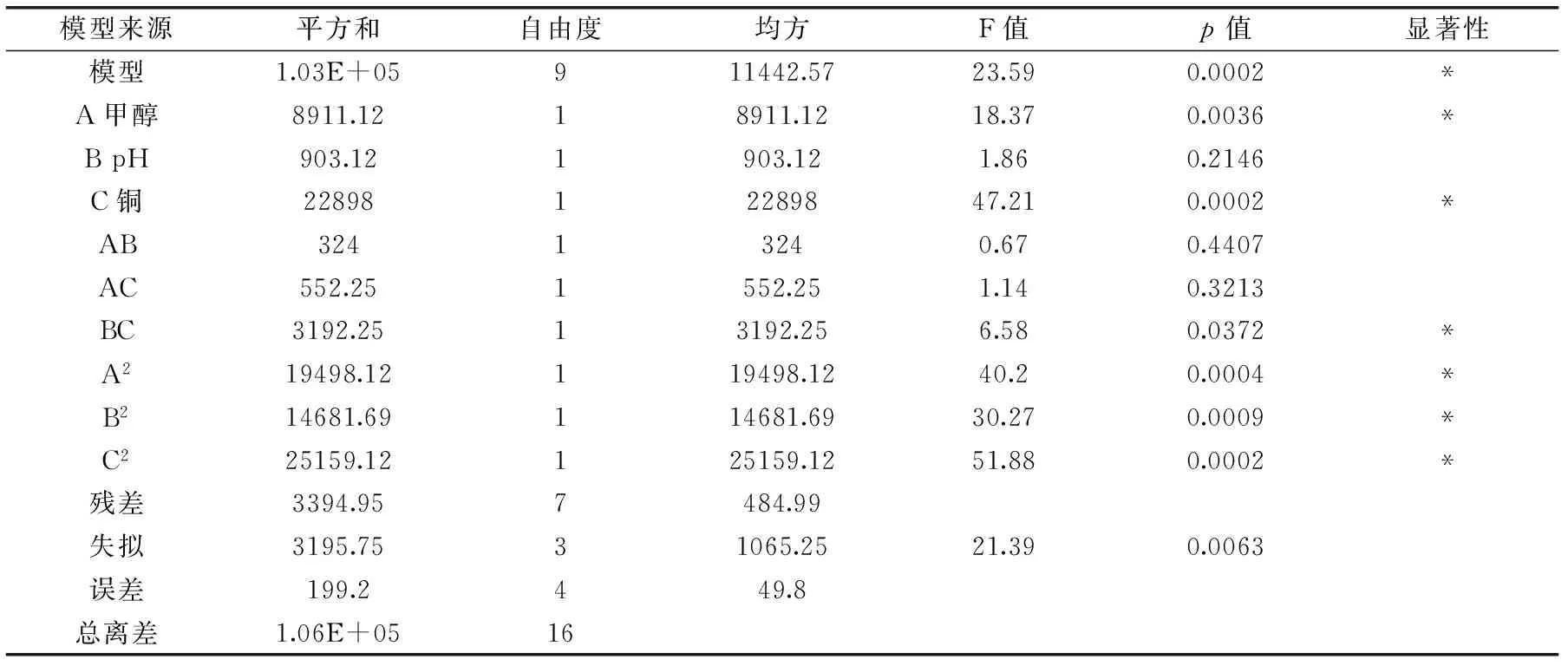
表6 回归模型1的方差分析Table 6 Variance analysis of regression model 1
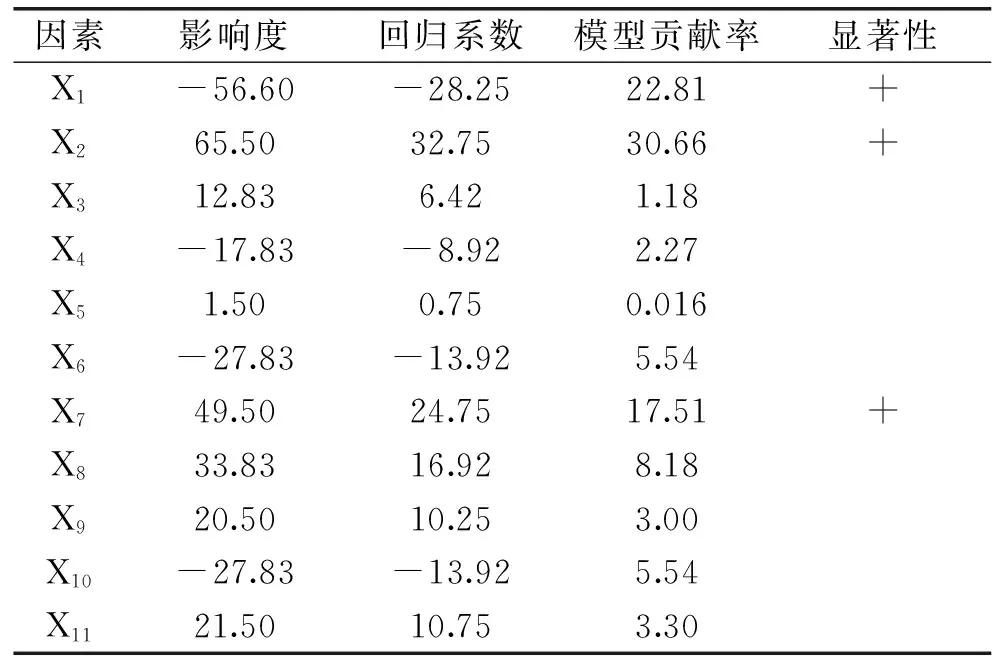
表4 Plackett-Burman设计中各因素的显著性分析Table 4 The significance of each factor in the design of Plackett-Burman
注:“+”表示显著性,p<0.05。
2.2.2Box-Behnken响应面分析利用Box-Behnken实验设计,设计3因素3水平共17个实验点的实验方案,其结果见表5。

表5 Box-Behnken设计实验方案及响应值Table 5 Design test and response value in the design of Box-Behnken
运用Design-Expert软件,按表5中的实验数据拟合得到多元二次回归方程如下:R1=3273.60-33.37A-10.62B+53.50C+9.00AB-11.75AC-28.25BC-68.05A2-59.05B2-77.30C2,对模型进行方差分析,分析结果见表6及表7。
由表6可看出,本实验所选用模型具有高度的显著性(p=0.0002);模型中,单个因素中A、C对响应值的影响显著,交互项B与C的影响较显著,二次项A2、B2及C2的影响也都非常显著。模型的失拟概率仅为0.0063,说明拟合的回归方程符合实际情况,可用此模型对发酵水平进行分析和预测。
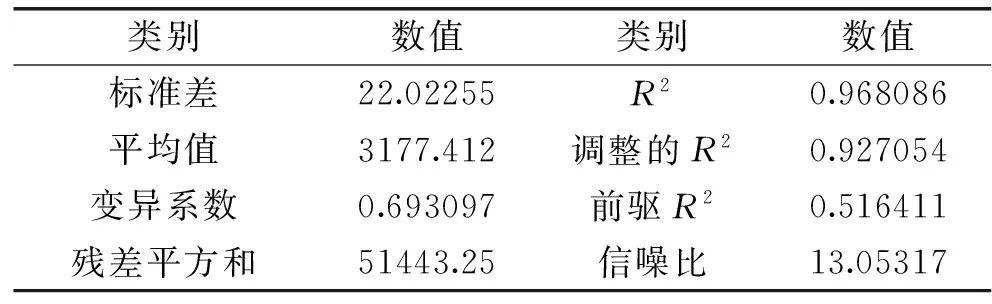
表7 回归模型2的方差分析Table 7 Variance analysis of regression model 2
由表7看出,相关系数R2=0.9681,校正系数R2=0.9270,即只有7.3%的降解率总变异不能由此模型进行解释,表明模型与实际情况拟和较好。变异系数Cv=0.69%,说明模型能很好地反映真实的实验值,即实验的可靠性较高。
2.2.3优化为了进一步研究相关变量之间的交互作用和确定最优点,通过Design-Expert软件做了三个关键影响因素对发酵水平交互影响的曲面图(图11~图13),从图可以直观地反映出两变量交互作用的显著程度,结果表明B和C两因素交互作用显著。
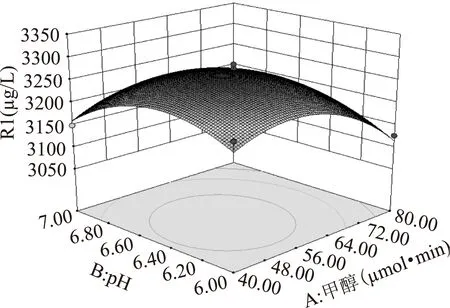
图11 因素A和B交互作用的响应面Fig.11 The interaction of response surface on the factors of A and B

图12 因素A和C交互作用的等高线和响应面Fig.12 The interaction of response surface on the factors of A and C
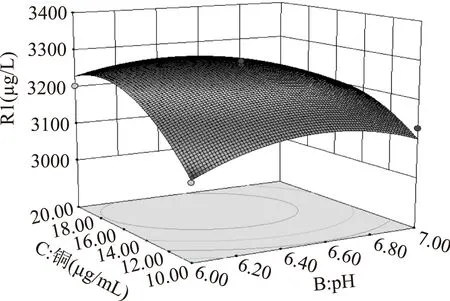
图13 因素B和C交互作用的等高线和响应面Fig.13 The interaction of response surface on the factors of B and C
由图11~图13中的响应面立体图可以看出,响应值Y存在最大值。对应于响应值Y越大说明Mb发酵水平越高,其优化要求取最大值,因而在优化标准上可以对Y项选取最大值,由Design-Expert软件得到优化结果,其结果见表8。
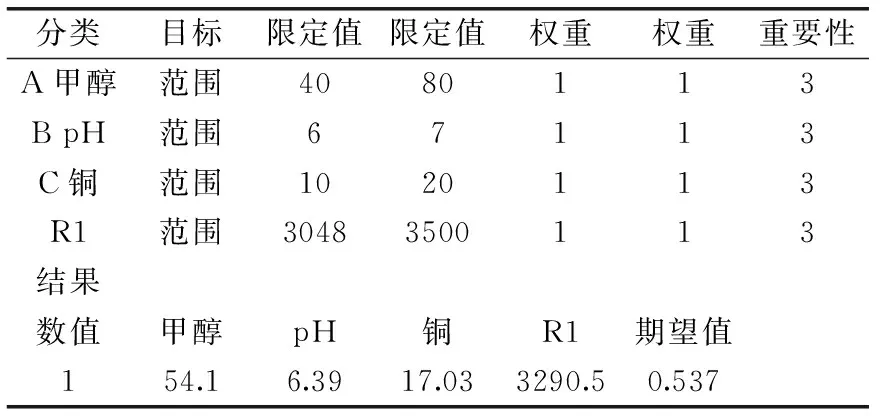
表8 响应面法优化结果Table 8 Optimization results of response surface method
根据计算,可得A、B、C对应实验值A=54.1 μmol/min,B=6.39,C=17.03 μmol/L此时响应值Y取最大值,Ymax=3290.5 μg/L。由回归方程根据效应的正负,其他因素可以取值为:温度30 ℃,接种量5×106CFU/mL,通氧量30 L/h,搅拌转速400 r/min。为验证模型预测的准确性和可靠性,按照优化后的条件,并考虑到实际情况,按照甲醇流加量54.1 μmol/min,pH6.39,铜17.03 μmol/L,温度30 ℃,接种量5×106CFU/mL发酵液,通氧量30 L/h,搅拌转速400 r/min进行验证实验,所得结果为3300.2 μg/L,实验值与模型预测值3290.5 μg/L非常接近(与模型计算值相差0.3%),表明该模型能很好地预测实际表达情况。
3 结论
将响应面分析法用于甲烷氧化菌3011提高Mb产量工艺参数的优化,确定的最佳工艺为甲醇流加量54.1 μmol/min,pH6.39,铜17.03 μmol/L,温度30 ℃,接种量5×106CFU/mL,通氧量30 L/h,搅拌转速400 r/min,进行验证实验,所得结果为3300.2 μg/L,实验值与模型预测值3290.5 μg/L非常接近。优化得到的最佳发酵工艺是甲烷氧化菌3011利用甲醇提高Mb产量的有效途径,为进一步工业化生产提供了可靠依据。
[1]VH David,VW Inka,H Sven,et al. Selection of associated heterotrophs by methane-oxidizing bacteria at different copper concentrations[J]. Antonie van Leeuwenhoek,2013,103(3):527-537.
[2]JA Zahn,AA DiSpirito. Membrane-associated methane monooxygenase from Methylococcus capsulatus(Bath)[J]. J Bacteriol,1996,178(4):1018-1029.
[3]HJ Kim,DW Graham,AA Dispirito,et al. Methanobactin,a copper-acquisition compound from methaneoxidizing bacteria[J]. Science,2004,305:1612-1615.
[4]DW Choi,RC Kunz,ES Boyd,et al. The membrane-associated methane monooxygenase(pMMO)and pMMO NADH:quinone oxidoreductase complex from Methylococcus capsulatus Bath[J]. J Bacteriol,2003,185(19):5755-5764.
[5]D W Choi,W E Antholine,Y S Do,et al. Effect of methanobactin on the activity and electron paramagnetic resonance spectra of the membrane-associated methane monooxygenase in methylococcus capsulatus bath[J]. Microbiology,2005,151:3417-3426.
[6]J Y Xin,LX Zhang,D D Chen,et al. Colorimetric detection of melamine based on methanobactin-mediated synthesis of gold nanoparticles[J]. Food Chemistry,2015,174:473-479.
[7]J Y Xin,D D Cheng,L X Zhang,et al. Methanobactin-Mediated One-Step Synthesis of Gold Nanoparticles[J]. Int J Mol Sci,2013,14:21676-21688.
[8]J Y Xin,K Lin,Y Wang,et al. Methanobactin-Mediated Synthesis of Gold Nanoparticles Supported over Al2O3toward an Efficient Catalyst for Glucose Oxidation[J]. Int J Mol Sci,2014,15:21603-21620.
[9]V N Khmelenina,O N Rozova,S Yu,et al. Biosynthesis of Secondary Metabolites in Methanotrophs:Biochemical and Genetic Aspects(Review)[J]. Applied Biochemistry and Microbiology,2015,51(2):150-158.
[10]W Gu,U Farhan,M Haque,et al. A TonB-Dependent Transporter is Responsible for Methanobactin Uptake by Methylosinus trichosporium OB3b[J]. Appl Environ Microbiol,2016,82(6):1917-1923.
[11]U M Farhan,B Kalidass,A Vorobev,et al. Methanobactin
from Methylocystis sp. strain SB2affects gene expression and methane monooxygenase activity in Methylosinus trichosporium OB3b[J]. Appl Environ Microbiol,2015,81(7):2466-2473.
[12]A A DiSpirito,J D Semrau,J C Murrell,et al. Methanobactin and the Link between Copper and Bacterial Methane Oxidation[J]. Microbiol Mol Biol Rev,2016,80(2):387-409.
[13]R Sesham,D Choi,A Balaji,et al. The pH dependent Cu(II)and Zn(II)binding behavior of an analog methanobactin peptide[J]. Eur J Mass Spectrom,2013,19(6):463-473.
[14]B S Baral,N L Bandow,A Vorobev,et al. Mercury binding by methanobactin from Methylocystis strain SB2[J]. J Inorg Biochem,2014,141:161-169.
[15]A Vorobev,S Jagadevan,B S Baral,et al. Detoxification of mercury by methanobactin from Methylosinus trichosporium OB3b[J]. Appl Environ Microbiol,2013,79(19):5918-5926.
[16]张铁男,辛嘉英,张秀凤.甲烷氧化菌素催化纳米金合成[J]. 分子催化,2013,27(2):192-196
[17]辛嘉英,姜加良,张帅.甲烷氧化菌素-铜配合物催化过氧化氢氧化对苯二酚[J].高等学校化学学报,2013,34(5):1233-1239
[18]S H Richard,E H. Thomas. Methanotrophic Bacteria[J]. Microbiological Reviews,1996,60(2):439-471.
[19]温拥军,游玟娟,郭浪.芽孢杆菌配伍发酵菜籽粕产中性蛋白酶条件研究[J].食品工业科技,2015,36(1):166-170.
[20]辛嘉英,董静,闫超泽.甲烷氧化菌素的产生和铜捕获作用[J].中国生物工程杂,2011,31(8):40-46.
Application of response surface methodology on high yield methanobactin byMethylosinustrichosporiumIMV3011
FAN Hong-chen1,XIN Jia-ying1,2,*,WANG Yan1,XIA Chun-gu2
(1.Key Laboratory for Food Science & Engineering,Harbin University of Commerce,Harbin 150076,China;2.State Key Laboratory for Oxo Synthesis & Selective Oxidation,Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences,Lanzhou 730000,China)
To optimize Methanobactin(Mb)fermentation conditions forMethylosinustrichosporium3011,Response Surface Methodology(RSM)were applied. The methanol flow,copper ion content and pH of seven factors were determined by Plackett-Burman design. The optimum condition was as follows:the methanol flow rate of 54.1 μmol/min,the pH of 6.39,the copper content of 17.03 μmol/L,the incubation temperature of 30 ℃,the inoculation amount of 5×106CFU/mL,the dissolved oxygen of 30 L/h,the stirring speed of 400 r/min. The optimum Mb production was 3300.2 μg/L. The RSM was feasible for high Mb production and this would improve the Mb production.
Response Surface Methodology;Methanobactin;methanotrophs;Plackett-Burman;Box-Behnken
2016-02-02
范洪臣(1978-),男,博士,研究方向:食品科学,E-mail:fanhongchen1@sina.com。
辛嘉英(1966-),男,博士,研究方向:生物催化,E-mail:xinjiayingvip@163.com。
国家自然科学基金项目(21073050,21573055)。
TS201.3
B
1002-0306(2016)15-0187-07
10.13386/j.issn1002-0306.2016.15.028

