野生酵母和商品酵母发酵葡萄酒中挥发性成分差异研究
刘峻溪,姜凯凯,韩爱芹,李蕊蕊,赵新节,孙玉霞,王世平
(1.齐鲁工业大学山东省微生物工程重点实验室,山东济南 250353;2.山东省农业科学院农产品研究所,山东省农产品精深加工技术重点实验室,山东济南 250100)
野生酵母和商品酵母发酵葡萄酒中挥发性成分差异研究
刘峻溪1,2,姜凯凯1,2,韩爱芹1,李蕊蕊1,2,赵新节1,孙玉霞2,*,王世平2
(1.齐鲁工业大学山东省微生物工程重点实验室,山东济南 250353;2.山东省农业科学院农产品研究所,山东省农产品精深加工技术重点实验室,山东济南 250100)
采用顶空固相微萃取(HS-SPME)和气相色谱-质谱联用(GC-MS)技术对5株商品酿酒酵母和7株野生酿酒酵母所酿葡萄酒中的挥发性物质进行分析。结果表明,各葡萄酒中挥发性物质的组成成分相差不大,但在含量上存在差异,野生酿酒酵母所酿造的葡萄酒中主要挥发性物质的总含量要高于商品酿酒酵母。对于葡萄酒中主要由酵母代谢产生的3类挥发性物质—酯类、醇类和酸类,其含量最高的均为用野生酿酒酵母酿造的葡萄酒,其中以W2和W7最为突出。感官分析结果表明,C1、C2和W2的果香、花香较为突出,C4和W2具有明显的草本味,C2和W1的胡椒味较强。
酿酒酵母,葡萄酒,挥发性物质,HS-SPME,GC-MS
Agro-Products Processing Technology of Shandong,Ji’nan 250100,China)
葡萄酒中的挥发性物质是葡萄酒独特风味的形成基础,主要包括醇类、酯类、酸类和挥发性酚类物质等。这些物质的形成与许多因素有关,包括葡萄品种、酿造工艺、酵母和陈酿等[1]。在这些因素中,酵母的作用最为关键,酵母在将糖转化为酒精的同时,生成的代谢产物可以直接或者间接地参与到挥发性物质的合成中[2]。与酒精发酵有关的酵母种属很多,其中最主要也最重要的是酿酒酵母。酿酒酵母参与了发酵的整个过程,直到发酵结束,而非酿酒酵母只在发酵的前两天存在活力[3]。因此,酿酒酵母影响着葡萄酒的风味,决定着葡萄酒的品质[4]。
目前,我国葡萄酒面临的一个重大问题就是同质化严重,其原因之一是由于过多的依赖进口商品活性干酵母,导致各产区产地所酿葡萄酒缺乏地域特色。因此,选择适合本土葡萄的野生酿酒酵母成为近几年研究的热点,许多学者针对我国各主要产区进行了相应的野生酿酒酵母筛选研究[5-7]。但这些研究都主要侧重于野生酵母的耐受性,而对于野生酿酒酵母的酿酒特性和对葡萄酒香气影响的研究很少。山东烟台产区受海洋气候的影响,有着优越的地理环境和气候条件,是我国葡萄酒酿造历史最为悠久的区域。本研究以烟台赤霞珠葡萄为原料,分别接种商品活性干酵母和野生酿酒酵母酿造红葡萄酒,对各菌株的耐受性以及各葡萄酒的挥发性物质进行分析比较,以期获得合适的野生酿酒酵母,并为野生酿酒酵母的实际应用提供理论依据。
1 材料与方法
1.1材料与仪器
野生酵母本实验室从成熟赤霞珠葡萄表面分离纯化的7株野生酿酒酵母,编号为W1~W7;商品酵母购于上海杰兔工贸有限公司的5株商品活性干酵母BDX、BM4×4、D254、L2323和RC212,编号为C1~C5;葡萄山东烟台莱山成熟赤霞珠葡萄,2014年10月采收,总糖含量:239.39 g/L,可滴定酸含量:4.10 g/L;YPD培养基1%酵母浸粉,2%葡萄糖,2%蛋白胨,115 ℃灭菌30 min;乙酸乙酯、己酸乙酯、辛酸乙酯、乙酸-2-苯乙酯、癸酸乙酯、月桂酸乙酯、异丁醇、异戊醇、己醇、2-苯乙醇、2,3-丁二醇、乙酸、3-甲基丁酸、己酸、辛酸美国Sigma公司;4-甲基-2-戊醇色谱纯(98%),美国Aldrich公司。
SW-CJ-1FD型超净工作台苏州安泰空气技术有限公司;LDZM-80KCS型立式压力蒸汽灭菌器上海申安医疗器械厂;SPL-250型生化培养箱天津莱玻特瑞仪器设备有限公司;ZHWY-200H型恒温振荡培养箱上海智城分析仪器制造有限公司;C-MAG HS7 digital型恒温加热磁力搅拌器德国IKA公司;SPME手动进样手柄、DVB/CAR/PDMS萃取头(50/30 μm)美国Supelco公司;GC-7890B/MS-5977A气相色谱-质谱联用仪、VF-WAXms(30 m×0.32 mm×0.25 μm)色谱柱美国Agilent公司。
1.2实验方法
1.2.1酵母发酵力实验将YPD培养基和杜氏发酵管放于试管中,灭菌后接入各酵母,28 ℃条件下静止培养,观察杜氏发酵管中气泡的形成情况,记录气泡开始形成和充满整个杜氏发酵管所用的时间。各酵母菌株均进行三次平行实验。
1.2.2酵母酒精耐受性实验将YPD培养基和杜氏发酵管放于试管中,灭菌后添加无水乙醇,使其含量达到12%。接入各酵母,28 ℃下静止培养1周,观察杜氏发酵管中气泡的形成情况。将能够产生气泡的酵母菌株再依次接入乙醇含量为14%、16%、18%和20%的YPD培养基中,观察杜氏发酵管中气泡的形成情况。各酵母菌株均进行三次平行实验。
1.2.3酵母SO2耐受性实验将YPD培养基和杜氏发酵管放于试管中,灭菌后添加亚硫酸,使其总SO2的含量为400 mg/L,接入各酵母,28 ℃下静止培养1周,观察杜氏发酵管中气泡的形成情况。将能够产生气泡的酵母菌株再依次接入总SO2含量为500、600、700 mg/L的YPD培养基中,观察杜氏发酵管中气泡的形成情况。各酵母菌株均进行三次平行实验。
1.2.4红葡萄酒酿造实验将7株野生酵母和5株商品酵母分别接种于盛有50 mL YPD培养基的三角瓶中,于25 ℃,150 r/min条件下培养12 h。培养结束后,各取1 mL分别转接到盛有50 mL澄清葡萄汁(已灭菌)的250 mL三角瓶中,25 ℃,150 r/min条件下培养12 h。
赤霞珠葡萄除梗后果粒混合均匀,分别称取4.5 kg置于12个5 L的广口瓶中,手工破碎。添加SO2至浓度为60 mg/L,浸渍12 h后接入酵母,恒温条件下(25 ℃)进行酒精发酵。发酵结束后取自流汁,调整葡萄酒中SO2的浓度至40 mg/L,以抑制其苹果酸-乳酸发酵(避免葡萄酒香气在苹果酸-乳酸发酵后发生变化),酒样装瓶避光贮存待测。
1.2.5挥发性物质的提取准确量取6 mL葡萄酒酒样于15 mL顶空瓶中,加入1.5 g NaCl促进挥发性物质的挥发,再加入30 μL内标4-甲基-2-戊醇以及磁力转子,立即用带有聚四氟乙烯(PTFE)垫片的盖子盖紧。加热温度为40 ℃,转速为100 r/min,预热10 min。然后用固相微萃取头在40 ℃加热条件下萃取吸附50 min。待吸附平衡后进行气相色谱-质谱分析。各葡萄酒酒样均进行三次平行实验。
1.2.6气相色谱-质谱条件程序升温为:35 ℃保持1 min,以3 ℃/min的速度升至160 ℃,以5 ℃/min的速度升至200 ℃,以10 ℃/min的速度升至220 ℃,保持5 min。载气:He(纯度99.999%),流速1.0 mL/min。检测器温度280 ℃,前进样口温度280 ℃,采用不分流进样。
采用EI电子轰击式离子源;电子能量为70 eV,分辨率500;离子源温度为230 ℃;全扫描模式,扫描范围:30~500 amu。
1.2.7挥发性物质的定性定量分析
1.2.7.1定性分析采用气相色谱-质谱-计算机联用仪进行分析鉴定。对于已有标样的挥发性物质,根据已建立的相同色谱条件下该物质的保留指数和质谱信息进行定性;对于没有标样的挥发性物质,根据计算机谱库NIST11对比结果进行半定性。
1.2.7.2定量分析用色谱级乙醇配制12%(v/v)的乙醇水溶液,酒石酸调pH至3.6,模拟葡萄酒溶液。按照葡萄酒中挥发性物质的浓度水平,分别称取各标样用乙醇溶解,混合配制标准母液,连续梯度稀释5个不同浓度,建立主要挥发性物质标准曲线。对于已有标样的挥发性物质,利用已建立的相应标准曲线定量;对于没有标样的挥发性物质,采用半定量法定量。
1.2.8酒样感官分析各葡萄酒样放在通风良好、无任何气味和噪音的房间中,由专业人员采用定量分析描述法对各酒样进行感官分析[8]。感官评定人员先各自对样品进行品评,记录能反映酒样感官特征的描述性词汇。由品评组长汇总全部词汇,再经小组讨论,确定最终的描述性词汇为:果香、花香、胡椒、草本、香草、酵母味和脂肪味。
品评采用的标度为一条长10 cm的直线,品评人员在直线上标出能代表某种感官特征强度的标志,从左向右强度逐渐增加。品评结束后,用直尺把各强度转化为数值,输入计算机进行统计分析。
1.3数据处理
各酒样的测定均重复3次,应用Excel和SPSS数据分析软件对数据进行统计分析。
2 结果与讨论
2.1酵母的发酵力
酵母的发酵力是指酵母启动发酵和到达发酵高峰所用的时间,所用时间越短说明酵母的发酵力越强,发酵周期也会相应缩短,这有利于提高葡萄酒生产的经济效益。表1表明,酿酒酵母一般在接种后的6.0~8.0 h启动发酵,在11.0~12.0 h达到发酵的高峰,其中C2、C5和W7的发酵力强于其他酵母。

表1 酵母发酵力实验结果
2.2酵母的酒精耐受性
在发酵过程中,酵母将糖转化为酒精,但当酒精达到一定浓度时,又会对酵母本身产生抑制作用,主要表现在抑制酵母的生长、存活和发酵力3个方面[9]。酿酒酵母对高浓度酒精的耐受性是葡萄酒生产中的重要特性,酿酒酵母对高浓度酒精的强耐受性可以提高设备利用率和生产效率。各酿酒酵母对不同浓度酒精的耐受性实验结果见表2,结果表明,商品酵母和野生酵母都能耐受12%酒精,野生酵母在14%酒精中的生长情况普遍强于商品酵母,但当酒精浓度进一步提高时,大多数野生酵母的耐受性弱于商品酵母,野生酵母W6的酒精耐受性较为突出。
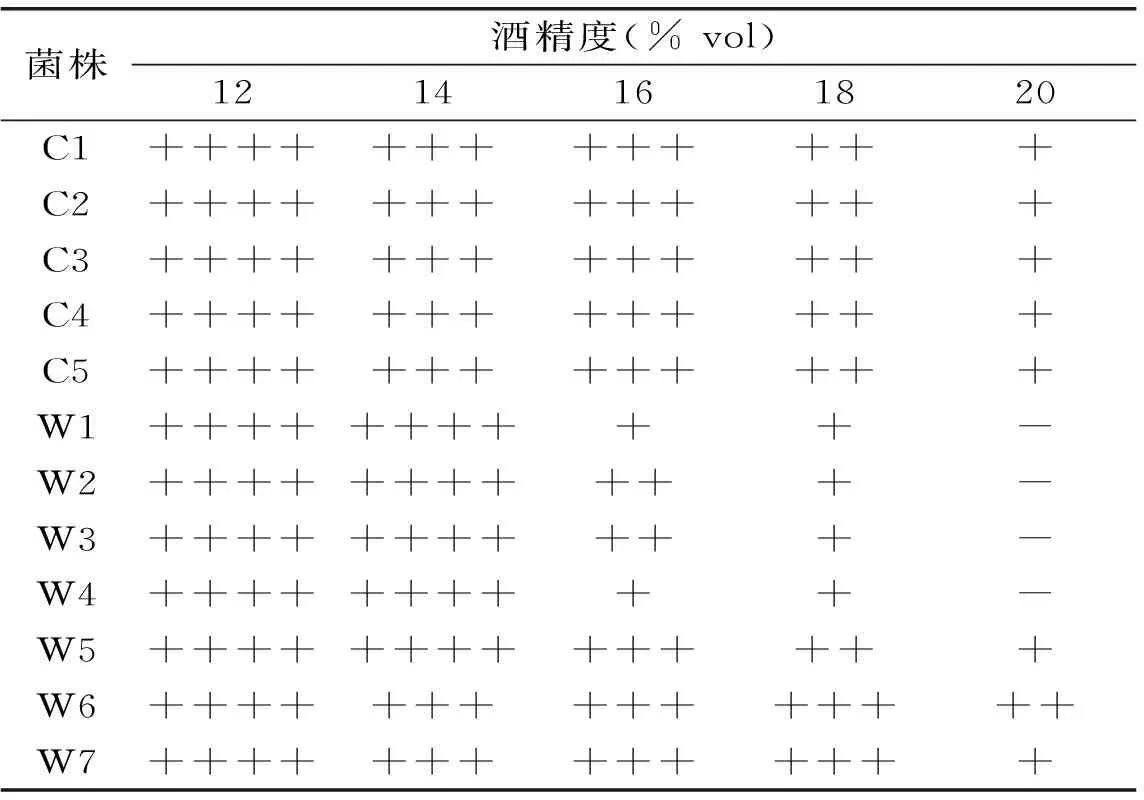
表2 酵母的酒精耐受性实验结果
注:“-”表明杜氏管中没有气泡,“+”表明杜氏管中气泡较小,“++”表明杜氏管中气泡占到一半,“+++”表明杜氏管中气泡超过一半,“++++”表明杜氏管中充满气泡;表3同。
2.3酵母的SO2耐受性
在葡萄酒酿造过程中,需要多次添加SO2,酒中总SO2浓度一般不超过250 mg/L,其主要目的是对发酵微生物的选择作用、抗氧化作用和澄清作用等[10]。SO2在发挥作用的同时也会对酵母产生抑制作用,因此酿酒酵母对高浓度SO2的耐受性也是葡萄酒生产中的重要参数,是葡萄酒品质的保证。各酿酒酵母对不同浓度SO2的耐受性实验结果见表3,表明商品酵母和野生酵母的SO2耐受性均满足酿造要求,且都能耐受400 mg/L的浓度,但随着SO2浓度的逐步提高,商品酵母对SO2的耐受性明显强于野生酵母。这可能与商品酵母的驯化有关。
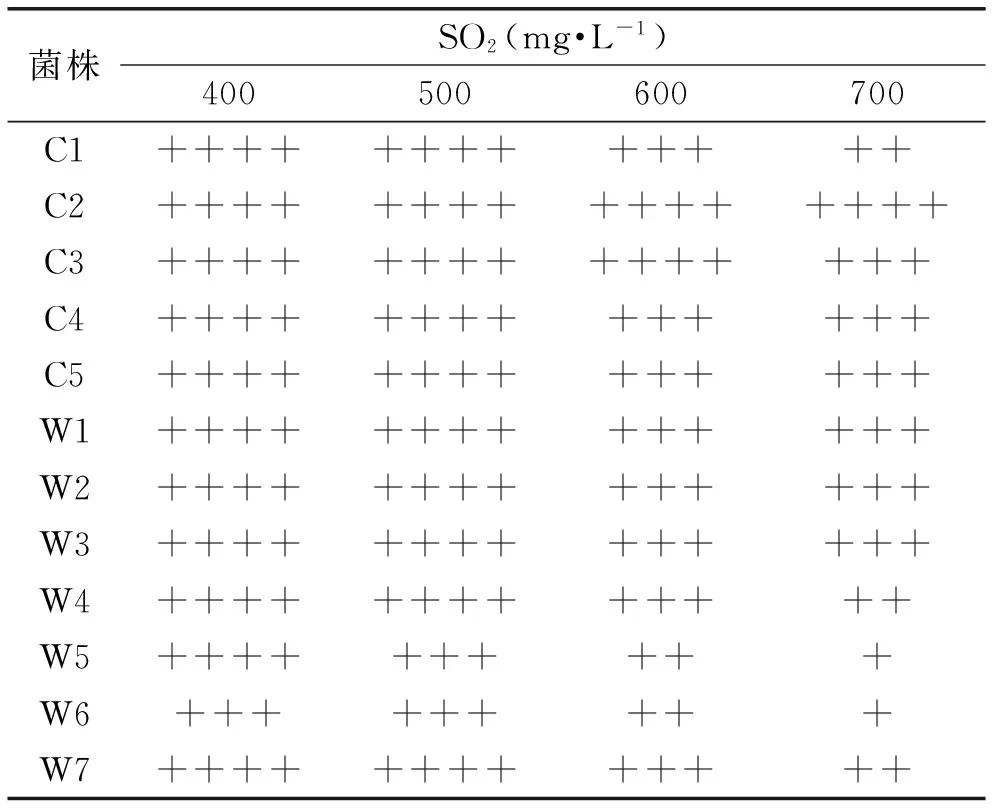
表3 酵母的SO2耐受性实验结果
2.4各酵母所酿葡萄酒的基本理化指标
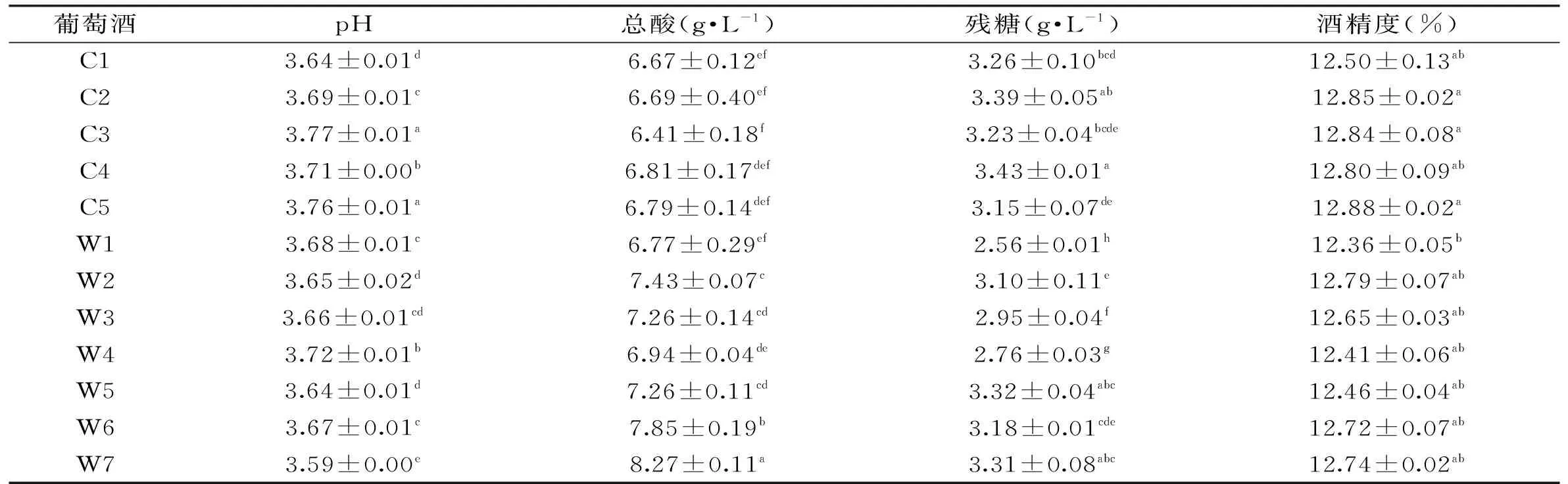
表4 不同酵母所酿葡萄酒基本理化指标
注:同列标有不同小写字母表示差异达到显著水平(p<0.05)。
用各酿酒酵母进行葡萄酒酿造实验,发酵结束后葡萄酒的pH、总酸、残糖和酒精度测定结果见表4。各酒样的pH均在3.7左右,W7最低为3.59。W7酒样的总酸最高(8.27 g/L),其次是W6(7.85 g/L),其他酒样的总酸均低于7.50 g/L,C3最低为6.41 g/L。各酒样的残糖均低于4 g/L,其中W1的残糖最低(2.56 g/L)。各酒样的酒精度相差不大,C5酒精度最高(12.88%),W1酒精度最低(12.36%)。

表5 各葡萄酒中挥发性物质的相对含量
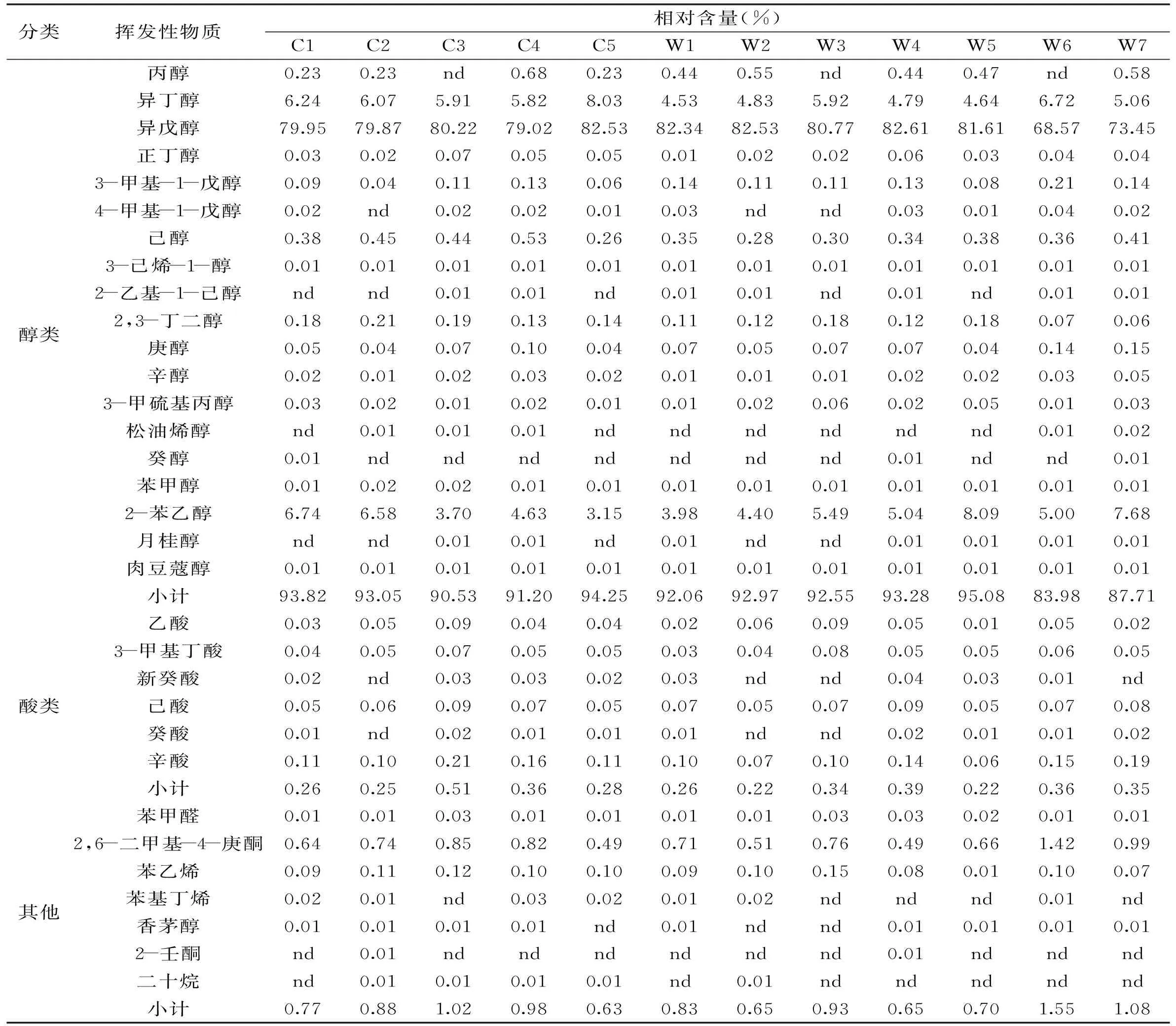
续表
注:nd:未检出。
2.5各葡萄酒中的挥发性物质
采用HS-SPME和GC-MS联用方法对各葡萄酒中的挥发性物质进行提取并检测,结果见表5,其中,相对含量是指该酒样中某挥发性物质含量占总挥发性物质含量的比例。共检测出了58种挥发性物质,酯类26种、醇类19种、酸类6种以及其他类7种,葡萄酒中比较常见的挥发性物质在各酒样中均能检测到。检测到挥发性物质最多和最少的葡萄酒都是由野生酵母酿造,W7最多52种,W3最少37种。
各酒样均能检测到的挥发性物质共有35种,结合文献报道[11-12],其中15种为与酵母代谢密切相关的挥发性物质,它们的总峰面积均占各葡萄酒中挥发性物质总峰面积的86.40%以上,因此把这15种物质作为葡萄酒中主要挥发性成分进行研究。对这15种主要挥发性物质进行定量计算,计算结果见表6,表7。
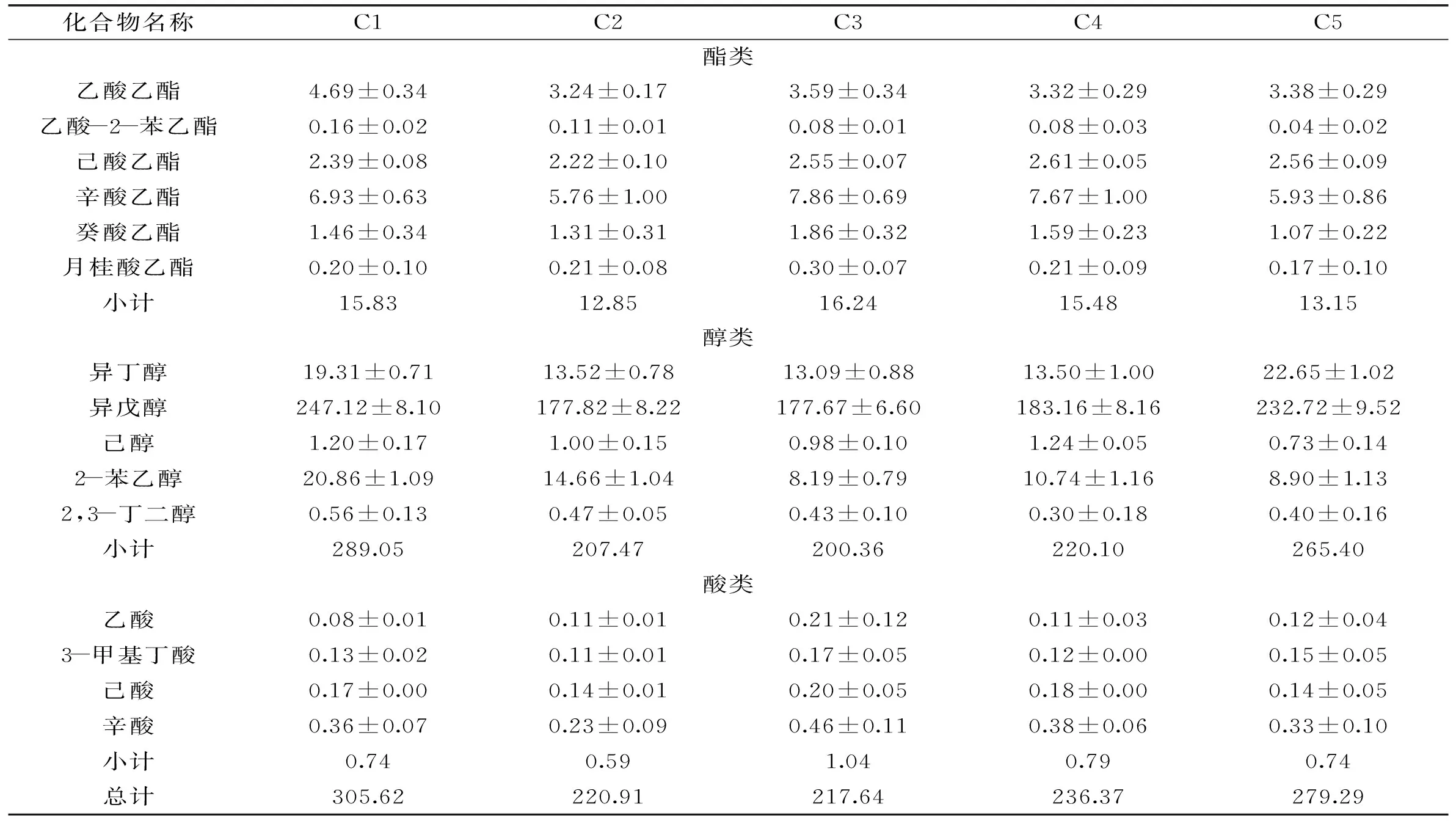
表6 各商品酵母葡萄酒主要挥发性物质含量(mg/L,n=3)

表7 各野生酵母葡萄酒主要挥发性物质含量(mg/L,n=3)
在商品酵母所酿造的红葡萄酒中,主要挥发性物质总量最高的是C1(305.62 mg/L),最低的是C3(217.64 mg/L);而野生酵母中,主要挥发性物质总量最高的是W2(326.84 mg/L),最低的是W1(267.68 mg/L)。
2.5.1酯类物质在检测出来的挥发性物质中,酯类物质的种类最多。酯类主要是在酵母代谢过程中形成的,能够赋予葡萄酒以新鲜的水果香气,是葡萄酒中果香的主要来源[13]。酯类的感觉阈值很低,易于被感知,另外,酯类物质之间会相互影响,形成协同作用[14]。酯类物质含量在不同酵母之间存在显著性差异(p<0.05),最高的是W2(19.09 mg/L),其次是W7(18.93 mg/L),含量最低的是W5(10.87 mg/L)。不计W5,除W4略低于C3外,其他野生酵母酿造的葡萄酒的酯类含量均大于商品酵母。C3是酯类含量最高的商品酵母(16.24 mg/L)。酯类物质按其结构可以分为乙酸酯和脂肪酸乙酯两类,W3的乙酸酯含量明显高于其他,而脂肪酸乙酯含量较高的是W7、W6和W2。野生酵母生成脂肪酸乙酯的含量高于商品酵母的现象与Torrens[15]的报道一致,但关于乙酸酯的报道却相反,这恰恰说明了野生酵母的特异性差异。
2.5.2醇类物质高级醇在主要挥发性物质中所占的比例最大,均占92%以上。高级醇主要是通过酵母的氨基酸降解途径生成[16],当葡萄酒中高级醇的含量低于300 mg/L时,会增加香气的复杂性,对葡萄酒的品质有积极作用[17]。高级醇含量在不同酵母之间存在显著性差异(p<0.05),W2和C1的高级醇含量最高,分别是306.94、289.05 mg/L,C3的含量最低(200.36 mg/L)。大多数野生酵母和商品酵母C5的高级醇含量都在260~270 mg/L。Callejon研究了4株野生酵母和1株商品酵母,发现生成高级醇含量最高的是野生酵母,最低的是商品酵母[18]。异丁醇、异戊醇和2-苯乙醇都是比较重要的高级醇[11]。异丁醇具有青草的香气,W6的含量最高(23.14 mg/L),W1含量最低(12.39 mg/L)。异戊醇在所有挥发性物质中的含量最高,这与Sangeeta的研究一致[19],有苦杏仁味,是构成葡萄酒香气骨架的主要物质[20]。异戊醇含量最高和最低的分别是W2(274.85 mg/L)和C3(177.67 mg/L)。2-苯乙醇有着玫瑰花的香味,C1的含量最高(20.86 mg/L),C3的含量最低(8.19 mg/L)。
2.5.3酸类物质有机酸在主要挥发性物质中占的比例较低,但对葡萄酒香气的平衡非常重要,是构成葡萄酒香气的基础[21]。葡萄酒中的有机酸主要有两个来源:葡萄果实和酵母合成,酵母生成的有机酸主要是偶数碳的直链脂肪酸[11]。有机酸含量最高的是W6(1.15 mg/L),最低的是W5(0.52 mg/L)。这与有关报道中商品酵母产酸高的现象不一致[4]。在商品酵母中,C3的有机酸含量最高(1.04 mg/L)。辛酸对有机酸的贡献最大,占到40%左右,而另外3种有机酸所占比例差不多。酸类物质往往带有不舒适的气味,辛酸具有刺鼻的陈腐味。W7的辛酸含量最高(0.58 mg/L),W5最低(0.19 mg/L)。
以上数据分析显示,各酒样在挥发性物质种类和主要挥发性物质含量上都存在差异。实验用于酿造各葡萄酒的原料和工艺条件是一致的,不同之处在于所接种的酿酒酵母不同,因此可以认为差异是由酿酒酵母引起的。酿酒酵母通过多种方式影响着葡萄酒的风味:a.代谢可产生一系列挥发性物质;b.释放葡萄果实中的一些挥发性物质前体;c.酵母细胞自身作用[22]。葡萄酒中的酯类、高级醇和挥发酸等物质主要是在发酵阶段由酵母产生的[23-24]。酯类物质是由醇类和酰基辅酶A在酶的催化作用下合成的[25];高级醇主要是通过降解代谢途径和合成代谢途径合成[26];挥发酸则是高级脂肪酸裂解或醇、醛氧化的产物[27]。这些物质的合成反应都需要酵母体内相关酶的参与,这些酶的数量和活性可能决定着产物的生成量,进而决定着葡萄酒中挥发性物质的成分和含量。
2.6感官品评
品评人员对各葡萄酒的感官特征进行定量描述分析,数据统计分析结果见图1。从图1中可以看出,各酒样在7个感官特征中所表达的强度不同。果香和草本在各葡萄酒中均表现的最为强烈,其次是胡椒和花香。对于果香,C1、C2、C5和W2、W7的强度明显高于其他;而对于草本,C4和W2、W3的强度较大;花香特征强度较大的是C1、C2和W2;胡椒特征强度较大的是C2和W1、W5。香草、酵母味和脂肪味在各葡萄酒之间的差异性不大。W2的果香和花香都比较明显,这与其酯类含量最高的实验数据相符;草本味则与高级醇有关,W2的高级醇含量最高,故其草本味较明显;酸类物质在葡萄酒中所占比例较小,其感官特征不易察觉,但酸类物质往往与脂肪味有关[28],品评结果中脂肪味较明显的正是脂肪酸含量高的W6。由此可见葡萄酒香气的仪器分析数据与感官分析结果有一定的相关性,但葡萄酒的香气是各种挥发性物质共同作用的结果,是许多复杂过程的最终产物,尚需要更加深入的研究去明确两者之间的关系。
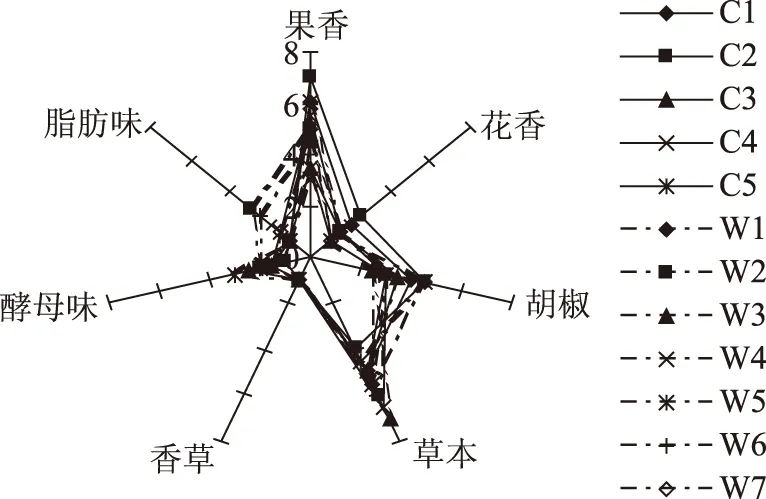
图1 各葡萄酒感官分析数据图Fig.1 Sensory analysis data of wines
3 结论
通过对5株商品酿酒酵母(C1~C5)和7株野生酿酒酵母(W1~W7)的发酵特性、耐受性和各葡萄酒基本指标的比较分析,结果表明,当酒精度为14%时,野生酿酒酵母的耐受性强于商品酿酒酵母,但当酒精度进一步提高时,野生酿酒酵母的耐受性不如商品酿酒酵母;野生酿酒酵母的SO2耐受性明显不如商品酿酒酵母;用各酿酒酵母所酿葡萄酒的基本指标差别不大。
采用HS-SPME和GC-MS联用技术对各葡萄酒的挥发性物质进行定量定性分析,结果表明,各葡萄酒中挥发性物质的组成成分相差不大,但在含量上存在差异,野生酿酒酵母主要挥发性物质的总含量要高于商品酿酒酵母。对于葡萄酒中的3类主要挥发性物质—酯类、醇类和酸类,其含量最高的均为用野生酿酒酵母酿造的葡萄酒,其中W2和W7最为突出。感官分析结果表明,C1、C2和W2的果香、花香较为突出,C4和W2具有明显的草本味,C2和W1的胡椒味较强。另外,本实验还证明了野生酿酒酵母应用的可行性,为野生酿酒酵母的进一步实用提供了理论依据。
[1]Dubourdieu D,Masneuf I,Tominaga T,et al. The role of yeasts in grape flavour development during fermentation:the example of Sauvignon blanc[J]. Am J Enol Vitic,2006,57(1):81-88.
[2]Cortes S,Blanco P. Yeast strain effect on the concentration of major volatile compounds and sensory profile of wines from Vitis vinifera var. Treixadura[J]. World Journal of Microbiology and Biotechnology,2011,27(4):925-932.
[3]Romano P,Fiore C,Paraggio M,et al. Capece. Function of yeast species and strains in wine flavour[J]. International Journal of Food Microbiology,2003,86(1-2):169-180.
[4]李艳,康俊杰,成晓玲,等. 3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J]. 食品科学,2010,31(22):378-382.
[5]陈金丽,郭阳,薛洁,等.优良野生葡萄酒酵母的筛选及性能评价[J]. 食品与发酵工业,2012,38(5):106-111.
[6]薛波,韩娜,侯敏,何苗,等.7株葡萄野生酵母菌的特性研究[J]. 中国酿造,2009,28(10):19-21.
[7]张珍,韩舜愈,王婧,等.祁连葡萄酒产区葡萄酒相关野生酵母菌株的分离及初步分类[J]. 食品工业科技,2013,34(8):179-182.
[8]李志江,牛广财,李兴革,等.定量描述分析(QDA)在葡萄酒感官评定中的应用研究[J]. 中国酿造,2009,28(6):158-160.
[9]杨建刚,马跃,肖冬光.酿酒酵母酒精耐性研究进展[J]. 酿酒科技,2006(11):86-89.
[10]李华.现代葡萄酒工艺学[M]. 西安:陕西人民出版社,2003:83-87.
[11]杨莹,徐艳文,薛军侠,等.葡萄酒相关酵母的香气形成及香气特征[J]. 微生物学通报,2007,34(4):757-760.
[12]李景明,于静,吴继红,等.不同酵母发酵的赤霞珠干红葡萄酒香气成分研究[J]. 食品科学,2009,30(2):185-189.
[13]Gürbüz O,Rouseff J M,Rouseff R L. Comparison of aroma volatiles in commercial Merlot and Cabernet Sauvignon wines using gas chromatography-olfactometry and gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2006,54(11):3990-3996.
[14]Lilly M. The development of yeast for the optimal production of flavor-active esters and higher alcohols in wine and distillates[D]. Stellenbosch:Stellenbosch University,2004.
[15]Torrens J,Urpí P,Aumatell R M,et al. Different commercial yeast strains affecting the volatile and sensory profile of cava base
wine[J]. International Journal of Food Microbiology,2008,124(1):48-57.
[16]Hazelwood L A. The Ehrlich pathway for fusel alcohol production:a century of research on Saccharomyces cerevisiae metabolism[J]. Applied and Environmental Microbiology,2008,74(22):59-66.
[17]Selli S,Cabaroglu T,Canbas A,et al.Volatile composition of red wine from cv.Kalecik Karas grown in central Anatolia[J]. Food Chemistry,2004,85(2):207-213.
[18]Callejon R M,Clavijo A,Ortigueira P,et al. Volatile and sensory profile of organic red wines produced by different selected autochthonous and commercial Saccharomyces cerevisiae strains[J]. Analytica Chimica Acta,2010,660(1-2):68-75.
[19]Sangeeta P,Takayuki S. Effect of 20 different yeast strains on the production of volatile components in Symphony wine[J]. Journal of Food Composition and Analysis,2003,16(4):469-476.
[20]Ackson R S. Wine tasting-a professional handbook[M]. Hong Kong:Elsevier,2002:46-52.
[21]Smyth H. The compositional basis of the aroma of Riesling and unwooded Chardonnay wine[D]. Australian:The University of Adelaide,2005.
[22]Polaskova P,Herszag J,Ebeler E. Wine flavor:chemistry in a glass[J]. Chemical Society Reviews,2008,37(24):78-89.
[23]Ferreira V,López R,Cacho J F. Quantitative determination of the odorants of young red wines from different grape varieties[J]. Journal of the Science of Food and Agriculture,2000,80:1659-1667.
[24]Escudero A,Gogorza B,Melús M A,et al. Characterization of the aroma of a wine from Maccabeo. Key role played by compounds with low odor activity values[J]. Journal of Agricultural and Food Chemistry,2004,52(11):3516-3524.
[25]Mason A B,Dufour J P. Alcohol acetyltransferases and the significance of ester synthesis in yeast[J]. Yeast,2000,16(14):1287-1298.
[26]程军,秦伟帅,赵新节.葡萄酒酿造中高级醇的形成机制与调节[J]. 中国酿造,2011,30(12):9-11.
[27]张明霞,吴玉文,段长青.葡萄与葡萄酒香气物质研究进展[J]. 中国农业科学,2008,41(7):2098-2104.
[28]Molina A M,Guadalupe V,Varela C,et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry,2009,117(2):189-195.
Study on volatile components of wine fermented with wild and commercialSaccharomycescerevisiaeyeasts
LIU Jun-xi1,2,JIANG Kai-kai1,2,HAN Ai-qin1,LI Rui-rui1,2,ZHAO Xin-jie1,SUN Yu-xia2,*,WANG Shi-ping2
(1.Shandong Key Laboratory of Microbial Engineering,Qilu University of Technology,Ji’nan 250353,China;2.Institute of Agro-Food Science and Technology,Shandong Academy of Agricultural Sciences,Key Laboratory of
The volatile components of the red wine fermented with 5 commercialSaccharomycescerevisiaeyeast strains and 7 wildSaccharomycescerevisiaeyeast strains were determined by head space solid phase microextraction(HS-SPME)followed by the gas chromatography-mass spectrometry(GC-MS). The results showed that the compositions of volatile components among different wines under different yeast strains were similar,while the contents of volatile components were significant different,and the total content of major volatile components in wine under wild yeast was higher than that under commercial yeast. Furthermore,the content of esters,alcohols and acids in wines fermented with wild yeast strains,which were three kinds of major volatile components of wine,were higher than wines under commercial yeast strains,especially W2 and W7. The sensory evaluation showed that the fruity and floral aroma of C1,C2 and W2 were outstanding,the herbal odour of C4 and W2 were obvious,whereas the peppery odour of C2 and W1 were strong.
Saccharomycescerevisiae;wine;volatile components;HS-SPME;GC-MS
2015-12-28
刘峻溪(1991-),男,在读硕士研究生,研究方向:现代酿酒技术,E-mail:liujunxi91@163.com。
孙玉霞(1973-),女,副研究员,研究方向:酿酒技术和酒类风味物质的研究,E-mail:sunyuxia1230@163.com。
山东省重点研发计划项目(2015GNC113010);山东省农业重大应用技术创新课题;山东省现代农业产业技术体系水果产业创新团队项目(SDAIT-03-021-12);泰山学者工程专项经费。
TS261.1
A
1002-0306(2016)12-0226-08
10.13386/j.issn1002-0306.2016.12.035

