由虾壳制备的蛋白水解物-柠檬酸钙的复合钙粉的生物利用率研究
张文静,刘云飞,陈舜胜
(上海海洋大学食品学院,上海 201306)
由虾壳制备的蛋白水解物-柠檬酸钙的复合钙粉的生物利用率研究
张文静,刘云飞,陈舜胜*
(上海海洋大学食品学院,上海 201306)
目的:评价从虾壳中制取的蛋白水解物-柠檬酸钙复合钙粉(PHC-Ca)的生物利用率。方法:选择4周龄体重无显著性差异的SD大鼠60只,随机分为6组,在自由进食低钙饲料的基础上分别以PHC-Ca、碳酸钙(CaCO3)、柠檬酸钙、葡萄糖酸钙以及虾壳细粉灌胃饲养,每日灌胃剂量为66.5 mg Ca/(kg·d)(以钙剂量及大鼠体重为计算指标)。喂养至4周末进行3 d代谢实验,测定钙表观吸收率、储存率。继续喂养至8周末,观察大鼠体格增长并测定血清碱性磷酸酶、骨钙素水平以及股骨相关指标。结果:低钙对照组大鼠各项体生长指标均显著低于除碳酸钙组外的其他组(p<0.05);PHC-Ca能显著提高大鼠钙表观吸收率、钙储存率,且能降低血清碱性磷酸酶、骨钙素水平(p<0.05);摄食PHC-Ca、葡萄糖酸钙的大鼠,其血清钙水平无显著性差异(p>0.05)且高于其他组;PHC-Ca组大鼠股骨钙、股骨长、股骨干重指标高于葡萄糖酸钙组、柠檬酸钙组、虾壳粉组(p<0.05)。结论:从虾壳中制取的PHC-Ca有促进钙吸收的效果,其生物利用率优于相同钙含量的柠檬酸钙以及虾壳粉,可作为一种良好的膳食钙补充剂。
虾壳,蛋白水解物-柠檬酸钙,生物利用率
钙是组成人体骨骼、牙齿支架的主要元素。钙离子参与人体生命活动,是传递细胞间主要信息的使者,其生理代谢对人体极为重要。摄入过量钙易沉积加重肾脏的负担,缺乏钙会导致骨质疏松等症状。因此,钙的吸收利用情况引起越来越多关注,在寻求来源丰富的天然钙基础上,研究出一种生物利用率高的补钙产品极为迫切。
钙吸收的过程为胃中消化、小肠吸收、血液运输、骨骼沉积,从而促进大鼠骨骼生长。在胃液作用下消化为Ca2+,一部分被代谢出体外一部分被小肠吸收,被吸收的Ca2+在氨基酸的作用下进入血液。而后在血液的运输下进入骨骼,最终沉积于骨质[1]。因此,本实验考察大鼠的代谢指标,血清中碱性磷酸酶、骨钙素等钙入骨指标[2],骨骼指标等。除此之外,钙吸收效果最明显是体格指标。
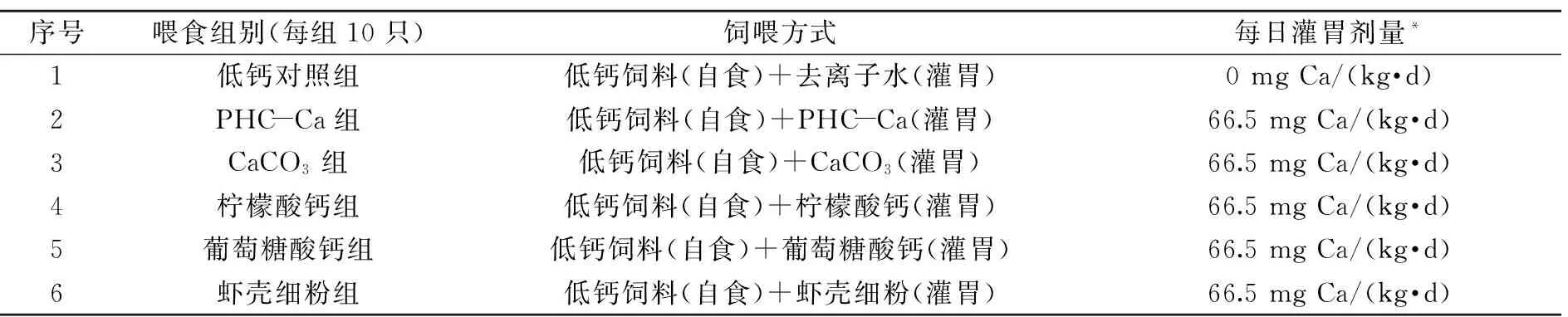
表1 大鼠分组及喂食钙剂量
注:*以钙的剂量及大鼠体重为计算指标。
蛋白水解成小分子的氨基酸、多肽,有促进钙吸收的效果。来源不同的蛋白水解成了不同的多肽、氨基酸,其中蛋清肽、鳕鱼皮胶原蛋白肽、鱼卵肽能有效地促钙吸收[3-6]。虾壳中含有丰富的蛋白,酶处理将其分解为小分子多肽氨基酸与钙质、甲壳素分离从而达到高值利用。然而利用其蛋白水解物探讨促钙吸收的研究鲜有报道。葡萄糖酸钙、乳酸钙、柠檬酸钙等有机钙被认为是良好的钙源应用于食品工业[7]。其中柠檬酸钙制备方法成熟,来源广,存在于天然水果的柠檬酸与虾壳中丰富的钙质结合制备柠檬酸钙,可用于钙强化食品中[8]。
2015中国渔业统计年鉴中显示,2014年全国海水养殖南美白对虾(Penaeusvannamei)产量总值为87万吨,占虾类总产值的75%左右[9]。而虾壳中富含蛋白质、钙质、甲壳素、虾红素等,仅作为鱼饲料低值利用。为更好地利用天然虾壳,虾壳中的蛋白、钙质等有益物质成为了研究的热点。
本实验以南美白对虾虾壳作为钙源,制取蛋白水解物-柠檬酸钙复合钙粉,分析比较制备的复合钙粉与其他不同类型的钙制剂生物利用率,分析其利用价值,为居民选择合适的补钙制剂提供参考。
1 材料与方法
1.1材料与仪器
4周龄SD大鼠(Sprague-Dawley)60只,清洁级,上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2013-0006,饲养环境:温度(22±2)℃、湿度60%±5%;蛋白水解物-柠檬酸钙复合钙粉(PHC-Ca)为实验室自制,其中钙含量为19.6%,总氨基酸含量18.3%,脂肪0.44%;胰蛋白酶(1∶250,酶活力≥50000 U/g)、柠檬酸、柠檬酸钙、碳酸钙分析纯,国药集团化学试剂有限公司;葡萄糖酸钙口服溶液哈药集团三精制药股份有限公司;血清钙、磷、碱性磷酸酶、骨钙素检测试剂盒艾迪康医学检验中心。
石墨炉消化炉长沙基隆仪器有限公司;MARS6微波消解仪美国CEM公司;Zoonit700原子吸收分光光度仪德国耶拿;BS-200全自动生化分析仪迈瑞医疗国际有限公司。
1.2实验方法
1.2.1低钙饲料的制备为建立低钙喂养模型,制备低钙饲料[10],其中钙含量为0.1%。配方如下:酪蛋白19.4%,大豆油10.0%,玉米淀粉39.3%,麦芽糖糊精13.6%,蔗糖8.7%,纤维素5.0%,维生素混合物1.0%,DL-蛋氨酸0.1%,酒石酸胆碱0.2%,TBHQ 0.002%,矿物质混合物2.5%(钙0.1%)。
1.2.2PHC-Ca的制取参考文献[11]的方法制备PHC-Ca:洗净的南美白对虾(PenaeusvannameiBoone)虾壳置于80 ℃鼓风干燥箱中烘干6 h,研磨过筛100目,制得虾壳细粉,直径<0.15 mm。称取2 g虾壳细粉以料液比1∶20加去离子水,均质5 min后进行酶解。利用胰蛋白酶酶解[11]:加酶量2.5×103U/g,pH8.0,温度45 ℃,酶解1.5 h,灭酶5 min。冷却至室温后,经5000 r/min离心10 min收集上层液,分离残渣。而后在残渣中继续添加20 mL,0.34 mol/L的柠檬酸,处理1.5 h后收集上层液。将两次收集的上层液合并、浓缩、80 ℃烘干后即为PHC-Ca。
1.2.3大鼠实验分组与喂养方式4周龄70~80 g体重大鼠经适应性喂养一周后,挑选体重无显著性差异的大鼠60只,分为6组:低钙对照组、PHC-Ca组、虾壳细粉组、碳酸钙组、柠檬酸钙组、葡萄糖酸钙组,每组10只。各组大鼠自由进食低钙饲料、饮用去离子水,在此基础上进行每日灌胃饲养8周。灌胃剂量(以钙的剂量为计算指标)参考人体(成年人体质量60 kg)每日需摄入钙含量800 mg,换算为13.3 mg Ca/(kg·d),中剂量66.5 mg Ca/(kg·d)吸收效果较好[12]。钙制剂与去离子水混合灌胃量为0.5 mL,低钙对照组每日灌胃0.5 mL去离子水(表1)。
1.2.4钙表观吸收率的测定大鼠体重需每日称量,喂养至4周后将大鼠放入代谢笼中收集3 d粪便、尿液至100 ℃鼓风干燥箱中干燥,恒重后磨成粉,利用火焰原子吸收测定代谢物中钙含量。
钙表观吸收率(%)=(摄入钙-粪钙)/摄入钙×100
钙储存率(%)=(摄入钙-粪钙-尿钙)/摄入钙×100
1.2.5血清中钙相关指标的测定喂养大鼠至8周后将其解剖,取动脉血,4 ℃静置0.5 h,10000 r/min、4 ℃离心取上层血清,4 ℃保存。利用生化自动分析仪测定血清钙、磷、碱性磷酸酶、骨钙素含量。
1.2.6股骨干重、骨长、骨钙含量的测定将大鼠处死后取右股骨,用游标卡尺测定长度,烘干恒重后称股骨干重,最后利用火焰原子吸收法测定骨钙含量。
1.3数据处理
所有测定数据均重复10次,测定值通过平均值及标准偏差表示,通过SSPS17.0软件处理,组间比较采用LSD法(least significant difference),p<0.05被认为有显著性差异。
2 结果与讨论
2.1PHC-Ca对大鼠生长的影响
大鼠体格指标是钙制剂吸收效果评定的关键指标。由表2可知,实验初期各组大鼠体重、身长无显著性差异。喂食8周后,各种钙制剂对大鼠的生长均有一定促进作用。喂养期间,低钙对照组大鼠较其他组瘦小,毛色暗淡。低钙对照组大鼠体重与碳酸钙组无显著性差异(p>0.05),PHC-Ca组、虾壳粉组大鼠体重最大,与葡萄糖酸钙组有显著性差异(p<0.05)。低钙对照组大鼠身长显著低于其他组(p<0.05)。除碳酸钙组,PHC-Ca组、葡萄糖酸钙组、柠檬酸钙组大鼠身长无显著性差异(p>0.05)。表明足量的钙质是保证大鼠正常生长发育的前提,PHC-Ca中的蛋白水解物、虾壳粉中的蛋白是有助体格增长的营养素。

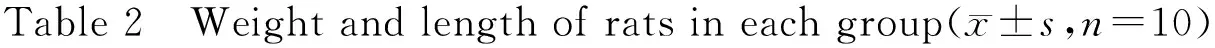
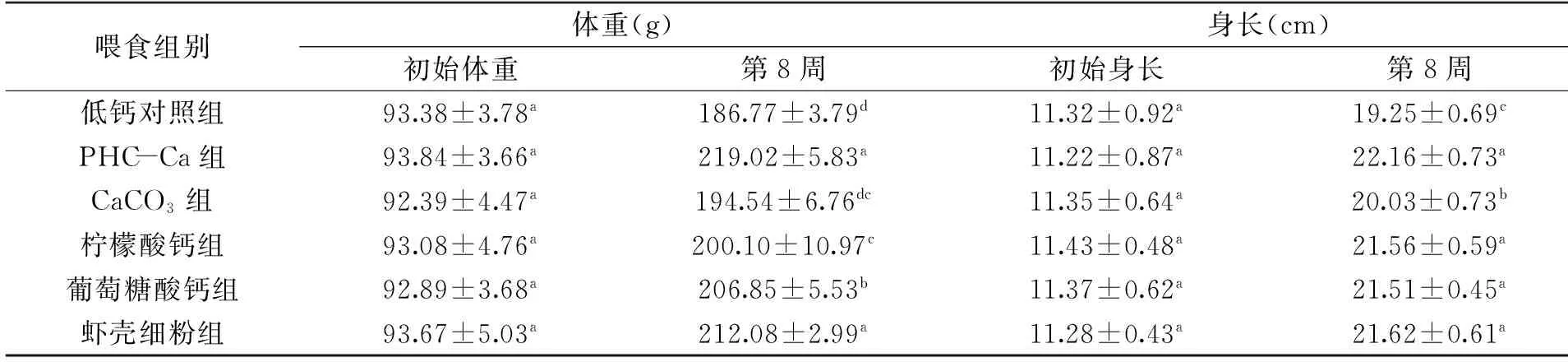
喂食组别体重(g)身长(cm)初始体重第8周初始身长第8周低钙对照组93.38±3.78a186.77±3.79d11.32±0.92a19.25±0.69cPHC-Ca组93.84±3.66a219.02±5.83a11.22±0.87a22.16±0.73aCaCO3组92.39±4.47a194.54±6.76dc11.35±0.64a20.03±0.73b柠檬酸钙组93.08±4.76a200.10±10.97c11.43±0.48a21.56±0.59a葡萄糖酸钙组92.89±3.68a206.85±5.53b11.37±0.62a21.51±0.45a虾壳细粉组93.67±5.03a212.08±2.99a11.28±0.43a21.62±0.61a
注:同一列中上标字母相同者无显著性差异(p>0.05),上标字母不同者存在显著性差异(p<0.05),表3~表5同。
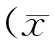
表3 大鼠摄入不同钙制剂对其钙吸收的影响±s,n=10)
2.2PHC-Ca对大鼠体内钙吸收效果的影响
大鼠摄入钙制剂,在胃液作用下将其分解为离子态,进入小肠中一部分被吸收利用。因此,钙表观吸收率,钙储存率能反映钙在大鼠体内表观的情况。由表3可知,大鼠仅摄食低钙饲料,钙表观吸收率、储存率均显著高于其他组(p<0.05)。可能是大鼠因缺钙产生应激反应,对少量的钙吸收效果显著增加。PHC-Ca、葡萄糖酸钙组大鼠钙表观吸收率显著高于柠檬酸钙、碳酸钙、虾壳粉组(p<0.05)。PHC-Ca组大鼠代谢物中粪钙、尿钙含量较低,可能是PHC-Ca溶解性好,成分中的小分子蛋白水解物能促进钙的吸收,葡萄糖酸钙为液体有机酸钙,在小肠中被充分吸收,因此,两者钙表观吸收率较高。
2.3PHC-Ca对大鼠血清钙水平的影响
钙离子经小肠吸收后进入血液,汇集于血清,因此血清中钙相关指标是评价钙吸收效果的重要方法。由表4可知,PHC-Ca、葡萄糖酸钙组大鼠血清钙、磷水平都高于其他组(p<0.05),可能是PHC-Ca、葡萄糖酸钙中的氨基酸、多肽、葡萄糖是促钙吸收的物质,使小肠吸收的钙基本进入血液。血清碱性磷酸酶、骨钙素水平又是骨代谢标志物,能维持钙在骨骼中的矿化的速率[13],摄食相同钙含量不同钙制剂的大鼠,其骨钙素水平无显著差异。低钙对照组大鼠血清中碱性磷酸酶、骨钙素骨代谢指标显著高于其他组(p<0.05),表明在缺钙状态下,大鼠骨钙不断流失。
2.4PHC-Ca对大鼠股骨指标的影响
钙离子通过血液的运输最终在骨骼的无机质中沉积成钙盐,构成骨骼的基本结构。股骨的长势是大鼠骨骼生长的主要指标,从股骨干重、骨长、骨钙结果(见表5)中看出摄食PHC-Ca的大鼠骨骼长势显著优于其他组(p<0.05)。虾壳粉作为补钙产品其钙吸收效果不及由虾壳制取的PHC-Ca。PHC-Ca的生物利用率高于柠檬酸钙,虾壳中蛋白水解物有效地促钙吸收。因此,PHC-Ca无需纯化,可直接作为膳食钙补充剂。经分析,PHC-Ca与其他钙制剂相比能更好地促进大鼠骨骼的生长,预防骨质疏松症。
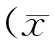
组别血清钙(mmoL/L)血清磷(mmoL/L)碱性磷酸酶(IU/L)骨钙素(ng/mL)低钙对照组2.364±0.072d1.568±0.017c219.40±6.52a0.712±0.037aPHC-Ca组2.871±0.089a1.842±0.029a189.40±6.52d0.421±0.011bCaCO3组2.655±0.035c1.679±0.029b196.10±5.51b0.446±0.033b柠檬酸钙组2.715±0.047b1.665±0.033b193.00±7.59c0.440±0.036b葡萄糖酸钙组2.898±0.069a1.809±0.051a190.20±3.76d0.456±0.026b虾壳细粉组2.725±0.053b1.596±0.059c194.40±6.62c0.492±0.027b

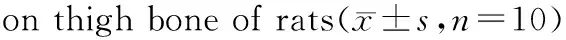

组别股骨干重(g)股骨长(cm)股骨钙(mg/g)低钙对照组0.1938±0.0024d2.72±0.02d152.8±3.2dPHC-Ca组0.2783±0.0074a2.93±0.01a191.4±4.3aCaCO3组0.2388±0.0083c2.83±0.03c177.7±3.1c柠檬酸钙组0.2645±0.0161b2.85±0.04c183.7±5.2b葡萄糖酸钙组0.2681±0.0179b2.90±0.03b189.6±2.9b虾壳细粉组0.2370±0.0064c2.91±0.03b183.0±3.0b
通过比较5种不同类型的钙制剂生物利用率相关的各项指标,发现利用胰蛋白酶-柠檬酸联用的方式制取PHC-Ca,其生物利用率优于虾壳细粉。虾壳细粉中的蛋白能促进大鼠体格生长,但从表观吸收率、血清钙水平、骨钙含量等指标得到,促钙吸收的效果较差,综合评价其生物利用率较低。相比之下,大鼠仅摄食低钙饲料时,因缺钙引起机体应激反应,钙表观吸收率较高,但其血清钙、骨钙处于各组最低水平,未达到补钙效果。
PHC-Ca与葡萄糖酸钙吸收效果较好,可能是两者在胃中溶解性好,得以充分吸收[14]。与柠檬酸钙相比其生物利用率较高,可能是PHC-Ca中的小分子多肽、氨基酸是促生长、促钙吸收的营养物质,这与氨基酸、鱼骨粉酶解物促钙吸收的研究结论一致[15-17]。PHC-Ca是利用废弃的虾壳制取而成,其成分中的蛋白水解物是促钙吸收的关键因素。因此,无需进一步纯化PHC-Ca。
3 结论
PHC-Ca组大鼠体格、血清钙磷水平、骨钙含量等指标最高,表明PHC-Ca能有效地促进钙的吸收,其生物利用率优于相同钙含量的柠檬酸钙以及虾壳粉。综上所述,PHC-Ca可作为一种良好的膳食钙补充剂添加到食品中。虾壳中的蛋白与钙质可作为天然的蛋白钙源进一步回收利用,为虾类废弃物的综合利用作参考。
[1]张经坤,张泽民,于傲.人体钙吸收理论探讨[J]. 科学通报,2000,45(10):1114-1120.
[2]郭晓强.骨钙素:一种重要的能量代谢调节激素[J].生命科学,2011,23(1):102-105.
[3]卢玉坤,姜慧明,王景峰,等. 鳕鱼皮胶原蛋白肽的促钙吸收作用[J].中国海洋药物,2013,32(4):49-56.
[4]韩樱,何慧,赵宁宁.蛋清肽-钙配合物体内促钙吸收作用研究[J].食品科学,2012,33(11):262-265.
[5]潘道东,陆皓茜.乳清蛋白肽对骨密度和骨钙含量的影响[J].营养学报,2010,32(4):350-353.
[6]黄海,李八方,刘尊英,等. 鱼卵肽钙复合物对大鼠体内促钙吸收作用的研究[J].食品工业科技,2014,35(3):331-335.
[7]甘振威,张娅婕,陈秋丽,等.葡萄糖酸钙和乳酸钙在大鼠体内的吸收和利用[J].吉林大学学报:医学版,2004(4):546-548.
[8]刘洪玲,刘建军,赵祥颖. 果酸钙的研制及应用[J].食品工业科技,2007,28(2):173-175.
[9]陈瑨,吴洪钟.2015中国渔业统计年鉴[M].北京:中国农业出版社,2015:30-31.
[10]Yooheon Park,Jonggun Kim,Angus G Scrimgeour,et al. Conjugated linoleic acid and calcium co-supplementation improves bone health in ovariectomised mice[J]. Food Chemistry,2013,140(1):280-288.
[11]任丽娥,黄光荣,蒋家新,等.胰蛋白酶水解虾头壳制备钙结合肽的工艺条件优化研究[J].水产科学,2011,30(2):107-111.
[12]马丹丹,朱文丽,梁学军,等. 酶解骨粉对大鼠钙吸收及骨密度的影响[J].卫生研究,2011,40(4):492-494.
[13]崔云鹏,曹永平,文立成,等.骨吸收抑制剂对卵巢切除骨折大鼠脂类代谢及骨钙素的影响[J].中国骨质疏松杂志,2013,19(8):791-795.
[14]王文清,邓丽,侯小龙,等. 4种口服补钙制剂对大鼠生长发育的促进作用及钙吸收率考察[J]. 中国医院药学杂志,2012,32(11):861-864.
[15]Ningning Zhao,Jun Hu,Tao Hou,et al. Effects of desalted duck egg white peptides and their products on calcium absorption in rats[J]. Journal of Functional Foods,2014,8(5):234-242.
[16]谢雯雯,尹涛,张晋,等.鱼骨粉粒径对鱼骨粉-鱼蛋白酶解物混合物中钙生物利用率的影响[J].食品科学,2014,35(7):211-216.
[17]菅凌燕,何晓静,肇丽梅,等.复方氨基酸螯合钙的人体吸收及其生物等效性[J].中国医院药学杂志,2009,29(12):983-986.
Study on bioavailability of protein hydrolysate-citrate calcium prepared from shrimp shell
ZHANG Wen-jing,LIU Yun-fei,CHEN Shun-sheng*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Objective:To evaluate bioavailability of protein hydrolysate-citrate calcium(PHC-Ca)from shrimp shell. Method:4 weeks SD rats were randomly divided into 6 groups with 10 rats in each,and then gavaged with PHC-Ca,CaCO3,calcium citrate,calcium gluconate,shrimp shell powder based on low calcium diet and low calcium control diet for 8 weeks. The calcium gavage dose to rats was 66.5 mg Ca/(kg·d). Calcium metabolic test was conducted by the end of the forth week. Moreover,the index related to serum and bone were assayed by the end of the 8th week. Result:The rats’ growth index in low calcium was lower than other group except CaCO3.The calcium absorption rate of PHC-Ca group was remarkable high than other groups except low calcium control. Furthermore,the level of ALP,BGP,in serum indicated that PHC-Ca improved calcium absorption in serum level significantly(p<0.05). Moreover,the bone index showed the bioavailability in PHC-Ca group(p<0.05). Conclusion:PHC-Ca prepared from shrimp shell could be promote calcium absorption,its bioavailability was better than same calcium content of calcium citrate and shrimp shell powder,which could be used as sources of dietary calcium supplement.
shrimp shell;protein hydrolysate-citrate calcium(PHC-Ca);bioavailability
2015-12-22
张文静(1990-),女,硕士研究生,主要从事水产品加工利用方面的研究,E-mail:zwj323@sina.com。
陈舜胜(1956-),男,硕士,教授,主要从事水产品加工与贮藏方面的研究,E-mail:sschen@shou.edu.cn。
国家自然科学基金资助项目(31471685);国家科技支撑计划项目(2012BAD28B05);融合海洋食品科学的海洋生物药物(B5201120040);上海市2015高校内涵建设项目(A2018150009)。
TS201.4
A
1002-0306(2016)10-0360-04
10.13386/j.issn1002-0306.2016.10.066

