核桃多肽制备酶解关键技术研究
李丽,刘阳,张帅,周涵黎,王亚云,吴娜,阮金兰,*(.武昌理工学院生命科学学院,生物多肽糖尿病药物湖北省协同创新中心,湖北武汉430223;2.武汉工程大学化工与制药学院,湖北武汉430073)
核桃多肽制备酶解关键技术研究
李丽1,2,刘阳1,2,张帅1,周涵黎1,2,王亚云1,2,吴娜1,2,阮金兰1,2,*
(1.武昌理工学院生命科学学院,生物多肽糖尿病药物湖北省协同创新中心,湖北武汉430223;2.武汉工程大学化工与制药学院,湖北武汉430073)
以核桃仁为原料,以水解度和对α-淀粉酶抑制率为评价指标,正交设计研究核桃蛋白酶解中相关的单酶水解、多酶水解、酶添加顺序、复合酶最佳配方等关键因子。结果表明,单酶对核桃蛋白的水解度大小依次为:碱性蛋白酶>中性蛋白酶≈酸性蛋白酶>胃蛋白酶>胰蛋白酶,而酶解产物对α-淀粉酶抑制率大小依次为:酸性蛋白酶>中性蛋白酶>碱性蛋白酶>胃蛋白酶>胰蛋白酶,并发现依次添加单酶比同时添加的效果更好。综合考虑,先加中性蛋白酶再加碱性蛋白酶的添加方式最佳,可使核桃蛋白水解度达到40%左右,同时还保证酶解产物对α-淀粉酶抑制率较大,可达到85.9%。关键词:核桃多肽;酶解;α-淀粉酶;核桃
核桃(Juglans regia L.),别名羌桃等,系胡桃科核桃属落叶乔木的果核,是一种罕见兼具经济价值和营养价值的果木,在植物界占据十分重要的地位。核桃仁中不仅含有丰富的不饱和脂肪酸,还拥有优质的蛋白质[1-2]资源,是人们喜好的坚果美食和常用的医疗保健原料。现代医学研究表明,核桃仁具有化痰、养血、补气、治喘等多种医疗和保健的功能,澳大利亚科学家进行的最新实验再次证明,糖尿病(DM)患者每天坚持吃核桃可以将体内无益胆固醇LDL的含量降低10%[3]。近期有研究[4]发现与蛋白质相比,多肽具有分子量小、结构简单、乳化性和热稳定性强、毒副作用小、特异性高、吸收快、水溶性好、利用效率高、易于改造和修饰等独特的优势,一些多肽不仅能够提供人体生长所必须的营养物质,还具有某些特殊的生理功能,例如:抗疲劳[5]、抗氧化[6]、降血压[7]等。
为了充分利用和开发核桃多肽资源,本研究采用碱溶酸沉法[8]提取核桃蛋白,以水解度和对α-淀粉酶的抑制率为指标,考察5种单酶和两酶协同水解方式及同时加酶和分步依次加酶方式对核桃蛋白水解的效果进行了解系统的研究,以期解决核桃多肽制备中酶解关键技术问题,确定最适酶的种类及其最佳酶解条件和参数,从而为核桃多肽制备及深加工提供实验参考,为核桃资源的综合开发利用奠定基础。
1 仪器与材料
1.1仪器
Avanti J-26XP超速冷冻离心机:贝克曼库尔特(美国);雷磁pHs-3c pH计:上海仪电科学仪器有限公司;UV-1800紫外分光光度计:岛津(日本);FreeZone TriadTM2.5 L冷冻真空干燥箱:LANCONCO(美国)。
1.2材料与试剂
核桃仁:购自新疆阿克苏,经华中科技大学同济药学院张长弓副教授鉴定为Juglans regia L.的果核;碱性蛋白酶(批号:060910)、中性蛋白酶(批号:060900)为BR:武汉市华顺生物技术有限公司;胃蛋白酶(批号:20140619)为BR、甲醛、NaOH、HCl、可溶性淀粉、酒石酸钾钠均为AR、考马斯亮蓝G250为BR:国药集团化学试剂有限公司;酸性蛋白酶(批号:CAS#9025-49-4)为BR:上海金穗生物科技有限公司;胰蛋白酶(批号:J130062)为BR:赛默飞世尔科技(中国)有限公司;无水硫酸钠为AR:天津市化学试剂有限公司;α-淀粉酶为BR:北京双旋微生物培养基制品厂;结晶酚为GC:阿拉丁。
2 方法
2.1核桃蛋白的提取[8]
试验工序为:核桃仁精选→浸泡→去皮→均浆→调pH 8~8.5→搅拌,浸泡过夜→以3 000 r/min,4℃离心30 min→去油层和下层沉淀→调pH 4.0~4.5→搅拌,静止→以3 000 r/min,4℃离心30 min→取沉淀层→水洗→调pH 7.0→冷冻干燥,得冻干粉。
2.2蛋白质含量测定
采用考马斯亮蓝法[9]测定提取蛋白含量,酶解液中多肽含量测定也采用此法。
2.3最适单酶种类筛选
配制一定浓度的核桃蛋白溶液,调至相应的pH(见表1),按比例分别加入常用的碱性、中性和酸性蛋白酶,胃蛋白酶,胰蛋白酶,以水解度和对α-淀粉酶的抑制率为评价指标,筛选确定最适水解酶的种类。
2.3.1氨基氮及总氮的测定
氨基氮的测定采用甲醛滴定法[10],总氮采用凯氏定氮法[11]。
氨基氮的测定:在5 mL水解液加蒸馏水25 mL,用0.05mol/LNaOH标准液滴定至pH为8.2,加入10mL的中性甲醛溶液混匀,再用0.05 mol/L NaOH溶液继续滴定至pH为9.2,记录加入甲醛后溶液滴定至pH=9.2所消耗的碱量。同时取水30 mL,做试剂空白试验。计算公式如下:

表1 各种酶的最适作用条件Table 1 The optimum hydrolysis condition of enzymes

式中:W为样品中氨基氮含量,g/100 mL;V1为测定用样品加入甲醛稀释NaOH标准液的体积,mL;V2为试剂空白试验加入甲醛后消耗NaOH标准液的体积,mL;V3为样品稀释液取用量,mL;C为NaOH标准液的浓度,mol/L;14为N的摩尔质量,g/mol。
总氮的测定:称取一定量的蛋白冻干粉于105℃的烘箱中干4 h,待降至室温后称重,随后继续干燥样品,每干燥1 h,称重一次,恒重即可。经消化、蒸馏后,用0.010 0 mol/L标准盐酸溶液滴定至终点。计算公式如下:
总氮含量/%=(V2-V1)×C×0.014×6.25m×V′/V×100
式中:V2为滴定试样时所需标准酸溶液体积,mL;V1为滴定空白时所需标准酸溶液体积,mL;C为盐酸标准溶液浓度,mol/L;m为试样质量,g;V为试样分解液总体积,mL;V′为试样分解液蒸馏用体积,mL。
2.3.2水解度的计算
水解度的计算公式如下:

2.3.3对α-淀粉酶活性抑制率测定
参照DNS(3,5-二硝基水杨酸)比色法[12]。将α-淀粉酶溶液在37℃水浴中孵育5 min后,加入淀粉溶液(1%)以启动反应,向反应体系中加入多肽液,体系于37℃反应20min后,加入NaOH停止反应,并加入2mL DNS,于沸水浴中反应10 min,冷却后于540 nm处测定吸光值,重复3次,α-淀粉酶活性抑制体系见表2。
计算公式如下:
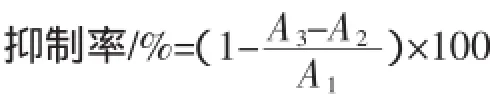

表2 α-淀粉酶活性抑制体系表Table 2 α-amylase activity inhibition system table
2.4单酶最佳酶解条件[13]
根据5种酶的水解度和对α-淀粉酶抑制率的效果,选出合适的蛋白酶即酶Ⅰ和Ⅱ,通过底物浓度、时间、pH 4、酶用量(酶量/底物量)种单因素设计正交试验,得到单酶的最佳水解条件。
酶Ⅰ(碱性蛋白酶)正交试验:采用底物浓度2 g/100 mL~4 g/100 mL,酶解pH 8.0~10.0,酶解时间2 h~4 h,酶用量8 000 U/g~12 000 U/g(酶量/底物量),进行正交试验,以确定酶Ⅰ最佳水解条件,选用因素及水平见表3。
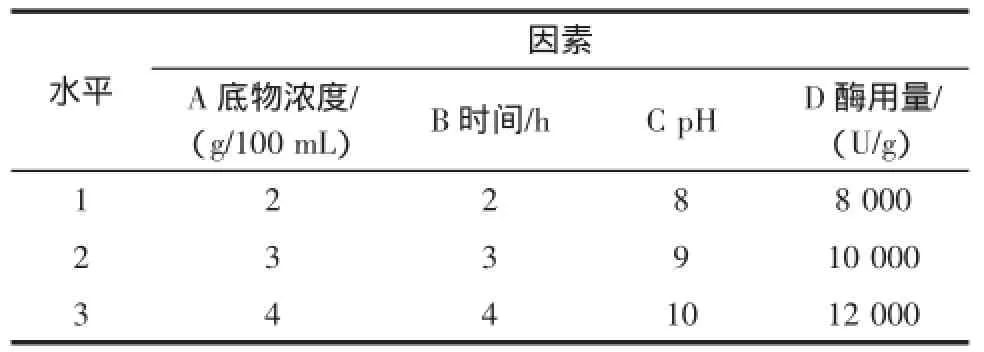
表3 酶Ⅰ选用因素和水平Table 3 The selection factors and levels of enzymeⅠ
酶Ⅱ(中性蛋白酶)正交试验:采用底物浓度2 g/100 mL~4 g/100 mL,酶解pH 6.0~8.0,酶解时间2 h~4 h,酶用量8 000 U/g~12 000 U/g(酶量/底物量),进行正交试验,以确定酶Ⅱ最佳水解条件,选用因素及水平见表4。
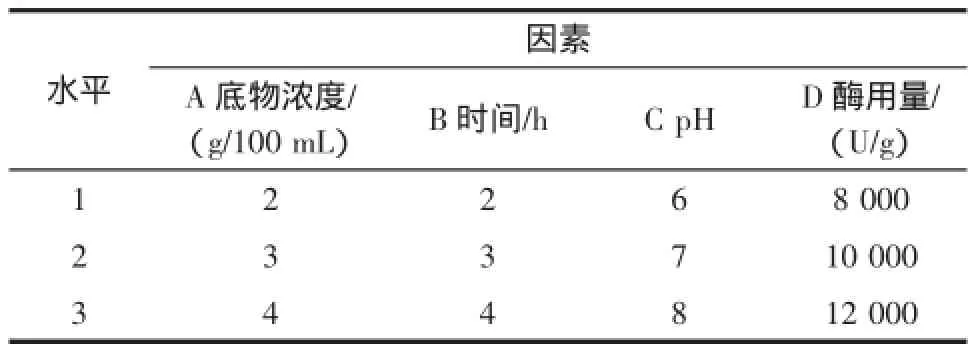
表4 酶Ⅱ选用因素和水平Table 4 The selection factors and levels of enzymeⅡ
2.5加酶方式[10]对酶解过程影响
以水解度和对α-淀粉酶抑制率为指标考察分步加酶和同时加酶对核桃蛋白酶解过程的影响。分步加酶的方式为先加入一种酶,水解完成后灭酶,调整最佳条件下加入第二种蛋白酶水解;同时加酶为在两种酶中采取较合适的水解条件下同时加入两种酶进行水解。依据单酶最佳酶解结果,加酶方式设计见表5。

表5 加酶方式Table 5 Sequence of adding enzyme
3 结果与分析
3.1蛋白含量测量
在试验研究中,为了增加核桃蛋白的溶解性和测量结果的准确性,首先对核桃蛋白冻干粉进行粉粹、过筛前处理,尽量减小蛋白颗粒直径,促进溶解;同时在溶解蛋白时采用远离其等电点范围(pH 4.0~4.5)[14]的pH约为8.0的溶剂,并且将核桃蛋白液通过0.45 μm微孔滤膜过滤后在进行UV检测。经此处理后,蛋白冻干粉的产率为9.38%,在0.5%浓度下纯度可达到56.36%。
3.2最适单酶的选择
各种蛋白酶水解核桃蛋白的能力各不相同,根据各个酶厂家提供的酶的最适条件,在各种酶的最适条件下,水解核桃蛋白4 h,测定各种酶对核桃蛋白的水解度和酶解液对α-淀粉酶抑制率如图1。

图1 5种蛋白酶水解效果的比较Fig.1 The Comparison of five enzymes
从图1中可看出碱性蛋白酶对核桃蛋白的水解度最高,且对α-淀粉酶抑制率较高,因此,确定碱性蛋白酶水解核桃蛋白能力最强,为最适水解酶。同样就中性蛋白酶和酸性蛋白而言,两种酶对核桃蛋白的水解能力基本一致,虽然酸性蛋白酶对α-淀粉酶抑制率最高,但是酸性蛋白酶最适pH与核桃蛋白的等电点相近,使得核桃蛋白溶解性很差,对蛋白的酶解影响较大。因此,最终选择碱性蛋白酶(酶Ⅰ)和中性蛋白酶(酶Ⅱ)作为后期复合酶酶解的种类。
3.3单酶最佳酶解工艺
3.3.1酶Ⅰ(碱性蛋白酶)正交试验
酶Ⅰ(碱性蛋白酶)正交试验结果与分析见表6。
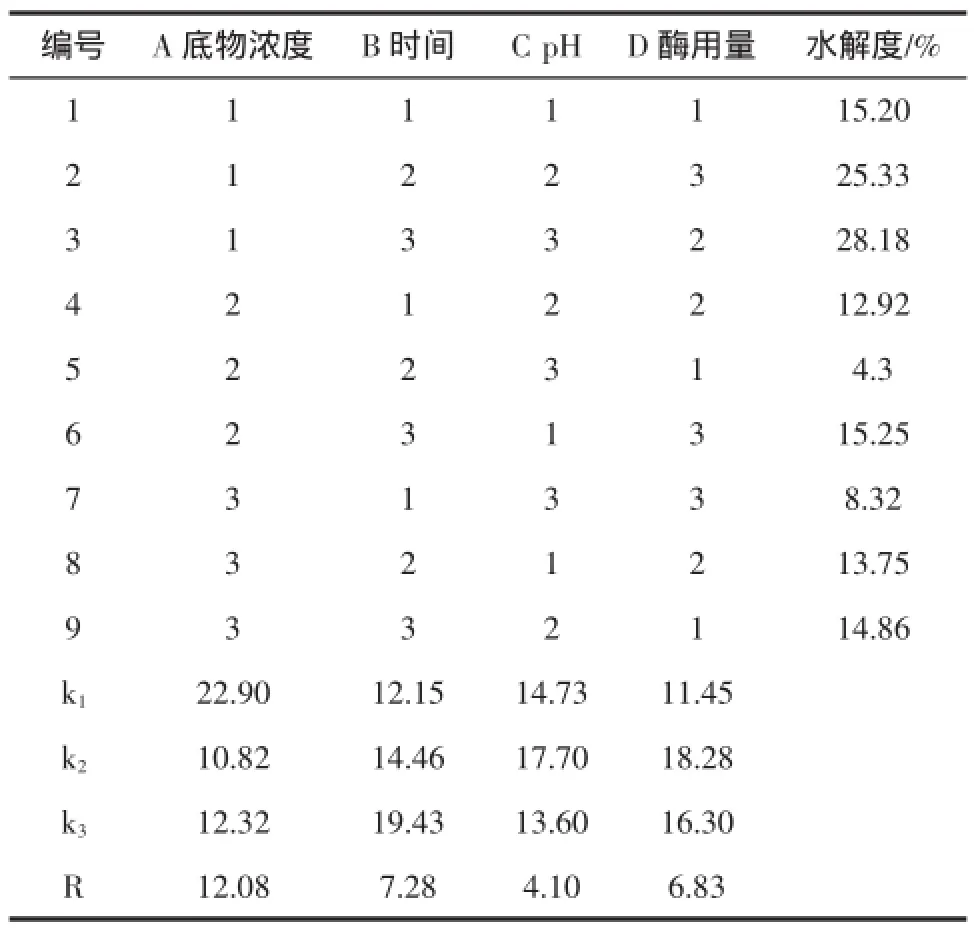
表6 酶Ⅰ(碱性蛋白酶)正交试验结果与分析Table 6 The results and analysis of orthogonal test on enzymeⅠ(Alkaline Protease)
由表6可见RA>RB>RD>RC,即底物浓度(A)、酶解时间(B)、酶解pH(C)和酶用量(D)4个因素对试验考查指标影响的主次关系是ABDC,即底物浓度影响最大,酶解时间次之,随之是酶用量,酶解pH影响最小。由于kA1>kA3>kA2,所以可以确定A1为A因素的最优水平。同理B3、C2和D2分别为B、C和D三因素的最优水平。故酶Ⅰ(碱性蛋白酶)酶解核桃蛋白的最佳工艺条件为:A1B3C2D2,即底物浓度为2 g/100 mL,酶解时间为4 h,酶解pH为9,酶用量为10 000 U/g。经试验验证,在A1B3C2D2条件下,核桃蛋白水解度达30.08%。3.3.2酶Ⅱ(中性蛋白酶)正交试验
酶Ⅱ(中性蛋白酶)正交试验结果与分析见表7。
由表7可见RA>RC>RB>RD,即底物浓度(A)、酶解时间(B)、酶解pH(C)和酶用量(D)4个因素对试验考查指标影响的主次关系是ACBD,即底物浓度影响最大,酶解pH次之,随之是酶解时间,酶用量影响最小。由于kA1>kA2>kA3,所以可以确定A1为A因素的最优水平。同理B2、C2和D1分别为B、C和D三因素的最优水平。故酶Ⅱ(中性蛋白酶)酶解核桃蛋白的最佳工艺条件为:A1B2C2D1,即底物浓度为2 g/100 mL,酶解时间为3 h,酶解pH为7,酶用量为8 000 U/g。经试验验证,在A1B2C2D1条件下,核桃蛋白水解度达17.48%。
3.4加酶方式对水解度的影响
按照试验方法2.5,以水解度和对α-淀粉酶抑制率为指标,考查加入方式对水解过程的影响,试验结果见图2。

表7 酶Ⅱ(中性蛋白酶)正交试验结果与分析Table 7 The results and analysis of orthogonal test on enzymeⅡ(Neutral protease)

图2 不同加酶方式试验结果与分析Fig.2 The results and analysis of different enzyme tests
由图2可知,不论以何种方式加酶,复合酶的水解效果都优于单酶,并且分步加入酶方式的水解度明显高于同时加入酶的方式。这是因为分步加酶的方式最大限度地保证在各个酶反应都是在最佳条件,因此选用分步依次加酶能够达到最大水解度,保证对α-淀粉酶抑制率最大的5号试验组方案,即先在最佳条件(参考3.3.1)下加中性蛋白酶,经历灭酶,调整至最佳条件(参考3.3.2)下再加碱性蛋白酶,并且保证中性蛋白酶与碱性蛋白酶酶解时间和酶量比为1∶2。
4 结论
核桃蛋白水解程度与酶解释放出具有对α-淀粉酶抑制率的生物活性肽密切相关。本文以核桃蛋白的水解度以及酶解产物对α-淀粉酶抑制率为综合评价指标,考察了5种单酶及复合酶对核桃蛋白酶解效果的影响。
研究5种单酶在生产商提供的最适条件下,对核桃蛋白的水解度大小依次为:碱性蛋白酶>中性蛋白酶≈酸性蛋白酶>胃蛋白酶>胰蛋白酶,而酶解产物对α-淀粉酶抑制率大小依次为:酸性蛋白酶>中性蛋白酶>碱性蛋白酶>胃蛋白酶>胰蛋白酶,且结合核桃蛋白在pH 3.5~4.5溶解度很低,因此选用碱性蛋白酶和中性蛋白酶作为复合酶组分。
分别对碱性蛋白酶和中性蛋白酶进行正交试验,确定其最佳酶解条件。分别为,碱性蛋白酶:底物浓度为2 g/100 mL,酶解时间为4 h,酶解pH为9,酶用量为10 000 U/g;中性蛋白酶:底物浓度为2 g/100 mL,酶解时间为3 h,酶解pH为7,酶用量为8 000 U/g。
考察分步依次加酶和同时加酶对核桃蛋白酶解的影响,试验结果表明论以何种方式加酶,复合酶的水解效果都优于单酶,并且分步依次加入酶方式的水解度明显高于同时加入酶的方式,并且先加中性蛋白酶再加碱性蛋白酶的方式可使核桃蛋白水解度达到40%左右,同时还保证酶解产物对α-淀粉酶抑制率较大,达到85.9%。
本试验结论可为后续核桃多肽功能性开发利用提供参考依据,核桃作为优质植物蛋白、多肽营养重要来源之一,对其功能性的开发将有助于我国核桃资源的充分利用,将对我国开发新型功能性食品有深远意义。
[1]Tolhurst G,Heffron H,Lam Y S,et al.Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein–coupled receptor FFAR2[J].Diabetes,2012,61(2):364-371
[2]Bastien-Dionne P O,Valenti L,Kon N,et al.Glucagon-like peptide 1 inhibits the sirtuin deacetylase SirT1 to stimulate pancreatic βcell mass expansion[J].Diabetes,2011,60(12):3217-3222
[3]子淇.常食核桃营养健康[J].糖尿病新世界,2014(5):52-53
[4]张亚,苏品,廖晓兰,等.多肽的分离纯化技术研究进展[J].微生物学杂志,2013,33(5):87-91
[5]贾靖霖,蒲云峰,李虎,等.核桃多肽抗疲劳作用的研究[J].食品工业科技,2014,35(7):340-342
[6]杨子明,刘金磊,李典鹏,等.核桃多肽对D-半乳糖诱导老年小鼠血脂水平的影响[J].食品科学,2015,36(9):181-184
[7]Alu’datt M H,Ereifej K,Abu-Zaiton A,et al.Anti-oxidant,antidiabetic,and anti-hypertensive effects of extracted phenolics and hydrolyzedpeptidesfrombarley protein fractions[J].International Journal of Food Properties,2012(15):781-795
[8]胡鑫,刘成柏,林相友,等.酶解核桃仁制备低分子肽[J].吉林大学学报,2003,41(4):526-530
[9]孙琳琳.长白山核桃楸种仁蛋白功能性质及其酶解产物的抗氧化活性研究[D].吉林:吉林农业大学,2014:1-56
[10]贾靖霖,刘晓丽,唐璐璐,等.多酶协同水解核桃蛋白的研究[J].食品科技,2014,39(4):58-63
[11]中华人民共和国卫生部.GB 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010
[12]莫丽春,陈丽娟,吴月霖,等.四种天然产物对α-淀粉酶抑制作用研究[J].食品科技,2012,37(3):85-88
[13]李建杰,荣瑞芬.复合酶酶解制备核桃多肽工艺条件的优化[J].油料蛋白,2011,36(1):22-27
[14]Sze-Tao K W C,Sathe S K.Walnuts (Juglans regia L):proximate composition,protein solubility,protein amino acid composition and protein in vitro digestibility[J].Journal of the Science of Food and A-griculture,2000,80:1393-1401
Study on the Key Technology of Enzymatic Hydrolysis for Preparation of Walnut Peptides
LI Li1,2,LIU Yang1,2,ZHANG Shuai1,ZHOU Han-li1,2,WANG Ya-yun1,2,WU Na1,2,RUAN Jin-lan1,2,*
(1.Synergy Innovation Center of Biological Peptide Antidiabetics of Hubei Province,School of Life Science,Wuchang University of Technology,Wuhan 430223,Hubei,China;2.School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430073,Hubei,China)
Taking the walnut as raw material,degree of hydrolysis and the inhibition rate to α-amylase as index,the enzyme hydrolysis technology was studied about single-enzyme hydrolysis,multi-enzyme hydrolysis,sequence of adding enzyme and the best formula of multi-enzyme by orthogonal.The rank of hydrolysis rate of single-enzyme was:alkaline protease>neutral protease≈acidic protease>pepsin>trypsin,and inhibition rate of hydrolysates to α-amylase was in the order of:acid protease>neutral protease>alkaline protease>pepsin>trypsin.The effects of multi-enzyme hydrolysis by adding enzymes in turn were better than that at the same time. Considing all,the alkaline protease and neutral protease was added in turn,the hydrolysis rate of walnut protein could reach about 40%,and also keep a higher inhibition rate to α-amylase,which could up to 85.9%.
walnutpolypeptide;enzymatichydrolysis;α-amylase;walnut
10.3969/j.issn.1005-6521.2016.15.030
湖北省自然科学基金资助项目(2013CFB482);湖北省大学生创新训练项目(201312310012)
李丽(1992—),女(汉),硕士研究生,研究方向:生物多肽糖尿病药物研究。
阮金兰,教授,研究方向:天然药物药效物质基础研究。
2015-08-20

