慢病毒介导的FoxA1高表达对乳腺癌MCF-7细胞株增殖凋亡探究
郑 璐,汤 铜,钱 波,周连帮,万圣云,张 磊,史加宁,李 佳
慢病毒介导的FoxA1高表达对乳腺癌MCF-7细胞株增殖凋亡探究
郑璐,汤铜,钱波,周连帮,万圣云,张磊,史加宁,李佳
目的 利用慢病毒载体,构建乳腺癌MCF-7高表达FoxA1细胞株,并初步探究FoxA1对乳腺癌MCF-7细胞株增殖凋亡的影响。方法 将FoxA1基因重组构建慢病毒载体穿梭质粒EX-Z1010-LV201,经PCR和测序后在脂质体Lipofectamine2000介导下转染293T细胞包装慢病毒,嘌呤霉素筛选出稳定转染的细胞,Real-Time PCR法检测稳定转染MCF-7细胞株中FoxA1基因的表达水平,MTT及流式细胞术对比高表达FoxA1细胞株与对照细胞株增殖凋亡差异。结果 PCR扩增和测序结果证实成功构建FoxA1慢病毒载体并包装慢病毒,成功筛选出FoxA1高表达的乳腺癌MCF-7细胞系。MTT及流式细胞术结果显示:与对照组比较,上调FoxA1乳腺癌MCF-7细胞株增殖下降,凋亡率增加。结论成功构建了重组慢病毒载体,并筛选出稳定高表达FoxA1的MCF-7细胞株,FoxA1可能参与了乳腺癌MCF-7细胞株增殖凋亡调控,为下一步进行其机制探讨提供了依据。
FoxA1;慢病毒载体;MCF-7;增殖凋亡
网络出版时间:2016-5-9 15:43:10 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.028.html
根据美国癌症协会(ACS)估计,美国2014年确诊的乳腺浸润性癌约235 030例,新确诊的乳腺癌病例约62 980例,死于的患者约40 430例[1],另外约64 640例妇女在同年被诊断患有乳腺原位癌[2],乳腺癌已成为美国妇女最常见的恶性肿瘤,在过去的几十年乳腺癌的发病率逐年上升,而死亡率呈现下降趋势,这得益于对乳腺癌早期发现和更加有效的治疗。FoxA1(Forkhead box A1)属于Fox转录因子家族成员之一[3],又名肝核因子3(HNF-3α),因其是从肝脏中纯化而命名。已有报道[4-6]显示FoxA1在人体许多组织中如乳腺、前列腺、甲状腺、膀胱、食管、胰腺和肝等部位的组织普遍表达,在雌激素受体阳性的luminal型乳腺癌中FoxA1尤其有很高的表达,并且具有较好的分化和药物敏感性,有望成为分子分型及预后判断的一个标志物,提示了其在乳腺癌中的潜在的研究价值。慢病毒(Lentivirus)属于逆转录病毒科(Rerrovidae),这类病毒因含有逆转录酶,故称为逆转录病毒[7]。而慢病毒载体(Lentivirus vectors)与其他逆转录病毒载体相比,具有可携带目的基因片段大、目的基因表达时间长、可侵染分裂细胞及非分裂细胞、不易诱发宿主免疫排斥反应等优点。该研究拟用慢病毒载体介导,构建稳定过表达FoxA1的MCF-7乳腺癌细胞株,为研究该基因对ER(+)的乳腺癌细胞株作用奠定实验基础。
1 材料与方法
1.1仪器和试剂 生物安全柜(北京AIRTECH公司);荧光倒置显微镜(日本Nikon公司);CO2培养箱(德国Thermo公司);质粒抽提试剂盒、Rotorgene Real-Time PCR仪(美国Qiagen公司);GIS-2009凝胶成像仪(上海天能科技有限公司);乳腺癌MCF-7细胞株由中国科学技术大生命科学院朱涛教授惠赠;DMEM培养基+10%FBS、Trypsin-EDTA Solution(0.05%Trypsin-EDTA)(南京Corning公司);胎牛血清、胰酶和DMEM培养基(德国Gibco公司);嘌呤霉素(日本Sigma公司);6孔板(美国BD公司);293T细胞、Lipofectamine2000、RNAzol RT RNAIsolationReagent:GeneCopoeia(Cat.No. E01010A);First Strand cDNA Synthesis Kit:GeneCopoeia(Cat.No.C0210A);All-in-OneTMQ-PCR Mix:GeneCopoeia(Cat.No.AOPR-0200)Primer synthesis(美国Invitrogen公司);M-MLV逆转录酶和dNTP(美国PROMEGA公司);OligodT(上海生工公司);Marker(加拿大Fermentas公司);Age I酶(美国NEB公司);慢病毒表达载体穿梭质粒EX-Z1010-LV201、Lentivirus-病毒液:LP-Z1010-Lv202-C0010、LP-NEG-Lv202-0200(广州复能公司);Annexin VFITC Apoptosis Detection Kit凋亡检测试剂盒(美国Beckman公司)。
1.2细胞培养 乳腺癌MCF-7细胞株培养于DMEM培养液(另含有10%胎牛血清、100 μg/ml青霉素和100 mg/ml链霉素),于37℃、5%CO2培养箱培养。
1.3FoxA1表达载体的构建
1.3.1引物设计及合成 上游引物:5′-GCGGTAGGCGTGTACGGT-3′,下游引物:5′-CTGGAATAGCTCAGAGGC-3′。
1.3.2重组慢病毒载体质粒的构建 将含目的基因的表达质粒,利用PCR技术扩增,用NotⅠ酶切载体EX-Z1010-LV201,琼脂糖凝胶电泳进行分离纯化。然后将Afl II质粒载体酶切产物与rFoxA1的酶切产物分别琼脂糖凝胶电泳,回收试剂盒将电泳产物纯化。将上一步纯化后的2个产物4℃过夜进行连接,转化感受态细胞,采用PCR鉴定细菌阳性克隆,质粒测序送往广州复能公司。
1.4慢病毒包装及滴度测定 将12 μg EX-Z1010-LV201质粒与相应体积的Opti-MEM充分混合,再与相应体积的DNA-Lipofectamine 2000混合均匀,室温下温育20 min,将混合液均匀滴至含有293T细胞的培养皿中,于37℃、5%CO2培养箱中培养。培养约6~8 h后弃去混合液,加入含血清的完全培养基,于37℃、5%CO2培养箱内继续培养36~48 h。吸取上清液,4 000 r/min、4℃离心10 min,以0.45 μm滤器过上清液于40 ml超速离心管中。再次25 000 r/min、4℃离心20 min,冰PBS重悬病毒沉淀,4℃溶解后过夜。以15 μl每管分装病毒液,置于-80℃冰箱中长期保存。慢病毒液依次按10倍梯度稀释为6个浓度后,分别感染293T细胞,细胞培养于DMEM培养液,约3周左右弃去培养液,PBS反复漂洗后,结晶紫染色,倒置显微镜观察细胞克隆数目。
1.5病毒感染及稳转株的筛选 将MCF-7细胞计数后铺到6孔板中培养,各孔加入2 ml DMEM培养基(添加10%FBS、青霉素-链霉素双抗溶液),在5%CO2条件下,37℃培养24 h。铺板24 h后每孔加入LP-Z1010-Lv202-C0010 50 μl慢病毒,LP-NEGLv202-0200加入20 μl慢病毒到MCF-7细胞中,混匀后于37℃、5%CO2培养48 h。感染48 h后,观察慢病毒侵染结果,拍摄细胞荧光图片。用胰酶消化感染过的细胞并转移至6孔板(每块6孔板对应一种慢病毒,留出1孔用于阴性对照细胞),以含2 μg/ml嘌呤霉素的DMEM培养基(添加10%FBS、青霉素-链霉素双抗溶液)进行药筛培养。连续加药培养12 d(嘌呤霉素浓度2 μg/ml),待细胞长满后,收取样品进行后续检测。
1.6FoxA1高表达检测
1.6.1RNA抽提 先离心收集细胞,约(5~10)× 106细胞数加1 ml TRIzol反复吹打裂解细胞。每1 ml TRIzol中加入200 μl氯仿,盖上盖子,振荡混匀约15 s,室温静置2~5 min,然后12 000 r/min、4℃离心约15 min,轻柔取出离心管,小心吸取最上层上清液约450 μl(每1 ml TRIzol的吸取量)至事先预备好的一支含有600 μl冷冻异丙醇的新离心管中,上下颠倒混匀,-20℃静置至少30 min,12 000 r/ min、4℃离心10 min。弃上清液,加入500 μl冷冻的75%乙醇溶液,混匀后12 000 r/min、4℃离心5 min,弃去上清液,再次离心,吸弃上清液。将沉淀自然风干,加入约30~50 μl DEPC水溶解沉淀,贴上标签-80℃保存备用。
1.6.2反转录反应 解冻First Strand cDNA Synthesis Kit的试剂,混匀,应用逆转录试剂盒合成cDNA,反应条件如下:42℃、30 min,95℃变性5 min,4℃退火5 min。
1.6.3Real-Time PCR实验 两细胞株cDNA产物进行Real-Time PCR实验,反应条件如下:首先95℃、5 min,然后95℃变性30 s,60℃退火15 s,共循环40次,最后绘制熔解曲线,按照SYBR Green染料Rotor-gene 3000设置。实验结果按照2-ΔΔCt方法计算:目的基因拷贝数2-ΔΔCt=2-(ΔCt目的基因-ΔCt内参基因),每个基因同时设复孔3个,重复3次。
1.7MTT法检测FoxA1上调后MCF-7增殖水平改变 取对数生长期含目的基因稳转株LP-Z1010-Lv202-C0010和对照病毒稳转株LP-NEG-Lv202-0200,按5 000个/孔接种于96孔板,共接种5板,每组9孔,另取1孔为对照,于37℃、5%CO2培养箱中培养,分别取24、48、72、96、120 h各时间点1板,每孔各加入20 μl(5 mg/ml)MTT,继续培养4 h,终止培养,去除孔内上清液,每孔加入150 μl DMSO,震荡10 min,选择490 nm波长,在酶标仪上测定各孔光密度(optical density,OD)值,重复3次,取平均值。
1.8流式细胞术检测FoxA1上调后MCF-7凋亡水平改变 按50 000个/孔接种于6孔板,培养72 h后,按AnnexinV-FITC Apoptosis Detection Kit凋亡检测试剂盒步骤检测两组细胞株凋亡差异,分别记录含目的基因稳转株LP-Z1010-Lv202-C0010和对照病毒稳转株(LP-NEG-Lv202-0200),早期凋亡(An+ PI-)及晚期凋亡(An+PI+)细胞总百分率,重复3次,取平均值。
1.9 统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示,若服从正态分布资料,两组均数间的比较采用两组独立样本t检验,若为偏态分布资料,两组均数间的比较采用两独立样本非参数检验。
2 结果
2.1FoxA1质粒构建 rFoxA1扩增的条带处于1 000 bp与2 000 bp之间,大约为1 400 bp,与目的条带相符,见图1。

图1 目的基因rFoxA1 PCR扩增产物电泳M:Marker;1、2、3:rFoxA1的目的基因片段
2.1FoxA1过表达慢病毒构建 将FoxA1基因重组构建慢病毒载体穿梭质粒EX-Z1010-LV201,载体结构图及酶切质粒结果见图2、3。
2.2MCF-7细胞FoxA1高表达体系建立
2.2.1荧光倒置显微镜观察慢病毒转染 转染细胞株于荧光倒置显微镜观察细胞生长状态及转染效率,见细胞生长状态良好,转染后细胞荧光强度高,见图4。
2.2.2Real-Time PCR法检测对照及稳转株表达采用Real-Time PCR法检测对照及稳转株内参基因GAPDH及基因FoxA1 mRNA水平表达情况,分别绘制扩增曲线及熔解曲线,见图5。
2.2.3FoxA1表达量分析结果 针对载体pEZLv202设计特异性引物进行反转录,目的稳转株LPZ1010-Lv202中FoxA1的表达量为对照稳转株LPNEG-Lv202的46.19倍,见表1。

图2 慢病毒EX-Z1010-Lv202载体

表1 Real-Time PCR法检测对照及稳转株表达结果
2.3FoxA1表达量上调后MCF-7增殖水平改变MTT结果显示,第2天(t=20.280,P<0.01)、第3天(t=9.473,P<0.01)、第4天(t=12.742,P<0.01)、第5天(t=8.892,P<0.01)FoxA1过表达细胞株增殖水平均较对照细胞株下降,可见FoxA1高表达可下调MCF-7细胞株增殖水平(t=4.472,P<0.01),见图6。
2.4FoxA1表达量上调后MCF-7凋亡水平改变

图3 酶切鉴定的电泳结果Lane M:100(A)、6 000(B)、15 000(C)bp DNA Ladder;1:慢病毒EX-Z1010-lv202;2:慢病毒EX-Z1010-lv202NotI酶切结果,共有3条预期酶切条带(7 872、1 036、1 171 bp);3:EX-Z1010-lv202 Afl II酶切结果,共有2条预期酶切条带(2 960、7 119 bp)
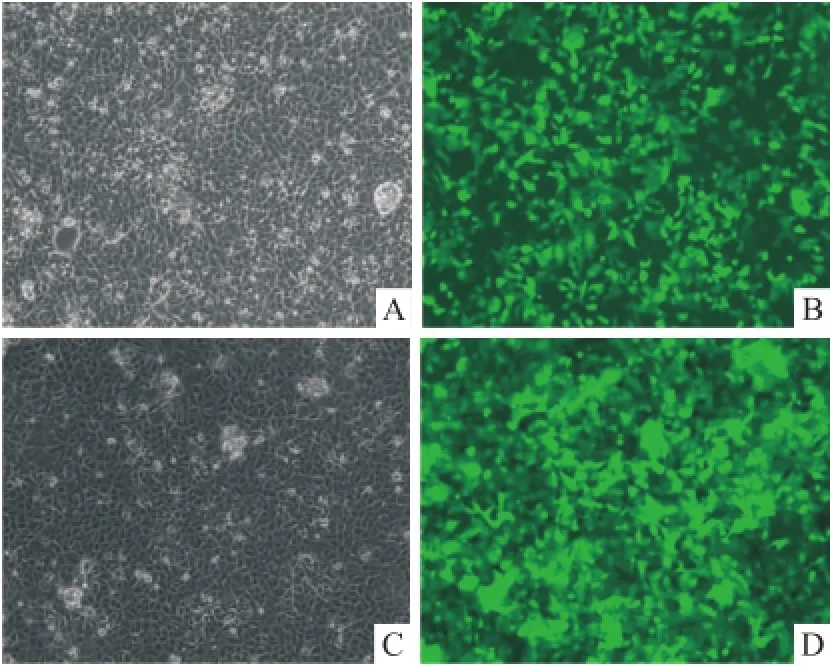
图4 稳转株细胞及荧光照片 ×100A:细胞照片;B:含目的基因稳转株(LP-Z1010-Lv202-C0010)荧光照片;C:细胞照片;D:对照病毒稳转株(LP-NEG-Lv202-0200)荧光照片

图5 Real-Time PCR法检测内参基因GAPDH及目的基因FoxA1A:GAPDH基因扩增曲线;B:GAPDH基因扩增后熔解曲线;C:FoxA1基因扩增曲线;D:FoxA1基因扩增后熔解曲线
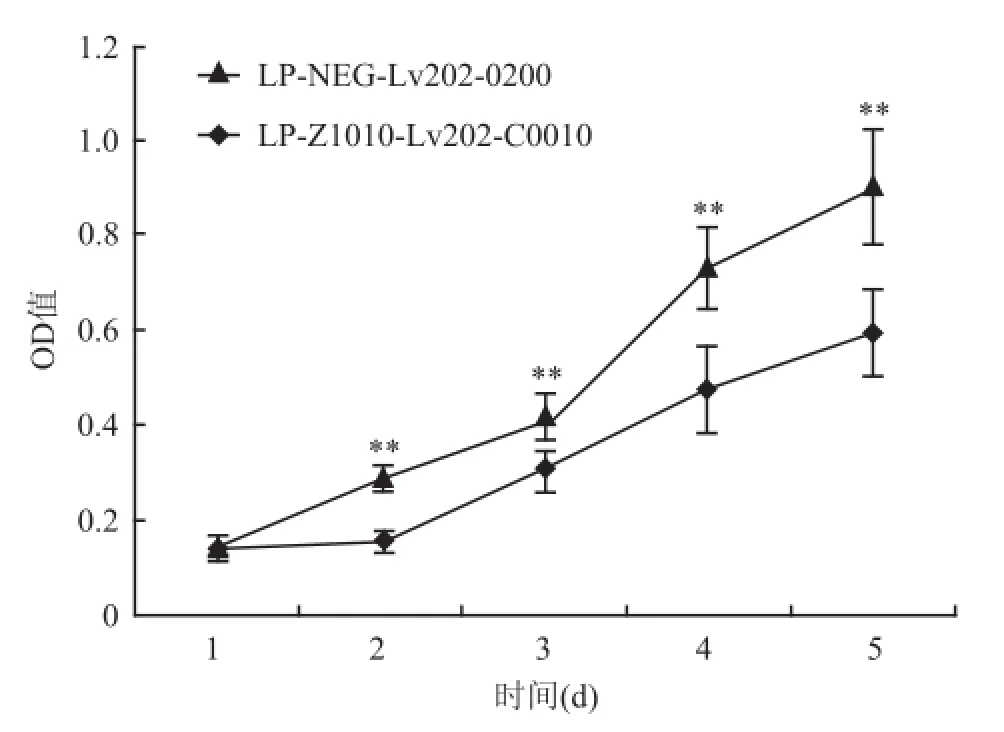
图6 MTT法比较两细胞株增殖差异(n=3,±s)与LP-Z1010-Lv202-C0010比较:**P<0.01
根据流式细胞术检测LP-Z1010-Lv202-C0010及LP-NEG-Lv202-0200凋亡率分别为(5.10± 0.37)%,(3.50±0.26)%,较对照细胞株,FoxA1高表达可上调MCF-7细胞株凋亡率(Z=-2.309,P= 0.021),见图7。

图7 流式细胞术检测两细胞株凋亡(n=3,±s)A:LP-Z1010-Lv202-C0010;B:LP-NEG-Lv202-0200
3 讨论
Fox家族基因又称叉头基因自1989年最早在果蝇中被发现,各种不同的种属逐渐被人们认识,目前根据其结合区域的相似性,在不同种属中已发现100多个Fox家族成员,包括FoxA-FoxS,分属于17个不同亚族。其家族的特征性结构称为叉头盒(Fork-head box),其特征结构的DNA结合区域为具有进化保守性的110个氨基酸组成。该特征结构位于蛋白质的核心区域,由3个α螺旋和2个翼状的环形结构组成,外观形似蝴蝶,故又称为带翼的螺旋区域(DBD)。FoxA家族包括FoxA1-Fox3 3个亚群,因其最早从小鼠肝细胞中被发现,故又名肝核心因子(HNF)。以FoxA1为代表,在人类染色体上,FoxA1定位于14q21.1,其核心区域位于N-端,又称叉头区域或翼状螺旋域(WHD)结构(H1-S1-H2-H3-S2-L1-S3-L2),包括3个β-折叠S,α-螺旋H和2个循环形成的螺旋般的翅膀[8]。
FoxA与DNA的结合区域类似于组蛋白H结构,C-端能够与组蛋白H3、H4作用,FoxA通过与染色质相关作用,可以替代组蛋白H1功能,使染色质结构松散,同时还参与了组蛋白H3第4个赖氨酸的单二甲基化和DNA去甲基化过程[9]。这些特征结构使FoxA能够与染色质紧密结合,并且即使在缺乏其他染色质修饰酶情况下,也能够松解核小体。FoxA还可以提高染色质对其它转录因子的募集能力,同时通过招募其它转录因子并联合ATP酶,进一步使染色质结构松解,因此,FoxA被誉为“先锋因子”[10]。
国内对FoxA1研究的文献较少,研究[11-12]报道:转录因子FoxA1在人体多种组织中,如:甲状腺、肺、白血病、乳腺、肝、膀胱、胰和前列腺等中均可检测到其表达,并可以和大约一百多个启动子结合,共同调节细胞信号及细胞周期。研究[13]显示FoxA1在肺癌、白血病、分化型甲状腺癌、乳腺癌、胰腺癌和转移性前列腺癌组织中高表达。研究[14]证实乳腺癌细胞中,FoxA1可以与多个雌激素受体结合位点相关作用,其与雌激素受体共同对下游靶基因的转录进行调控。乳腺癌细胞株普遍高表达FoxA1,ER阳性乳腺癌患者高表达FoxA1,往往预示较好的预后。最新的报道[15]显示,FoxA1同样能够与甲基化相关的增强子结合,解开其致密结构,促进多种基因的表达上调。FoxA1是否参与调控全基因组甲基化信号传导通路,能否通过改变FoxA1表达来调控肿瘤相关基因的甲基化状态,进而干扰相关癌基因及抑癌基因的表达是本课题组研究的方向。
[1] Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] Desantis C,Ma J,Bryan L,et al.Breast cancer statistics,2013[J].CA Cancer J Clin,2014,64(1):52-62.
[3] Katoh M,Igarashi M,Fukuda H,et al.Cancer genetics and genomics of human FOX family genes[J].Cancer Lett,2013,328(2):198-206.
[4] 郑 璐,汤 铜,钱 波.FoxA家族在肿瘤发生发展中的作用研究进展[J].癌症进展,2014,12(1):40-3.
[5] Zheng L,Qian B,Tian D,et al.FOXA1 positively regulated gene expression by changing gene methylation status in human breast cancer MCF-7 cells[J].Int J Clin Exp Pathol,2015,8(1):96-106.
[6] Nakshatri H,Badve S.FOXA1 in breast cancer[J].Expert Rev Mol Med,2009,11:e8.
[7] Nagano M,Shinohara T,Avarbock M R,et al.Retrovirus-mediated gene delivery into male germ line stem cells[J].FEBS Lett,2000,475(1):7-10.
[8] Lalmansingh A S,Karmakar S,Jin Y,et al.Multiple modes of chromatin remodeling by Forkhead box proteins[J].Biochim Biophys Acta,2012,18(19):707-15.
[9] Katoh M,Igarashi M,Fukuda H,et al.Cancer genetics and genomics of human FOX family genes[J].Cancer Lett,2013,17(9):198-206.
[10]Sekiya T,Muthurajan U M,Luger K,et al.Nucleosome-binding affinity as a primary determinant of the nuclear mobility of the pioneer transcription factor FoxA[J].Genes Dev,2009,23(7):804-9.
[11]Lin L,Miller C T,Contreras J I,et al.The hepatocyte nuclear factor 3 alphagene,HNF3alpha(FOXA1),on chromosome band 14q13 is amplified and overexpressed in esophageal and lung adenocarcinomas[J].Cancer Res,2002,62(18):5273-9.
[12]Wolf I,Bose S,Williamson E A,et al.FOXA1:Growth inhibitor and a favorable prognostic factor in human breast cancer[J].Int J Cancer,2007,120(5):1013-22.
[13]Robbins C M,Tembe W A,Baker A,et al.Copy number and targeted mutational analysis reveals novel so-matic events in metastatic prostate tumors[J].Genome Res,2011,21(1):47-55.
[14]Belikov S,Oberg C,Jaaskelainen T,et al.FoxA1 corrupts the antiandrogenic effect of bicalutamide but only weakly attenuates the effect of MDV3100[J].Mol Cell Endocrinol,2013,365(1):95 -107.
[15]Sérandour A A,Avner S,Percevault F,et al.Epigenetic switch involved in activation of pioneer factor FOXA1-dependent enhancers[J].Genome Res,2011,21(4):555-65.
Overexpression of FoxA1 by an adenoviral vector and its effects on cell cycle and apoptosis in MCF-7 human breast cancer cells
Zheng Lu,Tang Tong,Qian Bo,et al
(Dept of General Surgery,The Second Affiliated Hospital of Anhui Medical University,Hefei 230601)
Objective To investigate the effects of FoxA1 overexpression on proliferation and apoptosis of human breast cancer cell line MCF-7 by constructing high-level expression vetor FoxA1 for MCF-7 cell line.Methods FoxA1 gene was amplified by PCR to construct the recombinant shuttle plasmid EX-Z1010-LV201.After DNA sequence analysis,the recombinant lentiviral package plasmid was transfected into 293T cells by Lipofectamine 2000 to construct packed lentivirus.Stable transfected cell lines were selected out by puromycin.The FoxA1 protein expression level of stable MCF-7 cell line was detected by real-time PCR method.Differences of cell proliferation and cell apoptosis between FoxA1 overexpressed cell line and empty vector cell lines were determined by MTT assay and FCM.Results The recombinant FoxA1 lentiviral vectors and packed lentivirus were confirmed by PCR and DNA sequencing,and MCF-7 cell lines transfected by packed lentivirus which stably overexpress FoxA1 were successfully selected.MTT and FCM results presented a significant decrease of cell proliferation in human breast cancer MCF-7 cell lines with up-regulated FoxA1.Conversely,more obvious apoptosis was presented in MCF-7 cell lines with up-regulated FoxA1 than the control group.Conclusion FoxA1 is successfully selected and MCF-7 cell lines are transfected by packed lentivirus which are stably overexpressed.FoxA1 is involved in some important intracellular process of breast cancer cell line MCF-7,such as cell proliferation and apoptosis.This research provides a valid evidence for further investigation on its mechanism.
FoxA1;lentiviral vector;MCF-7 cell line;cell proliferation and apoptosis
R 346
A
1000-1492(2016)06-0822-06
2016-03-04接收
安徽省自然科学基金(编号:1308085QH152)
安徽医科大学第二附属医院普外科,合肥 230601
郑 璐,女,硕士,医师;汤 铜,男,主任医师,硕士生导师,责任作者,E-mail:tt20164@126.com

