变性高效液相色谱技术鉴别猪牛源性成分的试验
杨 娜,王向军,乔 晴,徐 超
(河南出入境检验检疫局检验检疫技术中心,河南郑州450003)
变性高效液相色谱技术鉴别猪牛源性成分的试验
杨娜,王向军,乔晴,徐超
(河南出入境检验检疫局检验检疫技术中心,河南郑州450003)
建立了检测动物源性食品中猪、牛成分的PCR结合变性高效液相色谱技术,为牛、羊成分的鉴别提供一种新的分子诊断技术.以猪、牛的线粒体DNA为靶基因,设计特异性PCR引物.双重PCR扩增后,DHPLC分析.经优化DHPLC最佳条件为:使用PS-DVB&C18 DNASep色谱柱(4.6 mmX50 mm,粒度3 μm),设定50℃柱温,起始流动相为: 45%缓冲液A和55%缓冲液B,流速0.9 mL/min;上样量:PCR产物5 μL.结果表明:DHPLC法具有良好的特异性,仅能检出猪、牛源成分,而与羊、鸡、鸭源成分无交叉反应;方法的灵敏度可以达到1 000 copies核酸.
变性高效液相色谱法;猪源性成分;牛源性成分;鉴定
我国已经成为世界第一位的动物源性食品生产大国,在猪、牛源性食品生产的总量和增长幅度方面保持着全球第一.但受经济利益驱动,我国动物源性食品掺假的手段和花样在不断地翻新,甚至规模化肉制品掺假的现象也越来越严重.因此,基于食品安全、宗教原因和营养成分的考虑,有必要对动物源性成分来源鉴别和追溯研究,开发一种安全、快速、自动化、高通量的检测技术确有必要.
高效变性液相色谱技术(Denaturing high per⁃formance liquid chromatograph,DHPLC)是近年来发现起来的一种快速核酸分析方法[1].通过增加流动相中具有亲水性的乙腈浓度,逐渐造成DNA和TEAA的脱离,核酸片段就会按分子量大小洗脱而分离.用DHPLC可以区分不同长度DNA片段的特点,国内外已经应用DHPLC进行病原的分型鉴别[2],遗传疾病的突变分析、食品微生物的检测等.本文采用PCR扩增结合非变性DHPLC分析模式,研究建立了食品中猪牛源成分的快速、自动化鉴别方法.
1 材料与方法
1.1材料和设备无污染的猪肉、牛肉、羊肉、鸭肉和鸡肉,由河南出入境检验检疫局检验检疫技术中心鉴定保存;2XTaq-PCR Master Mix,琼脂糖,100bp DNA ladder,购自天根生化科技(北京)有限公司;三乙胺乙酰盐(TEAA),购自美国WAVE公司;DNA Isolation Reagent for Meat and Meat Prod⁃ucts,购自宝生物工程(大连)有限公司;乙腈HPLC级别.
G:BOX-HREM全自动凝胶成像分析系统,购自美国SYNGENE公司;LabCycler Standard Plus梯度PCR仪,购自德国Senso公司;Wave4500变性高效液相色谱仪,购自美国环球基因公司;BioSpecnano紫外可见分光光度计,购自日本岛津公司.
1.2方法
1.2.1引物的设计和合成在NCBI上查找猪、牛线粒体DNA基因序列,比对分析后设计引物如下:猪源性成分:上游引物5′-GCCTAAATCTCCCCTCAATGCTA-3′,下游引物5′-ATGAAAGAGGCAAATAGATTTTCG-3′;牛源性成分的引物:上游引物5′-GCCATATACTCTCCTTGGTGACA-3′,下游引物5′-GTAGGCTTGGGAATAGTACGA-3′.引物均由宝生物工程(大连)有限公司合成.
1.2.2动物源成分DNA的提取分别称取50 mg的猪肉、牛肉、羊肉、鸭肉和鸡肉于1.5 mL的离心管中,参照TaKaRa DNA Isolation Reagent for Meat and Meat Products说明书操作,50 μL纯水溶解DNA后,-20℃保存备用.
1.2.3PCR反应体系和重组质粒构建以提取的猪肉、牛肉、羊肉、鸭肉和鸡肉的DNA为模板,PCR扩增.反应体系体积50 μL:2XTaq-PCR Mas⁃ter Mix 25 μL、引物各1 μL、模版DNA 5 μL、灭菌超纯水18 μL.反应条件:95℃预变性5 min,95℃变性1 min、56℃退火40sec、72℃延伸40sec,共30个循环.将阳性扩增产物送宝生物工程(大连)有限公司克隆测序.
1.2.4DHPLC分析条件使用PS-DVB&C18 DN⁃ASep色谱柱(4.6 mmX50 mm,粒度3 μm),柱温为50℃;起始流动相为:45%缓冲液A(0.1 mol/L TEAA pH值7.0),55%缓冲液B(0.1 mol/L TEAA,25%乙腈pH值7.0);终止流动相为:38.8%的缓冲液A,61.2%缓冲液B;流速:0.9 mL/min;上样量:PCR产物5 μL.
1.2.5DHPLC特异性试验分别提取猪肉、牛肉、羊肉、鸭肉和鸡肉的基因组,进行PCR扩增后,DHPLC仪检测分析结果.
1.2.6DHPLC灵敏度试验分别PCR扩增猪源和牛源成分,克隆构建猪源和牛源成分的重组质粒.等比例混合阳性重组体后,10倍比稀释为106,105,104,103,102,10和1个copies核酸.参照1.2.4DHPLC分析条件检测,研究方法的敏感性.
1.2.7实际样品检测对超市和农贸市场购买的27份食品样品平行进行DHPLC和商品化定量PCR方法检测.
2 结果
2.1PCR扩增和克隆结果以提取的猪肉、牛肉、鸭肉、鸡肉和羊肉的DNA为模板,扩增出牛肉和羊肉成的目的片段,而猪肉、鸭肉和鸡肉的PCR扩增结果为阴性(图1).克隆猪、牛成分的序列在NCBI上的比对结果表明获得特定的目的片段.
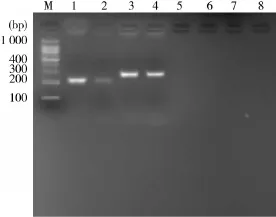
图1 动物源性成分的PCR扩增结果
2.2DHPLC的特异性试验结果PCR扩增,DH⁃PLC分析后发现,5.1 min出现猪源成分,6.4 min出现牛源成分的特征性吸收图谱.而羊肉、鸡肉、鸭肉为阴性结果.见图2.
2.3敏感性实验结果对稀释为106,105,104,103,102,10和1 copies的重组质粒,进行PCR-DHPLC检测.1 000个copies的质粒可以扩增出阳性结果,而 100 copies的质粒未能扩增出结果(图3).
2.4实际样品检测结果对27动物源性食品的检测结果表明,DHPLC方法和定量PCR方法的结果一致,两者的符合率为100%.
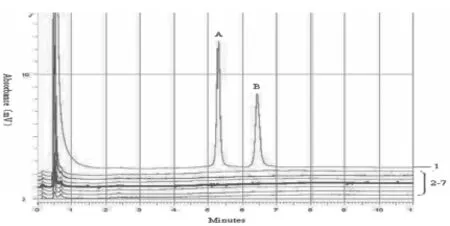
图2 DHPLC检测的特异性实验结果
3 讨论
对动物源性成分检测技术通常建立在对样品的物理形态特性、抗原抗体反应、有鉴别意义的基因组序列、标志性蛋白质或多肽的基础上,涉及的技术包括:显微镜观察[3]、ELISA方法[4-5]、定量或常规PCR法[6-9]、双向电泳[10]、质谱技术[11-13]等.显微镜观察是被欧盟(EU)认可的检测动物源性成分的官方方法,但需要显微镜分析师达到较高的专业水平,所测结果与试验员的经验相关性很大,具有一定的主观性.ELISA等免疫学分析方法主要检查新鲜肉制品,一般不能用于热加工处理的食品.双向电泳、质谱技术等方法在实际应用中较少,因为无论是二维电泳还是质谱等都对仪器、试剂和样品处理具有较高要求,而且该类方法在分析混合成分时难度较大.基于核酸的分析技术,充分利用DNA分子除了具有种内保守性高,种间特异性强的优点外还具有较高的热稳定性,而且其核苷酸序列不会受到环境和加工条件影响而改变优点,广泛应用于动物源成分的鉴定.但常规PCR需要进行对人体有害的核酸电泳.本实验以猪牛的线粒体DNA为靶基因设计引物进行PCR扩增,结合DHPLC的方法进行肉质成分的鉴定.所得的DHPLC的最佳条件为:使用PS-DVB&C18 DNASep色谱柱(4.6 mmX50 mm,粒度3 μm),柱温为50℃;猪源成分和牛源成分的DHPLC保留时间分别为5.1 min和6.4 min,灵敏度达到1 000 copies核酸.DHPLC方法自动化程度高,设计程序后可无人值守,特别适用于高通量、快速筛选检测的需要.该方法的建立提供了一种新的检测动物源性食品中猪牛源成分的分子诊断技术.
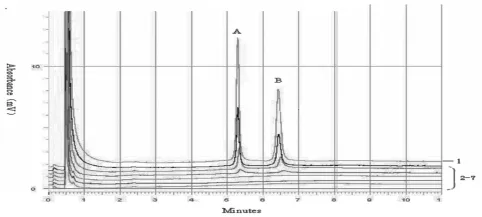
图3 DHPLC的敏感性检测结果
[1]Xiao W,Oefner P.Denaturing High-Performance Liquid Chroma⁃tography:A Review[J].Human mutation,2001,17(6):439-474.
[2]Franciosa G,Pourshaban M,De Luca A,et al.Identification of Type a,B,E,and F Botulinum Neurotoxin Genes and of Botuli⁃num Neurotoxigenic Clostridia by Denaturing High-Performance Liquid Chromatography[J].Applied and environmental microbiolo⁃gy,2004,70(7):4170.
[3]陈颖,吴亚君,徐宝梁,等.进出口动物源性产品中牛羊成分的检测方法[J].食品工业科技,2004(08):144-146.
[4]骆训国,栗绍文,周蕾蕾,等.夹心elisa方法检测生肉混合物中的猪肉成分的研究[J].动物医学进展,2010(S1):20-22.
[5]Chen F C,Hsieh Y H,Bridgman R.Monoclonal Antibody-Based Sandwich Enzyme-Linked Immunosorbent Assay for Sensitive De⁃tection of Prohibited Ruminant Proteins in Feedstuffs[J].J Food Prot,2004,67(3):544-549.
[6]毕宇涵,闫冰,赵凤,等.双重pcr检测食品中的动物源性成分[J].食品工业科技,2009(03):315-318.
[7]Luo J Q,Wang J Q,Bu D P,et al.Development and Application of a Pcr Approach for Detection of Bovis,Sheep,Pig,and Chick⁃en Derived Materials in Feedstuff[J].Agricultural Sciences in Chi⁃na,2008,7(10):1260-1266.
[8]Pegels N,González I,Martín I,et al.Applicability Assessment of a Real-Time Pcr Assay for the Specific Detection of Bovine,Ovine and Caprine Material in Feedstuffs[J].Food Control,2011,22(8):1189-1196.
[9]Zhang C L,Fowler M.R,Scott NW,et al.A Taqman Real-Time Pcr System for the Identification and Quantification of Bovine DNA in Meats,Milks and Cheeses[J].Food Control,2007,18 (9):1149-1158.
[10]Vallejo-Cordoba B,Rodríguez-Ramírez R,González-Córdova F. Capillary Electrophoresis for Bovine and Ostrich Meat Characteri⁃sation[J].Food Chemistry,2010,120(1):304-307.
[11]Sentandreu M A,Fraser P-D,Halket J,et al.A Proteomic-Based Approach for Detection of Chicken in Meat Mixes[J].J Pro⁃teome Res,2010,9(7):3374-3383.
[12]Sentandreu M A,Sentandreu E.Peptide Biomarkers as a Way to Determine Meat Authenticity[J].Meat Science,2011,89(3): 280-285.
[13]Zhang G,Liu T,Wang Q,et al.Mass Spectrometric Detection of Marker Peptides in Tryptic Digests of Gelatin:A New Method to Differentiate between Bovine and Porcine Gelatin[J].Food Hydro⁃colloids,2009,23(7):2001-2007.
S852.65+1
B
0529-6005(2016)06-0089-03
2015-04-02
杨娜(1979-),女,硕士,主要从事肉制品掺假鉴别检测技术研究,E-mail:tulliper_yang@hotmail.com
徐超,E-mail:xuc06@163.com

