过量表达枯草芽孢杆菌乙偶姻还原酶提高2,3-丁二醇产量
李秀鹏,杨套伟,徐美娟,张显,饶志明(江南大学生物工程学院,江苏无锡)
过量表达枯草芽孢杆菌乙偶姻还原酶提高2,3-丁二醇产量
李秀鹏1,杨套伟2,徐美娟3,张显4,饶志明*
(江南大学生物工程学院,江苏无锡214122)
枯草芽孢杆菌Bacillus subtilis 168是一株安全生产的菌株,但是在2,3-丁二醇(2,3-BD)的发酵过程中,会积累较多的副产物乙偶姻(AC)。乙偶姻还原酶是催化AC合成2,3-BD的关键酶。为了提高2,3-BD合成效率,首先将乙偶姻还原酶基因acr克隆到B.subtilis 168,构建了重组菌B.subtilis 168/pMA5-acr。对重组菌进行摇瓶发酵实验,结果表明,相比出发菌,重组菌的2,3-BD产量和转化率分别提高28.62%和22.87%,主要副产物AC积累量下降了20.01%。同时,分支路径的副产物甲酸、乙酸、乳酸、琥珀酸,也有不同程度的降低。
乙偶姻还原酶;2,3-丁二醇;乙偶姻;枯草芽孢杆菌
2,3-丁二醇(2,3-Butanediol,2,3-BD),化学式是CH3CHOHCHOHCH3,其结构存在3种立体异构体[1],分别为L-(+)-、D-(-)-和meso-构型。作为一种重要的化工原料和液体燃料,2,3-BD被广泛应用于化工、能源、食品及航空航天等多个领域[2]。随着经济社会的蓬勃发展和石油等不可再生资源的日益枯竭,2,3-BD逐渐受到世界的关注。由于2,3-BD结构特殊[3],利用化石原料生产2,3-BD成本高、条件苛刻、过程繁琐,容易对环境造成污染,并且化石原料日益枯竭,因此化学合成法工业化生产较为困难。微生物转化法是利用可再生资源生产2,3-BD,既克服了化学法生产的原料问题,又符合绿色化工的要求,因此受到了人们越来越多的关注。通过代谢工程、合成生物学及其集成的方法改造微生物[4],同时,通过优化发酵条件与分离纯化工艺来降低环境污染与生产成本,对我国低碳经济和循环经济的建设,具有重要的促进作用和潜在的经济效益[5]。早在1906年,Harden和Walpole[6]就研究了利用肺炎克雷伯氏菌(Klebsiella pneμmoniae)发酵生产2,3-BD;1926年,Donker[7]提出了用多粘芽孢杆菌(Bacillus polymyxa)发酵生产2,3-BD;1933年,Fulmer等[8]提高了产酸克雷伯氏菌(Klebsiella oxytoca)生物合成2,3-BD的水平,并指出了其工业化生产的潜力。2,3-BD高产菌株主要是克雷伯氏菌、产气肠杆菌和粘质沙雷氏菌[3,9-10]。然而,这些菌株都具有潜在致病性,不符合工业化安全生产的要求。
作者所在实验室保藏的枯草芽孢杆菌Bacillus subtilis 168是一株安全生产2,3-BD的菌株,其代谢产生的2,3-BD主要以D-(-)-和meso-两种构型存在[1]。枯草芽孢杆菌的2,3-BD合成途径[1,11]如图1所示,以糖类为底物经丙酮酸、α-乙酰乳酸、乙偶姻(Acctoin,AC)并最终转化为2,3-BD,此步反应需要NADH的参与[5,9],同时伴随着有机酸的合成[12]。乙偶姻还原酶(Acctoin,reductase,ACR)作为一种双功能酶可催化AC和2,3-BD之间的相互转化[12]:在弱酸性的条件下,该酶以催化AC向2,3-BD转化为主,过程中消耗NADH;弱碱性时,该酶则主要催化2,3-BD向AC逆向转化,该过程生成NADH[13-14]。因此,有机酸副产物如甲酸、乙酸、乳酸、琥珀酸的合成会与2,3-BD合成途径竞争碳源;另外,乳酸和琥珀酸的合成还会消耗NADH[1,11],这可能会影响AC 向2,3-BD转化的程度,从而造成AC的大量积累。
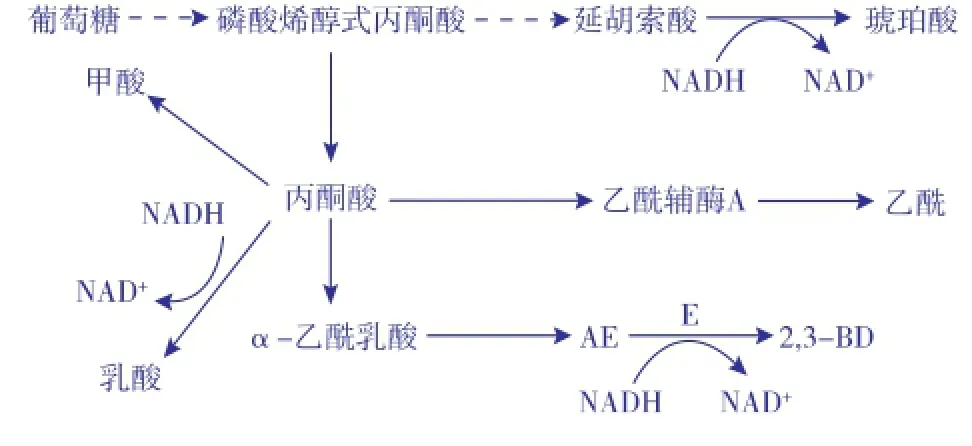
图12 ,3-丁二醇代谢路径Fig.1 Metabolic pathway of 2,3-BD.E;acetoin reductase
以B.subtilis 168作为出发菌,克隆乙偶姻还原酶基因acr,构建重组枯草芽孢杆菌B.subtilis 168/ pMA5-acr,并对其在弱酸性的条件下进行发酵试验,研究过量表达ACR对发酵过程中2,3-BD积累的影响,希望能达到2,3-BD提高、AC和相关有机酸减少的目标,为工业化应用打下基础。
1 材料与方法
1.1菌种与质粒
Bacillus subtilis 168由作者所在实验室保藏,表达载体pMA5亦由作者所在实验室保藏。
1.2主要试剂与培养基
工具酶,购自TaKaRa公司;质粒小量抽提试剂盒、胶回收试剂盒、抗生素、咪唑,购自上海Sangon公司;丙烯酰胺、甲叉双丙烯酰胺,购自Ferments公司;NADH,NAD+,购自Sigma Aldrich公司;PCR引物,由上海Sangon公司合成;其他试剂均为国产试剂。
活化培养基(g/L):蛋白胨10,酵母粉5,氯化钠10;自然pH值。
种子培养基(g/L):葡萄糖80,蛋白胨10,酵母粉5,氯化钠10;自然pH值。
发酵培养基(g/L):葡萄糖140,酵母膏5,KH2PO46,K2HPO4·3H2O 14,尿素5,玉米浆20,柠檬酸钠8;pH 6.5。
1.3主要试剂配制
A液(50 mmol/L磷酸氢二钠溶液):7.08 g Na2HPO4,加去离子水定容至1 L。
B液(50 mmol/L磷酸二氢钠溶液):5.99 g NaH2PO4,加去离子水定容至1 L。
磷酸钠缓冲液(pH 6.5):将A液和B液按照31.5∶68.5的体积比混匀。
PBS缓冲液(pH 7.0):NaCl 8.0 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.626 g/L,用浓盐酸调至pH 7.0。
1.4乙偶姻还原酶基因acr克隆及表达载体构建
根据NCBI中枯草芽孢杆菌全基因组核酸序列acr的基因序列设计一对引物,见表1,并在引物5′端分别加上BamH I和Mlu I酶切位点(下划线)。

表1 文中所涉及的引物Table 1 Primers used in the study
提取B.subtilis 168的基因组作为模板,以Forawrd/Reverse引物进行PCR扩增,获得目的基因片段acr。PCR总反应体系为50 μL,包含1 ng的质粒模板,200 μmol/L dNTP,20 μmol/L引物和1 μL 的ExTaq DNA聚合酶。程序设定为95℃预变性5 min;循环扩增程序为95℃变性50 s,56℃退火90 s,72℃延伸90 s(根据实际情况,时间设定为1 kb/min),35个循环;72℃延伸10 min。PCR反应产物用0.8 g/dL的琼脂糖凝胶电泳分离,目的条带经分离后,用胶回收试剂盒(Takara)回收,回收的基因片段与pMD18-T连接,转化E.coli JM109,经过氨苄青霉素抗性平板筛选,挑取阳性转化子。提取质粒酶切验证,重组质粒命名为T-acr,DNA测序由上海生工生物工程有限公司完成。经测序验证正确的重组质粒T-acr,用BamH I和Mlu I双酶切后连接到经过相同酶切的pMA5上,构建表达载体pMA5-acr。
1.5ACR在枯草芽孢杆菌中的表达
将构建好的表达载体pMA5-acr转化至B. subtilis 168中,在卡那霉素抗性平板上筛选阳性重组子并进行酶切验证。将验证正确的重组菌B. subtilis 168/pMA5-acr,接种至含有50 μg/mL卡那霉素的LB液体培养基37℃过夜培养,次日以体积分数1%的接种量转接至50 mL LB液体培养基37℃培养24 h。发酵的菌液8 000 r/min离心10 min,用pH 7.0的PBS缓冲液洗涤细胞3次,然后离心后的细胞重悬浮于pH 7.0的PBS缓冲液中,用超声波破碎仪破碎细胞,10 000 r/min离心30 min沉淀细胞碎片,上清液即为粗酶液,置于-4℃保存,后续用于蛋白质纯化、SDS-PAGE实验和ACR的酶活测定。
1.6酶的Ni-TNA纯化
超声破碎制得粗酶液后,经0.45 μm滤膜过滤,采用Ni-NTA蛋白纯化柱来纯化目的蛋白质,经过两次上样,蛋白质末端的6个His与Ni-NTA的金属离子螯合。洗脱过程,首先用不含有咪唑的缓冲液洗柱,洗脱掉未与Ni-NTA结合的细胞体杂蛋白质,然后用不同浓度的咪唑(20~300 mmol/L)缓冲液进行梯度洗脱,在一定的咪唑浓度条件下,可以得到较纯的酶液。
1.7重组蛋白质表达情况分析
利用SDS-PAGE分析重组菌的全细胞蛋白质[15],用5 g/dL的浓缩胶及12~15 g/dL分离胶的不连续垂直平板电泳进行蛋白质分离,考马斯亮兰R-250染色;总蛋白质浓度采用Brandford方法,以牛血清蛋白质(BSA)作为标准蛋白质[16]。
1.8ACR酶活力的测定
将20 μL粗酶液加入到酶活力测定缓冲体系,立即检测340 nm处吸光值在3 min内的变化。
乙偶姻还原酶活力测定缓冲体系:0.05 mol/L AC,5 mmol/L NAD+,磷酸钠缓冲液pH 6.5。
总酶活力(U/mL)定义:每毫升粗酶液OD600 nm每分钟消耗1 μmol/L NADH的酶量。
比酶活(U/g)定义:总酶活(U/mL)和粗酶液蛋白质质量浓度(g/mL)的相除值。
1.9摇瓶发酵产2,3-BD实验
重组枯草芽孢杆菌B.subtilis 168/pMA5-acr和出发菌株B.subtilis 168经过LB液体培养基活化后,按体积分数1%的接种量转接至10 mL种子培养基,37℃培养12 h后按照体积分数4%的接种量转接至50 mL发酵培养基于37℃培养,发酵过程跟踪监测菌体浓度、葡萄糖含量、相关有机酸含量、AC产量和2,3-BD产量。
1.10发酵参数分析方法
1)AC和2,3-BD含量测定:采用毛细管气相色谱法检测,仪器型号GC1600(JieDao TECH),色谱柱规格为柱长30 m,内径0.32 mm,液膜厚度0.50 μm;检测条件为柱箱温度160℃,进样器和检测器温度250℃,进样量0.2 μL,采用FID检测器。
2)葡萄糖含量测定:采用SBA生物传感器测定,发酵液经适当稀释后,取25 μL直接进样到生物传感器中,根据葡萄糖标准样品浓度、仪器读数及发酵液稀释倍数计算发酵液中葡萄糖的含量。
3)OD测定:取一定量的种子培养液或发酵液,以相应的培养基作对照液,在600 nm处测定OD值。
4)有机酸产物含量测量:采用高效液相色谱(HPLC)测定,流动相为含有体积分数5%甲醇的50 mmol/L的KH2PO4,体积流量为1.0 mL/min,紫外检测器检测波长为210 nm,温度为30℃。
2 结果与分析
2.1acr的克隆及其表达载体的构建
提取B.subtilis 168的基因组为模板,以Forawrd/Reverse引物进行PCR扩增,得到包含18 bp His编码序列的基因片段,总长1 041 bp,见图2。
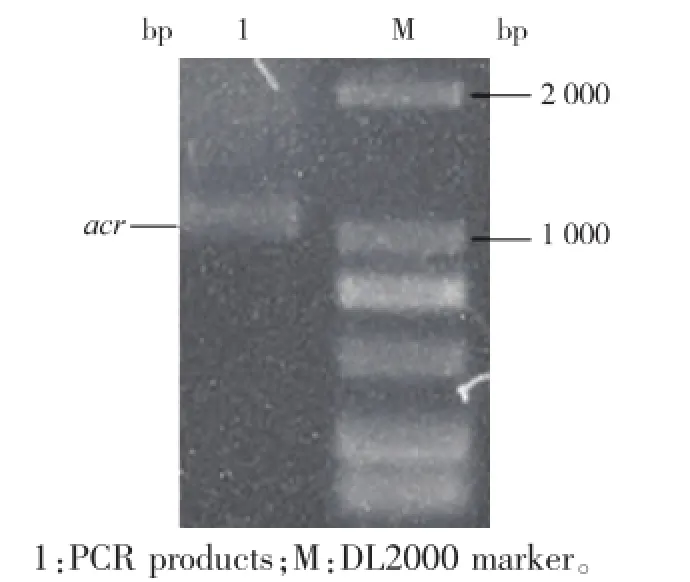
图2 acr基因的PCR扩增Fig.2 PCR amplification of acr gene
将目的基因片段,连接到经BamH I和Mlu I酶切的pMA5上,构建表达载体pMA5-acr,并且转化至B.subtilis 168感受态中。获得的重组表达载体pMA5-acr经BamH I和Mlu I双酶切验证(见图3),得到约7 200 bp和1 040 bp大小的片段,刚好对应线性化的pMA5和acr的大小,表明外源基因acr已经正确连接到表达载体pMA5上。
2.2ACR在B.subtilis 168/pMA5-acr中的表达
将重组载体pMA5-acr转化至B.subtilis 168,在卡那霉素抗性平板上筛选阳性重组子,即得B. subtilis 168/pMA5-acr,将其接种于LB液体培养基培养24 h,收集菌体并破碎,菌体用pH 7.0的PBS缓冲液悬浮,采用超声波破碎细胞,将破碎上清液及其纯化蛋白质进行SDS-PAGE分析,结果如图4所示,ACR的相对分子质量约为39 kDa,与预期的蛋白质相对分子质量大小相符,表明ACR在B. subtilis 168/pMA5-acr中成功获得了表达。
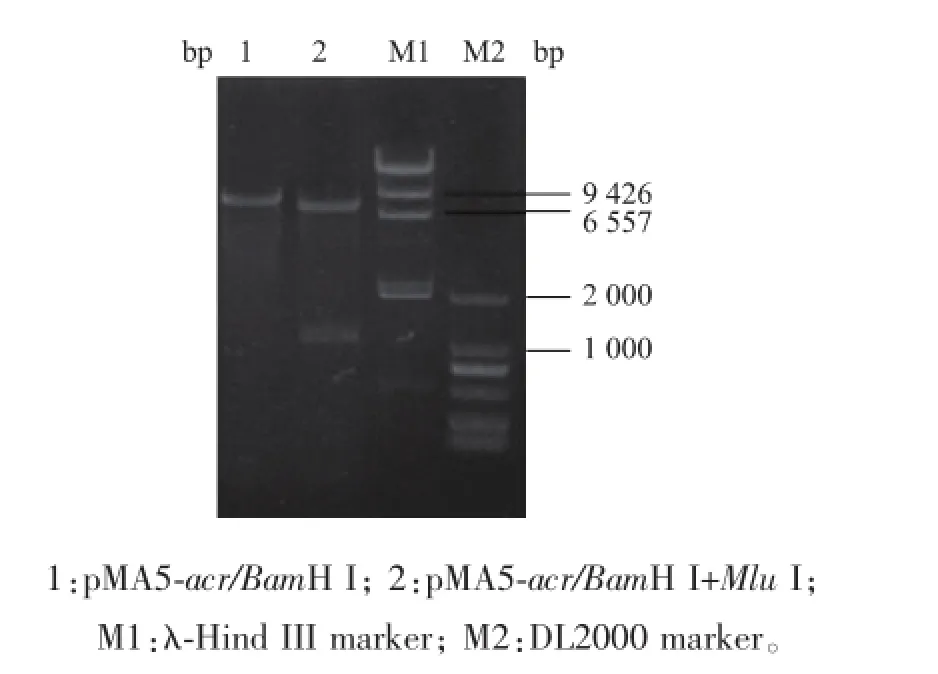
图3 重组质粒pMA5-acr的酶切验证Fig.3 Identification of the recombinant plasmid pMA5-acr by enzyme digestion
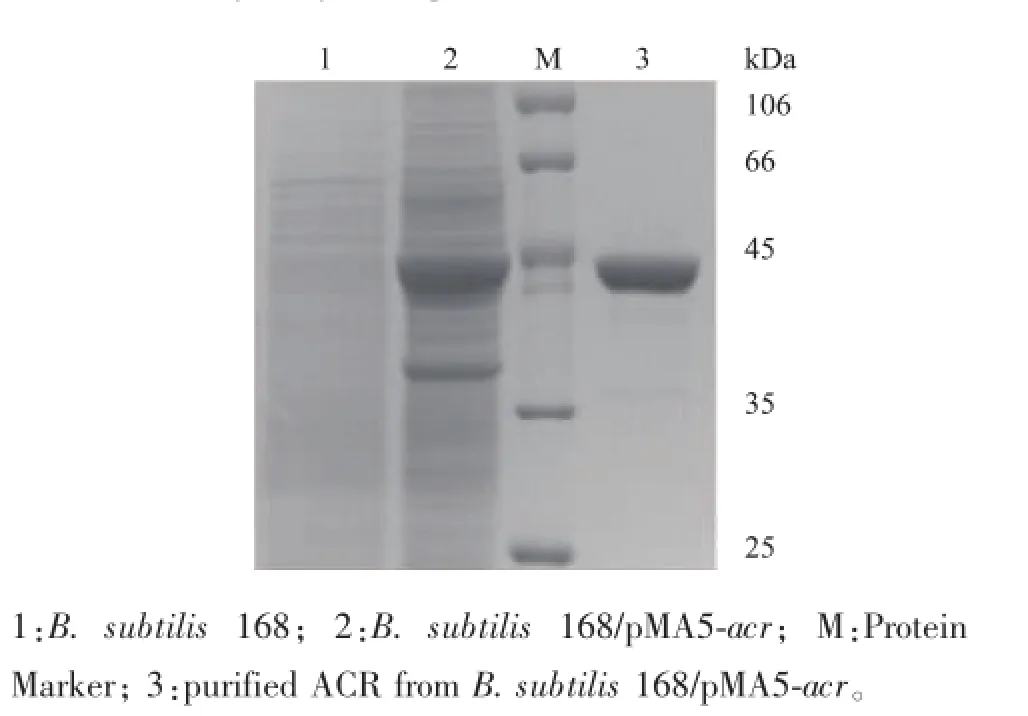
图4 ACR表达与纯化的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expressed and purified recombinant ACR
2.3ACR在B.subtilis 168/pMA5-acr中的酶活力测定
分别测定重组菌和原始菌破碎上清液中ACR的酶活力,结果如表2所示,与原始菌株相比,重组菌中ACR的比酶活提高了3.48倍,表明ACR在B. subtilis 168里成功过量表达。
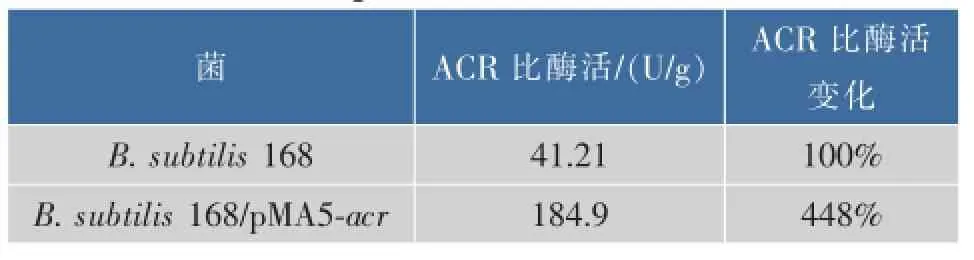
表2 B.subtilis 168和B.subtilis 168/pMA5-acr的ACR酶活Table 2 ACR enzyme activities of B.subtilis 168 and B. subtilis 168/pMA5-acr
2.4过量表达ACR对菌体生长、糖耗和2,3-BD积累的影响
对B.subtilis 168和B.subtilis 168/pMA5-acr进行发酵实验,菌体量和葡萄糖变化曲线见图5,AC和2,3-BD发酵曲线见图6,发酵特征分析见表3。重组菌在前期的生长速度较慢,发酵培养16 h后,菌体生长速度加快,80 h达到最高菌体量。可能的原因是ACR的过量表达,加重了菌体的负担,前期生长受到抑制。但是过量表达ACR后,对菌体生长有害的分支路径副产物有机酸等减少了,所以后半段的菌体长势较好,菌体量也比出发菌高,使得2,3-BD的合成具备良好的细胞基础。
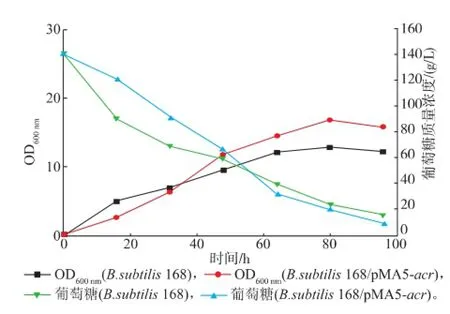
图5 发酵过程中OD和糖耗曲线Fig.5 Curves of OD and Glucose during the fermentation
从图5可以看到,重组菌的葡萄糖变化是一个前期下降平缓,中后期较为迅速的过程,而出发菌的糖耗曲线则较为均衡。这种现象表明,过量表达ACR,对菌体的生长造成负担。在前期,菌体生长缓慢,对于碳源的消耗减少,葡萄糖质量浓度下降较为平缓;而当菌体进入2,3-BD合成期后,对碳源的需求大大加强,发酵培养16 h,葡萄糖质量浓度开始较快减少。
图6和表3显示,发酵培养80 h,重组菌的2,3-BD的产量达到最大值33.08 g/L,比出发菌提高了28.62%;转化率达37.56%,提高了22.87%;副产物AC 11.59 g/L,降低了20.01%;2,3-BD/AC比率为2.854,提高了60.79%。过量表达ACR,并且控制发酵条件在弱酸性,促进了由AC到2,3-BD的转化程度,成功地使主产物2,3-BD的产量提高,同时降低了副产物AC的积累。
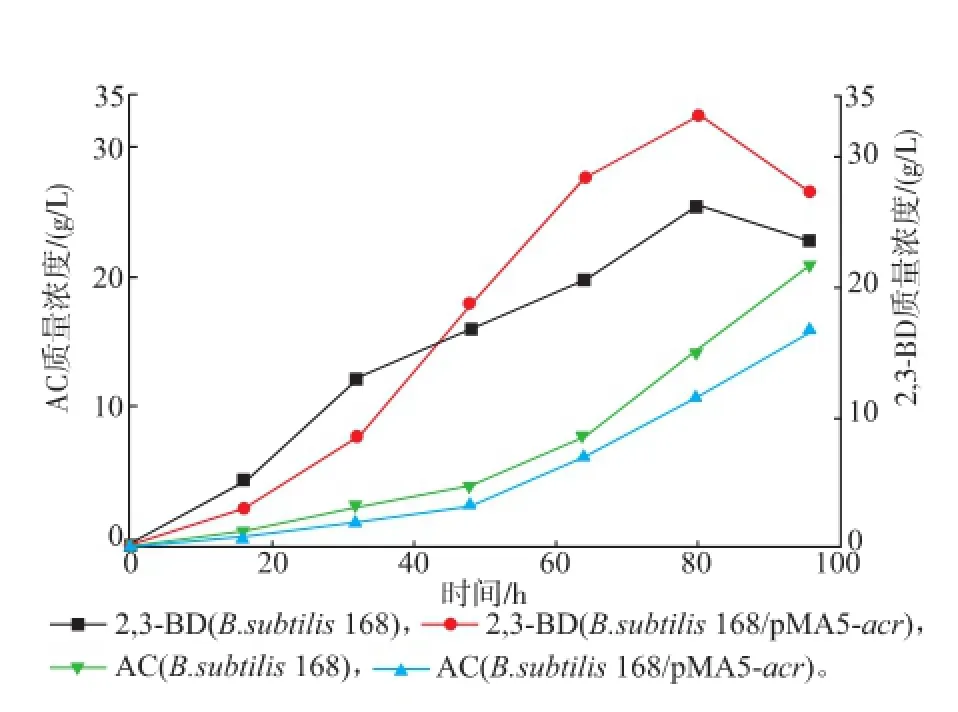
图6 发酵过程中AC和2,3-BD曲线Fig.6 Curves of AC and 2,3-BD during the fermentation

表3 发酵特征分析Table 3 Analysis of fermentation results
2.5过量表达ACR对有机酸积累的影响
对B.subtilis 168和B.subtilis 168/pMA5-acr两株菌发酵液进行有机酸测定分析,结果如表4所示,相比出发菌,重组菌株发酵液中副产物甲酸、乙酸、乳酸、琥珀酸分别降低了15.21%、34.35%、35.39%、39.53%。ACR的活力和NADH的含量是2,3-BD合成的两个重要因素,过量表达ACR,促进了从AC到2,3-BD的合成效率。获得了更多2,3-BD就意味着有更多的NADH参与了AC向2,3-BD的转化,也就是说该过程需要消耗更多的NADH,而用于需要NADH参与的其他有机酸副产物的NADH的量会相应减少,这可能是相关支路的有机酸积累量减少的原因所在。
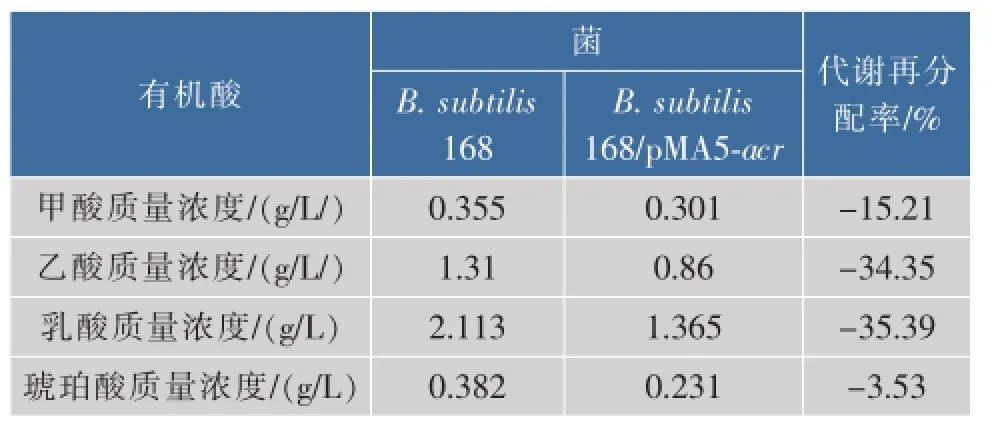
表4 ACR过量表达对发酵过程有机酸质量浓度的影响Table 4 Effects of overexpressing ACR on organic acidsin fermentation
3 结语
以安全菌株B.subtilis 168为出发菌,克隆其乙偶姻还原酶基因acr,构建重组质粒pMA5-acr,将重组质粒转化入B.subtilis 168,构建重组枯草芽孢杆菌B.subtilis 168/pMA5-acr。测定了重组菌ACR的酶活,并在弱酸性条件下进行发酵试验。结果表明,ACR在B.subtilis 168/pMA5-acr中实现了过量表达,主产物2,3-BD的产量得到提高,而副产物AC和相关有机酸的积累量则不同程度下降。2,3-BD高产菌株主要是克雷伯氏菌、产气肠杆菌和粘质沙雷氏菌[3,9-10],然而这些菌株都具有潜在致病性,不符合工业化安全生产的要求。而枯草芽孢杆菌有长期制备发酵食品的历史,不产内毒素和致热敏蛋白质,是一种公认安全的微生物,无论是作为出发菌还是宿主菌都具有很强可行性[17]。过量表达ACR和适当控制发酵pH,增强了合成2,3-BD的碳源通量,消耗了更多的辅酶NADH。相应地,AC和需要NADH参与的相关有机酸合成所需的碳源流量和NADH则会减少,因而成功地实现了主产物2,3-BD产量提高和相关副产物产量减少的目标。虽然重组菌产2,3-BD的产量和国内外最高产量还有一定的差距[1],但是相信通过进一步的分子改造和发酵条件优化,一定能实现微生物法高效安全生产2,3-BD的目标。
[1]Ji X J,Huang H.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnology Advances,2011,29(3):351.
[2]Garg S K,Jain A.Fermentative production of 2,3-butanediol:A review[J].Bioresource Technology,1995,51:103-109.
[3]Syu M J.Biological production of 2,3-butanediol[J].Applied Microbiology and Biotechnology,2001,55(1):10-18.
[4]Jarboe L R,Zhang X,Wang X,et al.Metabolic engineering for enzymes in Clostridium[J].Journal of Biomedicine and Biotechnology,2010:761042.
[5]付晶,王萌,刘维喜,等.生物法制备2,3-丁二醇的最新进展[J].化学进展,2012,24(11):2268-2276. FU Jing,WANG Meng,LIU Weixi,et al.Latest advances of microbial production of 2,3-Butanediol[J].Progress in Chemistry,2012,24(11):2268-2276.(in Chinese)
[6]Magee R,Kosaric N.The microbial production of 2,3-butanediol[J].Advances in Applied Microbiology,1987,32:89-161.
[7]Long S K,Patrick R.Microbial production of 2,3-Butylene glycol from cheese whey[J].Applied and Environment Microbiology,1982,43(5):1216-1218.
[8]Fulmer E I,Christensen L M,Kendali A R J.Production of 2,3-Butylene glycol by fermentation[J].Industrial and Engineering Chemistry,1933,25:798-800.
[9]Celinska E,Grajek W.Biotechnological production of 2,3-butanediol-current state and prospects[J].Biotechnology Advances,2009,27:715-725.
[10]Garg S K,Jain A.Fermentative production of 2,3-butanediol:a review[J].Bioresource Technology,1995:103-109.
[11]Maddox I S.Microbial production of 2,3-butanediol[J].VCH Verlagsgesellschaft mbH,1996:269-291.
[12]Larsen S H,Stormer F C.Diacetyl(acetoin)reductase from Aerobacter aerogenes Kinetic mechanism and regulation by acetate of the reversible reduction of acetoin to 2,3-butanediol[J].European Journal of Biochemistry,1973,34(1):100-106.
[13]Machielsen R,Uria A R,Kengen S W M,et al.Production and characterization of a thermostable alcohol dehydrogenase that belongs to the aldo-keto reductase superfamily[J].Applied and Environmental Microbiology,2006,62:233-238.
[14]Wang Z,Song Q,Yu M,et al.Characterization of stereospecific acetoin(diacetyl)reductase from Rhodococcus erythropolis WZ010 and its application for the synthesis of(2S,3S)-2,3-butanediol[J].Applied Microbiology Biotechnology,2013:1.
[15]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,5259:680.
[16]Bradford M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[17]李静静,徐美娟,张显,等.一种耐低温α-乙酰乳酸脱羧酶在枯草芽孢杆菌中的高效表达[J].食品与生物技术学报,2013,32(5):522. LI Jingjing,XU Meijuan,ZHANG Xian,et al.High-Level expression of Cold-Adapted α-acetolactate decarboxylase in Bacillus subtilis[J].Jouranl of Food Science and Biotechnology,2013,32(5):522.(in Chinese)
Improved 2,3-Butanediol Production by Overexpressing Acetoin Reductase in Bacillus subtilis 168
LI Xiupeng1,YANG Taowei2,XU Meijuan3,ZHANG Xian4,RAO Zhiming*
(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Bacillus subtilis 168 is a safe strain for industrial-scale microbial production of 2,3-butanediol(2,3-BD).However,a large quantity of by-product of acetoin(AC)is accumulated during 2,3-BD fermentation process.Acetoin reductase(ACR)is the key enzyme which catalyzes the conversion of acetoin to 2,3-BD.In this study,in order to improve 2,3-BD production,we firstly cloned the acr gene of acetoin reductase into B.subtilis 168,and then further constructed the recombinant strain B.subtilis 168/pMA5-acr.The results showed that the yield and conversion rate of the 2,3-BD were increased up to 28.62%and 22.87%by the recombinant strain,respectively. Whereas the accumulation of the main by-product of acetoin decreased by 20.01%.Furthermore,the molar yields of by-products of formic acid,acetic acid,lactic acid,and succinate were also decreased.
Acetoin reductase,2,3-Butanediol,Acetoin,B.subtilis 168
Q 78
A
1673—1689(2016)03—0252—06
2014-11-26
国家973计划项目(2012CB725202);国家自然科学基金项目(31400082,21276110);教育部重点科研项目(113033A);江苏高校优势学科建设工程资助和111引智工程项目(111-2-06)。
饶志明(1975—),男,江西临川人,农学博士,教授,博士研究生导师,主要从事工业微生物育种和发酵代谢方面的研究。
E-mail:raozhm@jiangnan.edu.cn

