外源性绵羊肺腺瘤病毒囊膜蛋白激活MAPK信号通路的分析
孙晓林,杜方原,刘淑英,2
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
外源性绵羊肺腺瘤病毒囊膜蛋白激活MAPK信号通路的分析
孙晓林1,杜方原1,刘淑英1,2
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
旨在深入探究外源性绵羊肺腺瘤病毒(exJSRV)囊膜蛋白(Env)的致病机制,通过组织病理学观察和免疫组织化学染色,检测病肺的病理特征以及Env、EGFR和MAPK信号通路中p-Erk1/2和p-p38的阳性表达区,通过Western blot检测Erk1/2和p38在病肺中的磷酸化水平。转染重组表达质粒pcDNA 4/myc-His /exJSRV-env到A549细胞中,通过Western blot检测Erk1/2和p38的磷酸化水平。通过CCK-8法检测转染重组表达质粒的A549细胞的增殖活力。免疫组化结果显示:JSRV Env蛋白主要表达于病肺组织的肺泡上皮细胞和肿瘤细胞,EGFR在病肺组织中过表达于肺泡上皮细胞,脱落的肿瘤细胞及间质细胞中,而在健康绵羊肺中只是少量表达于肺泡上皮细胞和支气管上皮细胞中,p-Erk1/2和p-p38在病肺组织中主要表达于肺泡上皮细胞和肿瘤细胞,EGFR、p-Erk1/2和p-p38的阳性表达区均与Env蛋白的阳性表达区一致。Western blot结果显示:病肺中p-Erk1/2和p-p38的磷酸化水平均极显著高于健康肺组织,转染重组表达质粒pcDNA4/myc-His/exJSRV-env的A549细胞中p-Erk1/2和p-p38的表达量均极显著高于对照组细胞,说明exJSRV-env确实激活了A549细胞的MAPK通路。而CCK8结果显示:转染重组表达质粒pcDNA4/myc-His/exJSRV-env的A549细胞增殖活力显著高于对照组细胞,说明exJSRV-env可能是通过激活的EGFR/MAPK通路促进A549细胞的恶性增殖,进而促使肿瘤的发生。本研究为进一步探索绵羊肺腺瘤病毒囊膜蛋白的致病机制奠定了基础。
外源性绵羊肺腺瘤病毒;囊膜蛋白;MAPK信号转导通路;细胞增殖
绵羊肺腺瘤病毒(jaagsiekte sheep retrovirus,JSRV)是绵羊肺腺瘤病(OPA)的病原,OPA是一种传染性绵羊肺癌[1]。由于组织培养体系的缺乏,JSRV/OPA的研究一直在病毒培养方面受到阻碍。就以往的研究来看,感染JSRV的绵羊病料(肺液)是传染性OPA的唯一来源[2]。显而易见,对于JSRV/OPA体系的研究只能建立在OPA病例的基础上[3]。该病的特点是肿瘤细胞产生大量分泌物导致肺部积聚肺液,OPA肿瘤起源于肺泡Ⅱ型上皮细胞或Clara细胞[4-5]。
之前已经有研究表明,JSRV的肿瘤形成机制是由肿瘤的Env蛋白激活涉及转染的信号通路蛋白激酶[6-7]。表皮生长因子受体(epidermal growth factor receptor,EGFR)与肿瘤有着密切的关系,常常在肿瘤的发生发展过程中,伴随着EGFR调控的异常,如EGFR的过表达或EGFR的突变等。有研究者发现,有50%~70%的肺癌、结肠癌和乳腺癌等上皮细胞癌都有EGFR的过度激活。通过抑制EGFR、磷酸化EGFR及其下游的信号通路,往往可以抑制肿瘤的生长、增殖和转移等[8]。而EGF及其受体是MAPK信号转导通路的主要启动者。目前已经发现EGFR主要激活两条MAPK介导的信号转导通路:MAPK/ERK和MAPK/JNK通路[9],MAPK/ERK、MAPK/JNK和MAPK/p38是MAPK重要的三种类型[6]。ERK1/2在肿瘤中起到的作用主要是通过活化的p-ERK1/2与其他信号途径中的效应分子或核转录因子相互作用后,促进细胞的增殖和恶性转化[11]。有大量的研究表明,p38 MAPK信号通路对肿瘤细胞的生长和增殖起着综合作用,而p38 MAPK蛋白激酶的抑制剂可以抑制肿瘤细胞的增殖,并诱导凋亡[12]。也有研究发现,通过抑制p38 MAPK信号通路的活性,会导致A549细胞的浸润和表达受到抑制,提示p38 MAPK可以促进肿瘤的浸润和转移[10]。而N.Maeda等[13]发现,p38抑制剂会增强JSRV Env的转化作用,并推测p38可能是通过活化PP1/2A,使MEK1/2去磷酸化,继而降低ERK1/2的活性,来抑制H/N-Ras-MEK-MAPK通路的活性。
基于以上研究基础,笔者通过组织病理学观察检测病肺的病理特征,通过免疫组织化学检测病肺组织中Env、EGFR、以及p-Erk1/2和p-p38的阳性表达区,通过观察各自的阳性信号表达区来定位蛋白发挥效应的靶细胞,并通过Western blot检测p-Erk1/2和p-p38在病肺中的磷酸化水平,以及将重组表达质粒pcDNA4/myc-His/exJSRV-env转入人肺癌细胞A549细胞中,检测p-Erk1/2和p-p38的表达量,判断是否A549细胞受到Env的诱导,激活了MAPK通路,最后通过CCK8法检测细胞增殖活力,推测细胞增殖活力的改变是否受到MAPK通路激活的影响,为进一步探索绵羊肺腺瘤病毒囊膜蛋白的致病机制奠定基础。
1 材料与方法
1.1实验动物与样品的采集
自然感染绵羊肺腺瘤病料于内蒙古四子王旗采集,健康绵羊肺由内蒙古呼和浩特市屠宰场提供。
1.2主要试剂
A549细胞(国家细胞资源共享平台购买);pcDNA4/myc-His真核表达载体由本实验室保存;pcDNA4/myc-His/exJSRV-env真核表达质粒由本实验室构建;E.coliDH5α感受态细胞(天根生化科技(北京)有限责任公司);Phusion高保真DNA聚合酶(Thermo公司);LipofectamineTMLTX & PLUS 转染试剂(Invitrogen公司);限制性内切酶NotⅠ和BamHⅠ,PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa公司);RNA提取试剂盒[天根生化科技(北京)有限责任公司];去内毒素质粒抽提纯化试剂盒(Promega公司);高糖DMEM培养基(Hyclone公司);胎牛血清(FBS)和Opti-MEM培养基(Gibco公司);兔抗Env51-394多克隆抗体为本实验室制备;兔抗His,Anti-EGFR antibody ab2430(Abcam公司);β-Actin(13E5) Rabbit mAb,p44/42 MAPK(Erk1/2)(137F5),Phospho-p44/42 MAPK(Erk1/2)(Thr202/Tyr204)(D13.14.4E)XP®Rabbit mAb,p38 MAPK Antibody,Phospho-p38 MAPK(Thr180/Tyr182)(D3F9)XP®Rabbit mAb(Cell Signaling公司),Pierce®Goat Anti-Rabbit IgG,(H+L),Peroxidase Conjugated(Thermo公司),ECL STAR特超敏显色试剂盒(北京碧云天公司)。
1.3肺组织病理切片制备及观察
将肺组织置10%福尔马林溶液中固定12 h后,冲洗12 h,依照常规操作进行脱水、透明、浸蜡、包埋、切片、烘片以及HE染色和免疫组化,中性树胶封片后,烤片12 h,最后在光学显微镜下观察组织切片。
1.4肺组织信号通路免疫组化检测
同上制片,选择相应试剂进行免疫组化染色,中性树胶封片后,烤片12 h,最后在光学显微镜下观察组织切片。
1.5肺组织信号通路Western blot检测
将病料从-80 ℃取出,放在液氮中研磨,加入组织裂解液后超声波破碎,提取总蛋白质,取蛋白质溶液进行聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白质上样量为每孔30 μg,并通过半干转法转移至PVDF滤膜上,将膜放入Western blot封闭液中,于摇床上封闭2 h。之后用TBST清洗5次,每次5 min,一抗4 ℃过夜孵育,TBST清洗5次,每次5 min,二抗于摇床上室温孵育1 h。TBST清洗5次,每次5 min,ECL 孵育1 min,曝光1 min后观察结果。
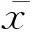
1.6最佳转染效率测定
转染前24h将A549细胞传代至60mm皿中,加入含10%FBS无双抗的完全培养基3mL,于37 ℃,5%CO2细胞培养箱中培养。待细胞长满至80% 时按照LipofectamineTMLTX&PLUS转染试剂说明书转染重组质粒pcDNA4/myc-His/exJSRV-env。分组试验梯度为500ng组质粒添加LTX2、3、4、5、6、8和10μL,转染48h后分别做RT-PCR和Westernblot检测最佳转染效率。RT-PCR引物为本试验根据exJSRV的全基因序列(No.AF105220),利用PrimerPrimer5.0软件,在env基因区域设计一对exJSRV-env的引物(预期扩增产物大小1 848bp)。引物上下游分别加入NotⅠ和BamHⅠ的酶切位点。上游引物(env-F):5′-CGCGGATCCACACCATGGCGAAGCGCCG-3′,下游引物(env-R):5′-AAGGAAAAAAGCGGCCGCCGGGTCGTCCCCCGC-3′,引物在上海生工生物工程股份有限公司合成。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 2 min,30个循环;72 ℃ 10 min;4 ℃保存。
1.7pcDNA4/myc-His/exJSRV-env瞬时转染A549细胞
根据测定的最佳转染条件分别转染重组质粒pcDNA4/myc-His/exJSRV-env和pcDNA4/myc-His空质粒到A549细胞,为后续试验做准备。
1.8细胞转染后exJSRV-envmRNA转录的检测
收集各组瞬时转染48 h的A549细胞,提取细胞总RNA,利用分光光度计检测RNA的纯度,利用1%的琼脂糖凝胶电泳在成像仪上检测RNA的完整性,确定可用后将所提RNA反转录成cDNA后进行PCR扩增,产物进行凝胶电泳检测。PCR引物及反应条件均与“1.6”相同。
1.9Western blot检测Env蛋白A549细胞中的表达
提取各组细胞总蛋白质,取蛋白质溶液进行聚丙烯酰胺凝胶电泳(SDS-PAGE),蛋白质上样量为每孔20 μg,并通过半干转法转移至PVDF滤膜上,将膜放入Western blot封闭液中,于摇床上封闭2 h。之后用TBST清洗5次,每次5 min,一抗4 ℃过夜孵育。TBST清洗,二抗于摇床上室温孵育1 h。TBST清洗5次,每次5 min,ECL 孵育1 min,曝光1 min后观察结果。
1.10Western blot检测信号通路蛋白在A549细胞中的表达

1.11CCK8法检测细胞体外增殖能力
将转染pcDNA4/myc-His-exJSRV-env的细胞及未转染的A549细胞铺板于96孔板中,每孔1 000个细胞,每组设5个复孔,每孔加100μL完全培养基,37 ℃,5%CO2培养,铺5个板子。每天同一时间加入10μLCCK8,37 ℃孵育1h,用酶标仪测定其在450nm处的吸光值,记录结果,以时间为横坐标,吸光值为纵坐标绘制生长曲线。
2 结 果
2.1肺组织病理切片观察与免疫组织化学检测
取自然感染的绵羊病肺组织分别做HE染色以及免疫组化检测,免疫组化检测一抗采用本实验室制备的Env多克隆抗体,结果显示,病肺肺泡壁增宽,有大量的肺泡上皮细胞肿瘤性增生,肺组织中充斥大量腺瘤灶及类腺瘤区,腺瘤灶周围有大量脱落的瘤细胞及巨噬细胞等典型的绵羊肺腺瘤病理特征(图1A)。健康绵羊肺的肺泡壁较薄,多成圆形或卵圆形,未见肿瘤灶(图1B)。FAN等[3]已经证明JSRVEnv足够引起细胞转化,并且exJSRV-env的主要靶细胞为肺泡上皮细胞。因此作者做了病肺免疫组化的JSRVEnv检测,发现肺泡上皮细胞及肿瘤细胞中有大量的阳性表达(图1C)。验证了JSRVEnv的靶细胞为肺泡上皮细胞这一点。而健康绵羊肺组织则未见表达(图1D)。
2.2肺组织信号通路免疫组化检测
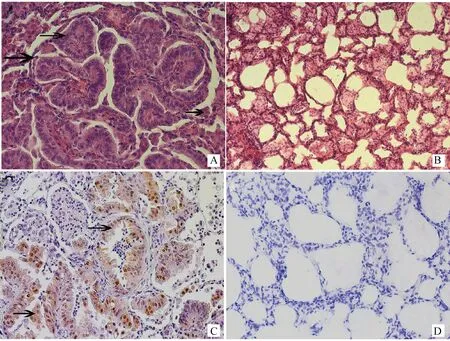
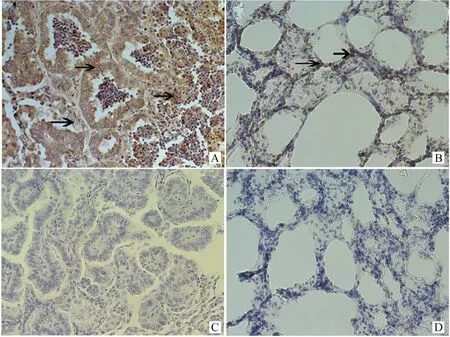
取自然感染的绵羊病肺组织,免疫组化检测EGFR在病肺组织中的表达,发现其过表达于肺泡上皮细胞,脱落的肿瘤细胞及间质细胞中(图2A),而在健康绵羊肺中只是少量表达于肺泡上皮细胞(图2B)和支气管上皮细胞中(未展示),这与JSRVEnv的靶细胞一致,而JSRVEnv是引起细胞转化的主要因素,因此有可能是JSRVEnv激活了病肺细胞中EGFR的表达。而作为阴性对照,一抗用PBS代替的病肺组织(图2C),以及正常绵羊肺组织(图2D)均未见阳性信号的表达。接着检测EGFR下游通路MAPK通路中两个重要蛋白Erk1/2和p38的磷酸化水平,正常绵羊肺组织及一抗用PBS取代的病肺组织均为阴性对照。发现p-Erk在肺泡上皮细胞及肿瘤细胞中均有大量表达(图3A、B),而正常绵羊肺组织(图3C、D)未检测到表达。p-p38也大量表达于肺泡上皮细胞中(图3E、F),正常绵羊肺组织未检测到表达(图3G、H),其中一抗用PBS代替的病肺组织(图3I、J),以及正常绵羊肺组织(图3K、L)均未见阳性信号表达。免疫组化结果显示:不同肿瘤结节间标记的强度不同,当用不同浓度的一抗时都保持不变,说明这种变化与一抗的浓度无关,而是与p-Erk1/2、p-p38在不同肿瘤中的浓度有关。JSRV感染的肺组织中,IHC表明OPA-N肺组织中Env阳性信号的细胞为肺泡上皮细胞和肿瘤细胞,而p-Erk1/2、p-p38阳性信号也主要表达于肺泡上皮细胞和肿瘤细胞,因此Env与p-Erk1/2和p-p38的阳性表达区一致,并且主要定位于细胞核和细胞质。而JSRVEnv是引起细胞转化的主要诱因,因此也有可能是JSRVEnv激活了病肺组织中p-Erk1/2和p-p38的表达。对于大部分结节来说,p-Erk1/2、p-p38标记的阳性肿瘤细胞在同一视野的不同结节中阳性信号的表达强度不同,在一些结节中,100%肿瘤细胞都有标记。标记的强度由弱到强变化。另外,有些阳性信号标记在支气管区的间质细胞,成纤维细胞,和一些单独的细支气管上皮细胞(未展示)。少量的间质细胞是p-Erk1/2、p-p38阳性信号。总体来讲,这些数据表明,JSRV感染的肺组织细胞表现出了EGFR的激活,以及其下游MAPK通路中p-Erk1/2、p-p38的活化。
2.3肺组织信号通路Westernblot检测
经Westernblot检测,自然感染OPA的病肺和健康绵羊肺组织均有Erk1/2和p38的表达,而自然感染OPA病肺的p-Erk和p-p38的表达量都极显著高于健康绵羊肺组织的表达量(图4、图5)。
2.4pcDNA4/myc-His/exJSRV-env最佳转染效率测定
结果显示,48h后加入不同LTX浓度的质粒,JSRV-env均有mRNA水平的表达(图6),而JSRVEnv蛋白的表达差异极显著,加入4μLLTX的蛋白表达量要极显著高于其他试验组的蛋白表达量(图7),因此最终选取500ng的pcDNA4/myc-His/exJSRV-env真核表达质粒中加入4μLLTX为最佳转染浓度。
A.肿瘤肺组织HE染色,200×;B.健康肺组织HE染色,100 ×;C.肿瘤肺组织免疫组化染色,200×;D.健康肺组织免疫组化染色,200×A.Neoplastic lung tissue of sheep HE staining,200×;B.Normal lung tissue of sheep HE staining,100×;C.Neoplastic lung tissue of sheep immunostaining,200×;D.Normal lung tissue of immunostaining,200×图1 病肺组织化学染色结果Fig.1 Result of ovine pulmonary adenocarcinoma
A.肿瘤肺组织免疫组化检测;B.健康肺组织免疫组化检测;C.肿瘤肺组织免疫组化染色;D.健康肺组织免疫组化染色A.Neoplastic lung tissue of sheep immunostaining staining;B.Normal lung tissue of sheep immunostaining;C.Neoplastic lung tissue of sheep immunostaining,;D.Normal lung tissue of immunostaining图2 EGFR在自然感染OPA病肺组织中的表达分布(200×)Fig.2 Neoplastic lung tissue of OPA-N sheep immunostaining for EGFR(200×)
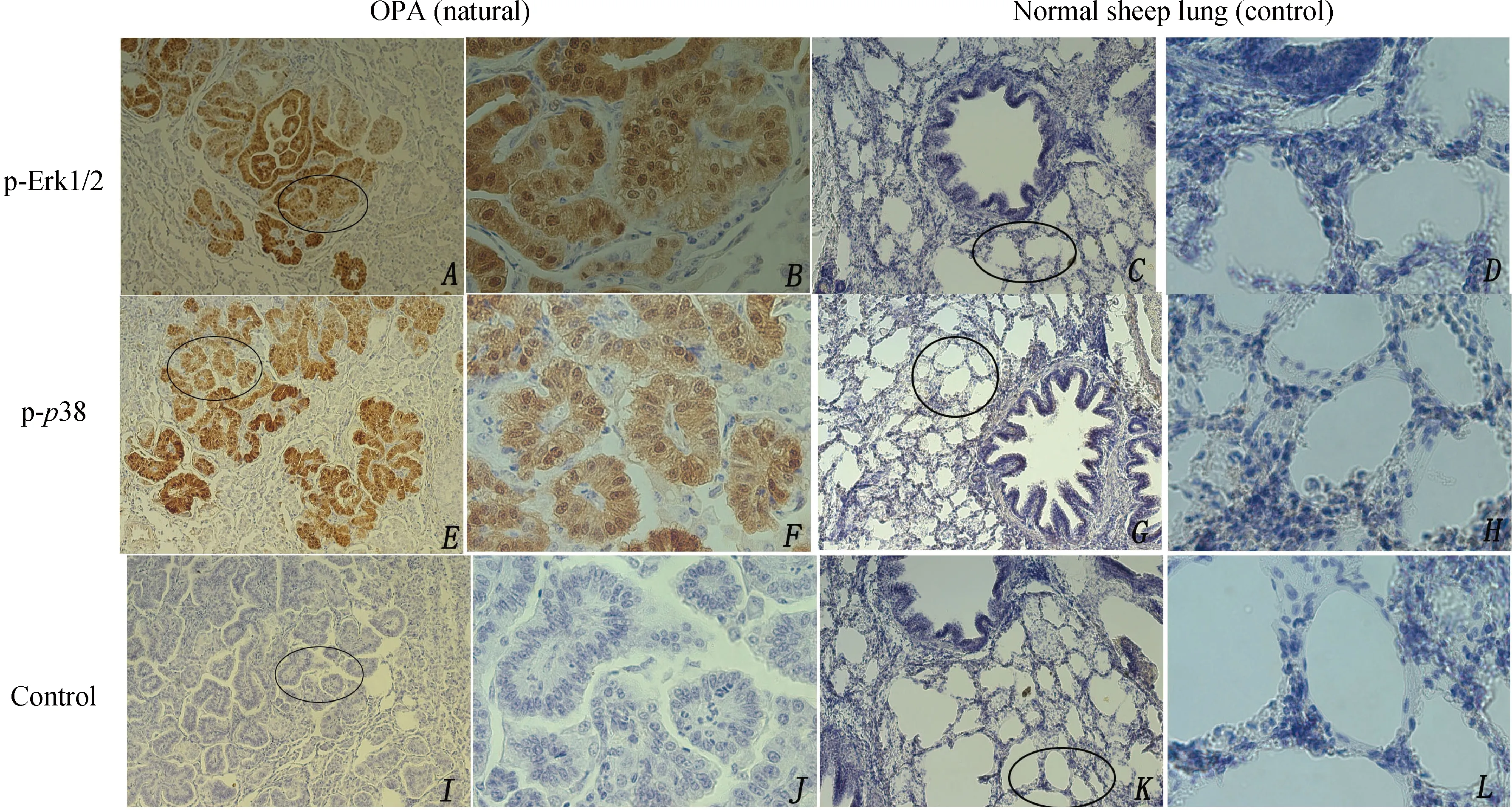
A、E、I.肿瘤肺组织免疫组化,100×;B、F、J.肿瘤肺组织免疫组化,400×;C、G、K.正常绵羊肺组织免疫组化,100×;D、H、L.正常绵羊肺组织免疫组化,400×A,E,I.Neoplastic lung tissue of sheep immunostaining staining,100×;B,F,J.Neoplastic lung tissue of sheep immunostaining,400×;C,G,K.Normal lung tissue of sheep immunostaining,100×;D,H,L.Normal lung tissue of immunostaining,400×图3 p-Erk1/2和p-p38在自然感染OPA病肺组织中的表达分布Fig.3 Neoplastic lung tissue of OPA-N sheep immunostaining For p-Erk and p-p38

1.健康绵羊肺组织;2.自然感染OPA病肺1.Normal sheep lung;2.OPA-N sheep lung图4 Western blot检测信号通路在肺中的蛋白表达Fig.4 Western blot analysis of protein expressions in the lung

Control.健康绵羊肺组织;OPA-N.自然感染OPA肺组织;**.P<0.01Control.Normal sheep lung;OPA-N.Natural infection OPA sheep lung;**.P<0.01图5 肺中通路蛋白质表达量的变化Fig.5 Activation of p-Erk1/2 and p-p38 in sheep lung
2.5pcDNA4/myc-His/exJSRV-env转染A549细胞后目的基因的检测
转染pcDNA4/myc-His/exJSRV-env真核表达质粒的细胞在2 000 bp下方均扩增出目的条带,未转染的细胞和转染空质粒的细胞没有扩增出目的条带(图8)。
2.6Western blot检测JSRV Env的表达情况
Western blot结果显示:转染重组表达质粒pcDNA4/myc-His-exJSRV-env的A549细胞和转染空质粒pcDNA4/myc-His的细胞均有His标签蛋白的表达,未转染的A549细胞没有表达,而转染重组表达质粒pcDNA4/myc-His-exJSRV-env的A549细胞有Env蛋白的表达,转染空质粒pcDNA4/myc-His的细胞和未转染的A549细胞没有表达(图9)。

M.DL5000 DNA相对分子质量标准;1~8.分别为pcDNA4/myc-His/exJSRV-env 真核表达质粒500 ng,加LTX 2、3、4、5、4、6、8、10 μLM.DL5000 DNA marker;1-8.A549 transfected with 500 ng pcDNA4/myc-His/exJSRV-env and LTX 2,3,4,5,4,6,8,10 μL图6 RT-PCR检测pcDNA4/myc-His/exJSRV-env真核表达质粒转染A549细胞48 h后mRNA转录Fig.6 Identification of exJSRV-env expressed in A549 cells after 48 h by RT-PCR

1~8.分别为pcDNA4/myc-His/exJSRV-env 真核表达质粒500 ng,加LTX 2、3、4、5、4、6、8、10 μL1-8.A549 transfected with 500 ng pcDNA4/myc-His/exJSRV-env and LTX 2,3,4,5,4,6,8,10 μL图7 Western blot检测pcDNA4/myc-His/exJSRV-env真核表达质粒转染A549细胞48 h后蛋白质表达Fig.7 Identification of exJSRV-env expressed in A549 cells after 48 h by Western blot

M.DL5000 DNA相对分子质量标准;1.未转染的A549细胞;2.转染pcDNA4/myc-His空质粒的A549细胞;3.exJSRV-env 基因扩增产物M.DL5000 DNA marker;1.A549;2.A549 transfected with pcDNA4/myc-His;3.A549 transfected with pcDNA4/myc-His/exJSRV-env图8 RT-PCR检测exJSRV-env在A549细胞中的表达Fig.8 Identification of exJSRV-env expressed in A549 cells by RT-PCR
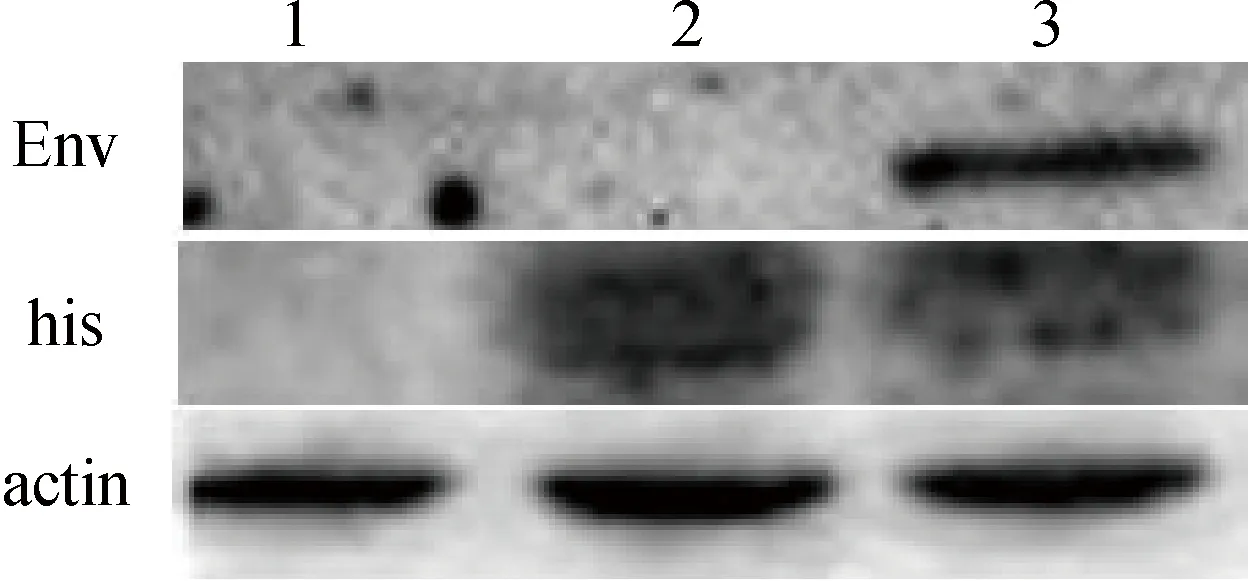
1.未转染的A549细胞;2.转染空质粒pcDNA4/myc-His的细胞;3.转染重组质粒pcDNA4/myc-His/exJSRV-env 的细胞1.A549;2.A549 transfected with pcDNA4/myc-His;3.A549 transfected with pcDNA4/myc-His/exJSRV-env图9 Western blot检测exJSRV-env在A549细胞的表达Fig.9 Western blot analysis of exJSRV-env expression in A549
2.7信号通路蛋白表达量的检测
经Western blot检测,转染重组表达质粒pcDNA4/myc-His-exJSRV-env的A549细胞和未转染的细胞均有Erk1/2和p38的表达,转染重组表达质粒pcDNA4/myc-His-exJSRV-env的A549细胞的p-Erk1/2的表达量极显著高于未转染的细胞,而转染重组表达质粒pcDNA4/myc-His-exJSRV-env的A549细胞的p-p38的表达量很高,未转染的细胞未检测到表达(图10、图11)。

1.未转染的A549细胞;2.转染pcDNA4/myc-His/exJSRV-env 的细胞1.A549;2.A549 transfected with pcDNA4/myc-His/exJSRV-env图10 Western blot检测信号通路在细胞中的蛋白表达Fig.10 Western blot analysis of exJSRV-env expression in A549 cells
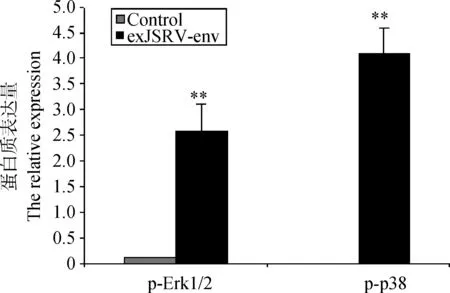
Control.未转染的空细胞对照组;exJSRV-env.转染pcDNA4/myc-His/exJSRV-env 的细胞组;**.P<0.01Control.Normal sheep lung;OPA-N.Natural infection OPA sheep lung;**.P<0.01图11 A549细胞中通路蛋白质表达量的变化Fig.11 Activation of p-Erk1/2 and p-p38 in A549 cells
2.8CCK8法检测细胞体外增殖能力
CCK8检测数据经SPSS软件分析,结果显示,转染pcDNA4/myc-His/exJSRV-env的A549细胞的增殖活力显著高于对照组细胞(P<0.05)(图12)。

*.P<0.05图12 转染后细胞增殖曲线Fig.12 Cells growth curve after the transformation
3 讨 论
最近的研究发现,自然感染OPA的肿瘤细胞和表达JSRV的肺模型中均相对于未感染的肺或肺模型有更高比例的Ki-67的表达[14],而Ki-67作为标记细胞增殖状态的抗原,表明JSRV Env在自然感染的肺和肺模型中的表达均可以促进细胞增殖。尽管JSRV Env促进转染的具体机制还不十分明确,但是有学者[14-17]认为它激活了一系列调控细胞增殖分化的信号通路。EGFR表达于正常上皮细胞表面,而在一些肿瘤细胞中常过表达,EGFR的下游信号通路为Ras/Raf/MEK/ERK-MAPK和PI3K/Akt/ mTOR通路。N.M.Linnerth-petrik等[18]提出,Env诱导的肿瘤中有EGFR在Tyr1068位点的磷酸化,并激活了Akt,而Akt是抗凋亡因素中的关键激酶,因此,Env有可能通过这条通路来逃避凋亡。而MAPK信号转导通路在肝癌等很多肿瘤细胞[11]中均检测到活化,MAPK信号通路可以通过影响动物细胞内基因的转录和调控,从而影响细胞的增殖、分化以及凋亡,p38 MAPK和ERK/MAPK为其重要的两条途径,p38和Erk1/2也与细胞的分裂和增殖息息相关[19]。p38抑制剂会促进ERK1/2的激活,甚至细胞的增殖活力都显著升高[13,20]。
本研究通过免疫组化检测EGFR在病肺组织中的表达,发现其过表达于肺泡上皮细胞,脱落的肿瘤细胞及间质细胞中,这与JSRV Env蛋白的阳性表达区一致。这为进一步研究MAPK通路在JSRV Env诱导肿瘤产生中的作用奠定了基础。而免疫组织化学检测病肺中p-Erk1/2和p-p38两个磷酸化蛋白的表达发现,p-Erk1/2的阳性表达区也是Env和EGFR的阳性表达区,并且自然感染OPA的肿瘤与健康绵羊肺相比,p-Erk1/2和p-p38的表达水平均极显著增高。通过Western blot检测发现转染pcDNA4/myc-His/exJSRV-env真核表达质粒的A549细胞中Erk1/2和p38两个蛋白的磷酸化水平均极显著高于对照组细胞,与组织中蛋白的表达一致,说明在转染了重组表达质粒后激活了MAPK/ERK通路及MAPK/p38通路。采用CCK8法发现转染的exJSRV-env的细胞增殖活性显著高于正常培养的A549细胞,说明exJSRV-env具有一定促进A549细胞增殖的能力。因此根据作者的试验结果推测,JSRV Env感染的细胞中,激活了EGFR/MAPK通路,其中MAPK/ERK通路的激活会抑制细胞的增殖,并抵抗细胞凋亡,而MAPK/p38的激活会抑制MAPK/ERK通路,p-p38的表达量较强又高于p-Erk1/2的表达量,因此在它们的综合作用下,促进了肿瘤细胞的增殖和恶性转化。而具体EGFR、p38、以及Erk1/2是怎样在共同调控并交互作用的同时激活下游的相关转录因子,诱导绵羊肺腺瘤的发生发展我们还在继续做进一步研究。
[1]PALMARINI M,FAN H.Retrovirus-induced ovine pulmonary adenocarcinoma,an animal model for lung cancer[J].JNatlCancerInst,2001,93(21):1603-1614.
[2]HOFACRE A,FAN H.Jaagsiekte sheep retrovirus biology and oncogenesis[J].Viruses,2010,2(12):2618-2648.
[3]FAN H,PALMARINI M,DEMARTINI J C.Transformation and oncogenesis by jaagsiekte sheep retrovirus[J].CurrTopMicrobiolImmunol,2003,275:139-177.
[4]WOOTTON S K,METZGER M J,HUDKINS K L,et al.Lung cancer induced in mice by the envelope protein of jaagsiekte sheep retrovirus(JSRV)closely resembles lung cancer in sheep infected with JSRV[J].Retrovirology,2006,3:94.
[5]MCGEE-ESTRADA K,FAN H.Invivoandinvitroanalysis of factor binding sites in jaagsiekte sheep retrovirus long terminal repeat enhancer sequences:roles of HNF-3,NF-1,and C/EBP for activity in lung epithelial cells[J].JVirol,2006,80(1):332-341.
[6]孔汉金,张克山,刘永杰,等.绵羊肺腺瘤病毒env基因致瘤机制[J].中国人兽共患病学报,2013,29(5):504-508.
KONG H J,ZHANG K S,LIU Y J,et al.Oncogenesis mechanism ofenvgene from Jaagsiekte sheep retrovirus[J].ChineseJournalofZoonoses,2013,29(5):504-508.(in Chinese)
[7]LEROUX C,GIRARD N,COTTIN V,et al.Jaagsiekte sheep retrovirus (JSRV):from virus to lung cancer in sheep[J].VetRes,2007,38(2):211-228.
[8]于敏,倪琛琛,刘善青,等.EGFR、pEGFR蛋白在非小细胞肺癌中的表达及临床意义[J].安徽医科大学学报,2011,46(1):57-60.
YU M,NI C C,LIU S Q,et al.Expressions of EGFR and pEGFR in non-small cell lung cancer and their clinical significance[J].ActaUniversitatisMedicinalisAnhui,2011,46(1):57-60.(in Chinese)
[9]蒋璐.PKGⅡ对胃癌细胞由EGF/EGFR启动的信号转导和相关的生物学活动的影响[D].镇江:江苏大学,2013.
JIANG L.Effect of PKG Ⅱ on EGF/EGFR-induced signal transduction and related biological activities in gastric cancer cells[D].Zhenjiang:Jiangsu University, 2013.(in Chinese)
[10]徐艳清,廖爱军.p38 MAPK在肿瘤浸润转移中的作用[J].现代医药卫生,2013,29(20):3090-3092.
XU Y Q,LIAO A J.The role of p38 lightning in tumor infiltration[J].JournalofModernMedicine&Health,2013,29(20):3090-3092.(in Chinese)
[11]梁佳,包翠芬,魏嘉,等.P38和ERK1/2在肝细胞癌中的表达及意义[J].中国组织化学与细胞化学杂志,2009,18(2):202-206.LIANG J,BAO C F,WEI J,et al.Expression and significance of p38 and ERK1/2 in human heap to cellular carcinoma[J].ChineseJournalofHistochemistryandCytochemistry,2009,18(2):202-206.(in Chinese)
[12]孙佳,王志军,曹平安,等.p38MAPK对肿瘤细胞ATM、ATR和p53信号通路的影响[J].中华临床医师杂志(电子版),2013,7(8):3426-3430.
SUN J,WANG Z J,CAO P A,et al.Effects of p38MAPK towards ATM,ATR and P53 cell signaling patways[J].ChineseJournalofClinicians(ElectronicEdition),2013,7(8):3426-3430.(in Chinese)
[13]MAEDA N,FU W,ORTIN A,et al.Roles of the Ras-MEK-mitogen-activated protein kinase and phosphatidylinositol 3-kinase-Akt-mTOR pathways in Jaagsiekte sheep retrovirus-induced transformation of rodent fibroblast and epithelial cell lines[J].JVirol,2005,79(7):4440-4450.
[14]COUSENS C,ALLEAUME C,BIJSMANS E,et al.Jaagsiekte sheep retrovirus infection of lung slice cultures[J].Retrovirology,2015,12:31.
[15]张亚坤,刘淑英.绵羊肺腺瘤病毒囊膜蛋白致癌作用的研究进展[J].中国兽医科学,2012,42(12):1315-1320.
ZHANG Y K,LIU S Y.Advance in tumorigenesis of jaagsiekte sheep retrovirus’ envelope protein[J].ChineseVeterinaryScience,2012,42(12):1315-1320.(in Chinese)
[16]刘畅,李磊,于立新,等.绵羊肺腺瘤病毒囊膜蛋白及其TM亚基通过激活Akt诱导NIH 3T3细胞转化[J].中国预防兽医学报,2014,36(8):606-610.
LIU C,LI L,YU L X,et al.Jaagsiekte retrovirus envelope protein and its transmembrane subunit induced transformation of NIH 3T3 cells by activating Akt[J].ChineseJournalofPreventiveVeterinaryMedicine,2014,36(8):606-610.(in Chinese)
[17]刘畅,敖威华,李磊,等.绵羊肺腺瘤病毒致病机制研究进展[J].动物医学进展,2015,36(1):79-82.
LIU C,AO W H,LI L,et al.Progress of tumorigenic mechanisms of ovine pulmonary adenomatosis virus[J].ProgressinVeterinaryMedicine,2015,36(1):79-82.(in Chinese)
[18]LINNERTH-PETRIK N M,SANTRY L A,YU D L,et al.Adeno-associated virus vector mediated expression of an oncogenic retroviral envelope protein induces lung adenocarcinomas in immunocompetent mice[J].PLoSOne,2012,7(12):e51400.
[19]KETAM S,JOHN F,BRION N,et al.Inhibition of p38 mitogen activated protein kinase increase LPS induced inhibition of apoptosis in neutrophils by activating extracellular signal regulated kinase[J].Surgery,2001,130(2):242-247.
[20]JOHNSON C,SANDERS K,FAN H,et al.Jaagsiekte sheep retrovirus transformation in Madin-Darby canine kidney epithelial cell three-dimensional culture[J].JVirol,2010,84(10):5379-5390.
(编辑白永平)
Recombinant Plasmid pcDNA4/myc-His/exJSRV-env Transiently Transfect A549 Cells and Detect the Activation of MAPK Signal Transduction Pathway
SUN Xiao-lin1,DU Fang-yuan1,LIU Shu-ying1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Huhhot010018,China;2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDiseaseofMinistryofAgriculture,Huhhot010018,China)
In order to explore the pathogenesis of exJSRV Env,by the means of the pathology observation and immunohistochemistry,we detected the pathological characteristics and the positive regions of Env,EGFR,p-Erk1/2 and p-p38 in OPA (ovine pulmonary adenomatosis) sheep lung.Then we detected the relative expressions of p-Erk1/2 and p-p38 in sheep lung and in A549 cells after transiently transfecting recombinant plasmid pcDNA4/myc-His/exJSRV-env by Western blot.Finally we detected the proliferation activity of the cells with recombinant plasmid by CCK-8.Immunohistochemistry results revealed that infected lung cells expressed Env in alveolar epithelial cells and tumor cells;EGFR in alveolar epithelial cells,tumor cells slipping off and interstitial cells but less expressed in alveolar epithelial cells and bronchial epithelial cells in normal sheep lung;p-Erk1/2 and p-p38 in alveolar epithelial cells and tumor cells.Western blot results showed that the activation of p-Erk and p-p38 in OPA sheep lung were higher than normal sheep lung.The relative expressions of p-Erk and p-p38 in the A549 cells with recombinant plasmid were higher than control cells.And CCK8 showed that the proliferation activity of the cells with recombinant plasmid were higher than the control cells.We conclude that exJSRV Env activated EGFR/MAPK signal transduction pathway in A549 cells,and possibly promoted the malignant cell proliferation by this pathway and tumorigenesis.We provide a platform for the pathogenesis of JSRV Env.
exJSRV;envelope protein;MAPK signal transduction pathway;cell proliferation
10.11843/j.issn.0366-6964.2016.08.017
2016-03-28
国家自然基金(31360597);内蒙古科技厅应用研究项目(201502070);内蒙古草原英才创新团队项目(20151031)
孙晓林(1989-),女,内蒙古呼伦贝尔人,博士生,主要从事动物生殖内分泌与病毒病理学的研究,E-mail:732121783@qq.com
刘淑英,教授,博士生导师,E-mail:liushuying_imau@126.com
S852.659.3
A
0366-6964(2016)08-1658-09

