光质对金线莲组培苗生长和主要化学成分的影响
陈美香,武礼宾,曹 立,王智杰,彭东辉,刘银春
(1.福建农林大学机电工程学院,福建 福州 350002;2.福建农林大学艺术园林学院,福建 福州 350002)
光质对金线莲组培苗生长和主要化学成分的影响
陈美香1,武礼宾1,曹立1,王智杰2,彭东辉2,刘银春1
(1.福建农林大学机电工程学院,福建 福州350002;2.福建农林大学艺术园林学院,福建 福州350002)
研究光质对金线莲组培苗生长和主要化学成分含量的影响。在湿度、温度、CO2浓度和光合光量子通量密度(PPFD)都一致的条件下,以白光(荧光)为对照,测量7种单色光处理金线莲组培苗生长量和叶绿素、总黄酮、蛋白和糖的含量。结果表明:白光处理比单色光处理更有利于金线莲组培苗鲜重、干重和叶绿素含量的积累,也更有利于茎粗的增长。和白光相比较,波长660nm红光处理能促进金线莲组培苗株高增长和蛋白的积累,但不利于叶绿素、总黄酮和糖含量的积累;波长442nm蓝光处理能促进叶面积的增长;波长452nm蓝光处理能促进总黄酮的积累。蓝光处理总黄酮含量均大于红光处理。绿光处理有利于糖的积累。
金线莲;特征光谱;生长量;化学成分
引言
金线莲(Anoectochilus roxburghii)为兰科开唇兰属多年生草本植物,是一种珍贵药用植物,有“药王”、“神草”之称。我国主要分布于亚热带地区的台湾、福建、浙江等地。野生金线莲资源非常稀少,加上鸟兽喜食、人为采摘和生态资源破坏,现已濒绝。目前,成熟的组培技术为金线莲大量快速繁殖提供了保障。在金线莲组培技术研究中,对培养基和外植体的研究占主要部分。比如,李艳冬等[1]研究发现,诱导芽培养基以MS+BA2.0 mg/L+NAA0.3 mg/L的处理效果最优,芽丛生增殖培养基以Ms+BA1.5 mg/L+NAA0.5 mg/L的效果最优;王雅英[2]等研究发现,不定芽为诱导愈伤组织最佳外植体。
光是植物生长中最重要的环境因子之一。研究表明,光质、光强、光照时间(或光周期)影响金线莲的生长和内含物积累[3]。例如,肖开前[4 ]等发现蓝光有利于金线莲总黄酮、槲皮素、异鼠李素等主要化学成分的积累。周锦业[ 5]等发现不同光质影响金线莲组培苗叶绿素含量及叶绿素荧光参数。目前,光质对金线莲生长量和内含物积累方面的研究仍然较少,而且研究的光质比较单一,通常是白光和宽波段的红、蓝光。不少研究发现,绿光对植物生长也有影响[6]。LED光源用于研究光质对植物生长的影响具有其独特的优势[7]。LED单色光源单色性好,半波宽度一般是15~35 nm,有利于更精细、更全面地研究光质对植物生长的影响。因此,本文以荧光为对照,设计7组单色LED光源对金线莲组培苗进行试验,目的是较精确地揭示光质对金线莲组培苗生长量和主要化学成分含量的影响,为研究适合金线莲生长的最佳光谱即金线莲特征光谱提供实验依据。
1 材料与方法
1.1材料
金线莲组培苗来自福建金草集团,为福建金线莲圆叶品种。每瓶苗接种10个茎段。2014年9月28日接种完成,放暗室10天,然后移到光量子通量密度(PPFD)小于5μmol·m-2·s-1的白光下培养5天,于2014年10月13日放入8组光源下培养。光源参数具体见表1。

表1 金线莲组培苗培养光源
1.2方法
1.2.1培养条件
试验在福建农林大学光电子农业工程与技术研究中心进行。共8个光照处理。7个单色光处理,分别放在福建农林大学自主研制的第二代植物特征光谱培养箱[8]内7个培养架上培养,组培苗距离光源20cm,光源发出光的PPFD均为100μmol·m-2·s-1。1个荧光对照组在温室中培养,光照条件和单色光处理一致。相对湿度(75±5)%,温度(25±2)℃。培养时间共110天,其中,第1~30天光照时间为8h/d,第31~60天光照时间为10h/d,第61~110天光照时间为12h/d。
1.2.2测量指标
试验结束从各处理中挑选30株大小适中的金线莲组培苗,用于测量株高、鲜重、叶面积、茎直径等生长量,并计算出平均值。植物烘干箱设定温度80℃,连续5h烘干后测量干重。用Tissuelyser-24型全自动样品快速研磨仪研成粉末待用。
叶绿素含量测定采用Amon[9]方法,称取金线莲组培苗鲜叶0.5g,放置于7mL离心管中,倒入5mL浓度为80%的丙酮溶液,置于黑暗条件浸提48h,以12h为间隔摇晃1次离心管,待植物叶片出现白色时,震荡均匀后放在紫外分光光度计中于波长663nm、645nm下测定。
总黄酮含量测定[10],将磨碎的金线莲干样0.1g,置于7mL离心管中。加入沸蒸馏水6mL,在100℃水浴锅浸提30min,随后冷却摇匀,置于冷冻离心机10000r·min-1离心10min。吸取上清液1mL,加入1%三氯化铝溶液5mL混合、震荡,10min后移入紫外分光光度计中,以蒸馏水作为对照进行空白实验,在波长420nm处测其吸光值。
可溶性蛋白含量采用考马斯亮蓝法测定[11]。取金线莲干样粉末0.1g加入5 mL PBS(0.05 mol/L pH=7.0),4℃条件下,10000r·min-1离心10min,上清液为蛋白质提取液。吸取提取液1mL,补充PBS至1mL,加入5mL考马斯亮蓝溶液,充分混合震荡,放置5min后用紫外分光光度计在595nm处测定吸光值,通过标准曲线计算出蛋白含量。
可溶性糖含量采用蒽酮浓硫酸法测定[11]。取金线莲干样粉末0.15g,加入6mL 80%的乙醇,80℃水浴提取30min,冷却至常温,4000r·min-1离心5min,上清液小心转入25mL的容量瓶,以蒸馏水定容到25mL。吸取提取液0.3mL,补充蒸馏水至2mL,对照为2mL蒸馏水,沿试管壁向所有试管中加入3mL的蒽酮-硫酸试剂。摇匀后放入沸水浴中加热10min,取出后自然降温,在625nm处测定吸光值,通过标准曲线计算出糖含量。
1.2.3数据处理
试验测得金线莲组培苗生长量和叶绿素、总黄酮、蛋白、糖的含量,并用SPSS Statistics17.0和Excel2010软件进行相关性分析。
2 结果与分析
2.1光质对金线莲组培苗生长量的影响
图1是试验结束8种光照处理下金线莲组培苗外观图。从图上可以看出,各组培苗的形态存在差异。绿光处理下金线莲组培苗叶片小且叶色枯黄;红光处理下植株最高,叶色浅绿;蓝光处理下植株矮,叶色深绿;荧光处理下植株矮状,叶色墨绿。
表2是金线莲组培苗各生长量的统计平均值。从表2可以看出,8个光照处理下,金线莲组培苗除茎粗差异不大外,株高、鲜重、干重和叶面积存在差异。从株高看,各光照处理下大小顺序是R2>Y>R1>B2>FL>G>B3>B1,红光R2处理下株高最高,达7.002cm,明显高于对照组。蓝光B1处理株高最小,只有红光R2处理的54.9%,比对照组小约1cm。三组蓝光处理中,B2处理株高明显高于B1和 B3处理,高出量达1.5cm。而B1处理株高和B3处理差异很小。两组红光处理差异也明显,红光R2处理比R1高约2cm。黄光处理株高也较高,接近红光R2处理株高。绿光处理株高接近最小。
表2显示,7个单色光处理下的金线莲组培苗鲜重和干重都小于荧光对照组。各光照处理下鲜重大小顺序是FL>R2>R1>B2>G>B3>Y>B1,干重大小顺序是FL> B3>R1>R2>G>Y>B2>B1。蓝光B1处理下鲜重和干重都最轻,但是干物率(=干重/鲜重)却最大,比对照组高2%。单色光中红光R2处理下金线莲组培苗鲜重最重,蓝光B3处理下干重最重。3组蓝光处理中,B2处理下鲜重大于其他两组处理,而蓝光B3处理下干重明显大于其他两组处理。两组红光处理鲜重、干重无明显差异,但红光R1处理下干物率大于R2处理。黄光、绿光处理下鲜重、干重和干物率大小居中。
表2还显示,各光照处理下叶面积的大小依次是:B2>FL > B3>R2> B1> R1> Y >G。除蓝光B2处理下叶面积略大于对照组外,其他单色光处理的叶面积都比对照组小。在单色光中,蓝光B2处理下叶面积最大,是叶面积最小的绿光处理下的2.6倍,且蓝光B2处理下叶面积明显大于其他两组蓝光。两组红光处理下叶面积也存在差异。从表2还可以看出,除了蓝光B3处理下叶片数最多外,其他几个处理差异较小。各单色光处理下茎直径比对照组略小,绿光和黄光茎直径最小,植株最纤细。总的看来,茎粗所有处理差异不大。

图1 金线莲植株生长状况Fig.1 The appearance of Anoectochilus roxburghii seedlings
2.2光质对金线莲组培苗主要化学成分的影响
表3为试验结束测得金线莲组培苗四种主要化学成分的含量。
2.2.1光质对金线莲组培苗叶绿素含量的影响
图2显示,叶绿素总含量(叶绿素a+叶绿素b)大小顺序是FL>B2>Y>G>R1>B1>B3>R2。各单色光处理下叶绿素含量均明显小于对照组。单色光中,蓝光B2处理下叶绿素含量最高,红光R2处理下最低,而蓝光B2处理下叶绿素总量约是红光R2处理下的10倍。三组蓝光处理下比较,差异较大。两组红光处理下比较,差异也显著(P<0.05)。绿光和黄光处理下叶绿素含量也很高,稍大于红光R1处理。
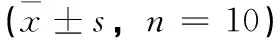
表2 金线莲组培苗的生长量
注:表2中株高、叶面积和叶片数用Dumcan法进行多重比较。同列不同大写字母者表示组间差异极显著(P<0.01);同列不同小写字母者表示组间差异显著(P<0.05);标有相同小写字母者表示组间差异不显著(P>0.05)。表中未标字母表示同列间差异不大。

表3 金线莲组培苗的主要化学成分含量±s,n=10)
注:用Dumcan法进行多重比较。同列不同大写字母者表示组间差异极显著(P<0.01);同列不同小写字母者表示组间差异显著(P<0.05);标有相同小写字母者表示组间差异不显著(P>0.05)。

图2 金线莲组培苗叶绿素含量Fig.2 The chlorophyll content of Anoectochilus roxburghii seedlings
2.2.2光质对金线莲组培苗总黄酮含量的影响
图3显示,总黄酮含量大小顺序是B3>B1>B2>R1>G>Y>FL>R2。蓝光B3处理下总黄酮含量与其他光质处理间存在极显著性差异(P<0.01);红光R2处理下总黄酮含量显著低于其他光质处理(P<0.05);蓝光处理下总黄酮含量均大于红光处理。绿光和黄光处理下总黄酮含量在所有处理中居中。

图3 金线莲组培苗总黄酮含量Fig.3 The flavonoid content of Anoectochilus roxburghii seedlings
2.2.3光质对金线莲组培苗蛋白含量的影响
图4显示,蛋白含量大小顺序是R2>FL>B1>B3>Y>B2>G>R1。红光R2处理下蛋白含量最高,除对照外,与其他光质处理间存在极显著性差异(P<0.01);红光R1处理下蛋白含量低于其他光质处理。三组蓝光处理中,B1处理下蛋白含量略高于其他两个处理。

图4 金线莲组培苗蛋白含量Fig.4 The protein content of Anoectochilus roxburghii seedlings
2.2.4光质对金线莲组培苗糖含量的影响
图5显示,糖含量大小顺序是G>B1>B2>B3>R1>FL>Y>R2。绿光G处理下糖含量最高,红光R2处理下含量最低,两者差异较大。除这两组外,其他光质处理间差异部显著。三组蓝光处理中,B1处理下糖含量略高于其他两个处理。两组红光处理中,红光R1处理下糖含量明显高于R2处理。

图5 金线莲组培苗糖含量Fig.5 The sugar content of Anoectochilus roxburghii seedlings
3 结论与讨论
光质对植物的生长、形态建成和物质代谢均有调控作用[12-14]。试验结果表明,白光处理比单色光处理更有利于金线莲组培苗鲜重、干重和叶绿素含量的积累,也更有利于茎粗的增长。和白光相比较,波长660nm红光处理能促进金线莲组培苗株高增长和蛋白的积累,但不利于叶绿素、总黄酮和糖含量的积累;波长442nm蓝光处理能促进叶面积的增长;波长452nm蓝光处理能促进总黄酮的积累。蓝光处理总黄酮含量均大于红光处理。绿光处理有利于糖的积累。
试验结果还显示,三组蓝光处理下金线莲组培苗生长量和叶绿素含量差异明显,两组红光处理下叶绿素含量也存在很大差异。Hall等[15]研究表明,叶绿素a和叶绿素b的吸收光谱在蓝光波段和红光波段各有两个吸收峰,蓝光波段峰值波长是430nm和453nm,红光波段是643nm和660nm。在本试验所用LED单色光源[16]中,对金线莲组培苗叶绿素积累较有利的蓝光波长是442nm,在430nm和453nm之间;对金线莲组培苗叶绿素积累较有利的红光波长是620nm,波长660nm的红光叶绿素含量在所有单色光处理中最小。可见,植物对蓝光和红光的吸收也具有选择性,对叶绿素积累较有利的光并非是叶绿素a、叶绿素b吸收峰所对应波长的光。其中的物理机理值得进一步研究探讨。绿光曾被认为是对植物生长没用的光,单一绿光对植物生长不利。但本试验表明,绿光下金线莲组培苗仍有较高的叶绿素含量。因此,绿光的作用不可忽视,叶绿素分子对绿光的吸收机理值得探讨。
在所有处理中,波长452nm蓝光处理下总黄酮含量最高;波长660nm红光处理下总黄酮含量最低;蓝光处理下总黄酮含量均大于红光处理。这与肖开前[4]等报道的蓝光促进金线莲总黄酮含量的积累一致,也和雒晓鹏[17]等报道的蓝光促进芽期苦荞总黄酮合成结果一致。波长660nm红光处理下总黄酮含量小于对照而表现出抑制作用,这与谢宝东[18]等在对银杏的研究结果一致,其原因可能与红光抑制PAL活性以及类黄酮合成有关。但波长620nm红光处理下总黄酮含量大于对照而未表现出抑制作用,这和前面分析结果又不相符。再有,研究表明,黄酮化合物有两个吸收带,分别处于波长250~285nm和波长304~350nm[10].。试验中最靠近这两个吸收带的是蓝光B1,但其处理下总黄酮含量并非最高,而低于远离这两个吸收带的蓝光B3处理。可见,光对金线莲组培苗黄酮化合物的影响机理仍需探讨。
本试验结果还表明,波长620nm红光处理抑制可溶性蛋白的积累,这与刘敏玲等[19]对金线莲组培苗的研究结论一致。但本试验同时发现波长660nm红光处理促进可溶性蛋白的积累。可见,不同波段的红光对可溶性蛋白的积累效果是不同的,其原因也值得探讨。
综上所述,本试验研究了同一光强下光质对金线莲组培苗生长和主要化学成分的影响。但是,不同光强、光周期对金线莲组培苗的影响依然未知。因此,有待进一步研究。
[1] 李艳冬,叶红霞,陈丽萍.金线莲组培快繁技术体系的研究[J].江西农业学报,2013,25(4):52-54.
[2] 王雅英,林小华,洪璇.金线莲外植体筛选及愈伤组织诱导研究[J].亚热带植物科学,2011,40(3):41-43.
[3] MA Zengqiang, LI Shishang, ZHANG Meijun. Light intensity affects growth, photosynthetic capability, and total flavonoid accumulation of Anoectochilus plants[J]. HORTSCIENCE,2010, 45(6):863-867.
[4] 肖开前,赖荣才,林仁穗,等.不同培养方式对福建金线莲主要化学成分的影响[J].中药材, 2014,37(4):555-558.
[5] 周锦业,丁国昌,何荆洲,等.不同光质对金线莲组培苗叶绿素含量及叶绿素荧光参数的影响[J].农学学报,2015,5(5): 67-72.
[6] LIN Yuan, LI Jia, LI Bo, et al. Effects of light quality on growth and development of protocorm-like bodies of Dendrobium officinale in vitro[J].Plant Cell Tiss Organ Cult, 2011,105: 329-335.
[7] BULA R J, MORROW T W, TIBBITTS T W, et al. Light-emitting diodes as a radiation source for plants[J]. HortScience,1991, 120: 808-881.
[8] 刘银春,吴金华,吴运铨.一种植物特征光谱实验箱:中国,ZL201320334674.6[P].2013-12-11.
[9] AMON D, MCSWAIN B D, Tsujimoto H Y, et al. Photochemical activity and components of membrane preparations from blue-green algae. I. Coexistence of two photosystems in relation to chlorophyll a and removal of phycocyanin[J]. Biochim.Biophys. Acta,1974,57: 231-245.
[10] 吴立军.天然药物化学[M].北京:科学技术文献出版社,2006:109-112.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:184-201.
[12] MARK T O, CHRISTIAN S H, NING Wei, et al.Targeted destabilization of HY5 during light-regulated development of Arabidopsis[J].Nature, 2000,405: 462-466.
[13] 余意,杨其长,赵姣姣,等.LED光质对三种叶色生菜光谱吸收特性、生长及品质的影响[J]. 照明工程学报,2013,24(增刊):139-145.
[14] 陈炎华,张善端. LED应用于莴苣补光照明综述[J]. 照明工程学报,2013,24(增刊):156-161.
[15] HALL D O, RAO K K,光合作用[M].张永平,译.北京:科学出版社,1984:100.
[16] 武礼宾,曹立,陈美香,等.植物培养箱内LED光源均匀性的研究[J].照明工程学报,2015,26(2):104-109.
[17] 雒晓鹏,卜星星,赵海霞,等.LED光源对芽期苦荞黄酮合成的影响[J].食品科学,2015, 36(3):86-89.
[18] 谢宝东,王华田.光质和光照时间对银杏叶片黄酮、内酯含量的影响[J].南京林业大学学报(自然科学版),2006,02:51-54.
[19] 刘敏玲.LED不同光质对金线莲生理特征及品质的影响[D].福州:福建农林大学,2013:43-45.
Effect of Light Quality on Growth and Main Chemical Composition of Tissue Culture in Anoectochilus Roxburghii
CHEN Meixiang1, WU Libin1, CAO Li1, WANG Zhijie2,PENG Donghui2, LIU Yinchun1
(1.CollegeofMechanicalandElectronicEngineeringFouzhou350002,China;2.CollegeofArtsandLandscapeArchitecture,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
The effect of light quality on growth and main chemical composition of tissue culture in Anoectochilus roxburghii was studied. In the experiment, humidity, temperature, CO2concentration and photosynthetic photon quanta flux density (PPFD) were same in all the tissue culture chambers. The seedlings cultured under white light (light of fluorescent lamp) were made as comparisons, and the seedlings cultured under seven kinds of monochromatic light were measured to get the data about growth mass and chlorophyll, total flavonoids, protein and sugar content. The results showed that white light was more beneficial to improving fresh weight,dry weight, stem diameter and chlorophyll content than monochromatic light. Compared with the comparisons, wavelength 660nm red light could improve the plant height and promote the accumulation of protein content, but it restrained increasing the content of chlorophyll, total flavonoids and sugar. Wavelength 442nm blue light could improve leaf area. Wavelength 452nm blue light helped increasing total flavonoids content. Treatments under blue light had higher total flavonoids content than those under red light. Finally, the results showed that green light promoted the accumulation of sugar.
anoectochilus roxburghii; characteristic spectrum;growth mass; main chemical composition
福建省高校产学合作重大科技项目(项目编号:2012N5002)
刘银春,E-mail:lyc@fafu.edu.cn
TM923
A
10.3969j.issn.1004-440X.2016.02.024

