沉淀法制备Bi2O3的晶相转变过程及其光催化性能
刘 果 卢圆圆 张 静,* 李 智 冯兆池 李 灿
(1辽宁石油化工大学化学化工与环境学部,辽宁抚顺113001;2中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京100190;3中国科学院大连化学物理研究所,催化基础国家重点实验室,辽宁大连116023)
沉淀法制备Bi2O3的晶相转变过程及其光催化性能
刘果1卢圆圆1张静1,*李智2,*冯兆池3李灿3
(1辽宁石油化工大学化学化工与环境学部,辽宁抚顺113001;2中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京100190;3中国科学院大连化学物理研究所,催化基础国家重点实验室,辽宁大连116023)
以硝酸铋为原料,氨水为沉淀剂,通过液相沉淀法制得前驱体Bi(OH)3,并将Bi(OH)3分别在不同温度和时间下焙烧。利用X射线衍射(XRD)、拉曼光谱、热重(TG)、扫描电子显微镜(SEM)、X射线光电子能谱(XPS)及紫外-可见漫反射光谱(UV-Vis DRS)详细研究了Bi(OH)3转变为Bi2O3的过程及相变过程中粒子形貌、大小、光吸收性质等。结果表明,前驱体Bi(OH)3经过焙烧之后,发生了如下的转变过程:Bi(OH)3→Bi5O7NO3→β-Bi2O3/Bi5O7NO3→β-Bi2O3/Bi5O7NO3/α-Bi2O3→α-Bi2O3,而且转变过程伴随着粒子长大。在上述转变过程中,与Bi5O7NO3向β-Bi2O3转变的过程相比,从β-Bi2O3到α-Bi2O3相变过程更为迅速。此外,以光催化降解罗丹明B(RhB)为模型反应,考察了不同晶相的Bi2O3光催化活性,结果表明Bi5O7NO3和β-Bi2O3材料具有优异的光催化性能,而α-Bi2O3具有较低的光催化活性。
Bi5O7NO3;β-Bi2O3;α-Bi2O3;氧化铋;沉淀法;相变
1 引言
近年来,环境污染问题日益严峻,如何有效治理人类发展过程中产生的环境问题迫在眉睫。半导体光催化在空气净化和污水处理等方面表现出诱人的前景1-4,所以半导体光催化材料的研究受到了人们的广泛关注。在众多光催化材料中,作为一种p型半导体材料,氧化铋(Bi2O3)由于其化学性质稳定,无毒,以及具有独特的光学性能,使其在能源利用与环境保护方面显示出广阔的应用前景,已经成为光催化领域研究的热点5-8。Bi2O3具有多种晶体结构:面心立方相δ-Bi2O3、体心立方相γ-Bi2O3、四方相β-Bi2O3、单斜相α-Bi2O3,其中α-Bi2O3和β-Bi2O3的研究及应用最为广泛。β-Bi2O3为室温亚稳晶相,α-Bi2O3为低温稳定相,在升温的过程中β-Bi2O3逐渐向α-Bi2O3转变9。很多研究结果表明,晶相结构是影响Bi2O3光催化性能的主要因素之一10-13。β-Bi2O3能带隙为2.58 eV,α-Bi2O3能带隙为2.85 eV,由于β-Bi2O3具有较窄的能带隙,β-Bi2O3常常显示出较α-Bi2O3更高的活性14。
综上所述,从应用的角度看,控制Bi2O3的物相结构对于光催化领域是非常重要的。因此研究Bi2O3的相变,从而根据实际需要,使晶相之间的转变可以实现人为可控,这对构造不同相结构的Bi2O3催化剂具有重要的意义,相关研究也受到了关注15-18。Hu17等以硝酸铋(Bi(NO3)3∙5H2O)和柠檬酸为原料,NaOH为沉淀剂,采用水热法制备了前驱体,然后将前驱体在250-500°C焙烧得到了Bi2O3光催化材料。研究结果表明,前驱体材料为Bi2O2CO3,在将其焙烧过程中分别发生如下的转变过程:Bi2O2CO3→β-Bi2O3/Bi2O2CO3→β-Bi2O3→β-Bi2O3/α-Bi2O3→ α-Bi2O3。李榕等19以Bi(NO3)3∙5H2O为原料,通过反向滴定沉淀法制备了纳米Bi2O3材料,经TG-DTA、高温XRD以及高温拉曼的研究结果表明,亚稳态β-Bi2O3在升温过程中于420°C先向低温稳定的α-Bi2O3转变,在720°C时向δ-Bi2O3相转变。
目前,Bi2O3的制备方法主要有化学沉淀法、溶胶-凝胶法、微乳法、水热合成法、雾化-燃烧法、固相室温法、等离子体法等。在制备Bi2O3的多种方法中,沉淀法工艺简单,易控制,易操作,易于实现规模化工业生产,是目前常用的制备超细Bi2O3粉体的方法之一19-21。沉淀法常常以硝酸铋为原料,NaOH、NH3∙H2O或Na2CO3为沉淀剂来制备Bi2O3粉体。其中以NH3∙H2O为沉淀剂,可以避免生产过程中混入阳离子杂质,因为在较低温度下就能分解为NH3气体除去,制得的Bi2O3纯度高,而且均匀性好,所以该法具有简单、易于控制、污染少等优点,从而受到了广泛应用。虽然沉淀法制备Bi2O3受到了普遍关注,但是目前关于沉淀法制备Bi2O3过程中各种晶相之间转变的详细研究却鲜有报道。
我们前期采用XRD、拉曼光谱等方法对多晶相氧化物TiO2、ZrO2的相变进行了详细研究22,23。基于前期工作基础,本文以Bi(NO3)3∙5H2O为铋源,NH3∙H2O为沉淀剂,采用沉淀法制备了Bi2O3前驱体,将其分别在不同温度和时间下焙烧得到不同晶相Bi2O3。利用XRD、拉曼光谱、SEM、XPS及紫外可见漫反射光谱详细研究了Bi2O3前驱体在焙烧过程中所经历的晶相转变。并以光催化降解罗丹明B为模型化合物,考察了不同晶相Bi2O3的光催化性能。
2 实验部分
2.1试剂
五水硝酸铋Bi(NO3)3∙5H2O、氨水、硝酸、罗丹明B、无水乙醇(国药集团化学试剂有限公司)等均为分析纯,使用前所有药品均未经过进一步的处理。去离子水为实验室自制。
2.2仪器
采用日本理学D/max-RB X射线衍射仪(XRD)进行成分和物相分析,Cu Kα辐射,管电压40 kV,管电流100 mA,采用θ-2θ连续扫描方式,步长0.02°(2θ),2θ扫描速率为6(°)∙min-1,扫描范围为10°-60°;使用Quanta 200FEG扫描电子显微镜,在加速电压为20 kV条件下对样品的形貌进行分析;紫外-可见漫反射吸收光谱(UV-Vis DRS)是在日本JASCO公司生产的JASCO-V550型紫外可见漫反射光谱仪上进行表征,采集波长范围为200-650 nm,采集速度为100 nm∙min-1。采集步长为2 nm。XPS实验是在Thermo ESCALAB 250Xi型X射线光电子能谱仪上进行的,以单色化Al Kα为激发源(hν=1486.6 eV,15 kV、10.8 mA),电子结合能值(B.E.)以样品污染碳(C 1s,284.6 eV)为内标校正样品的荷电效应。使用TG/ DTA6300型热重-差热综合热分析仪在升温速率为10°C∙min-1条件下对样品的失重情况进行观测。可见拉曼光谱表征是在Jobin Yvon公司生产的U-1000型拉曼光谱仪上进行,激发光源采用Suwtech LDC-2500型532 nm半导体激光器,在室温条件下对样品进行表征。
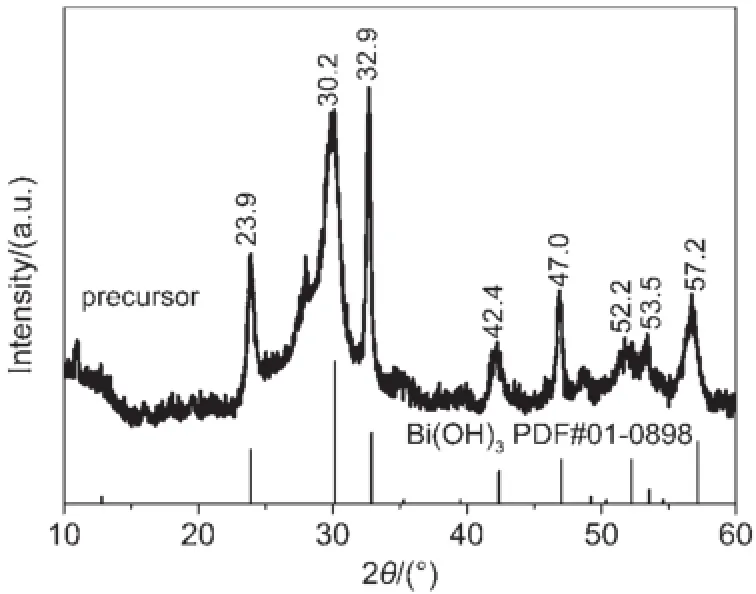
图1 前驱体样品的XRD谱图Fig.1 XRD pattern of the precursor sample
2.3氧化铋样品制备
将一定量的Bi(NO3)3∙5H2O溶于1 mol∙L-1的硝酸中,在搅拌条件下向上述溶液中滴加2 mol∙L-1氨水直至溶液的pH值为13。反应6 h后,将得到的产物分别用去离子水和无水乙醇洗涤两次,在60°C干燥12 h得到前驱体样品。
将前驱体样品分成两部分,一部分前驱体样品分别在365、375、390、400和435°C温度下焙烧4 h,然后冷却至室温。样品分别标记为:precursor-365°C、precursor-375°C、precursor-390°C、precursor-400°C和precursor-435°C。另一部分前驱体样品分别在375°C温度下焙烧1、5、8、10、15、17、20和24 h,然后冷却至室温。样品分别标记为:precursor-1 h、precursor-5 h、precursor-8 h、precursor-10 h、precursor-15 h、precursor-17 h、precursor-20 h、precursor-24h。
2.4光催化性能测试
利用光催化降解罗丹明B(RhB)为模型反应,考察了Bi2O3样品的可见光光催化活性。功率为1000 W,波长为400-700 nm的卤钨灯作为可见光光源。容积为60 mL的反应器上方10 cm处悬有光源。以罗丹明B作为目标降解物,实验在夹套圆柱形玻璃反应器中进行,光催化反应过程中在夹套玻璃中通入冷凝水,以使反应液的温度保持衡定。在反应器中加入初始浓度为10 mg∙L-1的罗丹明B水溶液60 mL和0.06 g的催化剂,搅拌以构成悬浮体系。在可见光光源的照射下进行光降解反应。在开灯之前,反应溶液在黑暗条件下搅拌30 min以达到吸附平衡。光照之后,每隔一定时间取相同体积的上层清液,离心后取上层清液在罗丹明B的553 nm吸收波长处测定其吸光度值,从而计算其光催化活性。
3 结果与讨论
化学沉淀法是将金属铋溶解制得铋盐溶液,然后加入沉淀剂和一定量的分散剂或络合剂,经过滤、洗涤、干燥之后得到前驱体,将前驱体在一定温度下焙烧等来制取Bi2O3粉体24。发生的主要化学反应如下。
溶解:
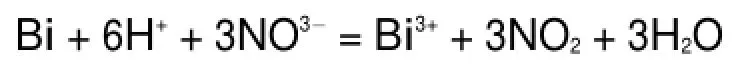
沉淀:
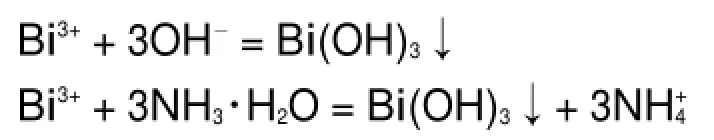
焙烧:
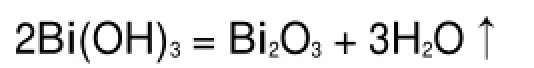
在沉淀过程中,随着溶液pH值的增大,除Bi(OH)3可能会出现BiONO3、Bi(OH)+2和Bi(OH)2+等前驱体24。
3.1前驱体经不同温度焙烧的XRD分析
图1为前驱体样品的XRD谱图,很明显,在2θ=23.9°,30.2°,32.9°,42.4°,47.0°,52.2°,53.5°, 57.2°处观察到归属于Bi(OH)3的特征衍射峰。这表明本实验方法得到的前驱体主要为Bi(OH)3。
图2为前驱体经过不同温度焙烧之后的XRD谱图。焙烧温度为365°C时,在2θ=7.6°,27.6°, 30.7°,45.2°,52.7°处观察到归属为Bi5O7NO3(PDF #51-0525)的较强特征衍射峰。Abdullah等25以Bi(NO3)3∙5H2O和NH3∙H2O为原料,在pH=9的条件下也观察到了Bi5O7NO3的生成。根据文献26报道,Bi5O7NO3是正交晶相,具有层状结构,属于Bi2O3-N2O5体系。Bi5O7NO3晶体结构由两层单元项链层在单元连接下组成的网状结构,硝酸根填充在晶体结构的孔道中。除了Bi5O7NO3的特征衍射峰之外,还在2θ=27.9°, 32.7°,46.1°,55.4°处观察到了强度较弱的特征衍射峰。这些衍射峰分别归属于β-Bi2O3的(201)、(220)、(222)和(421)晶面的衍射峰(PDF#78-1793)。这说明经过365°C焙烧之后,样品为Bi5O7NO3和β-Bi2O3的混合相,其中Bi5O7NO3为主要晶相。
当焙烧温度升高到375和390°C时,Bi5O7NO3特征衍射峰的强度逐渐减弱,而β-Bi2O3特征衍射峰的强度逐渐增强,呈现出此消彼长的趋势,说明样品中Bi5O7NO3含量逐渐减少,β-Bi2O3的含量逐渐增加。也就是说,随着焙烧温度的增加,Bi5O7NO3逐渐向β-Bi2O3转变,这是在一定温度下发生了如下分解反应26,27,从而发生了Bi5O7NO3向β-Bi2O3的转变。

焙烧温度为390°C时,除了Bi5O7NO3和β-Bi2O3的特征谱峰之外,在2θ=25.7°,26.9°,27.4°处也观察到了非常弱的衍射峰,这些衍射峰为α-Bi2O3的特征峰(PDF#71-2274)。说明经过390°C焙烧之后样品中同时存在Bi5O7NO3、β-Bi2O3和α-Bi2O3,而且温度为390°C时,不仅发生了Bi5O7NO3向β-Bi2O3的转变,而且也发生了从β-Bi2O3到α-Bi2O3的相变。当焙烧温度增加到400°C时,Bi5O7NO3的特征衍射峰强度继续减弱,β-Bi2O3的特征衍射峰强度也有所减弱。此外,在2θ= 25.7°,26.9°,27.4°处的α-Bi2O3特征衍射峰的强度有所增加。
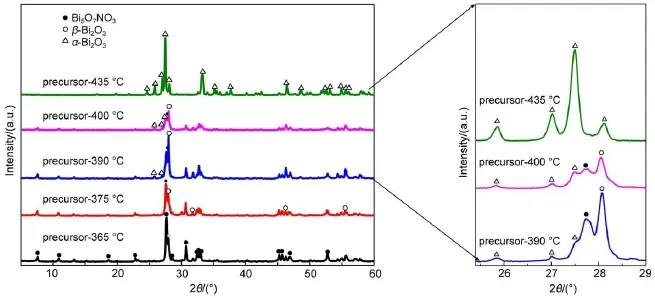
图2 不同温度焙烧前驱体的XRD谱图Fig.2 XRD patterns of precursor calcined at different temperatures
进一步增加焙烧温度到435°C时,Bi5O7NO3和β-Bi2O3的特征谱峰完全消失,只观察到了α-Bi2O3(a=0.5837 nm,b=0.8154 nm,c=0.7494 nm)的特征衍射峰,表明β-Bi2O3完全转变为α-Bi2O3晶相,样品完全处于α-Bi2O3晶相。可以看出,与Bi5O7NO3转变为β-Bi2O3的过程相比,β-Bi2O3到α-Bi2O3的相变速度更为迅速。
此外,值得一提的是,图2中XRD的结果表明,在温度升高的过程中,Bi5O7NO3逐渐向β-Bi2O3转变。所以本文所述实验条件下,Bi5O7NO3可能主要是由Bi(OH)3前驱体转变形成的,然后在一定温度下,Bi5O7NO3逐渐分解成β-Bi2O3。而卢远刚等28以硝酸铋为原料,六次甲基四胺为氮源,采用沉淀法合成了不同氮掺杂量的Bi2O3(N-Bi2O3)粉体。结果表明,N-Bi2O3粉体为Bi5O7NO3和β-Bi2O3的混合晶相。他们认为,Bi5O7NO3的生成是由于在以六次甲基四胺为氮源的条件下,N从体相内部取代了Bi2O3晶格中部分O原子从而形成了Bi―N键而稳定存在。
3.2前驱体经不同温度焙烧的拉曼光谱分析
为了进一步研究前驱体样品在焙烧过程中的晶相变化,我们采用拉曼光谱对不同温度焙烧的前驱体样品进行了分析,结果列于图3中。在前驱体样品的拉曼谱图中,没有观察到明显的拉曼谱峰。焙烧温度为365°C时,分别在90、108、116、146、313和344 cm-1处观察到拉曼谱峰。其中90、108、313 cm-1处的谱峰为β-Bi2O3的特征谱峰。随着焙烧温度增加到390°C,这些拉曼谱峰强度有所增加,而且在464 cm-1处出现了β-Bi2O3的特征谱峰。
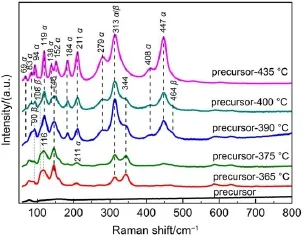
图3 不同温度焙烧前驱体的拉曼光谱图Fig.3 Raman spectra of precursor calcined at different temperatures
随着焙烧温度从365°C增加到390°C,位于116、146、344 cm-1处的Bi5O7NO3的特征谱峰逐渐减弱,表明Bi5O7NO3逐渐向β-Bi2O3转变,这与XRD的结果是一致的。在焙烧温度为375°C时,在184、211和447 cm-1处观察强度非常弱的α-Bi2O3的特征谱峰,表明375°C时有少量α-Bi2O3生成。而XRD的结果(图2)表明,390°C时才观察到α-Bi2O3的特征衍射峰。这可能是由于相比于XRD,拉曼光谱能更灵敏地检测到微量α-Bi2O3的原因。继续增加焙烧温度到390°C时,184、211 和447 cm-1处的谱峰强度增加,同时在83、119、279和313 cm-1处也观察到了α-Bi2O3的特征谱峰。当温度升高到435°C之后,Bi5O7NO3和β-Bi2O3的谱峰完全消失,只观察到α-Bi2O3的特征谱峰,表明435°C时样品完全处于α-Bi2O3晶相。
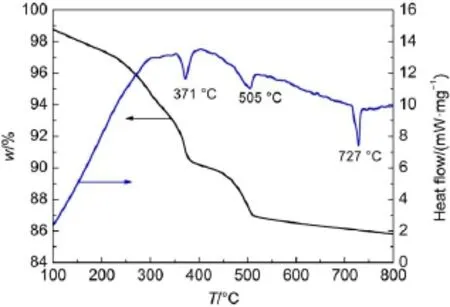
图4 前驱体样品的TG-DTA曲线Fig.4 TG-DTAcurves of the precursor sample
3.3TG-DTA表征
为了更详细了解前驱体的热分解性质,将所制备的前驱体进行了差热-热重分析,结果见图4。当温度升高时,前驱体逐渐失重,明显的失重在200°C后,到505°C后,前驱体的失重趋于平稳。在371和505°C处可以观察到两个吸热峰,均伴随有明显的失重,失重率总和为4.4%,这与Bi5O7NO3发生(1)中所述分解反应的理论失重率4.4%相当,所以371和505°C处的失重可能主要是由于Bi5O7NO3发生分解所引起的29。此外,在727°C处可以观察到一个尖锐的吸热峰,而且没有明显的失重,这个吸热峰的产生可归因于在高温条件下发生的从α-Bi2O3向δ-Bi2O3的晶相转变过程30。
3.4SEM分析
采用SEM进一步研究了焙烧温度对Bi2O3样品的形貌和粒径大小的影响,图5为前驱体经不同温度焙烧样品的SEM谱图。很明显,precursor-365°C样品呈片状,而且片状结构之间呈明显团聚现象。不同焙烧温度下,样品形貌没有明显变化。经过390°C焙烧之后,片状粒子明显长大。不同焙烧温度的XRD结果表明(图2),390和400°C焙烧之后,发生了从β-Bi2O3到α-Bi2O3的相变。这些结果说明,Bi2O3相变的过程伴随着粒子的长大。在其它金属氧化物例如TiO2体系中,很多研究者也都发现了在相变过程中粒子长大的现象31-34。Kumer31认为,由于相变过程中发生键的断裂,所以原子的流动性增加,进而使得粒子逐渐增长。
3.5XPS分析
图6为precursor-375°C样品的XPS全谱及Bi、O、N元素的高分辨分谱扫描图。从precursor-375°C样品的XPS全谱(图6(a))中可以看出样品是由Bi、O、N、C四种元素组成。在铋的高分辨图(图6(b))中,Bi 4f7/2和Bi 4f5/2谱峰分别位于159.1和164.4 eV处,说明precursor-375°C样品中铋以Bi3+存在17,26-28。图6(c)中406.1和403.5 eV处N 1s峰证明了precursor-375°C样品中Bi―N键和N―O的存在27,28。在O 1s的XPS谱图(图6(d))中观察到位于529.3、530.0和531.0 eV的特征峰。531.0 eV处高结合能的峰可以归属Bi―O―Bi,而位于529.3和530.0 eV的特征峰分别归属于O―N键和Bi―O 键26-28。
3.6紫外-可见漫反射光谱(UV-Vis DRS)分析
图7所示为前驱体样品经不同温度焙烧后的紫外可见漫反射光谱图。可以看出,365°C焙烧的样品(Bi5O7NO3和 β-Bi2O3的混合晶相,主要为Bi5O7NO3)在200-530 nm区间显示了较强的吸收。Yu等27采用水热方法制备了Bi5O7NO3,结果表明Bi5O7NO3在200-340 nm区间显示了较强吸收,波长大于400 nm之后几乎没有吸收。所以,365°C焙烧样品的紫外可见漫反射光谱图中,200-340 nm区间主要归因于为Bi5O7NO3和β-Bi2O3的吸收,而400-500 nm处的吸收峰主要归属于β-Bi2O3的吸收峰17。与365°C焙烧的样品相比,当前驱体样品在390°C焙烧之后,在399 nm处出现一个肩峰,这个肩峰是由于在390°C开始生成α-Bi2O3而产生的。399 nm处的肩峰随着焙烧温度的增加而逐渐变强,这也表明随着焙烧温度的增加样品逐渐向α-Bi2O3晶相转化,这与图2中XRD的结果一致。焙烧温度提高到435°C时,XRD的结果(图2)表明样品处于α-Bi2O3晶相,根据图7中内置图的计算结果,α-Bi2O3的能带隙为2.67 eV,与文献35的结果一致。

图5 前驱体经不同温度焙烧的SEM谱图Fig.5 SEM images of the precursor calcined at different temperatures(a,b)precursor-365°C,(c,d)precursor-375°C,(e,f)precursor-390°C,(g,h)precursor-400°C,(i,j)precursor-435°C
3.7前驱体经375°C不同时间焙烧的XRD分析
为了详细研究Bi5O7NO3、β-Bi2O3和α-Bi2O3之间转变过程,尤其是β-Bi2O3到α-Bi2O3的相变过程,我们选取了375°C为焙烧温度,以期通过改变焙烧时间来仔细研究相变过程。图8为前驱体经375°C焙烧不同时间的XRD衍射图,对于precursor-1 h样品,虽然一个弱的β-Bi2O3衍射峰出现,但Bi5O7NO3仍然是precursor-1 h主要的晶相结构。将焙烧时间从1 h增加到15 h时,β-Bi2O3的特征衍射峰强度逐渐增强,同时Bi5O7NO3的特征衍射峰的强度逐渐减弱,说明随着焙烧时间的延长,Bi5O7NO3逐渐向β-Bi2O3转变,这与图2的结果一致。
当焙烧时间达到17 h时,Bi5O7NO3的特征衍射峰强度继续减弱,β-Bi2O3的特征衍射峰强度没有明显变化,同时在precursor-17 h样品的XRD衍射中观察到α-Bi2O3,说明焙烧时间延长至17 h时,β-Bi2O3开始向α-Bi2O3相变。当焙烧时间增加到20 h时,Bi5O7NO3衍射峰强度继续减弱,β-Bi2O3的特征衍射峰强度也在减弱,同时α-Bi2O3衍射峰的强度增加。当焙烧时间达到24 h时,Bi5O7NO3和β-Bi2O3特征衍射完全消失,样品完全处于α-Bi2O3晶相。很明显,与Bi5O7NO3向β-Bi2O3转变的过程相比(precursor-1 h样品中Bi5O7NO3为主要晶相,precursor-20 h样品中仍然存在Bi5O7NO3),从β-Bi2O3到α-Bi2O3相变过程(precursor-17 h开始出现α-Bi2O3,precursor-24 h完全转变为α-Bi2O3)是迅速的。这可能主要是因为β-Bi2O3是亚稳相,一旦满足相变的条件,β-Bi2O3很容易相变为α-Bi2O3。

图6 precursor-375°C样品的XPS全谱图(a)及Bi(b)、N(c)、O(d)元素高分辨谱图Fig.6 XPS spectra of the precursor-375°C sample(a)and high resolution scan of Bi(b),N(c),O(d)elements

图7 不同温度焙烧样品的紫外-可见漫反射吸收光谱Fig.7 UV-Visble diffuse reflection absorption spectra of samples calcined at different temperaturesinset:calculated band gap energy of the precursor-435°C sample
综上所述,以Bi(NO3)3∙5H2O为铋源,NH3∙H2O为沉淀剂,采用沉淀法制备的Bi2O3前驱体(Bi(OH)3)在经过焙烧之后,发生了如下了转变过程:
前驱体→Bi5O7NO3→β-Bi2O3/Bi5O7NO3→β-Bi2O3/Bi5O7NO3/α-Bi2O3→α-Bi2O3
此外,结合图2和图8的结果,可以看出,采用本文所述制备方法,很容易在较高焙烧温度或较长焙烧时间下得到α-Bi2O3,但是不容易控制制备纯β-Bi2O3晶相及α-Bi2O3和β-Bi2O3的混合晶相。
3.8光催化活性分析
水和空气中的绝大多数有机污染物,其中包括染料、表面活性剂、卤代脂肪烃、多环芳烃等用传统的处理方法是难以消除的。而以Bi2O3作光催化剂,在光照下,这些有机物会发生氧化还原反应,逐步降解,最终氧化为环境友好的CO2、H2O和无毒的无机物,因此被认为是一种极具前途的有机污染物深度净化技术。我们选用罗丹明B (RhB)这种最常见的染料为光催化反应模型污染物,分别考察了不同晶相Bi2O3样品的光催化活性,结果示于图9中。
通常情况下,光降解反应遵循一级反应动力学36。在间歇式反应器中,动力学方程为:ln(C0/ C)=kt(C0和C分别代表初始时刻和任意时刻t罗丹明B的浓度),如果关于ln(C0/C)和时间t的线性方程成立,由直线的斜率可得到速率常数k。从图10可以看出,所有样品的线性相关系数在0.9以上,说明降解率罗丹明B的反应为一级动力学反应。
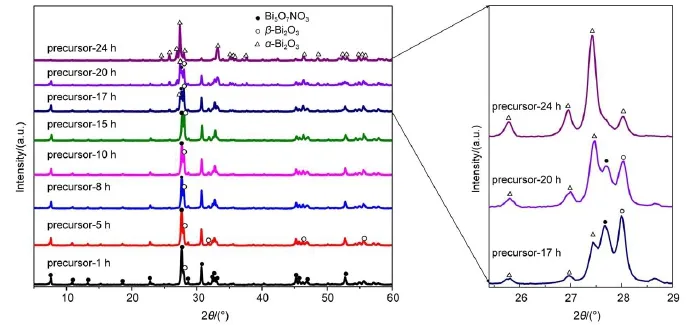
图8 前驱体经375°C焙烧不同时间的XRD图谱Fig.8 XRD patterns of the precursor calcined at 375°C for different time
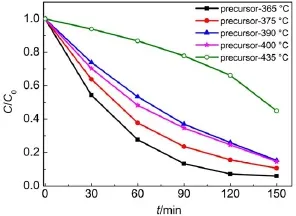
图9 前驱体经不同温度焙烧RhB的可见光催化降解率图Fig.9 Photocatalytic degradation of RhB on precursor calcined at different temperatures
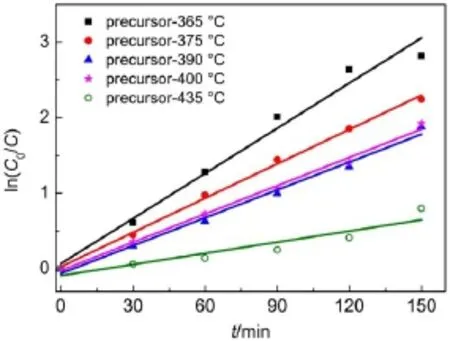
图10 前驱体经不同温度焙烧的光催化降解反应一级动力学曲线Fig.10 First-order kinetics curves of photocatalytic degradation on precursor calcined at different temperatures
很明显,precursor-365°C显示了最高的光催化活性,在150 min的光照条件下光催化降解率达到95%。precursor-375°C样品的光催化活性与precursor-365°C接近,光降解效率达到90%。XRD的结果表明(图2),precursor-365°C和precursor-375°C两个样品主要为Bi5O7NO3,说明Bi5O7NO3具有优异的光催化性能。Yu等27采用水热方法合成了Bi5O7NO3材料,结果表明,Bi5O7NO3具有较好的光催化降解罗丹明B的性能。虽然焙烧温度为390°C和400°C时,样品的光催化活性有所下降,但是150 min光照条件下光催化降解率仍能达到84%。XRD和拉曼的结果表明,焙烧温度为390和400°C时,样品为Bi5O7NO3、β-Bi2O3和α-Bi2O3的混合晶相,其中β-Bi2O3为主要晶相。说明β-Bi2O3也具有较优异的光催化性能。很明显,precursor-435°C样品为α-Bi2O3晶相,但是在相同光照条件下,其光催化降解率为55%,表明了α-Bi2O3具有较低的光催化活性。这是由于β-Bi2O3能带隙为2.58 eV,α-Bi2O3能带隙为2.85 eV,所以β-Bi2O3具有较窄的能带隙,β-Bi2O3常常显示出较α-Bi2O3更高的活性。此外,与390°C焙烧的样品相比(比表面积:11.1 m2∙g-1),precursor-435°C样品的比表面积较低(比表面积:4.7 m2∙g-1),也是α-Bi2O3具有较低的光催化活性的原因之一。
4 结论
通过沉淀法制备了前驱体Bi(OH)3,并采用XRD、拉曼光谱、热重、SEM和XPS等详细研究了经不同温度和不同时间焙烧下,Bi(OH)3、Bi5O7NO3、β-Bi2O3和α-Bi2O3之间的转变过程。结果表明,在高温焙烧下Bi(OH)3先转变为Bi5O7NO3。随着焙烧温度的增加或者焙烧时间的延长,Bi5O7NO3发生分解反应生成β-Bi2O3。继续升高焙烧温度,β-Bi2O3相变为α-Bi2O3。与Bi5O7NO3向β-Bi2O3转变的过程相比,从β-Bi2O3到α-Bi2O3相变过程是迅速的。这可能主要是因为β-Bi2O3是亚稳相,一旦满足相变的条件,β-Bi2O3很容易相变为α-Bi2O3。所以采用本实验条件下的沉淀方法,很容易在较高焙烧温度或较长焙烧时间下得到α-Bi2O3,但是不容易控制制备纯β-Bi2O3晶相及α-Bi2O3和β-Bi2O3的混合晶相。在本实验可以为控制合成不同晶相Bi2O3提供实验依据。
不同晶相光催化降解罗丹明B的实验结果表明,样品中Bi5O7NO3、β-Bi2O3和α-Bi2O3的组成对光催化活性有很大的影响。样品主要为Bi5O7NO3时,光照150 min条件下光催化降解RhB效率可达到95%,表现出优异的光催化。而当样品中开始出现α-Bi2O3晶相后,光催活性出现了明显的下降趋势。而当样品完全转变为α-Bi2O3时,其光催化活性进一步降低。
References
(1)Fujishima,A.;Honda,K.Nature 1972,238,37.doi:10.1038/ 238037a0
(2)Karunakaran,C.;Dhanalakshmi,R.Sol.Energy Mater.Sol. Cells 2008,92(5),588.doi:10.1016/j.solmat.2007.12.009 (3)Zhu,J.F.;Zäch,M.Curr.Opin.Colloid Interface Sci.2009,14 (4),260.doi:10.1016/j.cocis.2009.05.003
(4)Kumar,B.;Llorente,M.;Froehlich,J.;Dang,T.;Sathrum,A.; Kubiak,C.P.Annu.Rev.Phys.Chem.2012,63,541.doi: 10.1146/annurev-physchem-032511-143759
(5)Cheng,H.F.;Huang,B.B.;Lu,J.B.;Wang,Z.Y.;Xu,B.; Qin,X.Y.;Zhang,X.Y.;Dai,Y.Phys.Chem.Chem.Phys. 2010,12(48),15468.doi:10.1039/c0cp01189d
(6)Wang,C.H.;Shao,C.L.;Liu,U.C.;Zhang,L.N.Scripta Mater.2008,59(3),332.doi:10.1016/j.scriptamat.2008.03.038
(7)Wang,C.;Shao,C.;Wang,L.;Zhang,L.;Li,X.;Liu,Y. J.Colloid Interface Sci.2009,333(1),242. doi:10.1016/j.jcis.2008.12.077
(8)Brezesinski,K.;Ostermann,R.;Hartmann,P.;Perlich,J.; Brezesinski,T.Chem.Mater.2010,22(10),3079.doi: 10.1021/cm903780m
(9)Hou,J.G.;Yang,C.;Wang,Z.;Zhou,W.L.;Jiao,S.Q.;Zhu, H.M.Appl.Catal.B:Environ.2013,142-143,504.
(10)Xiao,X.;Hua,R.P.;Liu,C.;Xing,C.L.;Qian,C.;Zuo,X.X.; Nan,J.M.;Wang,L.S.Appl.Catal.B:Environ.2013,140-141,433.
(11)Huang,Q.Q.;Zhang,S.N.;Cai,C.X.;Zhou,B.Mater.Lett. 2011,65(6),988.doi:10.1016/j.matlet.2010.12.055
(12)Qiu,Y.F.;Yang,M.L.;Fan,H.B.;Zuo,Y.Z.;Shao,Y.Y.;Xu, Y.J.;Yang,X.X.;Yang,S.H.CrystEngComm 2011,13(6), 1843.doi:10.1039/C0CE00508H
(13)Schlesinger,M.;Schulze,S.;Hietschold,M.;Mehring,M. Dalton Trans.2013,42(4),1047.doi:10.1039/C2DT32119J
(14)Lu,Y.;Zhao,Y.;Zhao,J.Z.;Song,Y.H.;Huang,Z.F.;Gao,F. F.;Li,N.;Li,Y.W.Ceram.Int.2014,40(9),15057.doi: 10.1016/j.ceramint.2014.06.113
(15)Zhu,G.Q.;Lian,J.;Hojamberdiev,M.;Que,W.X.J.Clust. Sci.2013,24(3),829.doi:10.1007/s10876-013-0576-1
(16)Cai,G.Y.;Xu,L.L.;Wei,B.;Che,J.X.;Gao,H.;Sun,W.J. Mater.Lett.2014,120,1.doi:10.1016/j.matlet.2014.01.027
(17)Hu,R.P.;Xiao,X.;Tu,S.H.;Zuo,X.X.;Nan,J.M.Appl. Catal.B:Environ.2015,163,510.doi:10.1016/j. apcatb.2014.08.025
(18)Sun,Y.Y.;Wang,W.Z.;Zhang,L.;Zhang,Z.J.Chem.Eng.J. 2012,211-212(15),161.
(19)Li,R.;Zhen,Q.;Guo,S.Q.;Shi,G.;Vannier,R.N.;Drache, M.J.Funct.Mater.2006,37(11),1828.[李榕,甄强,郭曙强,石刚,Rose-Noelle Vannier,Michel Drache.功能材料,2006,37(11),1828.]
(20)Cheng,L.J.;Kang,Y.J.Alloy.Compd.2014,585,85.doi: 10.1016/j.jallcom.2013.08.010
(21)Tseng,T.K.;Choi,J.;Jung,D.W.;Davidson,M.;Holloway,P. H.ACS.Appl.Mater.Interfaces 2010,2,943.doi:10.1021/ am900812a
(22)Zhang,J.;Xu,Q.;Li,M.J.;Feng,Z.C.;Li,C.J.Phys.Chem. C 2009,113(5),1698.doi:10.1021/jp808013k
(23)Li,M.J.;Feng,Z.C.;Xiong,G.;Ying,P.L.;Xin,Q.;Li,C. J.Phys.Chem.B 2001,105,8107.doi:10.1021/jp010526l
(24)Wu,S.H.;Liu,J.;Lan,Y.Z.Hydrometallurgy of China 2005, 24(3),121.[吴绍华,刘进,兰尧中.湿法冶金,2005,24 (3),121.]
(25)Abdullah,A.H.;Abdullah,E.A.;Zainal,Z.;Hussein,M.Z.; Ban,T.K.Water Sci.Technol.2012,65(9),1632.doi: 10.2166/wst.2012.057
(26)Abdullah,E.A.;Abdullah,A.H.;Zainal,Z.;Hussein,M.Z.; Ban,T.K.E-J.Chem.2012,9(4),2429.doi:10.1155/2012/707853
(27)Yu,S.J.;Zhang,G.K.;Gao,Y.Y.;Huang,B.B.J.Colloid Interface Sci.2011,354,322.doi:10.1016/j.jcis.2010.10.012
(28)Lu,Y.G.;Yang,Y.C.;Ye,Z.X.;Liu,S.Y.J.Inorg.Mater. 2012,27(6),643.[卢远刚,杨迎春,叶芝祥,刘盛余.无机材料学报,2012,27(6),643.]doi:10.3724/SP.J.1077.2012.00643
(29)Kodama,H.J.Solid State Chem.1994,112,27.doi:10.1006/ jssc.1994.1259
(30)Hao,W.C.;Gao,Y.;Jing,X.;Zou,W.;Chen,Y.;Wang,T.M. J.Mater.Sci.Technol.2014,30(2),192.doi:10.1016/j. jmst.2013.09.023
(31)Kumar,K.P.Scripta Metall.Mater.1995,32(6),873. doi:10.1016/0956-716X(95)93217-R
(32)Hague,D.C.;Mayo,M.J.Nanostruct.Mater.1993,3(1-6), 61.doi:10.1016/0965-9773(93)90063-H
(33)Banfield,J.F.;Bischoff,B.L.;Anderson,M.A.Chem.Geol. 1993,110(1-3),211.doi:10.1016/0009-2541(93)90255-H
(34)Kumar,K.N.P.;Keizer,K.A.;Burggraaf,J.;Okubo,T.; Nagamoto,H.;Morooka,S.Nature 1992,358(6381),48. doi:10.1038/358048a0
(35)Wu,Y.C.;Chaing,Y.C.;Huang,C.Y.;Wang,S.F.;Yang,H. Y.Dyes Pigments 2013,98,25.doi:10.1016/j. dyepig.2013.02.006
(36)Li,X.Y.;Wang,D.S.;Cheng,G.X.;Luo,Q.Z.;An,J.;Wang, Y.H.Appl.Catal.B:Environ.2008,81,267.doi:10.1016/j. apcatb.2007.12.022
Phase Transformation and Photocatalytic Properties of Bi2O3Prepared Using a Precipitation Method
LIU Guo1LU Yuan-Yuan1ZHANG Jing1,*LI Zhi2,*FENG Zhao-Chi3LI Can3
(1School of Chemistry and Materials Science,Liaoning Shihua University,Fushun 113001,Liaoning Province,P.R.China;2Key Laboratory of Photochemical Conversion and Optoelectronic Materials,Technical Institute of Physics and Chemistry, Chinese Academy of Sciences,Beijing 100190,P.R.China;3State Key Laboratory of Catalysis,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,Liaoning Province,P.R.China)
ABi(OH)3precursor was prepared using a precipitation method using bismuth nitrate as a starting material and ammonia as the precipitation agent.Bi(OH)3was then calcined at different temperatures and different time.X-ray diffraction(XRD),Raman spectroscopy,thermogravimetry(TG),scanning electronic microscopy(SEM),X-ray photoelectron spectroscopy(XPS),and UV-Vis diffuse reflectance spectroscopy(UVVis DRS)were used to investigate the phase transformation from Bi(OH)3to Bi2O3and the particle size, morphology,and optical properties of Bi2O3during the phase transformation.It was found that Bi(OH)3after calcination undergoes the following process:Bi(OH)3→Bi5O7NO3→β-Bi2O3/Bi5O7NO3→β-Bi2O3/Bi5O7NO3/α-Bi2O3→α-Bi2O3.It was observed that the above phase transformation from Bi(OH)3to Bi2O3and the growth of the particle size are interrelated.It was also found that the phase transition from β-Bi2O3to α-Bi2O3was faster compared with the phase transition from Bi5O7NO3to β-Bi2O3.Also,the degradation of Rhodamine B(RhB)wasstudied to investigate and compare the photocatalytic performance of Bi2O3with different crystalline phases. The result indicates that Bi5O7NO3and β-Bi2O3exhibit excellent photocatalytic performance,while α-Bi2O3has a low photocatalytic activity.
November 19,2015;Revised:February 22,2016;Published on Web:February 23,2016.
Bi5O7NO3;β-Bi2O3;α-Bi2O3;Bismuth oxide;Precipitation method;Phase transformation
O643.3
10.3866/PKU.WHXB201602231
*Corresponding authors.ZHANG Jing,Email:jingzhang_dicp@live.cn;Tel:+86-24-5686390.LI Zhi,Email:zhili@126.com.
The project was supported by the National Natural Science Foundation of China(21573101),Scientific Research Foundation for the Returned
Overseas Chinese Scholars,Ministry of Education of China([2013]1792),Natural Science Foundation of Liaoning Province,China(2014020107), Program for Liaoning Excellent Talents in University,China(LJQ2014041),and Key Laboratory of Photochemical Conversion and Optoelectronic Materials,Technical Institute of Physics and Chemistry,ChineseAcademy of Sciences.
国家自然科学基金(21573101),教育部留学回国科研启动基金(教外司留[2013]1792号),辽宁省自然科学基金(2014020107),辽宁省高等学校优秀人才支持计划项目(LJQ2014041)和中国科学院理化技术研究所光化学转换与功能材料重点实验室开放课题资助

