翅碱蓬根系降油细菌的筛选及其生长特性研究
李作扬,田锐,于子超,王斌
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
翅碱蓬根系降油细菌的筛选及其生长特性研究
李作扬,田锐,于子超,王斌
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
为建立适用于沿海滩涂石油污染的翅碱蓬-细菌复合修复技术,对翅碱蓬Suaeda heteroptera Kitag根系及其土壤进行常规细菌分离,并采用柴油为唯一碳源的平板,从中筛选具有降油性能的菌株并对筛选的菌株进行降油性能测定,研究其在不同作用时间 (3、5、7 d)时对柴油的原始降解率,选择在3个时间段中降油性能均较高的菌株作为目的菌进行形态学观察、生理生化特征和16S rDNA序列分析,测定其生长特性。结果表明:试验中共分离纯化出28株细菌,其中具有降油性能的细菌有7株,编号分别为S1、G3、G4、G9、G10、G11、G12;7株细菌对柴油的原始降解率,作用3 d时分别为34.21%、3.68%、18.40%、18.95%、0.52%、9.47%、21.05%,作用5 d时分别为44.06%、3.19%、23.90%、24.70%、31.47%、25.90%、46.22%,作用 7 d时分别为 41.09%、1.49%、14.36%、28.22%、14.36%、29.70%、31.68%;S1、G11和G12菌株对柴油具有较高降解率;S1属微杆菌属Microbacterium,与Microbacterium saperdate的相似性为98.7%,G11和G12均属于刘志恒菌属Zhihengliuella,与Zhihengliuella halotolerans的相似性均为99.8%,3株菌的最适生长温度范围均为15~30℃,最适生长盐度分别为0、20、20,最适生长pH分别为5、7和7。
翅碱蓬;石油降解菌;鉴定
目前,海上石油泄露事故频发,使得海洋生态环境面临巨大的威胁和破坏,沿岸地区海洋经济的可持续发展受到了严重的威胁,因此,海洋生态系统的修复与保护越来越受到广泛的重视。从20世纪70年代起,国内外学者就开始了有关海洋环境受石油污染后的生物修复研究[1-6]。生物修复是指利用生物代谢活动催化降解有机污染以消除污染、保护环境的过程。1989年,美国油轮溢油事件中首次大规模使用了生物修复技术,1992年,以色列开发出一种菌制肥料用于增强烃降解活动[7]。此后,中国学者在石油生物修复研究中也进行了一些相关研究。白洁等[8]对优势石油降解菌进行了筛选,并对其最适生长条件、降解性能和环境修复过程中的作用进行了细致研究;刘媚媚等[9]在培养出高效降解菌的同时,对石油降解菌的碳纤维固定化进行了系统研究。但有关嗜盐菌株在沿海滩涂石油污染中的生物修复作用报道较少。
翅碱蓬 Suaeda heteroptera Kitag隶属于藜科Chenopodiaceae、碱蓬属Suaeda,属一年生草本植物[10],是高盐碱生态环境的重要植被。研究表明,石油烃污染修复的植物主要有苜蓿Medicago sativa、黑麦草Lolium perenne、酥油草Festuca ovina等非盐生植物,而海岸带等地多属高盐碱土壤,故耐盐碱的翅碱蓬优势显而易见。翅碱蓬不仅对于维持湿地生态系统的稳定性、吸收累积重金属等具有重要作用,而且对石油污染物的去除也具有促进作用。何洁等[11]研究表明,翅碱蓬对Cu、Pb均具有一定的耐受性,且低含量的Cu(100 mg/kg)会促进翅碱蓬生长。因此,翅碱蓬在盐碱及污染土壤生物修复中有着重要的地位。本研究中,通过分离筛选翅碱蓬根系土壤中的降油细菌,研究其相关特性,以期获取降油细菌菌种资源,构建翅碱蓬-降油细菌载体,为建立适用于沿海滩涂石油污染的复合生物修复技术提供理论依据。
1 材料与方法
1.1材料
试验用翅碱蓬采自辽宁省盘锦“红海滩”地区,将翅碱蓬连带根系土壤一起采集,24 h内带回实验室进行细菌分离。
试验用培养基为2216E固体培养基,柴油培养基由100 mL基础培养基中添加1 mL无菌0#柴油制成[12]。
1.2方法
1.2.1细菌分离 将翅碱蓬及其土壤样品分别处理,根系可抖落下的土壤作为样品T;然后用无菌海水冲洗根部,收集所有冲洗水作为样品S;取经过无菌海水冲洗3遍后的翅碱蓬根系,剪碎后置于无菌研钵中,并加入倍量无菌海水,充分研磨后取上清液作为样品G。将样品T、S、G分别用无菌水稀释101、102、103、104、105倍,分别取 0.1 mL涂布于2216E平板上,在25℃恒温培养箱中培养24 h。根据菌落形态特征挑取不同单菌落,在2216E平板上多次划线纯化后并保种。
1.2.2降油菌株的筛选 将纯化后的菌株分别在以柴油为唯一碳源的平板上划线,然后置于恒温培养箱 (25℃)中培养24 h,挑取在柴油平板上生长良好的菌株作为备选降油菌株进行后续试验。
1.2.3分离菌株原始降解率的测定 用5 mL无菌生理盐水将备选降油菌株从2216E斜面培养物上洗下,稀释至浓度为9×109cells/mL的菌悬液,以1%的接种量接种于100 mL以柴油为唯一碳源的液体柴油培养基中,将菌株置于25℃、150 r/min的恒温摇床中培养,每组设置3个平行,以不接菌的培养基作为对照组,分别培养3、5、7 d后测定其降油率作为复筛依据,选择原始降解率高的菌株作为目标菌株进行后续试验。
石油降解率的测定方法:向培养瓶中加入50 mL石油醚,充分振荡后静置,待分层后用移液枪取上层液500 μL放入25 mL比色管中,并用石油醚定容至25 mL。混匀后,在紫外分光光度计上扫描柴油的最大吸收波长,在最大波长处测量各试验组及对照组的吸光值 (OD),按照石油降解率公式计算平均降解率[13-14]:
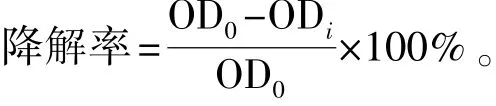
其中:OD0为对照组残余柴油的吸光值;ODi为试验组残余柴油的吸光值。
1.2.4降油菌株的鉴定 按照 《常见细菌系统鉴定手册》对复筛所得降解性能较好的降油菌株进行鉴定,其中生理生化特征利用API 20NE和API ZYM试剂条进行,接种2216E液体培养物以保证测试过程中NaCl浓度达到菌体生长要求。同时委托生工生物工程 (大连)股份有限公司进行试验菌株的16S rDNA序列测定,将16S rDNA测序结果在GenBank中进行比对,利用MEGA 5.0软件构建系统发育树,以进一步确定其分类地位。
1.2.5降油菌株的生长特性
(1)最适生长温度。将筛选得到的降解菌株于2216E液体培养基在25℃下活化24 h后,挑取一杯接种于2216E液体培养基中,分别置于0、10、15、20、25、30、35、40℃下静置培养24 h,每个温度设置3个平行。以不接菌的培养基作为对照,利用紫外分光光度法测定各组菌体的吸光值(OD600 nm)。
(2)最适生长pH。按照上述方法,将石油降解菌接种到pH分别为5、6、7、8、9、10的2216E液体培养基中,每个pH设置3个平行,以不接菌的培养基作为对照,25℃下静置培养24 h,利用紫外分光光度法测定各组菌体的吸光值。
(3)最适生长盐度。同法,将石油降解菌分别接种于盐度分别为0、5、10、20、30的牛肉膏蛋白胨液体培养基中,25℃下静置培养24 h,每个盐度设置3个平行,以不接菌的培养基作为对照,利用紫外分光光度法测定各组菌体的吸光值。
1.3数据处理
利用SPSS 19软件对试验数据进行统计分析,采用单因素方差分析法进行显著性检验,采用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1翅碱蓬样品细菌的分离
T、S、G 3种样品中,根据菌落形态共分离纯化出28株代表菌株,其中样品T有14株,样品G 有13株,样品S有1株,分别编号为T2、T3、T6、T8、T9、T12、T14、T15-1、T17、T18、T19、T19-1、T20、T21、G1、G3、G4、G5、G6、G6-1、G7、G8、G9、G10、G11、G12、G13、S1。
2.2降油细菌的筛选
2.2.1筛选细菌的菌落形态 通过柴油平板筛选,共得到7株能以柴油为唯一碳源生长的细菌,分别为S1、G3、G4、G9、G10、G11、G12,具体菌落形态见表1。

表1 分离菌株的形态特征Tab.1 Morphological characteristics of the isolated strains
2.2.2筛选降油细菌的形态 显微镜下7株菌的形态显示:S1菌株细胞呈微小杆状,为革兰氏阳性;G3、G4、G9、G11、G12菌株均呈杆状,为革兰氏阴性;G10菌株呈球状,为革兰氏阴性。
2.3降油菌株的初始降解性能
在紫外分光光度计上对商品柴油进行扫描,得到最大吸收波长为221 nm,在此波长下测得各组的吸光值,再利用公式计算降解率。从图1可见:作用3 d时,降解率最高为S1菌株 (34.21%),其次为G12菌株 (21.05%),其余按降解率由高到低依次为 G9、G4、G11、G3、G10菌株(18.95%、18.40%、9.47%、3.68%和0.52%);作用5 d时,降解率最高为G12菌株 (46.22%),其次为S1菌株 (44.06%),其余降解率由高到低依次为G10、G11、G9、G4、G3菌株 (31.47%、25.90%、24.70%、23.90%和3.19%);作用7 d时,降解率最高为 S1菌株 (41.09%),其次为G12菌株 (31.68%),其余依次为G11、G9、G4、G10、G3菌株(29.70%、28.22%、14.36%、14.36和1.49%)。多重比较结果表明:作用3 d时,S1菌株的降解率显著高于G3、G10、G11菌株 (P<0.05),G3、G10菌株的降解率显著低于其他菌株 (P<0.05);作用5 d时,S1、G12菌株的降解率显著高于 G3、G4、G9菌株 (P<0.05),G3菌株的降解率显著低于除G4、G9菌株之外的其他菌株(P<0.05),G10菌株的降解率提高最快,甚至超过了G4、G9和G11菌株;作用7 d时,S1、G12菌株的降解率显著高于G3、G4、G10菌株(P<0.05),G11菌株的降解率也较高,故选择S1、G11和G12菌株为目标菌株进行后续试验。

图1 降油菌株作用3、5、7 d时的柴油降解率Fig.1 Diesel degradation rate by oil degradating bacteria within 3,5,and 7 days
2.4菌株的鉴定
2.4.1生理生化特征 3株目标菌株的生理生化特征见表2,G11、G12菌株主要特征符合刘志恒菌属,S1菌株主要特征符合微杆菌属。

表2 S1、G11和G12菌株的生理生化特征Tab.2 Biochemical and physiological characteristics of strains S1,G11 and G12
将S1、G11、G12 3个菌株的16S rDNA序列结果输入NCBI中进行比对,结果发现,S1菌株与微杆菌 Microbacterium saperdate的相似性达到98.7%,G11、G12菌株与耐盐刘志恒菌Zhihengliuella halotolerans的相似性达到 99.8%,使用MEGA 5.0软件构建此3株菌及其属内其他菌株的系统发育树。可以确定,S1菌归属于微杆菌属,为微杆菌,G11、G12菌归属于为刘志恒菌属,为刘志恒菌 (图2)。
2.4.2菌株的生长特性 生长特性结果显示:S1菌株最适生长温度为30℃,生长温度范围为15~35℃,在盐度为0时生长最好,在盐度为5~10时生长较好,最适pH为5~6;G11、G12菌株最适生长温度均为30℃,最适生长盐度均为20,最适生长pH均为7(图3~图5)。

图2 S1、G11和G12菌株在系统发育树的位置Fig.2 Phylogenetic tree of strains S1,G11 and G12

图3 S1菌株的生长条件Fig.3 Growth conditions of strain S1
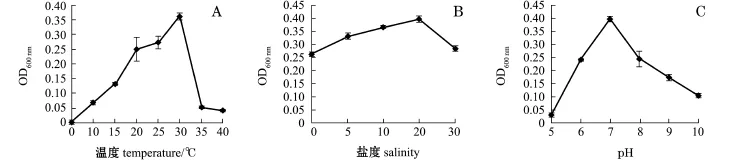
图4 G11菌株的生长条件Fig.4 Growth conditions of strain G11

图5 G12菌株的生长条件Fig.5 Growth conditions of strain G12
3 讨论
翅碱蓬具有耐盐生长以及对多种污染物耐受的特性[10],翅碱蓬的抗污染能力与其根系微生物有着密切的关系。翅碱蓬在石油污染土壤的修复中,其根系微生物起到了关键作用[15],王新新等[17]从翅碱蓬根基土壤中分离到多株耐盐石油烃降解菌。本研究中采集了辽宁盘锦地区生长的翅碱蓬,将其分为3种样品进行分离,其中样品T主要为土壤菌株,样品S主要为与根系呈附着状态的菌株,样品G为除去附着微生物后根系组织均浆中的菌株,可能包括共生或互生关系的菌株。根据菌株分离结果,虽然样品T和样品S中存在较多形态相同的菌株,但样品S中的S1菌株在样品T中不存在,可作为代表菌株保存。所选择的28株代表菌中复筛出能以柴油为唯一碳源的降油菌7株,除S1菌株外,其余菌株来源于样品G,因此,翅碱蓬根系的共互生菌中存在较多可利用石油烃的菌株,它们有可能与翅碱蓬组成一个协同作用体[2-3,18]。在植物生物修复中,根际微生物在根系分泌物的作用下,可加速农药、石油等土壤有机污染的降解;对于个别难降解的有机污染物,根系分泌物还可在降解中与微生物发生共降解作用,据报道,难以降解的有机物污染物的降解大多利用此作用[4-6,19]。本研究中从菌株分离结果推测,G11和G12菌株有可能与翅碱蓬根系形成互生或共生关系,具体机制有待深入研究。
本研究中,根据7株具有石油烃利用能力菌株对柴油的原始降解率结果分析,作用3 d时,除S1 和G12菌株降解率超过20%外,其余菌株降解率均较低;作用5 d后,除G3菌株外,其他菌株降解率均有所提高,其中S1、G12菌株降解率仍然最高,G10、G11菌株也有较大幅度提升;作用7 d后,降解率保持较高的为S1、G11和G12菌株,分别为41.09%、31.68%和29.70%。经鉴定,S1为微杆菌属Microbacterium,与Microbacterium saperdate的相似性高达98.7%,G11、G12菌株皆为刘志恒菌属Zhihengliuella[20]。王春明等[16]对微杆菌3-28菌株降解萘、菲、蒽、芘的性能进行了研究,结果表明,3-28菌株对此4种物质有着较高的降解能力,作用5 d后,萘、菲完全降解,而蒽、芘在作用 28 d时的降解率分别达到了 97.54%、90.2%。Chen等[21]的研究中有对其模式菌株Zhihengliuella halotolerans的相关报道,但目前对于刘志恒菌属,特别是其降油性能方面,国内外文献中鲜有报道。本研究中,G11、G12菌株的降解率有明显差别,具体原因有待进一步研究。
从菌株的生长特性结果可知,3株菌 (S1、G11、G12)的生长温度范围均为15~35℃,最适生长盐度分别为0、20、20,最适生长pH分别为5、7、7。S1菌株降解率最高,虽然其最适生长条件与海洋生态环境条件有差距,但在盐度为20、pH为8的条件下也能良好生长,3株菌均能适应沿海滩涂的理化条件生长。近年来,国内外学者进行了大量植物-微生物单一菌种及菌群联合修复污染土壤的研究,Soleimani等[22]将内生真菌Neotyphodium coenophialum和Neotyphodium uncinatum侵染高羊茅Festuca arundinacea Schreb.和草甸羊茅Festuca pratensis Huds.培养7个月后发现,真菌侵染的植物根系不仅生物量有明显增加,石油污染土壤中的总石油烃 (TPH)和多环芳烃 (PAHs)降解率也分别达到了80% ~84%和64% ~72%。Hernandez-Ortega等[23]研究百花草木犀 Melilotus albus与丛植菌根真菌 (AMF)联合修复柴油污染土壤时也发现,AMF能够减少柴油对植株的毒性,同时提高生物量,间接提高菌株的降油率。植物与特定的菌根真菌或根际菌群协同作用,增加对污染物的吸收和降解是一个很有价值的研究方向,目前此方面研究较少。Caman等[24]以柳树为研究对象,利用树木根部的根际微生物促进石油烃的生物降解,以修复威斯康星州一块被柴油污染的土壤,结果十分理想,作用24周时土壤中40%~90%的柴油被降解;刘鹏等[25]利用高效石油降解菌结合种植大豆、碱草等植物对石油污染土壤进行联合修复,作用 135 d时石油烃降解率达 63.65% ~83.26%,同时发现,根际土壤的石油烃含量明显低于非根际土壤。本研究中分离筛选的3株目的菌株,在短时间内即可达到较高的降油效果,有望成为构建翅碱蓬-细菌复合修复载体的备选菌株,其较长时间的降油性能以及对石油烃不同成分的降解性能需进一步研究。
[1] 郑向荣,吴新民,慕建东.海洋石油污染生物修复技术研究进展[J].河北渔业,2013(1):46-47.
[2] Takeuchi M,Hatano K.Union of the genera Microbacterium Orla-Jensen and Aureobacterium Collins et al.in a redefined genus Microbacterium[J].International Journal of Systematic and Evolutionary Microbiology,1998,48(3):739-747.
[3] 张爱君,郝建安,杨波,等.海洋石油降解菌的筛选、鉴定及降解活性[J].化学工业与工程,2015,32(1):31-36.
[4] 徐冯楠,冯贵颖,马雯,等.高效石油降解菌的筛选及其降解性能研究[J].生物技术通报,2010(7):221-226.
[5] 徐中阳,陈雯莉.萘降解菌的分离、鉴定及降解途径[J].华中农业大学学报,2015,34(1):59-65.
[6] 吴业辉,邵宗泽.海洋烷烃降解菌Alcanivorax sp.A-11-3的分离鉴定及其降解酶基因研究[J].台湾海峡,2008,27(4):427-434.
[7] 王建龙,文湘华.现代环境生物技术[M].2版.北京:清华大学出版社,2008.
[8] 白洁,崔爱玲.石油降解菌对石油烃的降解能力及影响因素研究[J].海洋湖沼通报,2007(3):41-48.
[9] 刘媚媚,金腊华.一株石油降解菌的活性炭纤维固定化研究[J].环境污染与防治,2009,31(10):48-51.
[10] 李超峰,葛宝明,姜森颢,等.碱蓬对盐碱及污染土壤生物修复的研究进展[J].土壤通报,2014,45(4):1014-1019.
[11] 何洁,陈旭,王晓庆,等.翅碱蓬对滩涂湿地沉积物中重金属Cu、Pb的积累吸收[J].大连海洋大学学报,2012,27(6):539-545.
[12] 王斌,周雅飞,张兴,等.一株沿海滩涂细菌的降油及生长特性研究[J].大连海洋大学学报,2012,27(4):306-310.
[13] 国家海洋环境监测中心.GB 17378.4-2007海洋监测规范第4部分:海水分析[S].北京:中国标准出版社,2008.
[14] 王战勇,顾贵洲,苏婷婷,等.石油降解菌株Pseudomonas sp. DY12的筛选及降解性能研究[J].化学与生物工程,2009,26 (8):67-87.
[15] 许崇彦,刘宪斌,刘占广,等.翅碱蓬对石油烃污染的海岸带修复的初步研究[J].安全与环境学报,2007,7(1):37-39.
[16] 王春明,李大平,王春莲.微杆菌3-28对萘、菲、蒽、芘的降解[J].应用与环境生物学报,2009,15(3):361-366.
[17] 王新新,白志辉,金德才,等.石油污染盐碱土壤翅碱蓬根围的细菌多样性及耐盐石油烃降解菌筛选[J].微生物学通报,2011,38(12):1768-1777.
[18] 戴青松,韩锡荣,黄浩,等.根际微生物对土壤有机物修复现状和发展[J].环境科技,2014,27(1):71-74.
[19] 杨仕美,张翼霄,高光军,等.不同碳源富集的石油烃降解菌群落结构的分析[J].海洋科学,2009,33(8):87-92.
[20] Zhang Yuqin,Schumann P,Yu Liyan,et al.Zhihengliuella halotolerans gen.nov.,sp.nov.,a novel member of the family Micrococcaceae[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(5):1018-1023.
[21] Chen Yiguang,Tang Shukun,Zhang Yuqin,et al.Zhihengliuella salsuginis sp.nov.,a moderately halophilic actinobacterium from a subterranean brine[J].Extremophiles,2010,14:397-402.
[22] Soleimani M,Afyuni M,Hajabbasi M A,et al.Phytoremediation of an aged petroleum contaminated soil using endophyte infected and non-infected grasses[J].Chemosphere,2010,81:1084-1090.
[23] Hernandez-Ortega H A,Alarcon A,Ferrera-Cerrato R,et al.Arbuscular mycorrhizal fungi on growth,nutrient status and total antioxidant activity of Meliloutus albusdurin phyto remediation of a diesel-contaminated substrate[J].Journal of Environmental Management,2011,95:S319-S324.
[24] Caman E P,Crossman T L,Gatliff E G.Phytoremediation of No.2 fuel oil contaminated soil[J].Soil Contam,1998,7(4):455-466.
[25] 刘鹏,李大平,王晓梅,等.石油污染土壤的生物修复技术研究[J].化工环保,2006,26(2):91-94.
Screening and growth of oil-degrading bacteria from roots of seepweed herb Suaeda heteroptera Kitag
LI Zuo-yang,TIAN Rui,YU Zi-chao,WANG Bin
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalain Ocean University,Dalian 116023,China)
In this study,culturable bacteria were isolated from soil and roots of seepweed herb Suaeda heteroptera from which the oil-degrading strains were screened using plates containing diesel oil as the sole carbon source in order to provide dominant strains for the establishment of practical composite technology using Suaeda heteropterabacteria carrier to repair the oil pollution in coastal beach.During the experiment,the original degradation rates of diesel were measured by the oil-degrading strains,through which the strains with high degradation rates were selected as the target strains in order to investigate their degradation of diesel and growth in 3,5,and 7 d.The strains with excellent degradation property were identified by morphological observation and analysis of 16S rDNA sequences and physio-biochemical characteristics.A total of 28 strains were isolated,in which 7 strains numbered as S1,G3,G4,G9,G10,G11 and G12 were tested to have oil degrading ability.It was found that the original diesel degradation rate was 34.21%in S1,3.68%in G3,18.40%in G4,18.95%in G9,0.52%in G10,9.47%in G11,and 21.05%in G12 in 3 d;44.06%,3.19%,23.90%,24.70%,31.47%,25.90%,and 46.22%at 5 d,and 41.09%,1.49%,14.36%,28.22%,14.36%,29.70%,and 31.68%at 7 d,S1,G11 and G12 showing the excellent degradation.S1 shared the maximal 16S rRNA gene sequence similarity with the type strain Microbacterium saperdate(98.7%),was affiliated with the genus Microbacterium.G11 and G12 which exhibited the highest 16S rRNA gene sequence similarity with the type strains of Zhihengliuella halotolerans (99.8%)were both affiliated with the genus Zhihengliuella.The suitable growth temperature for S1,G11 and G12 was 15-30℃,the optimal salinity for their growth were 0,20 and 20,and the optimal pH 5,7 and 7,for growth respectively.
Suaeda heteroptera Kitag;oil-degradation bacterium;identification
Q935
A
10.16535/j.cnki.dlhyxb.2016.01.006
2095-1388(2016)01-0030-07
2015-05-03
国家海洋公益性行业科研专项 (201305002,201305043)
李作扬 (1992—),女,硕士研究生。E-mail:lizuoyang1314@126.com
王斌 (1962—),女,教授。E-mail:wangbin@dlou.edu.cn

